浙贝母灰霉病病原真菌的分子鉴定
2022-04-04李吉二温思思张羽加金洛稼赵伟春
李吉二 温思思 张羽加 金洛稼 赵伟春

摘要 为了鉴定引起浙贝母Fritillaria thunbergii Miq. 灰霉病的病原真菌,于2015年-2019年收集浙贝母灰霉病样品,采用常规组织分离法在PDA培养基上分离纯化获得10株葡萄孢属Botrytis真菌。进一步以内转录间隔区(internal transcribed spacer,ITS)、RNA聚合酶亚基Ⅱ(the second largest subunit of the nuclear RNA polymerase enzyme Ⅱ,RPB2)、热激蛋白60(heat shock protein 60,HSP60)和甘油醛-3-磷酸脱氢酶(glyceraldehyde 3-phosphate dehydrogenase,G3PDH)为DNA条形码,用特异性引物进行PCR扩增并测序,运用CodonCode Aligner拼接序列及BLAST分析,这10个菌株序列相同,为同一菌株,在GenBank中进行同源性比对,用MEGA 10.1构建系统发育树,确定此菌株与灰葡萄孢Botrytis cinerea相应序列的一致性为100%。盆栽接种法检测表明此菌株可引起浙贝母灰霉病。据此认为浙贝母灰霉病的病原真菌是灰葡萄孢而非普遍认为的椭圆葡萄孢Botrytis elliptica。
关键词 浙贝母; 灰霉病; 病原真菌; 灰葡萄孢; 分子鉴定
中图分类号: S435.672
文献标识码: A
DOI: 10.16688/j.zwbh.2021091
Abstract In order to identify the pathogenic fungi causing grey mold on Fritillaria thunbergii Miq., the disease samples were collected from 2015 to 2019, conventional tissue isolate method was used to isolate and purify the pathogen from samples on PDA medium and the ten isolates belonging to Botrytis were obtained. The specific sequence of ITS (internal transcribed spacer), RPB2 (the second largest subunit of the nuclear RNA polymerase enzymeⅡ), HSP60 (heat shock protein 60) and G3PDH (glyceraldehyde 3-phosphate dehydrogenase) were used as DNA barcode. They were amplified by PCR and sequenced, respectively. The sequences were spliced using CodonCode Aligner software and then BLAST analysis was carried out. These ten isolates are same strain with same sequence. The sequences were aligned in GenBank, and the phylogenetic trees were constructed using MEGA 10.1 software. The results showed that this strain shared 100% identity with Botrytis cinerea. The pathogenicity test by in vivo pot inoculation revealed that this strain can cause gray mold disease on F.thunbergii. Therefore, the pathogenic fungus causing mold disease of F.thunbergii is B.cinerea rather than B.elliptica, which was generally believed.
Key words Fritillaria thunbergii; grey mold disease; pathogenic fungus; Botrytis cinerea; molecular identification
浙貝母Fritillaria thunbergii Miq.为百合科Liliaceae贝母属Fritillaria多年生草本植物,著名的“浙八味”之一。目前在浙江、江西、湖南、江苏和安徽大面积栽培,是当地农民收入的主要来源[1]。然而,随着种植面积的不断扩大,重茬和鳞茎营养繁殖,浙贝母病害发生日益突出,其中以灰霉病危害最重,高发年病株率达82%以上[23],2017年,2018年,2020年浙江省磐安县浙贝母灰霉病普遍发生,部分田块全田枯死,药农普遍称之为“难治之症”,每年给种植户造成10%~30%的损失[12,45]。
浙贝母灰霉病,也称“早枯”“青塌腐”“眼圈病”。叶、茎、花、果实均能受害,以叶片的症状最为明显,叶片染病,有时病斑上长出灰色霉状物,残留在田间的菌核、菌丝体和分子孢子是次年灰霉病发生的主要侵染来源[1, 3, 6]。李云山等采用形态学观察法将引起此病的病原鉴定为椭圆葡萄孢Botrytis elliptica(Berk.)Cooke[7]。宗侃侃等则认为浙贝母灰霉病的致病菌是灰葡萄孢Botrytis cinerea Pers[1],但未对其进行鉴定。至今未见有利用分子生物学技术对浙贝母灰霉病的致病菌进行准确分类鉴定的报道。Staats等利用RPB2、HSP60、G3PDH等3个核基因分析了葡萄孢属Botrytis 23个种(包括1个杂交种)及其寄主的进化关系[8]。为了明确浙贝母灰霉病致病菌的种类,本研究从浙江省磐安县获得浙贝母灰霉病病株并从中分离纯化病原菌,通过观察症状、菌落及孢子形态,并采用DNA条形码技术[9]结合致病性检测对其致病菌进行分类鉴定,为浙贝母灰霉病的监测和防治及生物学研究提供理论和试验依据。gzslib2022040413141 材料与方法
1.1 材料
浙貝母灰霉病植株:自2015年-2019年连续5年从浙江省磐安县冷水镇白岩村、新渥镇弹上村等浙贝母栽培基地采集叶片褪绿黄化,呈水浸状斑块或茎秆表面褐变湿腐,病斑上有灰色霉层等[1]疑似浙贝母灰霉病病株8株,带回实验室用于病原真菌的分离,记录采集时间、采集地点、样品编号和病害症状。
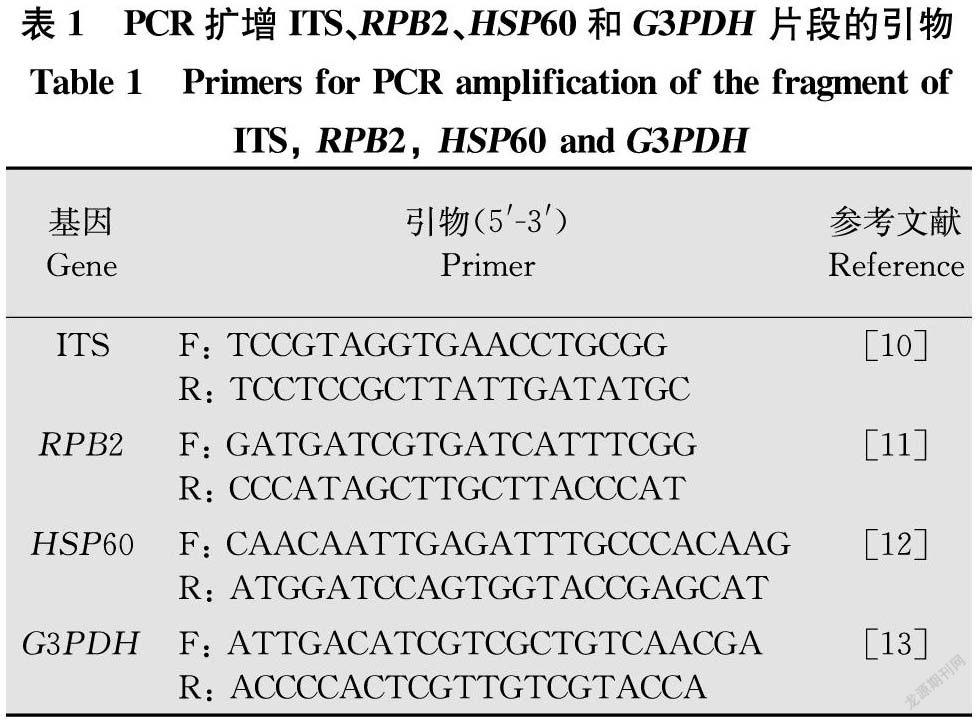
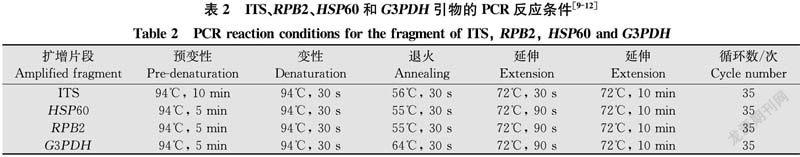
对病原菌的ITS、RPB2、HSP60、G3PDH基因扩增和测序。所用通用引物序列及PCR反应条件参考文献[1013]。引物由生工生物工程(上海)股份有限公司合成,序列见表1。
1.2 方法
1.2.1 病原真菌的分离纯化
采用常规组织分离法[1415]分离纯化浙贝母灰霉病病原真菌。病株经清水、无菌水冲洗后用75%乙醇浸泡1 min,1%NaClO溶液消毒5 min,再用75%乙醇漂洗50 s,最后用无菌水清洗。无菌条件下剪成5 mm×3 mm左右的组织块,放在PDA培养基平板上,置于23℃恒温培养箱中倒置培养。3~5 d后,观察菌落生长情况。用无菌接种环挑取组织块周围长出的菌丝,在PDA上继代培养分离菌株,直到获得单一菌落。用直径为1 cm的打孔器从菌落边缘打取菌饼,浸入70%甘油,-20℃冰箱保存备用。
1.2.2 病原真菌形态学鉴定
观察菌落的大小、质地、颜色和生长速度等培养性状,利用光学显微镜(YS100型,Nikon)观察纯化菌株的菌丝形态、孢子特征等显微形态[14],并且进行分类、编号及保存备用。
1.2.3 病原真菌DNA的提取
取培养4~6 d的菌丝体30 mg于2 mL离心管中,采用Ezup柱式植物基因组DNA抽提试剂盒(Sangon Biotech)提取病原菌基因组DNA,具体操作步骤参考试剂盒说明书。
1.2.4 PCR扩增及琼脂糖凝胶电泳检测
采用真菌rDNA-ITS的通用引物及G3PDH、HSP60、RPB2的特异性引物对基因组DNA进行PCR扩增(PCR自动系列分析仪 Tpersonal型,Biometra)。PCR反应体系(25 μL):2×Taq MasterMix 12.5 μL,0.1 mmol/L上、下游引物各1 μL,模板DNA 2 μL,ddH2O 8.5 μL。PCR反应条件见表2。取5 μL PCR产物,60 V恒压下在1%琼脂糖凝胶中电泳50 min,凝胶成像系统(Tanon-2500型,天能)观察DNA扩增情况。
1.2.5 PCR产物测序拼接
PCR产物由江苏金唯智生物科技公司进行双向测序。测序结果用Codoncode Aligner软件进行拼接。
1.2.6 序列的同源性比对及系统发育树的构建
拼接后的序列在GenBank数据库(http:∥blast.ncbi. Nlm. Nih.gov/)中对葡萄孢属真菌的ITS、RPB2、HSP60和G3PDH序列进行BLAST多序列比对。利用MEGA 10.1软件构建系统发育树,用1 000次重复bootstrap检验系统发育树各分支的支持率,以支持率≥50%为阈值作为成功鉴别物种的界限[16]。
1.2.7 病原菌的致病性检测
采用活体盆栽接种法:选6株健康的浙贝母植株,移栽到实验室内用无菌土培养7 d适应环境。将从病株上分离纯化并培养了5 d的菌株打成直径6 mm的菌饼两个,加入到50 mL无菌水中,用灭菌玻璃棒将菌饼碾碎,使菌丝团彻底散开,每株浙贝母浇灌50 mL菌悬液。同时以接种空白PDA的植株为对照。根据分子鉴定结果,10个分离物为同一菌株,故设接菌和不接菌2个处理,每个处理重复3组。接种后的植株于室温培养,观察、记录植株发病情况,并从发病部位再次分离病原真菌,确定分离得到的病菌是否为同一病菌。
2 结果与分析
2.1 浙贝母灰霉病的田间症状观察
发病初期,浙贝母叶片上出现淡褐色的小斑点,逐渐扩大成椭圆形或不规则的黄褐色病斑,边缘有明显的水渍状环,不断扩大形成灰色大斑,病株叶片略微黄色,有许多黑色斑块。发病后期可见整个植株枯死(图1)。潮湿时病部表层会产生大量的灰色霉层,上面分生孢子梗及分生孢子清晰可见。
2.2 病原真菌的显微观察
分离获得10个真菌菌落,观察各菌落在培养基上的形态与显微结构,均表现出葡萄孢盘菌属真菌的显著特征。菌落为近圆形,菌落正面内圈为褐色,外圈为淡褐色,背面呈淡褐色(图2);菌落初期为灰白色,菌丝生长旺盛,平均生长速率约为12 mm/d,后期培养基边缘长出圆形的或者规则的灰黑色菌核,菌落表面也有菌核产生,并常伴有水珠样分泌物;菌丝有隔,不规则分支,分生孢子梗清晰可见,分生孢子单生,球形或近球形,单孢(11.25~15.00)μm×(6.25~8.75)μm(平均13.13 μm×7.50 μm)。根据其形态特征初步鉴定为葡萄孢盘菌属真菌[14]。
2.3 病原真菌DNA的PCR扩增、测序、拼接及同源序列一致性比对
用真菌rDNA-ITS、RPB2、HSP60和G3PDH引物从10个分离物DNA中均成功获得相应序列。用Codoncode Aligner 软件对各分离物的上述序列测序结果进行拼接及BLAST分析,发现这10个分离物的序列相同,为同一菌株。将序列上传至GenBank获得序列登录号。分离物的ITS序列(登录号:MN243672,521 bp)与GenBank中登录号为KT279813的灰葡萄孢和登录号为AB828687的富氏葡萄孢盘菌Botryotinia fuckeliana (灰葡萄孢的有性型)的一致性为100%;RPB2序列(登录号:MN386055,1 143 bp)与登录号为MG846509、KX867998的灰葡萄孢一致性为99.74%和登录号为KJ018755的富氏葡萄孢盘菌一致性为99.46%;HSP60序列(登录号:MN386077,1 022 bp)与登录号为MK791187、MT233447、MH713609、MN159921的灰葡萄孢和登录号为KC620329、JN692388富氏葡萄孢盘菌的一致性为99.80%;G3PDH序列(登录号:MN386066,968 bp)与登录号MN448500、MK791186、MK296119的灰葡萄孢和登录号为KJ018759的富氏葡萄孢盘菌的一致性为99.90%。gzslib2022040413142.4 系统发育树的构建
基于ITS、RPB2、HSP60、G3PDH基因序列的系統发育树如图3所示。分离物的ITS序列与GenBank中灰葡萄孢、富氏葡萄孢盘菌和水仙葡萄孢的有性型Botryotinia narcissicola[17]等3个葡萄孢盘菌属真菌聚为一大支。分离物的RPB2基因序列先与灰葡萄孢及其有性型聚为一小支,然后与葱腐葡萄孢Botrytis aclada聚为一支。分离物的HSP60基因序列与灰葡萄孢及其有性型聚为一支。分离物的G3PDH基因序列与灰葡萄孢及其有性型聚为一大支。因此,通过对各分离物ITS、RPB2、HSP60、G3PDH序列分析并结合形态学特征,鉴定分离物为灰葡萄孢。
2.5 病原菌的致病性检测
经致病性检测,无菌土浇淋菌悬液1周后,浙贝母植株出现典型的灰霉病症状(图4):叶片褪绿发黄,叶片上有水浸状斑块。所以该分离物可引起浙贝母灰霉病,是引起浙贝母灰霉病的病原菌。
3 讨论
以往多数报道认为,浙贝母灰霉病由椭圆葡萄孢侵染所致[4,67,18],但文献资料均是通过病原真菌的菌落、菌丝体、分生孢子、分生孢子梗等形态学特性进行鉴定,未见有利用分子生物学技术对其进行分类鉴定。宗侃侃等认为其致病菌可能为灰葡萄孢,但未提供分类鉴定的试验依据[1]。本实验室历时数年从浙江省磐安县采集浙贝母灰霉病病株,并经多次分离纯化,获得了10株葡萄孢属真菌,并首次采用国际通用的rDNA-ITS、HSP60、G3PDH和RPB2序列作为DNA条形码结合致病性测定,证明了灰葡萄孢是浙贝母灰霉病的一种致病菌。
本实验室从2015年—2019年采集的浙贝母灰霉病病样中均未获得椭圆葡萄孢。究其原因,可能是由于椭圆葡萄孢的菌落、菌丝和孢子形态与葡萄孢盘菌的近缘种相似,以往观察到的可能并非椭圆葡萄孢,或是由于种植方式、气候、地域等条件的改变使浙贝母灰霉病的致病菌种类发生了变化。以往通过生物学特性研究,将同为百合科的百合灰霉病病原真菌鉴定为椭圆葡萄孢[1920],但近年来利用DNA条形码技术鉴定的结果证明,百合灰霉病的致病菌亦为灰葡萄孢[2122]。分子生物学技术避免了形态学鉴定方法不易区分近缘种的问题,能更准确地鉴定真菌的种类。椭圆葡萄孢是否为浙贝母灰霉病的致病菌仍有待于进一步研究。
因此,本研究首次证实了浙贝母灰霉病的致病菌为灰葡萄孢,这为浙贝母灰霉病的流行学研究、动态监测及防治奠定了基础。
参考文献
[1] 宗侃侃, 石红静, 陈淑淑, 等. 浙贝母灰霉病发生流行因子分析及综合防治技术[J]. 浙江农业科学, 2018, 59(9): 15471549.
[2] 佚名. 浙贝母灰霉病的发生情况及其防治初报[J]. 中药材科技, 1981(1): 1517.
[3] 赵永根. 贝母灰霉病发生特点与综合防治技术的研究[J]. 现代中药研究与实践, 2007, 21(4): 89.
[4] 吕先真, 郑永利, 潘兰兰, 等. 浙贝母主要病害及其综合防治[J]. 安徽农学通报, 2006, 12(2): 8586.
[5] 韦传宝, 刘林帅, 郑淼淼. 药用贝母栽培中病虫鼠害发生情况及防治措施[J]. 湖南农业科学, 2011(12): 101104.
[6] 赵培洁. 湿热条件对贝母灰霉病菌核存活的影响[J]. 中药材, 1990(12): 89.
[7] 李云山, 郑成. 浙贝母灰霉病病菌的生物学特性研究[J]. 浙江农业大学学报, 1984(3): 5363.
[8] STAATS M, VAN BAARLEN P, VAN KAN J A L. Molecular phylogeny of the plant pathogenic genus Botrytis and the evolution of host specificity [J]. Molecular Biology and Evolution, 2005, 22(2): 333346.
[9] 张艳杰, 沈凤英, 许换平, 等. 灰葡萄孢多样性研究进展[J]. 农业生物技术学报, 2017, 25(6): 954968.
[10]徐云飞, 祁依佳, 温思思, 等. 浙贝母黑斑病致病菌的分离鉴定及分子检测[J]. 浙江中医药大学学报, 2020, 44(2): 111118.
[11]DENTON A L, MCCONAUGHY B L, HALL B D. Usefulness of RNA polymerase Ⅱ coding sequences for estimation of green plant phylogeny [J]. Molecular Biology and Evolution, 1998, 15(8): 10821085.
[12]胡玉山, 王鸣, 杜琳, 等. hsp60基因序列分析及其在病原菌鉴定中的应用[J]. 中华微生物学和免疫学杂志, 2007, 27(9): 851855.
[13]卢倩, 弭晓菊, 崔继哲. 植物甘油醛-3-磷酸脱氢酶作用机制的研究进展[J]. 生物技术通报, 2013(8): 16.
[14]魏景超. 真菌鉴定手册[M]. 上海: 科学技术出版社, 1979.
[15]陆家云. 植物病原真菌学[M]. 北京: 中国农业出版社, 2001.
[16]郭静, 王超, 张宏彬, 等. 系统发生树构建方法综述[J]. 计算机应用研究, 2013, 30(3): 647655.
[17]张忠义. 中国真菌志:第26卷[M]. 北京: 科学出版社, 2006: 3756.
[18]吕先真, 潘兰兰, 黄海叁, 等. 8种药剂对浙贝母灰霉病、黑斑病的防治效果实验[J]. 农药科学与管理, 2004, 26(2): 2628.
[19]唐祥宁, 肖爱萍, 游春平, 等. 百合灰霉病病菌生物学特性研究[J]. 江西农业大学学报, 1998, 20(4): 7781.
[20]白滨, 杨花莲, 何苏琴, 等. 兰州百合叶枯病病原菌形态特征及生物学特性研究[J]. 中国蔬菜, 2013(16): 7884.
[21]CAO Xiaoqian, SHI Shaochuan, ZHANG Zhao. First report of Botrytis leaf blight on lily (Lilium longiflorum) caused by Botrytis cinerea in Beijing, China [J]. Plant Disease, 2018, 102(5): 10331034.
[22]杜艳丽, 曹兴, 王桂清, 等. 百合灰霉病病原菌鉴定及其部分生物学特性测定[J]. 南方农业学报, 2019, 50(2): 307314.
