重庆地区辣椒疫霉交配型分布及对烯酰吗啉的敏感性现状
2022-04-04张世才李怡斐王春萍杨小苗段敏杰黄任中黄启中
张世才 李怡斐 王春萍 杨小苗 段敏杰 黄任中 黄启中

摘要 为明确重庆地区辣椒疫霉Phytophthora capsici交配型分布及对烯酰吗啉的敏感性情况,对2019年-2020年分离的辣椒疫霉进行交配型和敏感性测定。研究发现重庆地区存在A1和A2两种交配型,且两者在大部分地区同时存在,测定的102株菌株中,24株菌株为A1交配型,78株为A2交配型,2种交配型的发生频率分别为23.53%和76.47%。采自重庆潼南、巴南、石柱等地的102株辣椒疫霉菌株对烯酰吗啉的敏感性测定结果显示,其EC50分布在0.107 5~0.438 3 μg/mL之间,最不敏感菌株是最敏感菌株的4.1倍,平均EC50为(0.296 2±0.005 3)μg/mL。102株菌株对烯酰吗啉的敏感性分布呈单峰曲线,未出现抗药性病原菌亚群体。
关键词 辣椒疫霉; 交配型; 烯酰吗啉; 敏感性
中图分类号: S436.418.1
文献标识码: A
DOI: 10.16688/j.zwbh.2021295
Abstract In order to clarify the mating type distribution of Phytophthora capsici and its sensitivity to dimethomorph in Chongqing, the mating types and sensitivity of P.capsici isolated in 2019-2020 were determined. The results showed that there were two mating types (A1 and A2) in Chongqing, and they existed in most areas at the same time. Among 102 isolates, 24 were A1 mating type and 78 were A2 mating type. The frequencies of two mating types were 23.53% and 76.47%, respectively. Their sensitivity to dimethomorph was tested, and the results showed that their EC50 values ranged from 0.107 5 to 0.438 3 μg/mL, with an overall mean of (0.296 2±0.005 3) μg/mL. The EC50 value of the most insensitive strain was 4.1 times of that the most sensitive strain.The distribution curve of sensitivity frequencies of P.capsici to dimethomorph was unimodal, and there was no resistant subpopulation among these isolates.
Key words Phytophthora capsici; mating type; dimethomorph; sensitivity
由辣椒疫霉Phytophthora capsici侵染引起的疫病是辣椒生产上的一种毁灭性土传病害,在世界各地辣椒种植区均有发生[1]。P.capsici属于异宗配合的卵菌,两种不同的交配型菌株相互诱导才能发生有性生殖,产生的卵孢子具有更强的致病性、抗逆能力以及更广泛的寄主植物[2]。有性生殖也是疫霉等植物病原菌遗传变异的重要来源,因此,研究辣椒疫霉的交配型及分布,对辣椒疫霉的起源与演化、疫病发生规律及抗性育种材料的筛选等有重要意义。
在生产上,辣椒疫病的防治主要以培育抗病品种和化学药剂为主[3]。烯酰吗啉(dimethomorph)是一种羧酸酰胺类的内吸性杀菌剂,对霜霉属Peronospora和疫霉属Phytophthora卵菌病害具保护和治疗作用,与苯基酰胺类杀菌剂无交互抗性[45]。当前,羧酸酰胺类杀菌剂已经在多种卵菌病害如辣椒疫病、番茄晚疫病、瓜类霜霉病等病害的防治中广泛应用[6]。随着药剂使用量的不断加大,辣椒疫霉的抗药性风险也逐年升高。近年来,有关辣椒疫霉对羧酸酰胺类杀菌剂的抗药性已有一些研究[67],但未见重庆地区的相关报道。
对重庆地区辣椒疫霉的交配型组成以及烯酰吗啉的抗药性水平的研究,旨在了解重庆地区辣椒疫霉有性生殖在病原菌遗传多样性和致病性分化中的作用及抗药性程度,为辣椒疫霉抗药性治理及化学杀菌剂的选择和绿色防控提供科学依据。
1 材料与方法
1.1 材料
1.1.1 供试菌株
2019年-2020年从重庆潼南、巴南、合川、石柱等辣椒主产区采集具有典型症状的病叶和病果样品,分离、纯化获得辣椒疫霉菌株102株,分离纯化用加有抗生素的选择性燕麦培養基,其配方和配制参照郑小波[8]的方法。
1.1.2 标准菌株
标准菌株A1交配型(P991)和A2交配型(P731)由南京农业大学提供。
1.1.3 供试培养基
10% V8 培养基:将100 mL V8蔬菜汁、0.2 g CaCO3、900 mL去离子水和18 g琼脂粉置于三角瓶中,充分摇匀后,高压灭菌锅中121℃灭菌20 min。
燕麦培养基:取燕麦片30 g放入l 000 mL的烧杯中,加入500 mL去离子水,沸水浴加热1 h后双层纱布过滤;称取18 g琼脂粉加入适量去离子水,溶化后与滤液充分混合,定容至1 000 mL后趁热分装,高压灭菌锅中121℃灭菌20 min。
1.1.4 供试药剂
96.8%烯酰吗啉原药,由安徽丰乐农化有限责任公司提供,将原药溶于二甲基亚砜(DMSO),配制成1×104 μg/mL母液,置于4℃冰箱中保存。
1.2 方法
1.2.1 交配型测定
交配型测定采用直接配对法[9]。供试菌株和标准菌株分别在燕麦培养基上培养7 d后,用直径5 mm的打孔器从菌落边缘打取菌饼,将A1、A2标准菌株分别与供试菌株对峙接种在V8平板上,每个培养皿平行排2列,每列放置3块菌饼,两列菌饼间距4~5 cm。平板置于25℃恒温箱中黑暗培养10 d后,将培养皿倒置在显微镜载物台上,10×10倍视野下检查菌落交界处及周围是否产生藏卵器、雄器及卵孢子。每处理设置3个重复,测定试验重复2次。
待测菌株交配型的确定按照以下标准[2,8]:仅与A1交配型菌株配对产生卵孢子的为A2交配型;仅与A2交配型菌株配对产生卵孢子的为A1交配型;与A1和A2交配型菌株配对均不产生卵孢子的为A0交配型;单独培养或自身配对即可产生卵孢子的为A1A2交配型;与A1和A2交配型菌株配对均产生卵孢子,但是单独培养或自身配对都不产生卵孢子的为A1,A2交配型。
1.2.2 辣椒疫霉对烯酰吗啉的敏感性测定
先进行预试验,将待测菌株转接至烯酰吗啉浓度为0.1、1.0、10.0、100.0 μg/mL的V8培养基平板中培养6 d,根据菌落的生长情况确定烯酰吗啉的浓度梯度0.05、0.1、0.2、0.3、0.4、0.5、0.6 μg/mL。待测菌株在V8培养基上25℃黑暗条件下培养5 d后,用打孔器(直径5 mm)在菌落外缘同一圆周上打取菌饼,分别接种到含系列浓度的烯酰吗啉V8培养基平板上,以只含等量二甲基亚砜的V8培养基平板作为对照,置25℃黑暗条件下培养6 d。采用十字交叉法测量处理菌落的直径,每个处理重复3次。求出每个药剂浓度对菌丝生长的抑制率,生长抑制率=(对照菌落的增长直径-药剂处理菌落的增长直径)/对照菌落增长直径×100%。计算抑制率的几率值,求出毒力回归方程y=a+bx,根据毒力回归方程计算烯酰吗啉的有效抑制中浓度EC50(μg/mL)和相关系数r值。
2 结果与分析
2.1 交配型测定
对分离保存的102株菌株进行交配型测定,结果显示(表1):78株为A2交配型,发生频率为76.47%,其余24株为A1交配型,发生频率为23.53%,未检测到其他交配型。可见,辣椒疫霉在重庆地区以A2交配型为主。在12个辣椒产区中,A1和A2两种交配型在其中10个产区同时存在,且两种交配型在不同地区的发生频率也不同。
2.2 辣椒疫霉对烯酰吗啉的敏感性测定
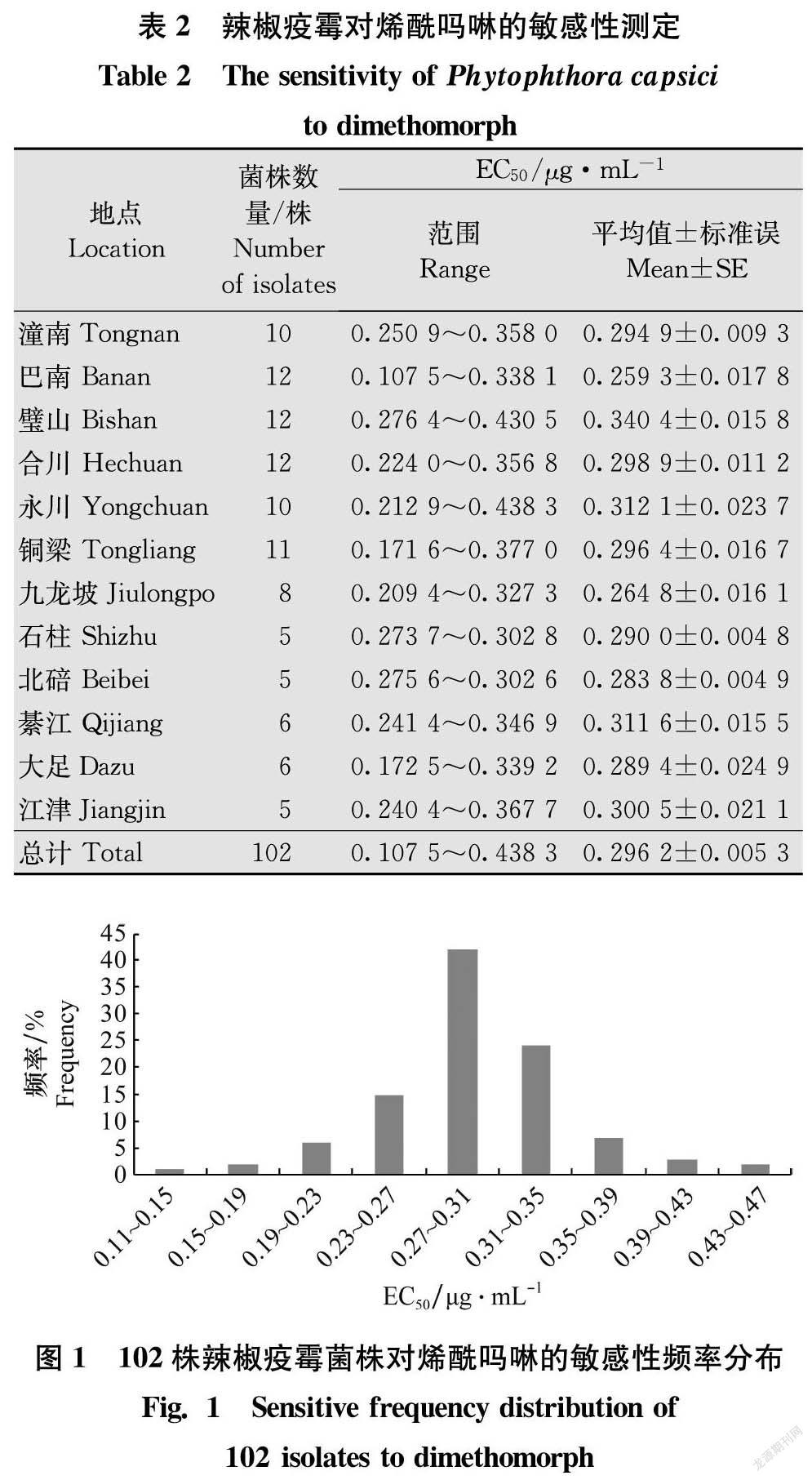
测定结果表明(表2):采自重庆潼南、巴南、合川及石柱等地区的102株辣椒疫霉菌株对烯酰吗啉的EC50介于0.107 5~0.438 3 μg/mL之间,平均值为(0.296 2±0.005 3)μg/mL,最不敏感菌株的EC50为最敏感菌株的4.1倍。所有菌株对烯酰吗啉的敏感性分布呈连续性单峰曲线(图1),总体来看,接近正态分布,未出现敏感性显著下降的病原菌亚群体。
对菌株敏感性分析表明,不同地区和同一地区的不同菌株对烯酰吗啉的敏感性有一定的差异。其中,巴南区12个菌株的EC50平均值最低,为0.259 3 μg/mL,分布范围为0.107 5~0.338 1 μg/mL;璧山区12个菌株的 EC50平均值最高,为0.340 4 μg/mL,分布范围为 0.276 4~0.430 5 μg/mL。雖然巴南区菌株的EC50平均值最低,但是其最高 EC50为最低的3.15倍,在所有测定地区中最高。
3 结论与讨论
关于辣椒疫霉的交配型,2012年-2014年的相关研究表明[1012],江西、安徽和青海的交配型均以A2为主,其中,江西省未发现其他交配型;安徽省A2交配型占90.6%,A1交配型占9.4%;青海省A2交配型占61.9%,A1交配型占33.3%,A0交配型占4.8%。2008年刘永刚等[13]研究认为甘肃省辣椒疫霉存在A1、A2和A0三种交配型,以A1和A0占优势;2009年杨明英等[14]报道了云南省疫霉菌株由A1、A2和A1A2三种类型组成,以A2和A1A2交配型为主。本研究中,重庆地区存在A1和A2两种交配型,A2交配型占76.47%,A1交配型占23.53%,未检测到其他类型,这一结果与江西、安徽和青海的分布相似,都以A2交配型为主,但不同地区之间交配型的发生频率又各不相同。可以看出,辣椒疫霉在我国有丰富的遗传多样性,其交配型呈不均等分布。本研究测定重庆的12个辣椒产区中,两种交配型共存的产区有10个,所有产区的交配型均以A2为主,这表明重庆地区辣椒疫霉能够完成有性生殖过程,产生的卵孢子有助于病原越冬存活,将大大提高疫病的发生频率。另外,有性生殖过程可通过基因重组提高病原的遗传变异几率,导致致病力和遗传多样性分化,增加病害防治的难度。
在我国,烯酰吗啉用于霜霉病、疫病等卵菌病害的防治已有20余年,随着烯酰吗啉等羧酸酰胺类杀菌剂使用量的不断增大,病原的抗药性问题引起了科研人员的极大关注。2009年崔晓岚等[6]对采自河北、内蒙古和陕西等地的125株辣椒疫霉菌株进行烯酰吗啉敏感性测定,结果表明未出现抗性的病原菌亚群体,其EC50在0.126~0.318 μg/mL之间,最不敏感菌株是最敏感菌株的2.5倍,平均EC50为(0.218±0.036 8)μg/mL;2010年Sun等[15]对采集自江苏、辽宁、安徽等地未接触过羧酸酰胺类杀菌剂的90株辣椒疫霉开展敏感性测定,结果显示EC50范围为0.122~0.203 μg/mL,最不敏感菌株是最敏感菌株的2倍,EC50平均值为(0.154±0.022)μg/mL。本研究中,重庆地区辣椒疫霉的平均EC50(0.296 2 μg/mL)、最大EC50(0.438 3 μg/mL)及最不敏感菌株是最敏感菌株的倍数值(4.1倍),与崔晓岚和Sun等的研究结果相一致。可见,目前重庆地区的辣椒疫霉对烯酰吗啉还没有产生抗药性。烯酰吗啉具有多个作用位点,由于抗药性机理复杂,尽管国内已使用多年,至今还未见从大田中检测到疫霉抗性菌株的报道,但有一些通过室内诱变抗性突变体的研究。崔晓岚等[6]通过室内紫外诱变辣椒疫霉,获得13个烯酰吗啉的抗性突变体,其中1个突变体菌株的抗性指数高达680倍;Sun等[15]获得了4个抗性突变体菌株,其中1个突变体菌株抗性指数高达1 200倍;Bagirova等[16]采用化学诱变和二次紫外线照射诱导致病疫霉游动孢子,筛选出了低水平抗药性菌株突变体;Stein等[17]研究得出抗烯酰吗啉突变体菌株在生长速率和致病性方面有下降的趋势,认为突变体在自然环境中很难发展成优势群体。可见,辣椒疫霉对烯酰吗啉存在一定的抗药性风险,至于某些抗性突变体菌株出现的生长速率和致病性下降情况,还有待进一步研究。在大田使用过程中应尽可能减少烯酰吗啉的使用频率及用量,注意与嘧菌酯、霜霉威等不同作用机理的药剂混配或轮换使用[1819],并继续开展抗药性监测工作。
参考文献
[1] HAUSBECK M K, LAMOUR K H. Phytophthora capsici on vegetable crops: research progress and management challenges [J]. Plant Disease, 2004, 88(12): 12921303.
[2] 马国胜,高智谋,吴向辉.疫霉菌的交配型与性分化[J].安徽农业大学学报,2003,30(3):250254.
[3] 韩帅,张河庆,吴婕,等.四川主要辣椒栽培品种对疫病的抗性鉴定及评价[J].中国蔬菜,2019(7):5661.
[4] 朱书生,卢曉红,陈磊,等.羧酸酰胺类(CAAs)杀菌剂研究进展[J].农药学学报,2010,12(1):112.
[5] GISI U, WALDNER M, KRAUS N, et al. Inheritance of resistance to carboxylic acid amide (CAA) fungicides in Plasmopara viticola [J].Plant Pathology, 2007, 56(2): 199208.
[6] 崔晓岚,孟庆晓,毕扬,等.辣椒疫霉对烯酰吗啉的敏感性基线及室内抗药突变体研究[J].植物病理学报,2009,39(6):630637.
[7] 马辉刚,何烈干,张海良,等.江西省辣椒疫霉生理小种构成及其对烯酰吗啉的敏感性分析[J].植物保护学报,2013,40(4):374378.
[8] 郑小波.疫霉菌及其研究技术[M].北京:中国农业出版社,1997.
[9] 王革,郑小波,陆家云,等.云南省烟草黑胫病菌的交配型及其分布[J].南京农业大学学报,1997,20(1):3134.
[10]张海良,马辉刚,何烈干,等.江西省辣椒疫霉病菌的交配型及对霜脲氰敏感性的测定[J].植物病理学报,2013,43(2):196200.
[11]戚仁德,汪涛,李萍,等.安徽省辣椒疫霉交配型的分布及在无性后代的遗传[J].植物病理学报,2012,42(1):4550.
[12]付迎坤,田晓丽,李屹,等.青海省辣椒疫霉菌交配型分析及分布特征[J].北方园艺,2014(18):139141.
[13]刘永刚,张海英,郭建国,等.甘肃省辣椒疫霉菌的交配型分布及其致病力差异[J].植物保护学报,2008,35(5):448452.
[14]杨明英,曹继芬,李向东,等.云南辣椒疫病的分子诊断及其病原菌群体特征研究[J].植物病理学报,2009,39(3):297303.
[15]SUN Haiyan, WANG Hancheng, STAMMLER G, et al. Baseline sensitivity of populations of Phytophthora capsici from China to three carboxylic acid amide (CAA) fungicides and sequence analysis of cholinephosphotranferases from a CAA-sensitive isolate and CAA-resistant laboratory mutants [J]. Phytopathology, 2010, 158: 244252.
[16]BAGIROVA S F, LI A Z, DOLGOVA A V, et al. Mutants of Phytophthora infestans resistant to dimethomorph fungicide [J]. Journal of the Russian Phytopathological Society, 2001, 2: 1924.
[17]STEIN J M, KIRK W W. The generation and quantification of resistance to dimethomorph in Phytophthora infestans [J]. Plant Disease, 2004, 88(9): 930934.
[18]朱桂宁,黄福新,冯兰香,等.番茄晚疫病菌对甲霜灵、霜脲氰和烯酰吗啉的敏感性检测[J].中国农业科学,2008,41(5):13551365.
[19]MENG Qixiao, CUI Xiaolan, BI Yang, et al. Biological and genetic characterization of Phytophthora capsici mutants resistant to flumorph [J]. Plant Pathology, 2011, 60: 957966.
(责任编辑:田 喆)
