飞蝗前肠最适内参基因筛选
2022-04-04段家琪武卓宇翟慧娴张育平于荣荣
段家琪 武卓宇 翟慧娴 张育平 于荣荣




摘要 为了筛选在不同发育天数的飞蝗5龄若虫前肠中及其前肠不同部位能够稳定表达的最适内参基因,选用β-肌动蛋白(β-actin)、延伸因子1-α(EF-1α)、3-磷酸甘油醛脱氢酶(GAPDH)、核糖体蛋白49(RP49)和α-微管蛋白(α-tubulin)5个基因作为候选内参基因,利用实时荧光定量PCR技术(qRT-PCR)分析各候选内参基因的相對表达量,采用geNorm、NormFinder和Bestkeeper软件相结合,筛选出5龄飞蝗前肠不同部位和不同发育天数若虫前肠中的最适内参基因。结果表明,β-actin和α-tubulin为前肠不同部位最适内参基因组合,β-actin、α-tubulin和GAPDH为不同发育天数若虫前肠中最适内参基因组合。本文为飞蝗肠道关键靶基因分子特性及进一步生物学功能研究提供重要理论基础。
关键词 飞蝗; 前肠; qRT-PCR; 最适内参基因
中图分类号: S433.2
文献标识码: A
DOI: 10.16688/j.zwbh.2021175
Abstract In order to screen the optimal internal reference genes that can be stably expressed in different segments of foregut and foregut of 5th-instar Locusta migratoria on different developmental days, five candidate genes, including β-actin, EF-1α, GAPDH, RP49 and α-tubulin, were selected as internal reference genes. Real time quantitative PCR (qRT-PCR) was performed to analyze the relative expression of each candidate gene. The optimal internal reference genes were screened out by using geNorm, NormFinder and Bestkeeper software. The results showed that β-actin and α-tubulin was the most suitable gene combination for different parts of foregut, and β-actin, α-tubulin and GAPDH were the most suitable internal reference genes for foregut of 5th-instar nymphs of L.migratoria on different developmental days. This study provides an important theoretical basis for further study of the molecular characteristics and biological functions of the key target genes in L.migratoria.
Key words Locusta migratoria; foregut; qRT-PCR; optimal internal reference genes
飞蝗Locusta migratoria是典型的农业害虫,同时也是昆虫学研究的经典模式昆虫,由于其具有食量大、易迁飞等特点,一旦发生蝗灾,会严重影响农业生产[1]。飞蝗前肠位于肠道最前端,具有储存、过滤和研磨食物的功能[2]。其前肠主要由食道(esophagus,Es)、嗉囊(crop,Cr)和前胃(proventriculus,Pr)组成[3]。食道是首先接触食物的部位,其中有齿,可以防止食物倒流;嗉囊具有暂时储存食物和对食物进行初步消化的功能;前胃除了储存和研磨食物外,可将食物下推至后面部位[4]。
随着分子生物学技术快速发展以及全基因组信息发布,实时荧光定量PCR(qRT-PCR)技术已广泛应用于基因分子特性研究[5]。qRT-PCR常用于检测目的基因转录水平的表达,具有准确性高、重复性好、灵敏度强等特点,但其结果易受变量影响,如RNA的数量、纯度等[6]。qRT-PCR为相对定量的常用方法,其优点为不需明确标准品用量[7]。最适内参基因即在不同试验条件和不同类型的组织和细胞中,均恒定表达且表达量无明显差异的基因[8]。为了保证试验结果的准确性,分析前需要选择最适的内参基因对目的基因进行数据校正,此步骤是保证qRT-PCR检测结果准确和可靠的关键因素,对试验结果的校准具有重要意义[910]。
昆虫不同龄期和不同组织部位最适内参基因组合具有特异性。如瓜实蝇Bactrocera cucurbitae不同虫态在不同温度胁迫下内参基因组合为核糖体蛋白S13(RPS13)和核糖体蛋白L32(RPL32)[11]。大灰象甲Sympiezomias velatus成虫不同组织内参基因组合为α-微管蛋白基因(TUA),β-微管蛋白基因(TUB),核糖体蛋白S20(RPS20)和核糖体蛋白L12(RPL12)[12]。美国白蛾Hyphantria cunea不同发育阶段内参基因组合为RPL12和延伸因子1-β(EF-1β);幼虫不同部位内参基因组合为肌动蛋白(ACT)和核糖体蛋白S16(RPS16)[13]。牧草盲蝽Lygus pratensis不同龄期内参基因组合为转录起始因子TFIID亚基基因(TAF),谷胱甘肽S-转移酶基因(GST)和泛素蛋白基因(UBQ),不同部位内参基因组合RPL32和TAF[14]。飞蝗5龄整虫不同组织部位最适内参基因为EF-1α和GADPH,不同发育天数若虫的最适内参基因组合为β-actin和RP49[7,15]。昆虫特定组织部位最适内参基因组合是否与整虫最适内参相一致,目前未有报道。本文以5龄飞蝗前肠为研究对象,选取5个常用的内参基因,采用qRT-PCR检测各基因在飞蝗前肠不同部位和不同发育天数若虫前肠中的相对表达量,进一步使用geNorm、NormFinder和BestKeeper软件综合分析5个候选内参基因的表达稳定性,综合其结果筛选获得最适内参基因并明确内参基因个数,为研究飞蝗前肠靶基因的表达情况和生物学功能提供了重要理论基础。
1 材料与方法
1.1 供试昆虫
飞蝗虫卵取自河北沧州飞蝗养殖基地,将购买的虫卵放置在敞口培养盘中,用保鲜膜封好口,并在上面扎孔以保证空气流通,将其放置在人工培养箱中,温度(30±2)℃,相对湿度(40±10)%,光照周期L∥D=14 h∥10 h。待虫卵孵化后,将孵化出的蝗蝻轉移至边长为25 cm的正方体纱笼中,每天饲喂新鲜的小麦幼苗,待其长至3龄若虫时加喂麦麸,至5龄若虫时进行试验。
1.2 主要仪器和试剂
D3024台式高速微量离心机(SCILOGEX,美国),D3024R台式高速微量冷冻型离心机(SCILOGEX,美国),NanoDrop 2000(Thermo Fisher Scientific,美国),DYY-6C型电泳仪(北京六一仪器厂),Bio-Rad 凝胶成像仪(Bio-Rad,美国),StepOne/StepOnePlus实时荧光定量PCR仪(ABI,美国)。
RNAisoTMPlus、Hiscript Ⅲ RT SuperMix for qPCR购自天根生化科技有限公司(北京);2×Taq PCR MasterMix购自全式金生物技术有限公司(北京);SYBR GREEN实时定量试剂盒购自TaKaRa公司(日本),异丙醇等均为国产分析纯。
1.3 飞蝗前肠不同部位和不同发育天数若虫样品总RNA提取
1.3.1 前肠不同部位取样
选取5龄2 日龄若虫,在冰上将其前肠不同部位(食道、嗉囊、前胃)小心分离,并分别放于不同1.5 mL EP管中,液氮速冻,-80℃保存。设置4个生物学重复,每个重复8头虫。
1.3.2 不同发育天数若虫前肠的取样
从5龄第1天(N5D1)开始,每隔24 h取8头虫,在冰上进行解剖,取其前肠,连续取样8 d。将解剖好的新鲜组织放于1.5 mL EP管中,液氮速冻,-80℃保存。设置4个生物学重复,每个重复8头虫。
1.3.3 总RNA提取和cDNA第一链的合成
将盛有前肠组织的EP管置于冰上,加入RNAiso Plus,在盛有液氮的匀浆器中研磨。冰上静置5 min,加入200 μL氯仿,振荡2 min。样品在冰上放置15 min后,4℃ 12 000 g离心5 min。取上清液加入等体积的异丙醇,混匀,冰上静置15 min。12 000 g离心10 min,弃掉上清液后向沉淀中加入1 mL预冷的75%乙醇。4℃ 12 000 g离心5 min,沉淀晾干后加入适量的DEPC水至完全溶解。用1%琼脂糖凝胶电泳检测所提取的总RNA的完整性,用NanoDrop2000 测定总RNA的浓度。
以1 μg总RNA为模板,用 M-MLV 反转录酶将其反转录成第一链cDNA,随后将其置于-80℃冰箱备用。
1.4 候选内参基因筛选和引物设计
搜索飞蝗转录组数据库,选取5个不同功能的基因,分别为β-actin、EF-1α、GAPDH、RP49和α-tubulin作为候选内参基因[16]。使用Primer Premier 5.0软件设计特异性引物,并在NCBI数据库中进行引物特异性比对。引物合成由上海英潍捷基公司合成。引物信息见表1。
1.5 候选内参基因的qRT-PCR检测
以cDNA作为模板,参照试剂盒说明书进行实时荧光定量PCR(qRT-PCR)反应。反应体系:SYBR Premix ExTaqTM Ⅱ 10 μL,cDNA模板 2 μL,10 μmol/L上、下游引物各 0.8 μL,ddH2O 6.4 μL;程序:95℃预变性10 s;95℃变性5 s,60℃退火并延伸30 s,共40个循环。扩增结束后,在60℃时进行荧光检测。温度以1℃/min的速率从60℃上升到95℃。连续测定样品的荧光强度以获得熔解曲线,从而对DNA进行熔解分析。每个样品设置4个生物学重复和2个技术重复,分别对上述5对引物进行qRT-PCR反应,反应结束后收集数据进行分析。
1.6 数据处理与分析
通过2-ΔCt方法计算出各候选内参基因的相对表达量,利用geNorm软件分析得到候选内参基因的表达稳定值(M),M值越小内参基因的稳定性越好。进一步利用geNorm计算配对变异值(pairwise variations,V),确定最适内参基因个数[1718]。以标准化因子的配对变异值(0.15)作为阈值,将Vn/Vn+1对应的配对变异值与0.15做比较,>0.15时需要n+1个内参基因,<0.15时则需要n个内参基因。再使用NormFinder和BestKeeper软件对候选内参基因进行分析,综合3种软件的分析结果筛选出表达最稳定的内参基因。
2 结果与分析
2.1 geNorm软件分析
2.1.1 最适内参基因筛选
采用geNorm程序分析5个候选内参基因在前肠不同部位和不同发育天数若虫前肠中的表达稳定性(图1a,1b),5个候选内参基因在前肠不同部位中表达稳定值(M)顺序为:GAPDH(0.766 9)>RP49(0.448 7)>EF-1α(0.373 2)>α-tubulin=β-actin(0.291 3),5个基因的M值均<1.5,表达均较为稳定,其中,α-tubulin和β-actin的M值最小,表达最稳定;在不同发育天数若虫前肠中M值顺序为: EF-1α(0.678 2)>RP49(0.623 6)>β-actin(0.602 5)>α-tubulin=GAPDH (0.536 7),5个基因的M值均<1.5,表达均较为稳定,其中,α-tubulin和GAPDH的M值最小,表达最稳定。
2.1.2 最适内参基因个数确定
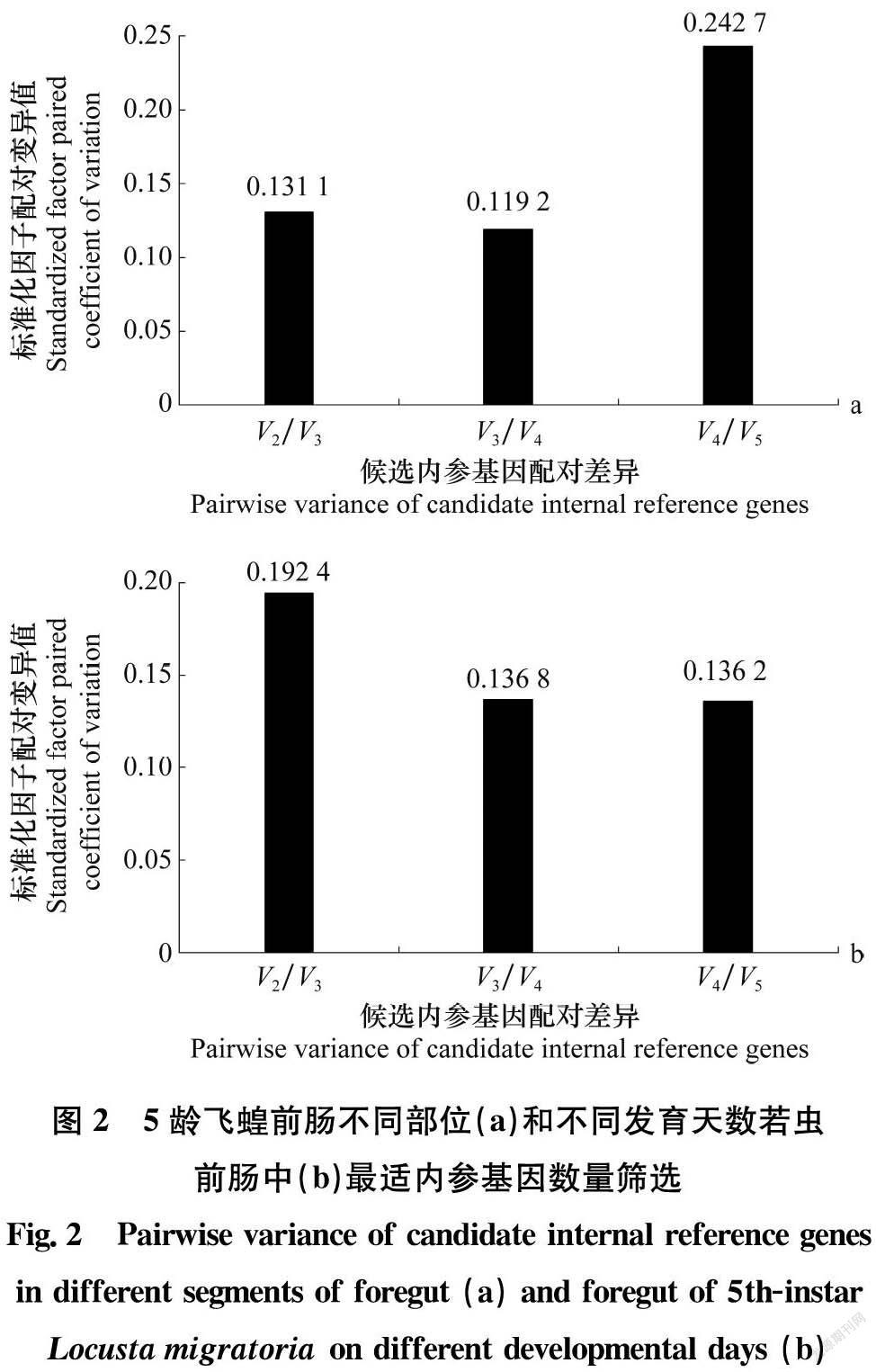
利用geNorm软件对5个内参基因在前肠不同部位以及不同发育天数若虫的前肠中的M值进行分析,得到两个归一化最适内参基因数目柱形图(图2),由图2a可知,V2/V3对应配对变异值为0.131 1<0.15,试验中应选择2个基因作为最适内参基因组合。因此,选择表达稳定性较好的2个基因(β-actin和α-tubulin)为前肠不同部位的最适内参基因组合。由图2b可知,V2/V3对应配对变异值为 0.192 4>0.15,V3/V4 对应的值为 0.136 8<0.15,说明加入第3个内参基因后提高了内参基因组合的稳定性,因此对于不同发育时期的前肠应选择3个基因作为最适内参基因组合。推荐表达稳定性较好的3个基因(β-actin、α-tubulin和GAPDH)为不同发育天数若虫前肠的最适内参基因组合。
2.2 NormFinder程序分析
使用NormFinder软件分析后获得5个候选内参基因分别在前肠不同部位和不同发育天数若虫前肠的表达稳定值 (M),根据M值越小,基因表达越稳定原则,NormFinder软件筛选获得表达最稳定的内参基因。由表2可知,在前肠不同部位中β-actin基因表达最稳定;在不同发育天数若虫的前肠中GAPDH基因表达最稳定。
2.3 Bestkeeper程序分析
将qRT-PCR得到的不同内参基因的Ct值输入到BestKeeper软件中内置Excel表格中计算出标准偏差(SD)和变异系数(CV)。SD和CV值越小基因表达越稳定。当SD>1.5,说明基因表达不稳定,不适合作为内参基因。由表3可知,在前肠不同部位中基因α-tubulin的SD值最小且CV值也最小,因此,表达最为稳定;由表4可知,在不同发育天数若虫的前肠中基因β-actin的SD值最小且CV值相对较小,因此,表达最为稳定。
3 讨论
本试验采用3个软件筛选获得β-actin在不同发育天数的5龄飞蝗前肠及前肠的不同部位均稳定表达,为最适内参基因。这一结果与不同发育天数的5龄飞蝗中β-actin表达稳定相一致[7],说明β-actin在飞蝗整虫和特定部位前肠中具有保守性。同一内参基因在不同处理中具有保守性这一特点同样存在于其他昆虫中。如沙漠蝗Schistocerca gregaria成虫脑部中EF-1a表达稳定,澳大利亚疫蝗Chortoicetes terminifera神经组织中EF-1a表达稳定,因此,EF-1a可以作为神经组织中的最适内参基因[1920]。
本研究表明,不同发育天数的5龄飞蝗前肠的最适内参基因组合为β-actin、α-tubulin和GAPDH;而文献报道,不同发育天数5龄若虫整虫的最适内参基因组合为β-actin和RP49;3龄若虫在微孢子感染胁迫下内参基因组合为ACT,EF1和TUB[7,21]。导致结果不一致的原因可能是在同一昆虫的不同发育阶段或不同部位表达稳定的内参基因组合可能是不同的,即具有部位和时间特异性。该现象也存在于其他昆虫中,如美国白蛾幼虫不同组织中最适内参基因为ACT;不同发育时期最适内参基因组合为RPL12和EF-1β[13]。综上所述,选取特定组织部位和龄期进行试验时,对靶标基因表达谱进行系统内部稳定性评价尤为重要。
本文选用geNorm、Normfinder和Bestkeeper 3个软件对候选内参基因的表达稳定性进行综合性分析评估,筛选出最适内参基因和内参基因个数。目前,采用该种方法进行最适内参基因的筛选试验已在植物和动物中得到广泛的应用[22]。如珙桐Davidia involucrata不同营养器官最适内参基因筛选[23],铁皮石斛Dendrobium officinale不同组织和不同生长阶段最适内参基因筛选[24],小鼠Mus musculus脂肪组织冷暴露和CL316243刺激下最适内参基因筛选[25],小鼠睾丸最适内参基因筛选[26]。本文以飞蝗5龄若虫为研究对象,选取不同部位和不同发育天数若虫的前肠,利用qRT-PCR技术检测了来自于飞蝗转录组数据库中5个候选内参基因β-actin、EF-1α、GAPDH、RP-49和α-tubulin的表達水平,并对各候选内参基因的表达稳定性进行综合性分析后,筛选获得2个最适合前肠不同部位基因研究的内参基因,分别为β-actin和α-tubulin。同时获得3个可作为5龄飞蝗发育过程中前肠基因研究的最适内参基因,分别为β-actin、α-tubulin和GAPDH。研究结果筛选获得飞蝗前肠最适内参基因,将为前肠靶标基因的分子特性研究和生物学功能研究提供重要理论基础,同时对其他昆虫内参基因的筛选具有一定的参考价值。
参考文献
[1] 李政伟. 东亚飞蝗发生规律与生活习性研究[J]. 农技服务, 2009, 26(8): 7576.
[2] 马鹏娟. 飞蝗几丁质脱乙酰基酶对肠道表皮发育和体表脂成分的影响[D]. 太原: 山西大学, 2019.
[3] 李德智. 东亚飞蝗消化道形态学观察及三维重建可视化[D]. 呼和浩特: 内蒙古农业大学, 2011.
[4] 张小民. 蝗虫消化道的形态结构与进化的相关性研究[D]. 太原: 山西大学, 2006.
[5] 梁子英, 刘芳. 实时荧光定量PCR技术及其应用研究进展[J]. 现代农业科技, 2020, 4(6):13.
[6] 王玉倩, 薛秀花. 实时荧光定量PCR技术研究进展及其应用[J]. 生物学通报, 2016,51(2):16.
[7] 崔淼, 刘晓健, 李涛, 等. 五龄飞蝗不同发育时间实时定量PCR内参基因的筛选[J]. 应用昆虫学报, 2014, 51(3): 733740.
[8] 任锐.应用于珙桐基因表达定量分析的内参基因的筛选及验证[D].长沙:中南林业科技大学, 2017.
[9] 张岗, 赵明明, 张大为, 等. 铁皮石斛实时定量PCR内参基因的筛选[J]. 中国药学杂志, 2013, 48(19): 16641668.
[10]侯维海, 孙鹏, 陈全家, 等. 地黄实时定量PCR内参基因的筛选[J]. 中国农学通报, 2011, 27(17): 7682.
[11]王凤英, 杨朗, 黎柳锋, 等. 不同温度胁迫下瓜实蝇RT-qPCR内参基因筛选[J]. 环境昆虫学报, 2018, 40(5): 10971105.
[12]李晓, 李建文, 成波, 等. 大灰象甲实时定量PCR内参基因的筛选[J].昆虫学报, 2018, 61(11): 12841294.
[13]陶蓉, 李慧, 孙宇航, 等. 美国白蛾内参基因的鉴定及筛选[J]. 林业科学, 2019, 55(9): 111120.
[14]贾冰, 马亿, 庞保平, 等. 牧草盲蝽实时定量PCR内参基因的筛选[J]. 昆虫学报, 2019, 62(12): 13791391.
[15]LIU Xiaojian, LI Feng, LI Daqi, et al. Molecular and functional analysis of UDP-N-acetylglucosamine pyrophosphorylases from the migratory locust, Locusta migratoria [J/OL]. PLoS ONE, 2018, 8(8): e71970. DOI: 10.1371/journal.pone. 0071970.
[16]ZHANG Jianqin, GE Pengting, LI Daqi, et al. Two homologous carboxylesterase genes from Locusta migratoria with different tissue expression patterns and roles in insecticide detoxification [J]. Journal of Insect Physiology, 2015,77:18.
[17]VANDESOMPELE J, PRETER K D, PATTYN F, et al. Accurate normalization of real-time quantitative RT-PCR data by geometric averaging of multiple internal control genes [J/OL]. Genome Biology, 2002, 3(7): research0034. DOI: 10.1186/gb-2002-3-7-research0034.
[18]吴建阳, 何冰, 杜玉洁, 等. 利用geNorm、NormFinder和BestKeeper软件进行内参基因稳定性分析的方法[J].现代农业科技, 2017(5): 278281.
[19]VAN HIEL M B, VAN WIELENDAELE P, TEMMERMAN L, et al. Identification and validation of housekeeping genes in brains of the desert locust Schistocerca gregaria under different developmental conditions [J/OL]. BMC Molecular Biology, 2009, 10: 56. DOI: 10.1186/1471-2199-10-56.
[20]CHAPUIS M P, TOHIDI-ESFAHANI D, DODGSON T, et al. Assessment and validation of a suite of reverse transcription-quantitative PCR reference genes for analyses of density-dependent behavioural plasticity in the Australian plague locust [J/OL]. BMC Molecular Biology, 2011, 12: 7. DOI: 10.1186/1471-2199-12-7.
[21]魏笑佳, 何岚, 阿地拉·阿吉, 等. 微孢子感染东亚飞蝗实时定量PCR内参基因的筛选[J].应用昆虫学报, 2021, 58(1): 108116.
[22]王浩, 蔡启忠, 刘露, 等. 何首乌实时荧光定量PCR内参基因筛选[J].中国中药杂志, 2021, 46(1): 8085.
[23]任锐, 戴鵬辉, 李萌, 等. 珙桐实时定量PCR内参基因的筛选及稳定性评价[J].植物生理学报, 2016, 52(10): 15651575.
[24]孙静. 铁皮石斛qPCR内参基因的筛选及开花相关基因的表达分析[D].南京: 南京师范大学, 2017.
[25]范秀琴,王瑞,李苹,等.冷暴露和CL316243刺激小鼠脂肪组织内参基因的筛选[J].生物技术, 2021, 31(3):239244.
[26]海卓, 熊显荣, 马鸿程, 等. 小鼠睾丸荧光定量PCR分析的内参基因筛选[J].西南民族大学学报(自然科学版), 2020, 46(5): 448456.
(责任编辑:田 喆)
