发酵陈皮黑茶改善高脂饮食诱导的小鼠糖脂代谢紊乱
2022-04-01王黎明牛兴和唐培安郝彬秀常国生
肖 杰,侯 粲,陈 鑫,应 剑,*,朱 炫,王黎明,牛兴和,唐培安,李 颂,郝彬秀,常国生
(1.中粮营养健康研究院有限公司,北京 102209;2.营养健康与食品安全北京市重点实验室,北京 102209;3.浙江工商大学食品与生物工程学院,浙江 杭州 310018;4.南京财经大学食品科学与工程学院,江苏省现代粮食流通与安全协同创新中心,江苏 南京 210023;5.中茶科技(北京)有限公司,北京 102209;6.广州市艺洋实业有限公司,广东 广州 510360)
糖脂代谢异常主要表现为腹部肥胖、胰岛素抵抗、高血压、高脂血症等[1],其患病率已从2002年的9.5%达到了2012年的18.7%[2]。以糖尿病为例,2015—2017年一项针对我国31 个省级行政区、75 880 名调查者的研究中发现,我国成人居民的糖尿病标准化总患病率约为12.8%,糖尿病前期标准化患病率约为35.2%[3]。探讨糖脂代谢异常人群患病进程及干预措施,对改善当前的患病现状,提高患者的生存质量具有重要意义。
改善糖脂代谢异常的传统方式是利用他汀类化合物、二甲双胍、α-葡萄糖苷酶抑制剂等进行药物治疗。但是,由于糖脂代谢调控机制复杂,药物治疗作用靶点单一且存在不良反应风险,因此,有必要寻找安全、有效的替代方式[4]。利用健康食品调整现有饮食结构是改善糖脂代谢异常的重要手段之一[5]。茶富含多酚类物质,具有改善糖尿病、肥胖、心血管疾病等糖脂代谢异常的潜力[6]。在糖脂代谢领域,近年来,对于以微生物发酵为标志性工艺的后发酵茶的研究逐渐深入。其中,冠突散囊菌发酵的茯砖茶可以调节肠道菌群减轻高脂诱导的C57BL/6J小鼠肥胖[7]。随着研究的日趋深入,冠突散囊菌发酵的技术亦被应用于红茶、乌龙茶等各品类[8-9]。乌龙茶经冠突散囊菌发酵后,可有效抑制α-葡萄糖苷酶、α-淀粉酶活性,同时,0.4~1.6 g/kgmb茶汤干预可以有效改善高糖高脂饲料诱导的大鼠体质量增加,改善血脂水平,增加双歧杆菌等益生菌的相对丰度[10]。
陈皮是芸香科植物橘及其栽培变种的干燥成熟果皮,作为食药两用的中药材广为应用。中医典籍中记载,陈皮气香、味辛、微苦,归肺经、脾经,具有理气健脾、燥湿化痰的功效[11]。陈皮含有川陈皮素、橙皮苷等活性成分,具有广泛的药理作用,广泛作用于心血管、消化和呼吸系统等,具有抗肿瘤、抗氧化和抗炎特性,可以对肝脏和神经有保护作用[12-13]。有研究显示,灌胃0.25%和0.5%陈皮提取物超过15 周,由于其富含独特的5-羟基聚甲氧基黄酮可显著预防高脂饮食诱导的肥胖、肝脂肪变性和糖尿病症状[14]。
发酵陈皮黑茶是以黑毛茶和广东新会陈皮为原料,借鉴传统茯砖茶的工艺,将陈皮和黑毛茶经冠突散囊菌(Eurotium cristatum)发酵后干燥制成的新工艺茶。前期研究显示,与发酵前原料相比,发酵陈皮黑茶成品总多糖含量由原料中的0.96%上升至发酵后的2.15%~3.56%,茶多酚含量从14.96%下降至8.99%~12.44%。发酵陈皮黑茶在体外实验中表现为改善脂肪酶、α-葡萄糖苷酶的活性[15]。
尽管茯砖茶与陈皮都有抗氧化、抗炎、改善糖脂代谢等的作用,但是由于发酵陈皮黑茶采用了陈皮与黑毛茶共同发酵,不同于其他简单拼配的茶产品,因此量效关系及机制研究尚不明确,亟需进行新的研究明确其改善糖脂代谢异常的作用机制。本研究以发酵陈皮黑茶为研究目标,用高脂诱导C57bl/6J小鼠糖脂代谢异常模型,测定小鼠体质量增加率、摄食量、空腹血糖(fasting blood glucose,FBG)水平、口服糖耐量测试(oral glucose tolerance test,OGTT)、血脂水平、病理特征及肠道菌群结构等指标,旨在考察评价发酵陈皮黑茶改善糖脂代谢异常的潜力,探索其改善作用的主要机制。
1 材料与方法
1.1 动物、材料与试剂
6 周龄雄性C57BL/6J小鼠购于北京维通利华实验动物技术有限公司,生产许可证号:SCXK(京)2016-0006。
发酵陈皮黑茶 贵州梵锦茶业有限公司;大鼠维持饲料(14.23 kJ/g) 北京科澳协力饲料有限公司;高脂饲料D12492(21.93 kJ/g) 北京华阜康生物有限公司。
FBG、胰岛素、胆固醇(total cholesterol,TC)、甘油三酯甘油三酯(triglyceride,TG)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)、游离脂肪酸(free fatty acid,FFA)水平测定试剂盒 北京中生北控生物科技股份有限公司。
1.2 仪器与设备
脱水机、包埋机 武汉俊杰电子有限公司;病理切片机 德国徕卡仪器有限公司;正置光学显微镜日本尼康公司;全自动生化仪 德国罗氏公司;酶标分析仪 美国Biotek公司。
1.3 方法
1.3.1 发酵陈皮黑茶浸提液制备
发酵陈皮黑茶生产工艺:黑毛茶与10%广东新会陈皮拼配后经蒸汽渥堆,在25~30 ℃,相对湿度大于70%条件下自然发花15 d,后经干燥过程,制成成品。发酵陈皮黑茶主要成分:茶多糖2.70%(质量分数,下同);总黄酮2.82%;总多酚11.63%[15]。
发酵陈皮黑茶浸提液的制备:准确称取3 g茶叶粉碎,按料液比3∶10(m/V)加入10 mL加热至沸腾的蒸馏水置于离心管内,沸水浴加热45 min(每10 min振摇一次),浸提结束后使用中速定性滤纸常温常压过滤,最终定容至10 mL。浸提液每周配制一次,于4 ℃保存,此浸提液为高剂量干预组茶叶浸提液,分别稀释2、4 倍后为中、低剂量干预组茶浸提液。
1.3.2 分组及饲养
6 周龄雄性C57BL/6J小鼠饲养于SPF级动物房,室温(22±2)℃,相对湿度40%~70%,12 h人工照明/黑暗循环,换气次数15 次/h。小鼠自由摄食并饮水,基础饲料(即大小鼠维持饲料)适应性饲喂一周后进行实验。
雄性C57BL/6J小鼠随机分为6 组,每组10 只,分别为正常对照组(基础饲料+10 mL/kgmb蒸馏水,NC组)、模型组(高脂饲料+10 mL/kgmb蒸馏水,MC组)、低剂量干预组(高脂饲料+10 mL/kgmb稀释4 倍的茶叶浸提液,LI组)、中剂量干预组(高脂饲料+10 mL/kgmb稀释2 倍的茶叶浸提液,MI组)、高剂量干预组(高脂饲料+10 mL/kgmb茶叶茶浸提液,HI组)、阳性对照组(高脂饲料+200 mg/kgmb二甲双胍,PC组)(灌胃体积均为10 mL/kgmb,低、中、高剂量干预组对应的发酵陈皮黑茶干预剂量分别为0.75、1.50、3.00 g/kgmb)。各组小鼠每日灌胃给药1 次,预防性干预12 周,观察记录各组小鼠每周体质量、摄食量,实验期间,小鼠自由饮水采食。按式(1)计算干预结束期较造模初期不同组别动物的体质量增加率。

1.3.3 口服糖耐量测试
干预第10周第1天,各组小鼠禁食10 h,给药前测定各组小鼠FBG水平,测试后分别给予0.75、1.50、3.00 g/kgmb受试样品、二甲双胍200 mg/kgmb以及蒸馏水,灌胃体积均为10 mL/kgmb,20 min后经口给予0.2 g/mL葡萄糖溶液(10 mL/kgmb),尾静脉取血使用血糖仪试纸测定经口给予葡萄糖后0、0.5、1.0、2.0 h时的血糖水平,绘制糖耐量曲线,按式(2)计算血糖曲线下面积。

1.3.4 标本采集及处理
干预期结束后,各组小鼠禁食12 h后处死;禁食期间,保持正常饮水。实验当天,眼球采血并分离血清,于-80 ℃保存待测。小鼠采血后颈椎脱臼处死,取完整心脏、肝、肾、胸腺等,生理盐水漂洗后,用滤纸吸干测定质量,并使用福尔马林液常温保存,计算脏器系数(小鼠脏器质量与体质量的比值)。
在标本采集前2 d使用悬尾法取小鼠粪便,置于无菌冻存管中-80 ℃保存。待后续肠道菌群分析。
1.3.5 生化指标测定
实验动物眼球采血后分别按照试剂盒说明书测定血清FBG、ALT、AST、TC、TG、HDL-C、LDL-C的水平;肝组织匀浆后离心,取上清液参照试剂盒说明书进行肝脏TC、TG、FFA水平的测定。
1.3.6 脏器组织切片观察
肝组织经固定、脱水、包埋、切片、脱蜡、HE染色、脱水透明、封片后于显微镜下观察,每个组织随机选择5 个视野进行拍照[16]。
肝组织制备冰冻切片,复温后,经油红O染色、分化、复染细胞核、封片后于显微镜下观察,每个组织随机选择5 个视野进行拍照[16]。
1.3.7 肠道菌群检测
使用细菌DNA提取试剂盒提取小鼠肠道内容物中的细菌基因组,经NanoDrop 2000分光光度计测定后选择DNA质量浓度为20 ng/μL的样本进行下一步聚合酶链式反应(polymerase chain reaction,PCR)扩增。基因组通过PCR进行扩增得到细菌16S rRNA基因的V4~V5区。扩增子经质量分数2%琼脂糖凝胶电泳后凝胶回收提取,使用AxyPrep DNA凝胶提取试剂盒按照制造商的说明进行纯化,并使用QuantiFluor™-ST进行定量。纯化后的扩增子汇集在等分子质量的测序池中,使用Illumina MiSeq进行配对测序(2×PE300)。原始fastq文件使用QIIME(1.17版)进行质量过滤。具有97%相似性的序列通过UPARSE 7.1软件(http://drive5.com/uparse/)聚类为一个操作分类单元(operational taxonomic units,OTUs),并使用UCHIME识别和去除嵌合体序列。基于得到的ASV(feature)特征序列和ASV(feature)相对丰度表格进行α多样性(Chao1指数和Shannon指数)分析和β多样性分析(使用主成分分析(principal component analysis,PCA)表征)。利用RDP分类器(http://rdp.cme.msu.edu/)对置信阈值为70%的Silva(SSU115)16S rRNA数据库中每个16S rRNA基因序列的系统发育亲缘关系进行分析及注释。使用PICRUSt(http://huttenhower.sph.harvard.edu/galaxy)软件对OTU进行标准化后,预测其功能,通过与京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)数据库的KEGG Mapper软件(https://www.genome.jp/)比对获得代谢通路以及酶的注释,筛选差异代谢酶。
1.4 数据统计分析
所有数据结果以平均值±标准差表示,使用Graph Pad Prism 7.0软件作图,采用SPSS 17.0软件进行单因素方差分析,通过最小显著性差异法(least significant difference,LSD)检验进行显著性分析,P<0.05表示组间差异显著。
2 结果与分析
2.1 发酵陈皮黑茶对小鼠体质量、摄食量、脏器系数的影响
如图1所示,与正常对照组相比,在第12周,模型组小鼠体质量增加率极显著增加(P<0.01)。经0.75~3.00 g/kgmb发酵陈皮黑茶干预后,由高脂饲料诱导的小鼠体质量增加有所改善,体质量增加率具有一定的下降趋势,体质量增长率由模型组(35.89±5.59)%下降至低剂量干预组的(29.57±6.89)%,中剂量干预组的(28.67±5.01)%,高剂量干预组的(30.67±6.07)%,但没有显著差异。对小鼠摄食量进行分析,高脂饮食会增加小鼠的能量摄入,而和模型组相比,各组小鼠摄食量没有明显差异,说明陈皮黑茶对小鼠摄食没有影响。


图1 发酵陈皮黑茶对干预终点小鼠体质量变化率、摄食量的影响Fig. 1 Effect of dark tea with Pericarpium Citri Reticulatae on body mass and feed intake in mice
如表1所示,干预12 周后对小鼠的肝、肾、心脏、脾以及胸腺等主要脏器称质量,计算脏器系数。与正常对照组相比,模型组肝脏指数高度显著降低(P<0.001),其余主要脏器没有明显差异。与模型组相比,0.75~3.00 g/kgmb发酵陈皮黑茶干预后,主要脏器的脏器指数没有明显差异,提示发酵陈皮黑茶具有较好的安全性。

表1 发酵陈皮黑茶对小鼠脏器指数的影响Table 1 Effect of dark tea with Pericarpium Citri Reticulatae on visceral organ coefficients of mice
2.2 发酵陈皮黑茶对小鼠糖代谢的影响
FGB及糖耐量是反应糖代谢的重要指标。OGTT结果如图2A、B所示,与NC组相比,MC组小鼠高脂饮食导致糖耐量异常,曲线下面积增加了49.78%,差异高度显著(P<0.001),二甲双胍阳性药物可以高度显著降低曲线下面积(P<0.001),缓解由于高脂饮食带来的小鼠糖耐量异常。而HI组和MC组相比,曲线下面积由1 694.0±137.2下降至1 491.0±112.9,且差异高度显著(P<0.001),改善小鼠的糖耐量异常,缓解葡萄糖稳态失调的现象。
干预第12 周,各组小鼠禁食8 h后,测定各组小鼠FGB浓度(图2C)。和NC组相比,和NC组相比,MC组高脂饮食可以诱导小鼠FGB浓度升高,FGB浓度由(5.76±0.57)mmol/L上升至(7.43±0.77)mmol/L,且差异高度显著(P<0.001)。实验结果显示,和MC组相比,LI、MI及HI组可以有效降低高脂饮食诱导的小鼠的FGB水平上升。进一步对小鼠的空腹胰岛素水平进行测定,发现各组小鼠空腹胰岛素水平没有显著差异(图2D)。

图2 发酵陈皮黑茶干预对小鼠糖代谢的影响Fig. 2 Effect of dark tea with Pericarpium Citri Reticulatae on glucose tolerance of mice
2.3 发酵陈皮黑茶对小鼠脂代谢的影响
血脂水平是评价机体脂代谢情况的重要指标。如图3所示,与NC组小鼠相比,MC组小鼠的TC、TG、LDL-C的水平显著增高。和MC组相比,LI组和MI组的TC、LDL-C和HDL-C水平变化不大,高剂量发酵陈皮黑茶干预组对TC、LDL-C和HDL-C具有一定的降低作用,但是差异没有显著性。LDL-C浓度/HDL-C浓度异常升高是心血管疾病重要的危险因素之一,与NC组小鼠相比,MC组小鼠饲喂高脂饮食后,会在一定程度上升高LDL-C浓度HDL-C浓度,而发酵陈皮黑茶各干预组均不同程度上能够缓解高脂饮食带来的LDL-C浓度/HDL-C浓度升高,但差异没有显著性。与NC组小鼠相比,MC组小鼠的TG水平极显著增加(P<0.01),发酵陈皮黑茶各干预组对TG具有一定的降低作用,但是差异没有显著性。
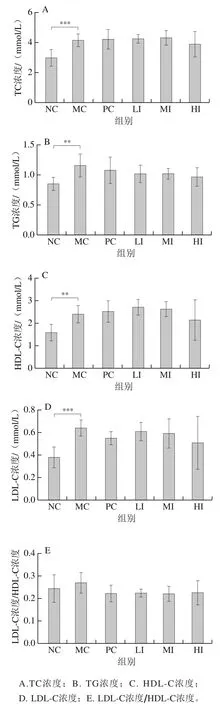
图3 发酵陈皮黑茶对小鼠血脂水平的作用Fig. 3 Effect of dark tea with Pericarpium Citri Reticulatae on blood lipid levels of mice

图4 发酵陈皮黑茶对小鼠肝组织结构及肝内脂质的影响Fig. 4 Effect of dark tea with Pericarpium Citri Reticulatae on hepatic histological changes and hepatic lipid levels of mice
如图4A所示,小鼠肝组织切片HE染色结果显示,正常对照组小鼠肝组织结构均匀;高脂饮食诱导后,小鼠肝细胞里呈现零散的脂肪空泡(黑色箭头处);而发酵陈皮黑茶干预能够明显改善脂肪变性的情况,表现为肝细胞空泡减少,且存在一定程度的剂量依赖性。对小鼠肝组织进行油红O染色,以观察轻度早期的肝脂肪变性,正常对照组小鼠无脂肪性肝损伤表现;高脂饮食诱导后,可见小鼠肝组织中出现轻度脂肪变性;低、中、高剂量发酵陈皮黑茶干预分别有9、8、2 只小鼠的肝组织发生脂肪变性(表2),说明发酵陈皮黑茶,尤其是高剂量发酵陈皮黑茶早期预防性干预可以在一定程度上缓解由高脂饮食带来的肝组织早期脂肪变性。如图4B~D所示,与正常对照组相比,高脂饮食诱导后,小鼠肝组织中TG、TC、FFA的含量没有明显变化。和模型组小鼠相比,中剂量发酵陈皮黑茶干预后,可以极显著降低小鼠肝组织中的总胆固醇浓度(P<0.01)。

表2 发酵陈皮黑茶对小鼠肝组织形态学的影响Table 2 Effect of dark tea with Pericarpium Citri Reticulatae on hepatic histological changes
2.4 发酵陈皮黑茶对小鼠肠道菌群的影响
Chao1指数和Shannon指数分别用来评估物种的丰富度和均匀度。如图5A、B所示,和正常对照组相比,高脂饮食使小鼠菌群物种丰富度高度显著下降(P<0.001);发酵陈皮黑茶干预后,小鼠肠道微生物菌群丰富度有所提高,其中低剂量干预后,小鼠肠道菌群Chao1指数极显著提高(P<0.01)。和正常对照组相比,高脂饮食使得小鼠菌群的均匀度极显著下降(P<0.01),发酵陈皮黑茶干预对小鼠肠道菌群的均匀度没有明显改变。
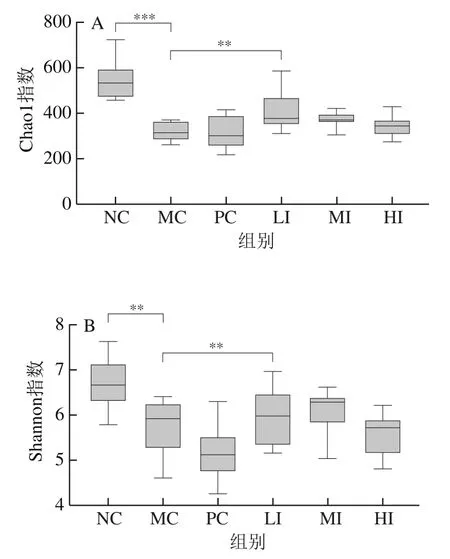
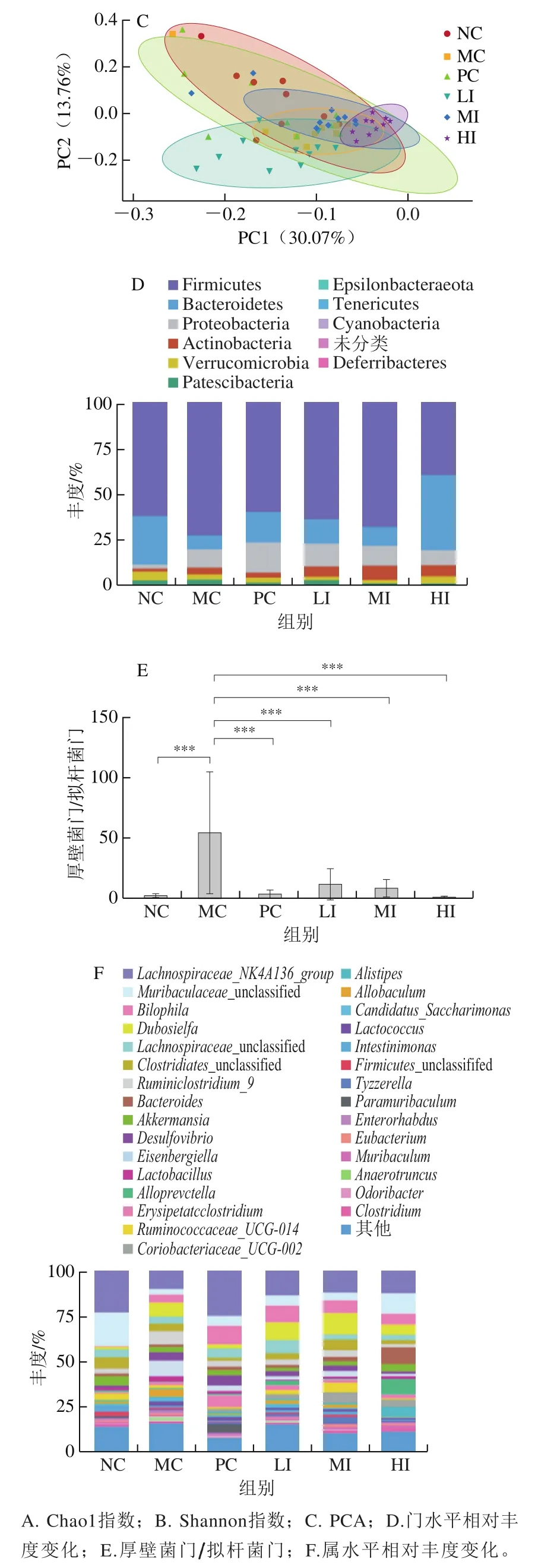
图5 发酵陈皮黑茶干预对各组小鼠肠道菌群的影响Fig. 5 Effect of dark tea with Pericarpium Citri Reticulatae on gut microbiota
各组小鼠肠道菌群PCA结果如图5C所示,PC1、PC2贡献率分别为30.07%、13.76%,正常对照组聚集在坐标轴的右下角,其余各组聚集在坐标轴的左侧,说明高脂饮食对小鼠肠道菌群结构有所影响;给予发酵陈皮黑茶干预后,与模型组及正常组都有区别,说明发酵陈皮黑茶可以定向改变菌群结构,但是并没有完全逆转由于高脂饮食带来的菌群结构的改变。
对小鼠的肠道菌群的门水平进行分析,结果如图5D所示,各组小鼠的粪便微生物菌群在门水平上主要由厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)以及变形菌门(Proteobacteria)构成。与正常对照组相比,高脂饮食诱导变形菌门相对丰度增加;发酵陈皮黑茶干预后,变形菌门的相对丰度随着剂量增加而下降。变形菌门相对丰度增加与肠道上皮功能障碍密切相关,发酵陈皮黑茶干预可能有助于维持肠道上皮细胞完整性,从而维持肠道厌氧环境[17]。如图5E所示,高脂饮食诱导厚壁菌门的比例增加,同时拟杆菌门的相对丰度下降,厚壁菌门/拟杆菌门比例高度显著升高(P<0.001),而发酵陈皮黑茶干预可以高度显著降低厚壁菌门/拟杆菌门(P<0.001),并呈明显的剂量依赖性(LI:12.300±3.943;MI:9.137±2.143;HI:1.157±0.233)。Turnbaugh等[18]最早报道厚壁菌门和拟杆菌门与肥胖密切相关,高脂或高纤维膳食饲喂别表现为厚壁菌门或拟杆菌门水平的提高[19-20]。菌群中厚壁菌门/拟杆菌门的异常增加,与促进能量获取、脂肪生成及蓄积相关。因此,厚壁菌门/拟杆菌门的降低,可能与发酵陈皮黑茶缓解小鼠由于高脂饮食诱导的肥胖趋势相关。
对各组小鼠肠道菌群的属水平进行分析,如图5F所示,与NC组相比,MC组脱硫弧菌属(Desulfovibrio)相对丰度由(1.281±2.004)%上升至(4.657±3.598)%,差异显著(P<0.05),梭菌属(Clostridium)相对丰度由(0.746±0.465)%下降至(0.553±0.441)%;和MC组相比,发酵陈皮黑茶尤其是高剂量发酵陈皮黑茶干预可以显著降低脱硫弧菌相对丰度,其相对丰度由(1.278±1.280)%上升至(4.657±3.598)%,差异显著(P<0.05),并提高梭菌相对丰度。脱硫弧菌属与脂多糖生成密切相关,是2型糖尿病的风险因素[21]。脱硫弧菌属的分泌物,可以促进参与脂质吸收的受体CD36的表达,进而调节宿主的脂质吸收能力,最终影响宿主的体质量等[22],此外,产生的脂多糖可以促进炎症反应,促进宿主肥胖[23]。反之,梭菌Clostridum则使得CD36减少[22,24]。因此,饮茶后体质量增速的减缓,可能与CD36通路被抑制,脂肪酸吸收减少有关。
与NC组相比,MC组嗜胆菌属(Bilophila)相对丰度由(0.479±0.721)%上升至(4.741±5.646)%,差异显著(P<0.05),与人体进食动物性饮食的结果一致[25]。饮用发酵陈皮黑茶后嗜胆菌的相对丰度继续升高,LI组为(9.287±9.144)%,MI组为(7.142±5.393)%,HI组为(6.249±4.259)%,提示饮茶可能进一步促进胆汁酸分泌;随着饮茶剂量增加,嗜胆菌属相对丰度下降,可能与机体稳态调节相关。有研究认为,动物性饮食促进嗜胆菌增殖,与机体自发性降低动物性饮食带来的心血管风险相关[26],饮用陈皮黑茶后的一系列变化支持这一推论。和NC组相比,MC组Lactobacillus和Lactococcus相对丰度有所上升,Lactobacillus由(1.486±1.034)%上升至(3.108±3.176)%,但差异不显著(P>0.05),和MC组相比,LI组相对丰度由(3.108±3.176)%下降至(0.352±0.287)%,差异显著(P<0.05),MI组下降至(1.107±0.917)%,差异显著(P<0.05)。而Lachnospiraceae_NK4A136_group则呈现相反的变化趋势,NC组为(23.230±13.130)%,MC组为(10.230±8.903)%,LI组为(25.070±15.450)%,MI组为(12.350±10.370)%,HI组为(12.670±9.847)%。肠道中的胆盐在Lactobacillus和Lactococcus等微生物表达的胆盐水解酶作用下分解,从结合型胆汁酸转化为游离型胆汁酸;进一步地,在梭菌属和Lachnospiraceae_NK4A136_group等微生物的作用下,转化为次级胆汁酸。因此,饮用发酵陈皮黑茶后可能导致Lachnospiraceae_NK4A136_group有激活肠道法尼醇X受体作用的游离胆汁酸减少,而具有抑制法尼醇X受体作用的次级胆汁酸增加;这一变化很可能进一步作用于肝脏的法尼醇X受体-小异二聚体伴侣,从而促进脂解和胆固醇代谢,改善肝脏脂肪沉积[27]。
高脂饲料诱导后,Ruminiclostridium_9相对丰度有所上升,由NC组的(2.871±2.974)%上升至(7.422±8.804)%,且差异显著(P<0.05),与非酒精性脂肪肝人群中观察到的变化一致[28];而高剂量发酵陈皮黑茶干预可以显著降低其相对丰度,由MC组的(7.422±8.804)%下降至HI组的(1.719±2.477)%,且差异显著(P<0.05)。此外,和NC组相比,MC组Ruminococcaceae_UCG-014相对丰度有所下降,由(3.675±2.380)%下降至(1.417±1.049)%,但差异不显著(P>0.05),而MI组相对丰度上升至(5.255±4.860)%,且差异极显著(P<0.01),说明发酵陈皮黑茶干预可以显著提高其相对丰度。
对小鼠的生化指标(包括FBG、空腹血清胰岛素、TC、TG、HDL-C和LDL-C水平)同肠道菌群进行相关性分析,结果如图6所示,与代谢指标呈正相关的菌包括Dubosiella、Ruminiclostridium_9、Desulfovibrio、Alloprevotella、Coriobacteriaceae_UCG-002、Alistipes、Lactococcus等,而呈负相关的菌包括Muribaculaceae_unclassified、Akkermansia、Ruminococcaceae_UCG-014、Allobaculum、Paramuribaculum、Eubacterium以及Odoribacter等。

图6 微生物代谢指标相关性分析Fig. 6 Correlation analysis between gut microbiota and metabolic indexes
通过PICRUSt以及KEGG数据库分析发酵陈皮黑茶对营养物质的微生物消化的影响,预测发酵陈皮黑茶干预组与模型组间的微生物消化差异代谢酶,结果表明,差异代谢酶分布在糖酵解与糖异生、脂肪酸代谢、丙酮酸代谢等多种途径。对主要差异代谢酶基因表达量进行分析,结果如图7所示,发酵陈皮黑茶各剂量干预组中,在糖酵解途径发挥关键作用的乳酸脱氢酶[EC1.1.1.27]、6-磷酸-β-葡萄糖苷酶[EC:3.2.1.86]被高度显著抑制(P<0.001),因此,微生物消化乳酸转变为丙酮酸以及磷酸化二糖的水解等途径被抑制。此外,参与脂磷壁酸合成的酶脂磷壁酸合酶[EC:2.7.8.20]以及1,2-二酰基甘油3-α-葡糖基转移酶[EC:2.4.1.337]经发酵陈皮黑茶干预后表达显著下调(P<0.05)(图7),而脂磷壁酸是革兰氏阳性菌细胞壁的重要成分,与革兰氏阳性菌的富集、黏附作用等密切相关,有研究显示,高脂饮食喂养的小鼠会导致革兰氏阳性细菌的积累[29],而发酵陈皮黑茶的干预,可以导致脂磷壁酸的下降,提示其具有潜在的缓解高脂饮食带来的菌群结构的变化的作用。
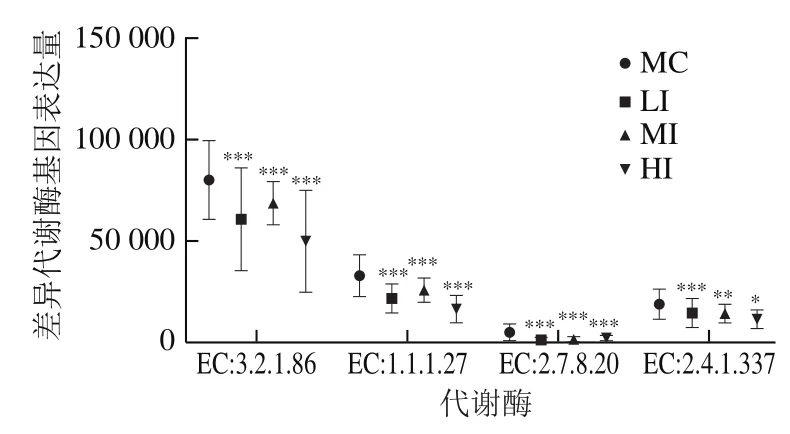
图7 主要差异代谢酶基因表达量Fig. 7 Main differential metabolic enzyme gene expression
3 讨 论
发酵陈皮黑茶是一种以陈皮和黑毛茶为原料,经过“金花菌”(冠突散囊菌)标准化发酵制成的新型茶品。饮用发酵陈皮黑茶不影响小鼠脏器指数,呈现良好的安全性,同时有助于缓解因高脂饮食导致的小鼠FGB及糖耐量异常并改善肝脏脂肪沉积,其中以糖耐量异常的改善最为显著。中剂量干预组还可以显著降低肝组织中的总胆固醇。
饮用发酵陈皮黑茶,具有较为显著的调节肠道菌群的作用,在门水平主要表现为属抑制变形菌门、降低厚壁菌门/拟杆菌门,从而与维持肠道屏障完整、降低炎症反应相关。代谢通路分析发现,饮用陈皮黑茶可能通过抑制脂磷壁酸合成,干扰革兰氏阳性菌在肠道的富集和黏附。
此外,属水平的分析发现,发酵陈皮黑茶逆转高脂饮食导致的脱硫弧菌属相对丰度增加、梭菌属相对丰度降低,从而与抑制CD36通路、减少脂肪酸吸收相关。在促进嗜胆菌增殖的同时,减少表达胆盐水解酶的Lactobacillus和Lactococcus相对丰度,提高作用于次级胆汁酸生成环节的梭菌属和Lachnospiraceae_NK4A136_group的相对丰度,因此发酵陈皮黑茶极有可能通过作用于胆汁酸代谢通路,促进脂解和胆固醇代谢,从而改善肝脏脂肪沉积。
发酵陈皮黑茶中没食子儿茶素没食子酸酯的含量较低,而茶褐素和茶多糖的含量较为丰富,同时含有橙皮苷等黄酮类化合物[15]。普洱茶中的茶褐素可以降低小鼠和人类肠道菌群中乳杆菌属、芽孢杆菌属、链球菌属和乳球菌属等的相对丰度,从而降低胆盐水解酶活性,作用于胆汁酸激活核受体法尼醇X受体相关信号通路,进而降低肝脏胆固醇水平,发挥降脂作用[30]。本研究表明,发酵陈皮黑茶的茶褐素也可能作用于相同的通路,与发酵陈皮黑茶中的其他成分协同发挥调节肠道菌群、改善糖脂代谢的作用。
