罗望子种皮原花青素系统的非酶褐变动力学和食品配方因素影响
2022-04-01苏晨露艾连中赖凤羲宋子波
苏晨露,艾连中,吴 艳,赖凤羲,*,王 溢,张 汇,宋子波
(1.上海理工大学健康科学与工程学院,上海食品微生物工程技术研究中心,上海 200093;2.上海交通大学农业与生物学院,上海 200240;3.云南猫哆哩集团食品有限责任公司,云南 玉溪 653100)
植物多酚为茶饮料、功能性饮料及草药饮料中常见的活性化合物[1],主要有没食子酸、(+)-儿茶素((+)-catechin,CN)、黄酮类、花青素、以及相关的酯化物和聚合体,例如表儿茶素(epicatechin,EC)、没食子酸糖苷、表没食子儿茶素(epigallocatechin,EGC)、表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)和缩合单宁(亦称原花青素)等[2],赋予功能性饮料优良的抗氧化、抗发炎、预防肿瘤、降血脂、降血糖及抑菌等活性[1,3]。因此,富集或添加特定多酚提取物以强化功能性饮料的保健功效是创新性研发的趋势之一。
食品多酚提取物大多来自农产加工副产品(种子壳、咖啡渣、茶叶或果皮),例如绿茶提取物[2-3]及种子壳提取物(如葡萄子[4]、咖啡豆壳[5]、栗子壳[6]和罗望子壳[7])等。种子壳的多酚提取物常富含儿茶素、EGC、EGCG、原花青素等活性成分[8-9],常具有抗氧化、抗肥胖、降血糖、抑菌和临床上辅助治疗Covid-19病毒的多重保健效益[9-11]。罗望子(Tamarindus indicaL.)又名酸角,其种子壳(即种皮)质量约占种子的29%,以50%~75%(体积分数)乙醇水溶液提取的罗望子壳多酚提取物具有良好的体外抗氧化活性[7],可能具有开发为功能性饮料、食品抗氧化剂和天然食用色素的商业应用潜力。
非酶褐变现象是茶、果汁等富含多酚饮料常见的质量问题[12-13],其机理因所含多酚组成和饮料配方因素而异,酚类的降解与缩合引起的褐变[12,14-15]密切影响产品的保健功效、颜色、香气、味道、安全性和贮藏期。因此,利用食品配方因素(天然产物保护剂、金属离子等)来控制多酚饮料的褐变反应速率是可行的方式[16-18];而配方因素对多酚饮料褐变速率与多酚关键组成的影响鲜有系统性的报道。
因此,本实验以罗望子种皮原花青素提取物(tamarind seed coat proanthocyanidins extract,TSPA)为研究对象,旨在分析常见的食品配方因素(TSPA质量浓度、食品增稠性胶体、保护剂、低pH值和金属阳离子(钠、钙、锌)等)对原花青素类提取物系统(原花青素为醇溶性,故应用乙醇系统)贮藏过程中褐变速率的影响,得到能有效控制多酚非酶褐变的基础配方,并结合超高效液相色谱-串联质谱(ultra high performance liquid chromatography-tandem mass spectrometry,UPLC-MS/MS)和主成分分析解析非酶褐变中相关成分变化,以推测原花青素非酶褐变的可能机理。本研究可为原花青素提取物的功能性饮料的研发以及其非酶褐变的控制机理提供重要的理论参考。
1 材料与方法
1.1 材料与试剂
罗望子(Tamarindus indicaL.)种皮粉末 云南猫哆哩集团食品有限责任公司;没食子酸(纯度98%)、无水乙醇(分析纯)、硫酸亚铁七水合物、水杨酸、过硫酸钾、氯化钠、七水硫酸锌、五水硫酸铜、无水柠檬酸、阿拉伯胶(arabic gum,AG)(分析纯)上海阿达玛斯试剂有限公司;原儿茶酸(protocatechuic acid,PCA)(纯度98%)、EGC(纯度大于98%)、EC(纯度大于98%)、原花青素B2(procyanidin B2,PCB2,纯度大于98%)、芦丁、香兰素(香草醛)、福林-酚、无水碳酸钠、抗坏血酸、无水氯化钙、β-环糊精(β-cyclodextrin,β-CD) 上海源叶生物科技有限公司;CN(纯度98%) 梯希爱(上海)化成工业发展有限公司;甲醇 上海安谱实验科技股份有限公司;羧甲基纤维素(carboxymethyl cellulose,CMC) 丹尼斯克(中国)有限公司;96%伏特加基酒(乙醇体积分数96%)波兰帕慕斯酒业;人参花提取物(90%(体积分数)乙醇提取,富含类黄酮)、百香果皮低甲氧基果胶(passion low-methoxy pectin,PLP)(糖醛酸质量分数78.9%、甲基酯化度31.4%)和桃胶(peach gum,PG)均为本研究室自制。
1.2 仪器与设备
Avanti JXN-26冷冻离心机 美国贝克曼库尔特有限公司;冷冻干燥机 美国Labconco公司;e2695高效液相色谱(high performance liquid chromatography,HPLC)、Acquity I-class超高效液相色谱和VION离子淌度四极杆飞行时间质谱联用仪 美国Waters公司;725型紫外分光光度计 上海光谱仪器有限公司。
1.3 方法
1.3.1 罗望子种皮原花青素提取物的制备
将罗望子种皮粉末过60 目筛后称取10 g,以液料比40∶1(V/m)加入55%(体积分数)乙醇水溶液,在50 ℃下提取105 min。提取结束后立刻离心(8 000 r/min、15 min),然后取上清液50 ℃下旋转蒸发100 mL)后冷冻干燥,得到冻干的TSPA。
1.3.2 总酚含量测定
参照Sato等[19]的方法测定总酚含量。以没食子酸为标准品,标准曲线方程为y=0.040 2x-0.012 6(R2=0.999),按式(1)计算TSPA中总多酚含量(以没食子酸当量计,单位为mg/g,TSPA为基准),按式(2)计算罗望子种皮粉末中总多酚含量。

式中:W为TSPA中总多酚(或总原花青素(单宁)、总黄酮)含量/(mg/g);ρ为样品溶液中多酚(或总原花青素(单宁)、总黄酮)的质量浓度/(μg/mL);D为稀释倍数;V为提取液总体积/mL;m为TSPA的质量/g;m0为罗望子种皮粉末的质量/g。
1.3.3 总原花青素(单宁)含量测定
参照文献[20]测定总原花青素(单宁)含量。以CN为标准品,标准曲线方程为y=0.445 3x+0.019 8(R²=0.994),计算TSPA及罗望子种皮粉末中的总单宁含量(以每克样品中所含CN质量,单位为mg/g),计算方法同式(1)、(2)。
1.3.4 总黄酮含量测定
参照文献[21]测定总黄酮含量。以芦丁为标准品,标准曲线方程为y=0.002 7x+0.056 8(R²=0.998),计算TSPA及罗望子种皮粉末中的总黄酮含量(每克样品中所含芦丁质量计,单位为mg/g),计算方法同式(1)、(2)。
1.3.5 总花青素含量测定
参考文献[22]测定总花青素含量。精确称取0.030 g TSPA溶于6.0 mL浓盐酸(质量分数36.5%)-甲醇溶液(体积比1∶99),于室温暗处萃取2 h,4 ℃离心(1 000×g、15 min),取上清液分别测定530、657 nm波长处的吸光度A530nm、A657nm。按式(3)计算TSPA中的总花青素含量,并参考式(4)计算罗望子种皮粉末中总花青素含量/(μmol/g)。
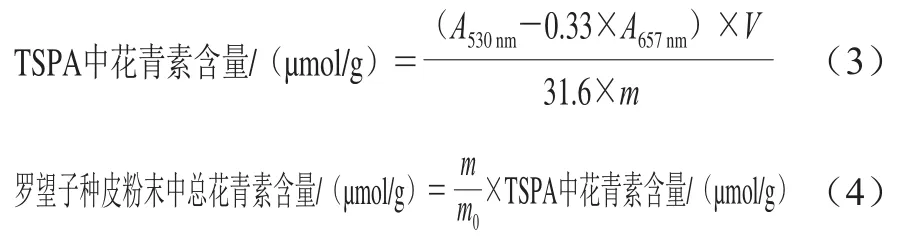
式中:V为反应体系体积/mL;m为TSPA的质量/g;m0为罗望子种皮粉末的质量/g。
1.3.6 不同TSPA溶液系统的制备与贮藏
选取乙醇体积分数、TSPA质量浓度、pH值以及常见食品添加物成分的种类(包括金属阳属子、增稠性胶体和保护剂等)等因素进行研究,探究其对多酚系统稳定性的影响,并初步解析抑制褐变的效果与机理。样品制备方法如下,将制备的样品进行55 ℃恒温贮藏稳定性的加速实验(55 ℃贮藏6 d),测定褐色指标并分析褐变动力学参数。
1.3.6.1 乙醇体积分数
96%(体积分数)伏特加基酒用食品级纯净水稀释配制成体积分数50%乙醇溶液,作为下列样品溶液配制所用母液,准确称取0.10 g TSPA溶于上述50%(体积分数)乙醇溶液中,再用食品级纯净水分别稀释得到100 mL 1.0 mg/mL TSPA溶液(乙醇体积分数分别为5%、10%、25%、45%)。
1.3.6.2 TSPA质量浓度
准确称取0.01、0.05、0.10、0.15、0.20 g样品溶于10 mL 50%(体积分数)乙醇溶液中,再以食品级纯饮用水稀释至总体积100 mL,得TSPA 0.1~2.0 mg/mL(质量浓度)、乙醇5%(体积分数)的样品溶液。所得TSPA溶液的pH值约4.8。
1.3.6.3 pH值
以10%(体积分数)乙醇水溶液配制TSPA质量浓度为2.0 mg/mL的样品溶液50 mL,加入食品级纯净水40 mL预稀释,再用1 mol/mL柠檬酸或0.1 mol/mL氢氧化钠调节pH值,记录滴加酸或碱的体积,最后补加纯水至总体积100 mL,分别得到pH 3.0、3.8、4.8和pH 5.6的含1.0 mg/mL TSPA、5%(体积分数)乙醇的样品溶液。
1.3.6.4 金属离子
用10%(体积分数)乙醇水溶液配制50 mL 2.0 mg/mL TSPA溶液,然后分别取50 mL 10 mmol/L Na+、Ca2+、Zn2+或Cu2+水溶液(分别用NaCl、CaCl2、ZnSO4·7H2O、CuSO4·5H2O配制,后同),将TSPA溶液和金属离子溶液等体积混合(对照组(CK)添加等体积的去离子水),得到100 mL含5%(体积分数)乙醇、5 mmol/L金属离子的1.0 mg/mL TSPA溶液。其中含Cu2+溶液为单宁的螯合剂[23]。
1.3.6.5 增稠性胶体
配制6.0 mg/mL的CMC、AG、PLP及PG混合体系,另用10%(体积分数)乙醇水溶液配制2.0 mg/mL的样品溶液,将两者等比例混合至总体积为100 mL,得TSPA 1.0 mg/mL、乙醇5%(体积分数)、增稠性胶体3.0 mg/mL的混合体系(对照组(CK)为不含增稠性胶体的相同体系)。
1.3.6.6 保护剂
以50%(体积分数)乙醇水溶液配制质量浓度均为20 mg/mL的TSPA溶液和人参花提取物溶液,两者等比例混合至总体积为10 mL,加纯水稀释至100 mL,得TSPA 1.0 mg/mL、乙醇5%(体积分数)、人参花提取物1.0 mg/mL的样品(对照组(CK)为不添加保护剂的相同体系)。以10%(体积分数)乙醇水溶液配制TSPA质量浓度为2.0 mg/mL的样品溶液50 mL,加入等体积的2.0 mg/mL的β-CD水溶液,混合后40 ℃水浴加热,以200 r/min搅拌30 min溶解,得TSPA 1.0 mg/mL、乙醇5%(体积分数)、β-CD质量浓度1.0 mg/mL的样品。
1.3.7 褐色指标的测定
将1.3.6节样品分装于100 mL有螺旋盖的玻璃瓶中,置于55 ℃恒温培养箱中静置6 d,每隔24 h测定420 nm波长处吸光度A420nm,以A420nm作为褐色指标[13]。
1.3.8 褐变动力学分析
果汁饮料的非酶褐变反应可以褐色指标(A420nm)进行零阶或一阶的动力学拟合[13,24],模型的适用性随所采用的指标不同而异,褐色指标变化适用于零阶动力学[15,24],故本研究采用零阶动力学拟合,拟合方程如式(5)所示,按式(6)计算褐变程度(ΔA)。
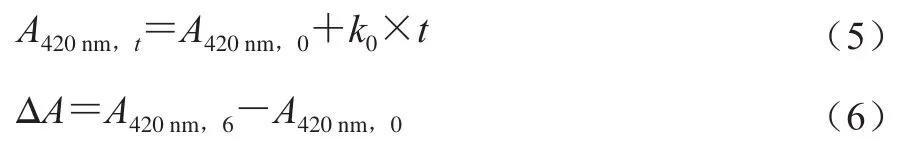
式中:t为贮藏时间/d;A420nm,0、A420nm,6和A420nm,t分别为第0、6、t天褐色值;k0为零阶动力学拟合的反应速率常数/d-1。
1.3.9 色泽的测定
室温下称取TSPA样品0.01 g溶于10 mL 50%(体积分数)乙醇水溶液,取样品溶液5 mL于色差仪CR-400中测量L*、a*、b*值,校正白板色度为L*=95.21、a*=-0.33、b*=3.41。
1.3.10 多酚组分的高效液相色谱分析
色谱条件:C18色谱柱(150 mm×4.6 mm,3.5 μm),进样量:10 μL,柱温:25 ℃,流动相A:含0.1%(体积分数)乙酸水溶液,流动相B:甲醇,流速为0.8 mL/min,检测波长:280 nm,洗脱梯度:0~3 min,90%~85% A;3~8 min,85%~80% A;8~10 min,80% A;10~35 min,80%~70% A;35~40 min,70% A;40~50 min,70%~60% A;50~52 min,60%~90% A;52~55 min,90% A。所有溶剂都经过0.22 μm滤膜过滤后使用。结果采用Empower软件进行分析处理。
将标准品PCA、EGC、CN、PCB2、EC用50%(体积分数)乙醇稀释成质量浓度分别为1、3、5、7、9、11、20 μg/mL的标准溶液,经0.22 μm滤膜过滤后进行HPLC分析。分别绘制标准曲线,得到回归方程为PCA:y=9 395.8x-3 273(R2=0.996);EGC:y=2 404.4x+313.48(R2=0.999);CN:y=5 004.3x+604.81(R2=0.999);PCB2:y=4 741.1x+361.37(R2=0.999);EC:y=6 013x+353.24(R2=0.999)。
参考1.3.6.4节方法配制含5%(体积分数)乙醇及5 mmol/L金属离子(Na+、Ca2+、Zn2+或Cu2+)的1.0 mg/mL TSPA溶液(对照组(CK)添加等体积的去离子水),将以上样品常温贮存1 d,经过离心(12 000 r/min、20 min)后取上清液进行HPLC分析,计算主要色谱峰的峰面积百分比,同时对样品进行褐色指标、褐变动力学分析。
1.3.11 多酚组分的UPLC-MS/MS分析
色谱条件:流动相A为0.1%(体积分数)甲酸水溶液,流动相B为0.1%(体积分数)甲酸-乙腈,色谱柱为BEH C18(2.1 mm×100 mm,1.7 μm),柱温45 ℃,进样量1 μL,负离子模式。洗脱条件:0~3 min,5%~20% B;3~10 min,20%~100% B;10~12 min,100% B;12~15 min,100%~95% B;15~19 min,95% B。结果进行归一化处理,计算主要色谱峰的峰面积百分比。
参考1.3.6.3节方法配制pH 3.0及含5%(体积分数)乙醇的1.0 mg/mL TSPA溶液,热贮藏(55 ℃)6 d(记为AH6);参考1.3.6.4节方法配制含5%(体积分数)乙醇及5 mmol/L金属离子(Na+、Ca2+、Zn2+或Cu2+)的1.0 mg/mL TSPA溶液,热贮藏(55 ℃)1 d(分别为NaH1、CaH1、ZnH1、CuH1),含Cu2+的TSPA溶液贮藏6 d(记为CuH6);将不作任何处理的TSPA溶液(记为对照组C0)置于55 ℃贮藏6 d(记为CH6)。样品经过离心(12 000 r/min、20 min)后取上清液进行UPLC-MS/MS分析。
1.4 数据分析与统计
实验设置3 个平行,实验数据以平均值±标准偏差表示。采用Origin 2020b软件作图。使用SPSS Statistics软件对数据结果进行单因素方差分析,通过Duncan多重比较分析显著性差异,P<0.05表示差异显著。采用SIMCA 13.0软件进行主成分分析。
2 结果与分析
2.1 罗望子种皮原花青素提取物的多酚组成和色泽
由表1可知,TSPA中总酚含量为(397.1±3.1)mg/g,在罗望子种皮粉末中含量为(144.0±1.1)mg/g。TSPA总酚组成以总原花青素(单宁)((218.3±3.9)mg/g)为主,总黄酮其次,总花青素较少。本研究所得TSPA的总酚含量高于山楂种子[25]和辣木籽[26]多酚提取物的总酚含量,后两者中主要多酚为黄酮。此外,本研究的TSPA溶液(1.0 mg/mL)呈琥珀色,L*=16.24±0.24、a*=31.81±0.61、b*=25.28±0.45。

表1 TSPA的多酚组成Table 1 Polyphenolic composition of TSPA
2.2 食品配方因素对TSPA溶液的褐变动力学的影响
2.2.1 TSPA的褐变动力学
图1为TSPA样品褐变的零阶动力学拟合结果。在所探讨的范围内,乙醇体积分数(图1A)对1.0 mg/mL TSPA溶液的褐变速率(斜率)无明显影响。TSPA质量浓度(图1B)和pH值(图1C)越高,褐变速率越大。图1D显示,与对照组CK(未添加金属离子)相比,添加Na+、Ca2+和Zn2+对1.0 mg/mL TSPA溶液的褐变速率无明显影响,但Ca2+和Zn2+略降低了褐色指标,与Zn2+、Ca2+促使溶液产生少量红棕色沉淀有关。添加单宁的螯合剂Cu2+[23]时褐色指标在热贮藏第1天上升至0.628,但第2天后随时间的延长而线性减少,在第6天降低至0.068,与Cu2+促使溶液生成大量的墨绿色沉淀有关。Cu2+组初期(1 d)褐色指标显著上升可能是Cu2+促进酚类物质的氧化[27]所致。在胶体的影响方面(图1E),与对照组CK相比,CMC、AG、PLP的添加对褐变速率具有促进作用,而PG无明显影响,褐变速率大小为:CMC>AG>PLP>CK和PG。人参花提取物和β-CD的添加(图1F)均使褐变速率减小,虽然人参花提取物提高了初始褐色值。除了Cu2+组(图1D)之外,所有样品的褐色值均随着热贮藏时间的延长而线性升高,符合零阶动力学模型。这与曹少谦等[28]研究水蜜桃在80 ℃的褐变动力学模型一致;类似的,Yang Hua等[29]对砀山梨酒的褐变因素进行分析,得到低浓度和中浓度溶解氧条件下砀山梨酒的褐变符合零阶动力学模型,而高浓度溶解氧下砀山梨酒的褐变符合一阶动力学模型。
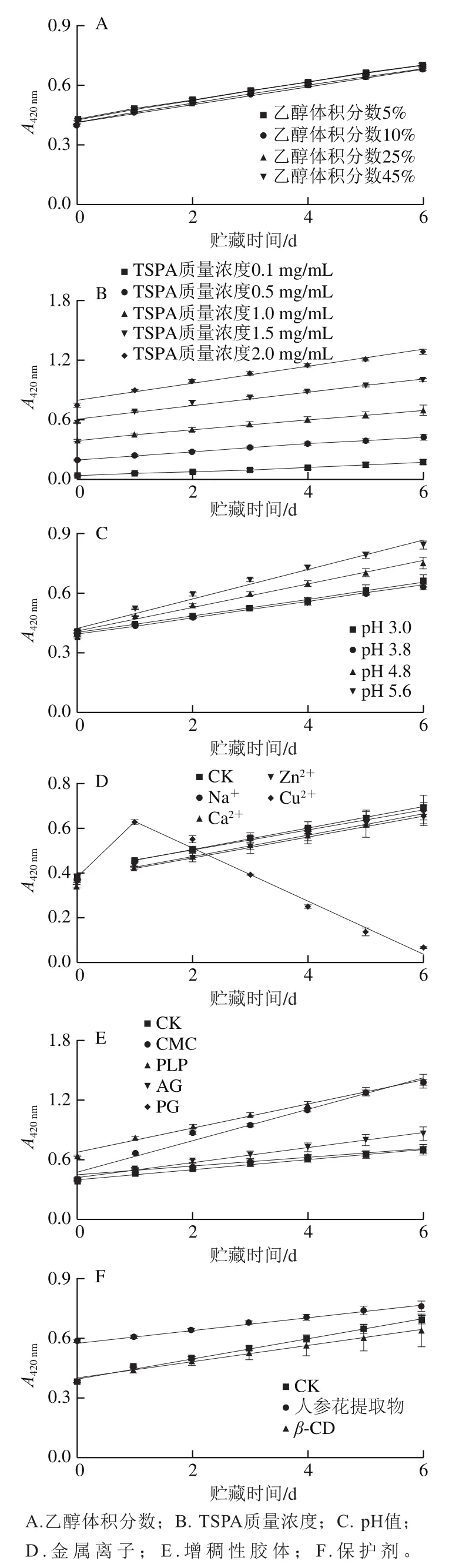
图1 不同食品配方因素下的TSPA溶液的褐变零阶动力学Fig. 1 Zero-order kinetics for browning of TSPA with different food formulation factors
不同配方因素下TSPA溶液在热贮藏6 d的褐色指标、褐变程度(ΔA)、褐变速率常数(k0)、决定系数(R2)如表2所示。0.1~2.0 mg/mL TSPA溶液的第0天褐色指标(A420nm,0)为0.049~0.747,第6天褐色指标(A420nm,6)为0.172~1.285,6 d内褐变程度ΔA=0.123~0.538,各个质量浓度之间均呈现显著差异(P<0.05)。而其他食品配方因素下(TSPA质量浓度均为1.0 mg/mL),A420nm,0=0.373~0.636,A420nm,6=0.068~1.390,ΔA=0.177~0.991(除了Cu2+组外)。TSPA样品的褐变速率常数k0为0.020 7~0.158 1 d-1。Cu2+组k0为-0.119 6 d-1,相当于澄清速率常数。零阶动力学模式拟合均呈现非常良好的线性关系,相关系数R2为0.969~0.999。综上可知,TSPA溶液的ΔA和k0主要决定于TSPA质量浓度,其次受pH值、二价金属离子和特定胶体所影响。在1.0 mg/mL TSPA溶液的基准下,1 mg/mL人参花提取物可显著降低褐变(以ΔA和k0为指标)(P<0.05),抑制程度高达40%~50%,优于其他食品因素。pH 3.0~3.8明显抑制褐变程度;而pH 5.6、添加CMC和PLP和AG会显著促进褐变(P<0.05),且促进褐变效果为CMC>PFP>AG。由于乙醇体积分数对TSPA样品褐变的影响不大,故本研究以含体积分数5%乙醇的TSPA溶液进行后续研究。
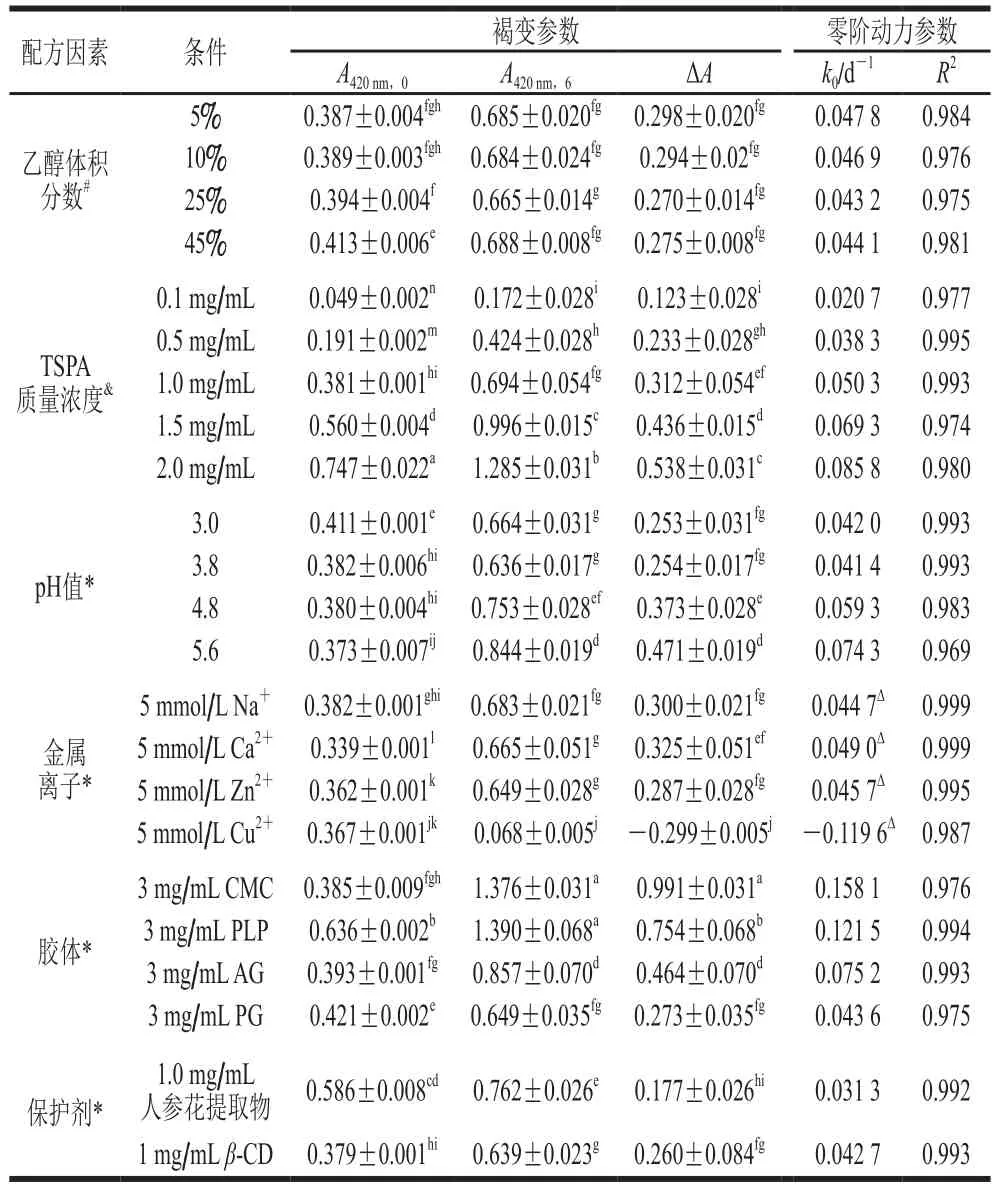
表2 食品配方因素对TSPA溶液褐变参数和零阶动力学参数的影响Table 2 Effects of food formulation factors on browning parameters and zero-order kinetic parameters of TSPA
2.2.2 TSPA质量浓度、pH值及其他食品配方因素的影响
将表2的数据进一步作线性关系分析,以阐明褐色指标A420nm(果汁贮藏稳定性的指标之一)[15]、TSPA质量浓度及pH值与褐变程度ΔA、零阶动力学拟合的反应速率常数k0的关系以及食品配方因素的影响趋势。结果如图2所示。图2A显示单纯TSPA溶液系统的A420nm,0和贮藏6 d的褐变程度(ΔA)都与TSPA质量浓度呈紧密的线性关系,斜率分别为0.367 8(R2=0.999 9)和0.214 9(R2=0.995 5)。即A420nm,0可较准确反映系统的TSPA质量浓度。图2B显示ΔA是A420nm,0的线性函数,斜率为0.584 1(R2=0.994 2)。在1 mg/mL TSPA质量浓度基准下,所探讨的食品配方因素大都不会大幅改变溶液的A420nm,0(PLP除外),图2C显示k0是TSPA质量浓度的线性函数:k0=0.033 5x+0.018 7,决定系数(R2=0.995 0)非常高。在pH 3.8~5.6范围内(图2D),k0与pH值呈线性关系,且R2=0.999 8。
综合表2可得,与不做任何处理的1 mg/mL TSPA溶液相比,添加CMC使ΔA和k0提高3 倍以上,添加PLP使A420nm,0、ΔA和k0提高约2 倍以上;而pH 5.6和添加AG会提高ΔA和k0约50%。人参花提取物能有效地抑制TSPA褐变的速率常数为40%~50%,可能由于人参花提取物中含有类黄酮成分,具有一定的抗氧化活性,因此可减缓TSPA的氧化褐变速率[30]。增稠胶体中PG适合用作TSPA溶液配方且能轻微减轻褐变的作用;而CMC、PLP和AG不适合添加,这可能与CMC和PLP富含羧基而AG含少量蛋白质有关:多酚能与多糖的羧基或蛋白质的胺基、巯基发生共价键和非共价作用[31]。二价的Ca2+、Zn2+、Cu2+会作用TSPA溶液中特定的多酚组成,沉淀量为Cu2+>Ca2+>Zn2+,Ca2+和Zn2+的沉淀作用不影响TSPA上清液的褐变程度,但Cu2+能引起大量沉淀而降低TSPA上清液后期的褐变程度。类似地,苹果缩合单宁的沉淀效果也是Fe2+>Cu2+>Zn2+[23]。至于pH值的影响,与其他pH值条件相比,低pH(3.0~3.8)组的褐变程度更低,这可能与低pH值下酚酸较稳定有关,pH值越高多酚类的自动氧化速率越高,且氧化物的醌基越容易进行亲核性反应[31]。
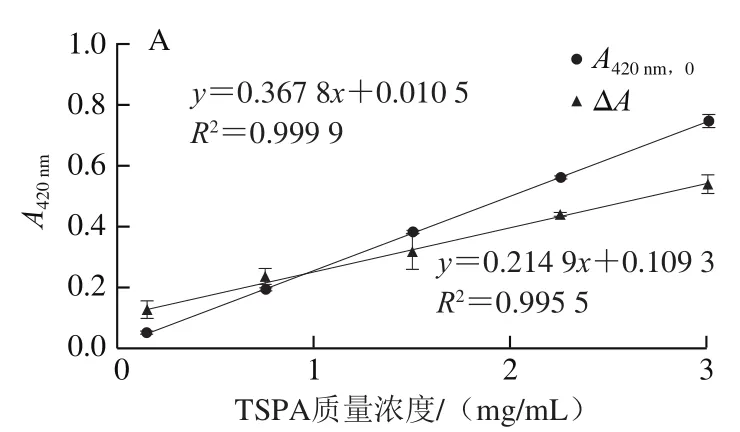
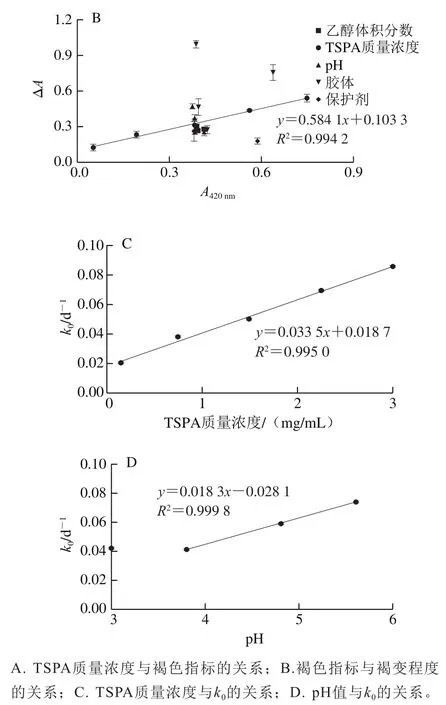
图2 TSPA质量浓度、pH和其他食品配方因素对TSPA溶液褐色指标及速率常数的影响Fig. 2 Effect of TSPA concentration, pH, and other food formulation factors on the brown indicators and rate constant of TSPA
2.3 金属离子沉淀对TSPA溶液多酚组成的影响
由于金属离子会与TSPA溶液中特定多酚组成作用而沉淀,故贮藏后TSPA溶液中的褐变程度决定于其未沉淀的多酚组成。因此,进一步以HPLC法分析经金属离子完全作用(室温静置1 d)后TSPA溶液中的多酚组成,并推论可与金属离子键结的多酚类化合物。图3的HPLC图谱显示,CK(对照组)呈现8 个可辨别的峰,与标准品对照,可鉴定出最主要的3 个峰是PCA(峰2*)、PCB2(峰5*)和EC(峰6*),未检出EGC和CN。所以TSPA主要由缩合单宁(以黄烷醇为单体)而非水解单宁(以没食子酸为单体)构成[9]。添加5 mmol/L Na+或Zn2+并室温静置1 d后(Na1或Zn1),TSPA溶液多酚组成分布类似对照组,为整体峰信号强度较小。但添加5 mmol/L Ca2+或Cu2+并室温静置1 d后(Ca1或Cu1),主要多酚为PCA,保留时间15 min以后的峰都消失,说明主要成分PCB2和EC以及小峰4*、7*和8*化合物可与Ca2+和Cu2+螯合而沉淀。

图3 添加不同金属离子后TSPA溶液多酚组成的HPLC图谱Fig. 3 HPLC chromatograms for phenolic composition in TSPA added with different metal ions
如表3所示,PCA、PCB2、EC的质量浓度范围分别为1.93~2.88 μg/mL、0.11~4.43 μg/mL以及0.10~3.27 μg/mL。与对照组相比,4 种金属离子都会显著降低TSPA中PCA、PCB2、EC质量浓度(P<0.05),Ca2+与Cu2+样品中PCA质量浓度分别降低了33%、38%,PCB2、EC质量浓度降低了96%~98%,远大于Na+与Zn2+对溶液中PCA、PCB2、EC质量浓度的影响(降低率为10%~25%)。因此,Ca2+沉淀法可用于富集食品用途的PCB2和EC类缩合单宁,效果与Cu2+沉淀法相似。对苹果缩合单宁的研究也发现PCB2和EC易与二价金属离子发生螯合并产生沉淀,效果依次为Fe2+>Cu2+>Zn2+[23]。
2.4 金属离子与热贮藏对TSPA多酚组成的影响
各种处理的样品上清液的多酚类详细组成的UPLCMS/MS基峰离子流图如图4所示。图4A为未处理的TSPA溶液(对照组C0),多酚组成有关的主要峰3、7、10、11和小峰6、9、12~16,峰4为柠檬酸。和C0组相比较,热贮藏6 d的样品(CH6,图4B)峰3相对高度减小,峰6、7、9、10、11等相对高度增加约2 倍,且新增大峰5和小峰8、17。以柠檬酸酸化至pH 3并热贮藏6 d的样品(AH6,图4C),峰4、8、11的峰面积增加(峰4为柠檬酸),峰10面积减小,且数个峰(1~3、6、12~16)消失。添加Na+并热贮藏1 d的样品(NaH1,图4D)新增峰5和0.60 min峰(Na+),多酚组成分布与C0组近似,但峰3相对高度较小些。添加Ca2+并热贮藏1 d的样品(CaH1,图4E)中与多酚相关的主要峰为峰5、7、10、11,离子强度因0.66 min峰(Ca2+)太强而相对较小。添加Zn2+并热贮藏1 d的样品(ZnH1,图4F)的多酚组成分布(峰3~17)与NaH1近似,离子强度因0.57 min峰(Zn2+)太强而减半。添加Cu2+并热贮藏1 d的样品(CuH1,图4G)多酚相关的主要峰是峰7、10、11、16;贮藏6 d后(CuH6,图4H)只剩峰7(主要)和峰10;离子强度因0.66 min处的峰(Cu2+)太强而相对较小。
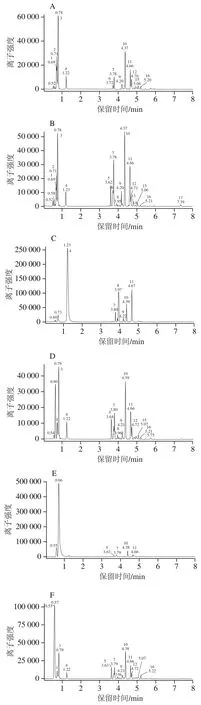
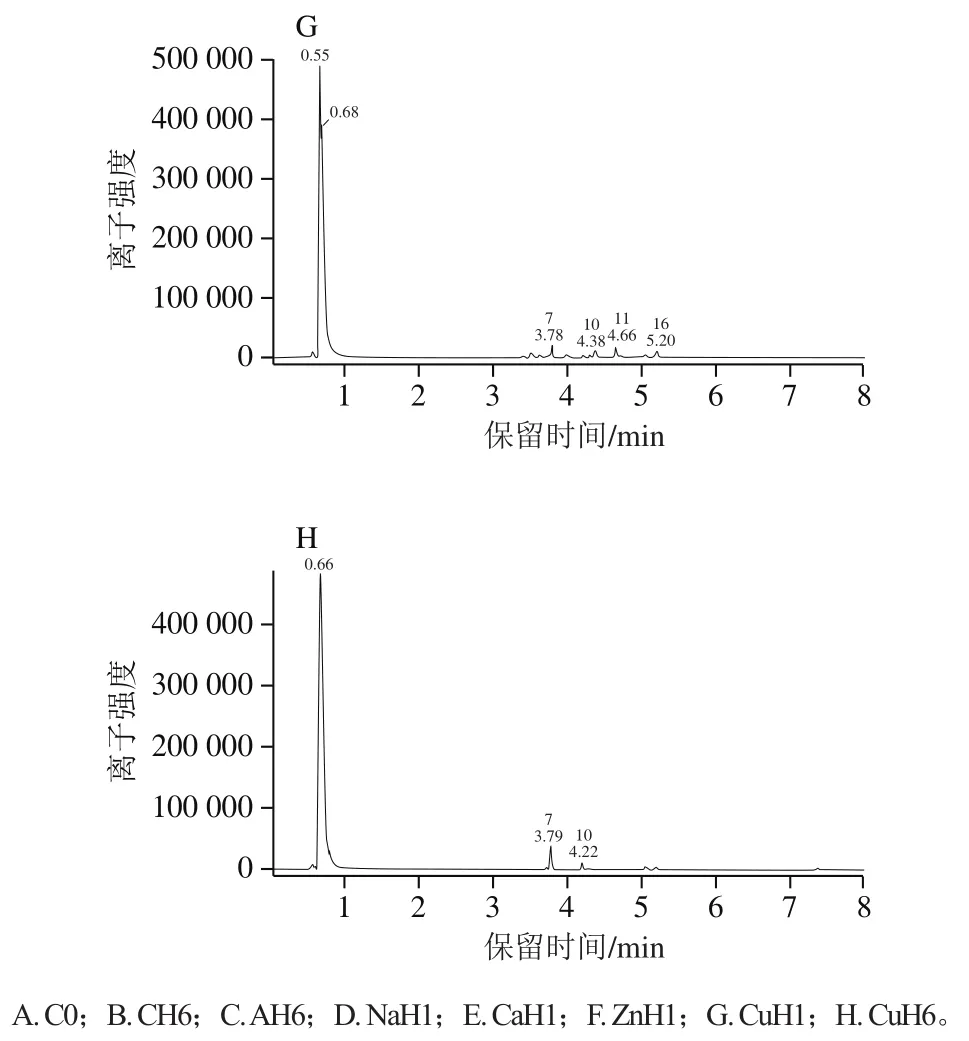
图4 不同处理后TSPA溶液上清液的多酚组成在负离子模式下的基峰离子流图Fig. 4 Base peak ion (BPI) chromatograms in the negative ion mode for polyphenolic composition in supernatants of TSPA with different treatments
参照文献[32-35]对图4各峰的质谱碎片特征进行鉴定,将质谱碎片特征与鉴定结果列于表4中。
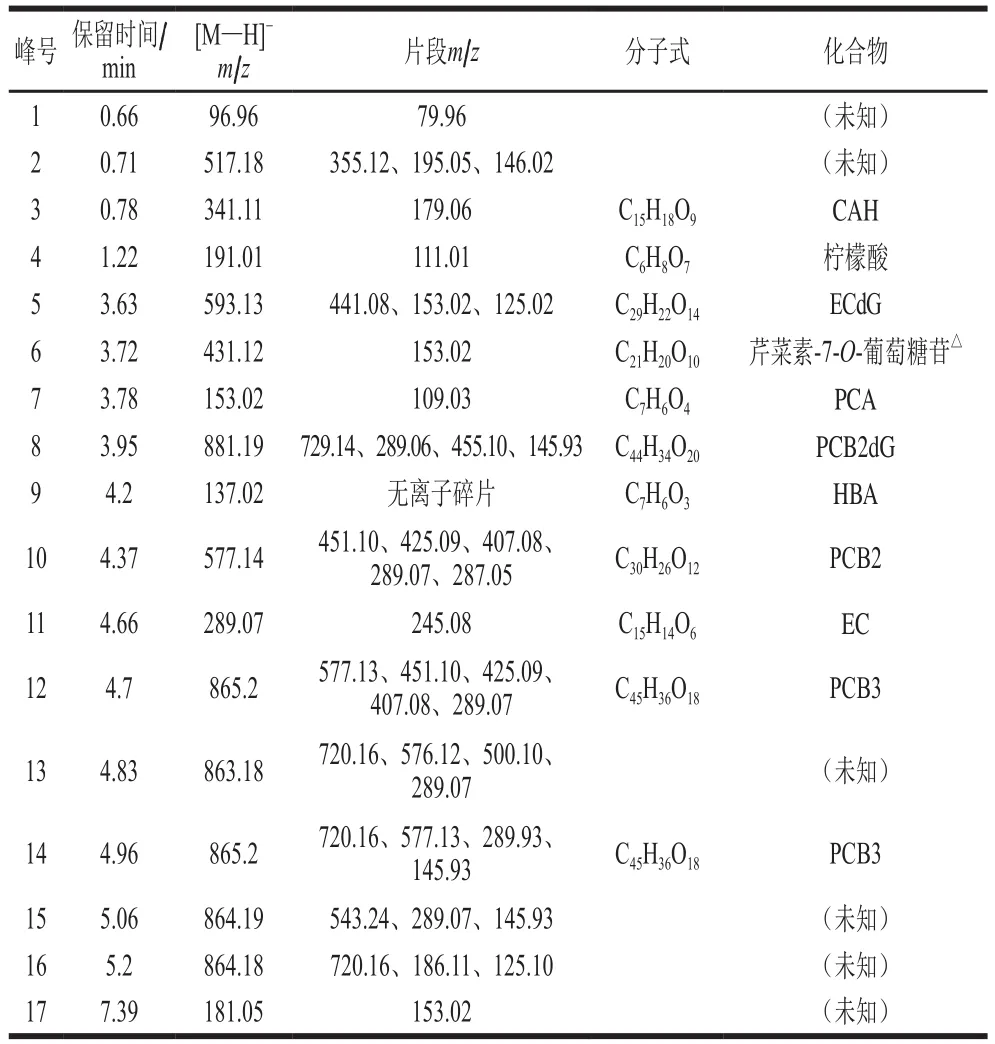
表4 UPLC-MS/MS分析TSPA中多酚组成结果Table 4 Polyphenolic composition of TSPA identified by UPLC-MS/MS
主要酚类(PCB2dG、PCB3及相关的化合物)分子离子峰与碎片离子的生成过程如图5所示。图5A显示化合物8(分子离子峰m/z881.19)鉴定为PCB2dG,失去一个没食子酰基形成原花青素B2-3’’-O-没食子酸酯(特征碎片m/z729.14),经过醌甲基化物(quinone methide,QM)裂变得到(-)-表儿茶素-3-O-没食子酸酯(m/z441.08)和m/z287.06的分子离子碎片。(-)-表儿茶素-3-O-没食子酸酯再经过甲基化形成(-)-表儿茶素-3-(3’-O-甲基)没食子酸酯(m/z455.10),或得到一个没食子酰基形成(-)-表儿茶素-3,5-O-双没食子酸酯,同化合物5的特征,其分子离子m/z为593.13,碎片离子为m/z441.08(失去没食子酰基)、m/z153.02(没食子酰基)及m/z125.02。图5B显示化合物10为PCB2(m/z577.14),其碎片离子生成途径主要包括[32]:1)醌甲基化途径形成EC特征碎片(m/z287.05和289.07);2)经过逆狄尔斯-阿尔德反应(retro Diels-Alde,RDA)裂解途径生成m/z425.08与m/z407.08两种离子碎片;3)经杂环裂变(heterocyclic ring fission,HRF)途径形成m/z451.10碎片离子。化合物11鉴定为EC,具有m/z289.07的分子离子与m/z245.08的碎片离子。化合物12和14可鉴定为PCB3的异构物(皆为m/z865.2),可通过QM途径形成PCB2和其特征离子片段。
综合图4和表4可知,对照组C0的主要多酚是CAH、PCA、PCB2以及EC,并有少量的PCB3、芹菜素-7-O-葡萄糖苷(apigenin-7-O-glucoside,AG)、HBA和未知化合物(可能是原花青素多聚体)。和C0组相比较,CH6样品的CAH相对含量减少,AG、PCA、HBA、PCB2以及EC等相对含量显著增加,新增较多的ECdG以及微量的PCB2dG和未知化合物。AH6样品新增大量的PCB2dG,EC含量显著提高,但PCA和PCB2含量大幅减少,而CAH和原花青素聚合体消失。NaH1和ZnH1样品的CAH含量减少,新增ECdG,其他多酚组成分布与C0组近似。CaH1样品的主要多酚组成有ECdG、PCA、PCB2及EC。CuH1的样品主要有PCA、PCB2、EC及未知化合物(可能是原花青素多聚体)。CuH6样品只有EC和PCB2。
本研究发现热贮藏时会产生较多的ECdG、提高原花青素主要成分与多聚体含量以及减少CAH。酸性环境(pH 3)使原花青素多聚体和CAH水解消失,新增大量的PCB2dG和EC等。4 种金属离子的添加也会使TSPA上清液的原花青素多聚体和CAH消失,但Na+和Zn2+不影响主要原花青素组成分布,Ca2+和Cu2+会显著降低原花青素主成分。TSPA和板栗壳原花青素提取物(没食子酸、CN、EC、PCB2)[36]都富含PCB2,但TSPA含大量CAH和PCA,没有没食子酸、CN和没食子儿茶素。栗子壳原花青素提取物已被开发为功能性食品并实现临床应用[10],表明TSPA也具有类似的开发价值。
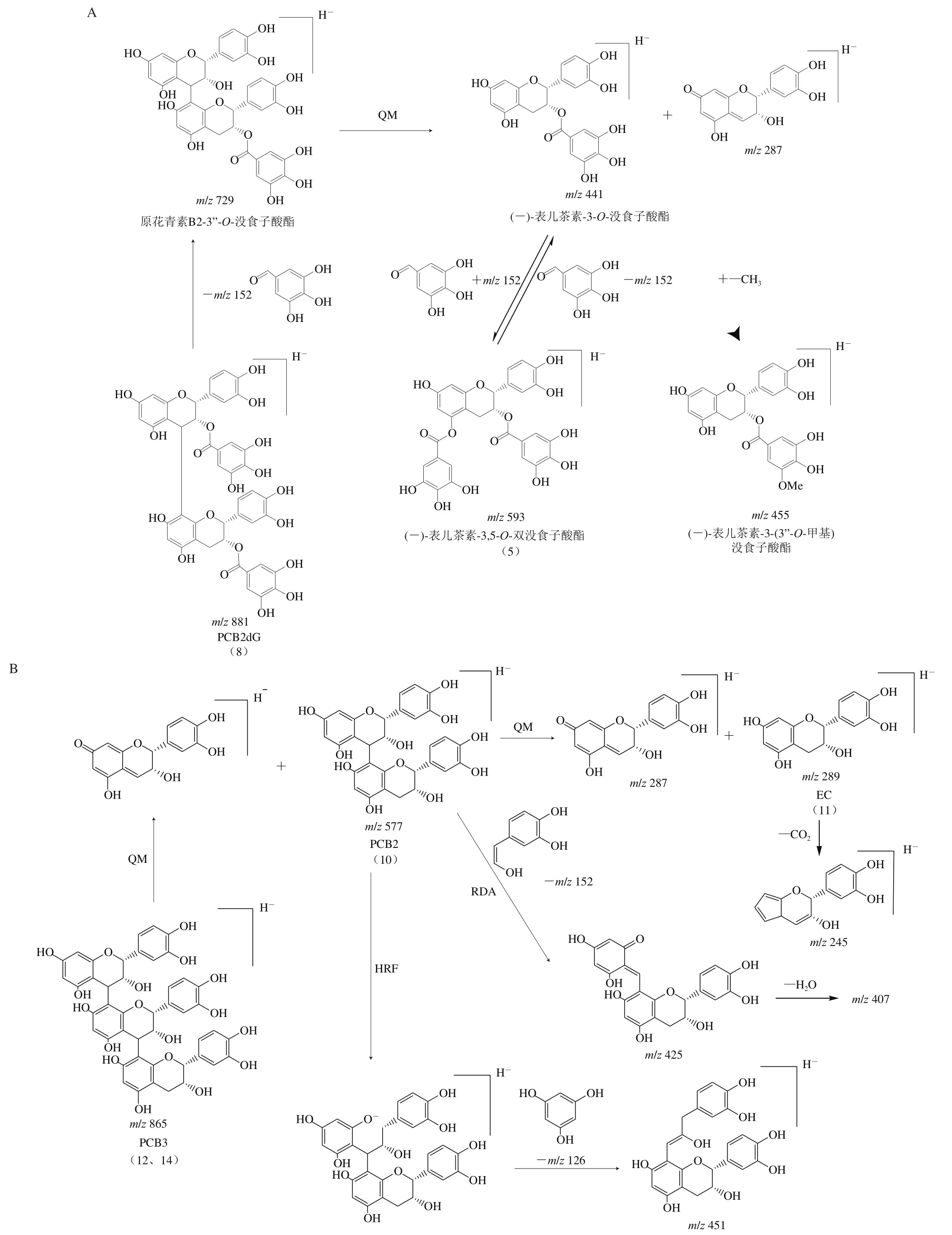
图5 PCB2dG(A)与PCB3(B)的主要碎片形成途径Fig. 5 Main fragmentation pathways of procyanidin B2-3,5-digallate and procyanidin trimer
2.5 TSPA多酚组成与褐色参数的关系
对TSPA的HPLC分析结果(图3中主要化合物的峰面积百分比)与其对应样品的褐色参数(ΔA、A420nm,0、A420nm,1)进行主成分分析,结果如图6A所示,PC1和PC2的方差贡献率分别为78.4%和18.9%,表明该模型可解释97.3%的数据变化。由于聚类程度越接近表示正相关性越高(或贡献度越大),可知C0、Na1和Zn1相接近,表示其酚类组成相近似,共同化合物4*~8*的峰面积百分比与A420nm,0或ΔA以及A420nm,0与ΔA都呈正相关(同在PC1正值区),其中化合物5*(PCB2)的峰面积百分比对ΔA的贡献最大(两者最接近且在同一象限)。Ca1和Cu1酚类组成相近似,共同化合物1*~3*的峰面积百分比与A420nm,1(第1天褐色值)呈正相关,其中化合物2*(PCA)的峰面积百分比对Cu1的高A420nm,1贡献较大(距离较接近)。针对金属离子作用、酸性(pH 3)及热贮藏前后的TSPA样品的化学组成(图4中主要化合物的峰面积百分比)与其对应样品的褐色参数(表2中ΔA、A420nm,0、A420nm,1)的主成分分析结果如图6B所示。其中,PC1和PC2的方差贡献率分别为58.2%和17.7%,总方差贡献率为75.9%。C0和NaH1酚组成相近似,化合物3、12~15的峰面积百分比与C0、NaH1位置较接近,说明样品中这些化合物含量较多;而化合物5~7、9~10的峰面积百分比较接近CH6和ΔA,化合物11的峰面积百分比接近A420nm,0,即化合物5~7、9~10的峰面积百分比对CH6和ΔA的贡献较大,而化合物11的峰面积百分比对A420nm,0贡献较大。另外,CaH1、CuH1、CuH6的酚组成相近似且与A420nm,1呈正相关,与样品CH6的情况相反。AH6含有较多的化合物8,另也含有化合物7~11(与CH6相似),但缺乏化合物3~5、12~15(与C0反向)。
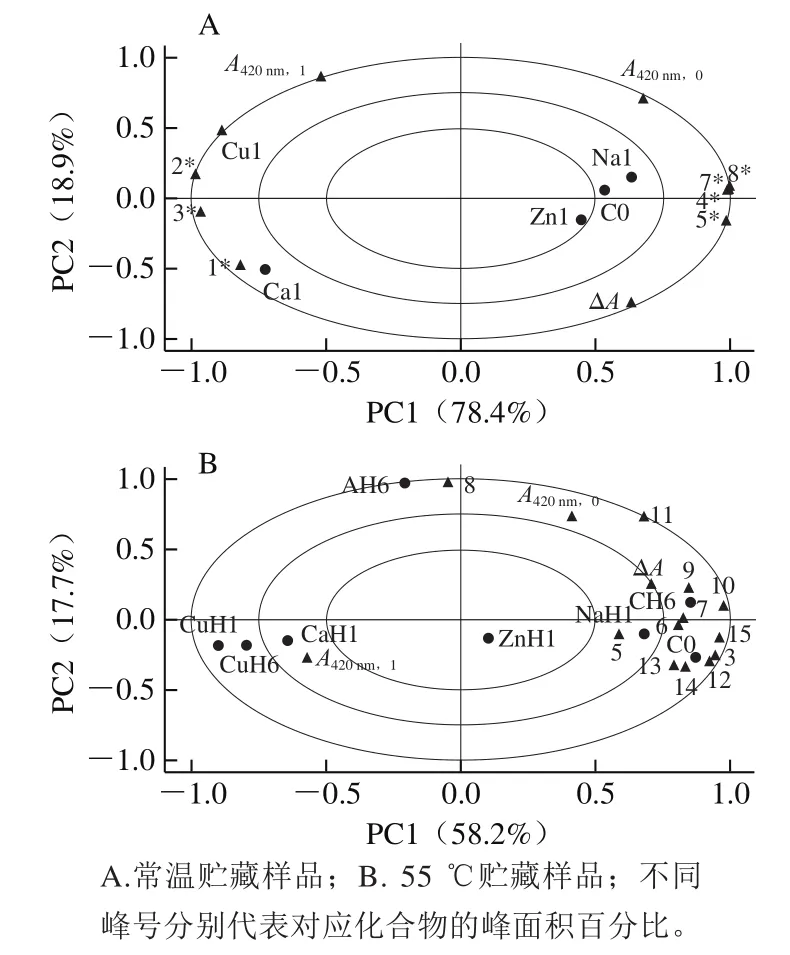
图6 TSPA中主要多酚组分及褐变参数的主成分分析结果Fig.6 Principal component analysis biplots for polyphenolic composition and browning parameters of TSPA
综上,C0、Na1和Zn1酚组成相似;CaH1、CuH1和CuH6酚组成相似;CH6及AH6各具特有的酚组成。对于未加热贮藏时的TSPA样品,PCB2的峰面积百分比与ΔA呈正相关,PCA的峰面积百分比与A420nm,1呈正相关,与ΔA呈负相关。对于热贮藏的TSPA样品,化合物11(EC)的峰面积百分比与A420nm,0呈正相关,但热处理后化合物5~7、9~10的峰面积百分比与ΔA呈正相关。因此,主成分分析结果显示TSPA原花青素主要组成中ECdG、PCA、PCB2与EC是褐变的关键因素,AG和HBA因含量少故不予考虑,这与杨子涵等[37]研究归纳出的邻苯二酚(CN/EC等)、邻苯三酚(EGC等)等多酚类结构易被氧化的结果相符。
2.6 TSPA原花青素组成变化机理的初步推断
综上,可归纳出TSPA系统在热、酸化与添加Na+或Zn2+时酚类组成变化的初步反应机理,如表5所示。将酚类化合物根据结构特性分为两类:羟基酚酸类(CAH、PCA和HBA)和黄酮类(AG、EC、PCB2和多聚体)[9],所涉及的可能反应机理与其结构特性有关。归纳如下:1)PCB3与多聚体会降解生成PCB2、EC和苯酚等,产物进一步氧化缩合反应形成ECdG、PCB2dG和EC等,热催化会促进ECdG形成,酸催化会促进PCB2dG形成,苯酚经热催化氧化形成PCA和HBA;2)PCB2会氧化聚合形成PCB3和多聚体。3)CAH分解脱去糖基形成咖啡酸(citric acid,CA)(酸催化),易与其他酚化合物氧化聚合而沉淀;4)Na+或Zn2+会沉淀部分PCA、PCB2、EC和PCB多聚体,催化EC进行ECdG形成路径。所涉及ECdG、PCA、PCB2dG、PCB2与EC的形成与含量决定了该条件下的褐变程度。
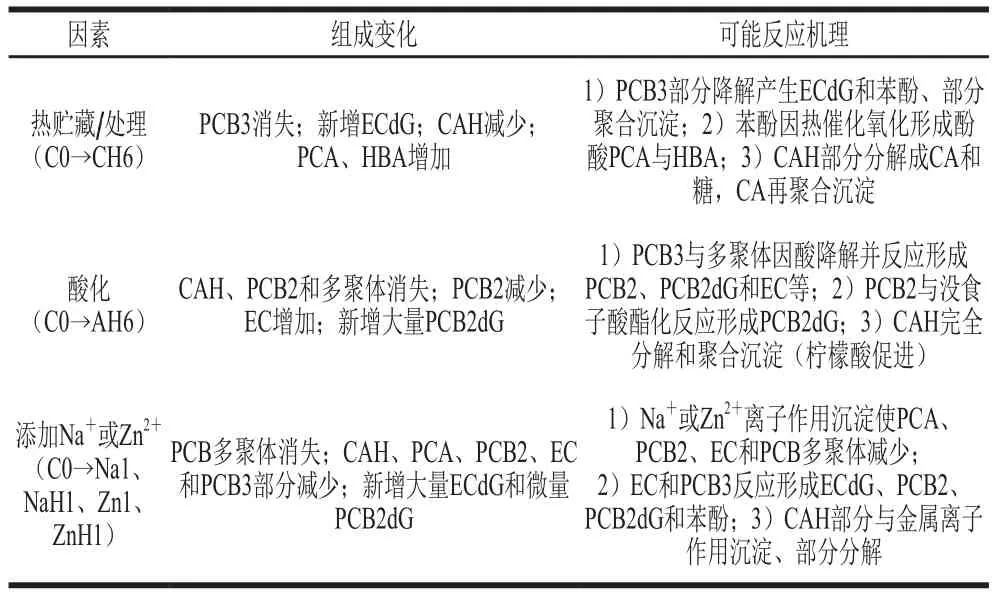
表5 TSPA系统中酚类组成变化的可能反应机理Table 5 Possible reaction mechanisms for polyphenolic composition changes of TSPA
3 结 论
本研究鉴定了TSPA中主要多酚的组成,发现不同食品配方因素下的TSPA系统的非酶褐变符合零阶动力学模型,并初步解析得到原花青素关键主成分变化及褐变的可能机理。以酒精系统为应用系统,在各种食品配方因素(TSPA质量浓度、食品增稠性胶体、保护剂、低pH值和金属阳离子(除了Cu2+外))中,所有样品的褐变均符合零阶动力学模型。TSPA溶液的ΔA和k0主要决定于TSPA质量浓度,其次受pH值、二价金属离子和特定胶体所影响。UPLC-MS/MS分析结果显示,TSPA主要含PCB2、EC、PCA和CAH,添加金属离子会显著降低TSPA溶液上清液的主要酚类含量,尤其是Ca2+和Cu2+所致降低率为96%~98%(PCB2和EC)。本研究发现TSPA原花青素主要组成中ECdG、PCA、PCB2与EC是非酶褐变的关键因素,并推测了TSPA非酶褐变的可能机理。TSPA溶液呈琥珀色,具有作为功能性饮料的基材和天然食品色素的潜力。本实验为评估和研究植物多酚的非酶褐变关键成分提供了理论参考,为工业应用中罗望子原花青素提取物提供了依据。未来需进一步研究罗望子原花青素提取物饮料的综合配方、功能性及长期贮藏稳定性,以实现其在食品饮料上的应用。
