棉铃虫效应蛋白HARP1体外表达与纯化体系的建立
2022-04-01崔少勃丁鲜张峰
崔少勃,丁鲜,张峰
(南京农业大学植物保护学院,江苏 南京 210095)
在与病原微生物和植食性昆虫等有害生物的长期生存斗争中,植物进化出了多种防御手段抵抗有害生物的侵害[1-5]。植物激素茉莉酸(jasmonate,JA)在植物应对环境胁迫时发挥了重要的作用。当植物受到昆虫取食或病原菌侵害时,植物体内迅速合成有活性的茉莉酸(JA-Ile),并与JA途径关键抑制因子JAZ蛋白和SCFCOI1泛素连接酶互作,导致JAZ蛋白的泛素化并以26S蛋白酶体的方式降解,从而释放出被JAZ蛋白抑制的转录激活因子MYC蛋白,MYC蛋白继而招募MED25等转录激活因子激活JA响应基因的表达[6-13]。
在与植物的协同进化中,有害生物也进化出操纵JA信号途径干扰植物免疫从而促进其侵染。棉铃虫(Helicoverpaarmigera)是农业生产上最具破坏性的害虫之一,其效应蛋白HARP1被证实与JAZ蛋白互作。HARP1由棉铃虫的口腔分泌,在棉铃虫取食植物时从伤口进入植物细胞,与JAZ蛋白互作并干扰JAZ蛋白与SCFCOI1的互作,JAZ蛋白无法降解进而抑制JA响应基因的表达,阻止植物的免疫激活。类HARP1蛋白在夜蛾类昆虫中具有很高的保守性,比如REPAT38是甜菜夜蛾(Spodopteraexigua)中HARP1的一个同系物,与HARP1具有相似的作用[14]。HARP1同系物在昆虫中广泛分布,表明类HARP1蛋白的进化与植食性昆虫的寄主适应有一定的关系。
蛋白质是生命活动的体现者,获得较高纯度和较大蛋白量的HARP1是对其生物学性质进行深入研究的关键,因此需要对HARP1蛋白进行体外表达与纯化。目前,常用的蛋白表达系统有原核、酵母、昆虫细胞和哺乳动物细胞等表达系统。原核表达系统表达水平高,培养周期短,操作简单,抗污染能力强,是一般蛋白质表达优先选择的表达系统。常用的蛋白纯化方法有亲和层析、离子交换层析、凝胶过滤层析和疏水相互作用层析等,需要根据蛋白质的特性制定出合理的纯化方案。本文通过原核表达系统对HARP1蛋白进行体外表达、分离与纯化,旨在为HARP1蛋白结晶条件的筛选以及相关的生物化学试验提供足量的高质量蛋白质,从而为HARP1蛋白三维结构的解析,以及在结构层面揭示效应蛋白HARP1与JAZ蛋白互作干扰JA信号途径促进昆虫取食的作用机制奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株、基因、质粒DH5α、BL21(DE3)菌株、pETDuet1-His6-MBP(His6标签由6个连续的组氨酸组成,MBP为麦芽糖结合蛋白Maltose Binding Protein)质粒来自于南京农业大学农药靶标生物学实验室。harp1基因由南京金斯瑞生物科技公司进行密码子优化并人工合成质粒pUC57-HARP1。
1.1.2 主要试剂主要试剂为T4DNA连接酶(TOLOBIO)、FastPfu Premix酶(TOLOBIO)、3C蛋白酶(南京农业大学农药靶标生物学实验室)、DNA胶回收试剂盒(TOLOBIO)、限制性内切酶BamHⅠ和XhoⅠ(TaKaRa)、MBP抗体(Absin)、ECL(electrochemiluminescence)化学发光液(天能)、脱脂奶粉(BBI)、Ni-NTA(Ni2+-Nitrilotriacetic acid)柱(BBI Ni-NTA琼脂糖纯化树脂填装)、PVDF(polyvinylidene fluoride)膜(BioLeaders)、阴离子交换柱(Cytiva source 30Q填装)、凝胶过滤层析柱superdex 200 incease 10/300GL(Cytiva)、氨苄青霉素钠(Amp)(上海生工)、异丙基-β-D-硫代半乳糖苷(IPTG)(源叶生物)。引物由南京金斯瑞生物科技公司合成。BamHⅠ-3C-HARP1(22aa)-F序列:TATATGGATCCCTGGAAGTGCTGTTTCAGGGGCCCCATATGCTGCAGCAAAACC-CGGCG;XhoⅠ-HARP1-R序列:TATATCTCGAGTTATCGGCCCCAGATTTCGA。测序由安徽通用生物科技公司完成。
1.1.3 主要仪器主要仪器为Heal Force Trident960基因扩增仪、Eppendorf centrifuge 5424高速离心机、BECKMAN COULTER Avanti J-26S XP高速离心机、SPXAPV1000高压均质机、Cytiva AKTA pure 25蛋白纯化仪、君意JY-SCZ2垂直电泳槽、君意JY-SPCT水平电泳槽、君意JY-ZY5转移电泳槽。
1.2 方法
1.2.1 序列分析使用SignalP-5.0 Server(http://www.cbs.dtu.dk/services/SignalP/)对HARP1氨基酸序列进行分析。使用Expasy(https://web.expasy.org/protparam/)进行蛋白理化性质预测。
1.2.2 PCR扩增、表达质粒构建以pUC57-HARP1质粒为模板DNA,BamHⅠ-3C-HARP1(22aa)-F和XhoⅠ-HARP1-R为上、下游引物进行扩增。50 μL扩增体系:25 μL 2×FastPfu Premix,上、下游引物各2 μL,模板DNA 1 μL,ddH2O 20 μL。PCR程序:94 ℃ 5 min;94 ℃ 30 s,58 ℃ 30 s,72 ℃ 30 s,35个循环;72 ℃ 10 min。对pETDuet1-His6-MBP质粒和3C-HARP1(22~122)片段进行BamHⅠ、XhoⅠ双酶切。50 μL酶切体系:1μg DNA,1 μLBamHⅠ,1 μLXhoⅠ,5 μL 10×Universal Buffer,补水至50 μL,37 ℃过夜酶切。用DNA胶回收试剂盒对酶切的质粒和片段进行回收,T4DNA连接酶连接,连接产物转化入DH5α,挑取阳性克隆测序验证。
1.2.3 蛋白诱导表达将表达质粒转化到BL21(DE3)菌株,37 ℃培养,挑取单菌落在Amp终浓度为50 mg·L-1的LB培养基中37 ℃过夜振荡培养成为种子液,按1∶100体积比将种子液加入Amp终浓度为50 mg·L-1的LB中进行培养至D600值为1.0,加入终浓度为100 μmol·L-1IPTG,16 ℃振荡诱导表达20 h,然后离心弃去上清液,收集菌体。
1.2.4 Western blot取10 μL诱导表达的蛋白样品,以120 V电压进行变性聚丙烯酰胺凝胶(SDS-PAGE)电泳,200 mA电流转膜2 h将蛋白转移至PVDF膜上,用5%脱脂牛奶封闭2 h,加入按1∶1 000比例稀释MBP的一抗振荡孵育2 h,用TBST(tris buffered saline tween)洗膜3次,每次5 min,加入按 1∶10 000 比例稀释的MBP二抗振荡孵育1 h,用TBST洗膜3次,每次5 min,然后加入发光液。
1.2.5 亲和层析纯化用重悬缓冲液(50 mmol·L-1Tris-HCl、200 mmol·L-1NaCl、25 mmol·L-1咪唑、5%甘油,pH8.0)重悬菌体,使用高压均质机破碎,4 ℃、18 000 r·min-1离心45 min,取上清液。使用5倍柱体积重悬缓冲液平衡Ni-NTA柱,向Ni-NTA柱中加入蛋白上清液,同时收集流穿,使用5倍柱体积重悬缓冲液冲洗Ni-NTA柱,使用洗脱缓冲液(50 mmol·L-1Tris-HCl、200 mmol·L-1NaCl、250 mmol·L-1咪唑、5%甘油,pH8.0)进行洗脱。
1.2.6 蛋白透析酶切按照质量比1∶1 000(3C蛋白酶:蛋白)向洗脱的融合蛋白中加入3C蛋白酶以切除His6-MBP标签,将蛋白与3C蛋白酶的混合液转移至透析袋中,在透析缓冲液(50 mmol·L-1Tris-HCl、10 mmol·L-1NaCl、5%甘油,pH8.0)中4 ℃过夜透析,以去除高浓度NaCl。
1.2.7 离子交换柱纯化收集透析袋内蛋白,4 ℃、18 000 r·min-离心45 min,取上清液。使用10倍柱体积的平衡缓冲液(50 mmol·L-1Tris-HCl、10 mmol·L-1NaCl、5%甘油,pH8.0)平衡阴离子交换柱,然后向阴离子交换柱中加入酶切后的蛋白上清液,收集流穿,使用10倍柱体积的平衡缓冲液冲洗阴离子交换柱,再用洗脱缓冲液(50 mmol·L-1Tris-HCl、1 mol·L-1NaCl、5%甘油,pH8.0)进行洗脱并收集洗脱液。
1.2.8 凝胶过滤层析纯化将Superdex 200 Increase 10/300GL与AKTA pure 25蛋白纯化仪连接,使用凝胶过滤层析缓冲液(50 mmol·L-1Tris-HCl、200 mmol·L-1NaCl、5%甘油,pH8.0)平衡层析柱,通过上样环进行蛋白上样,设置程序洗脱并收集。
2 结果与分析
2.1 harp1基因序列优化
从图1可见:进行密码子优化后,密码子适应度值(CAI)从0.39上升到0.95,有助于提高蛋白表达量。
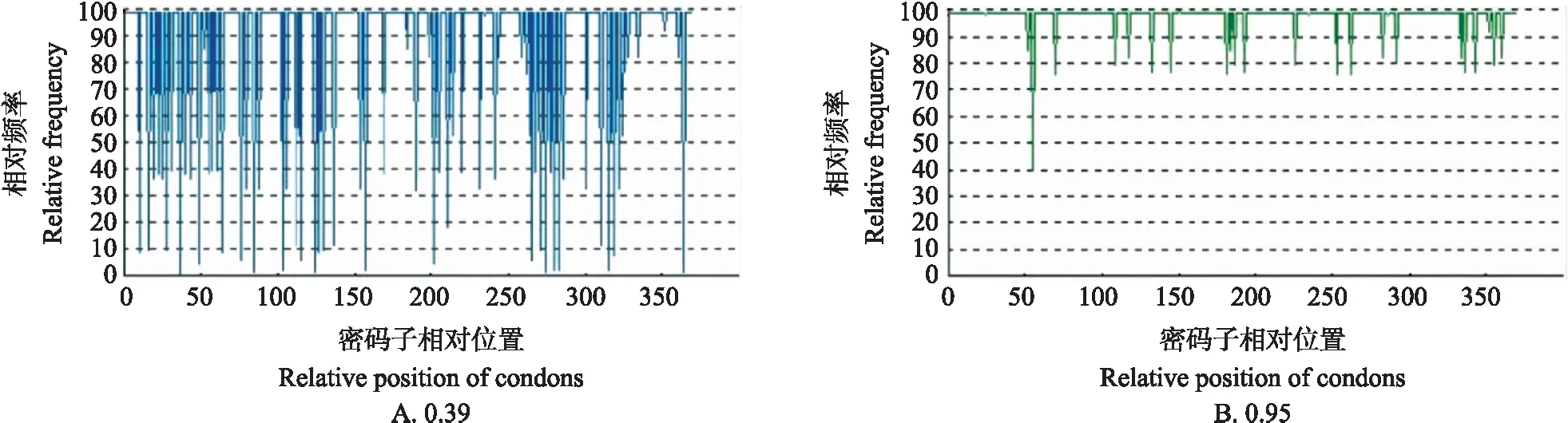
图1 密码子优化前(A)与优化后(B)harp1基因密码子使用频率沿基因序列长度的分布
2.2 HARP1蛋白序列分析
HARP1蛋白含有122个氨基酸,第1至第21个氨基酸预测为信号肽,可能性为99.93%,信号肽与成熟肽切割位点预测在第21位丙氨酸和第22位亮氨酸之间,成熟肽含有101个氨基酸(图2)。经过Expasy计算,HARP1(22~122)蛋白相对分子质量约为12×103,理论等电点(pI)为10.06。

图2 HARP1信号肽预测
2.3 HARP1截短蛋白表达质粒的构建
从图3-A可见:扩增出358 bp的3C-HARP1(22aa)DNA片段含有3C蛋白酶酶切位点基因和HARP1的第22至第122位氨基酸的基因。对pETDuet1-His6-MBP质粒和3C-HARP1(22~122)的DNA片段进行BamHⅠ和XhoⅠ双酶切(图3-B),回收目的片段,连接后转化DH5α菌株,比对测序结果。

图3 HARP1截短蛋白表达质粒的构建
2.4 HARP1截短融合蛋白的诱导表达
对转入pETDuet1-His6-MBP-3C-HARP1(22~122)的BL21(DE3)菌株进行诱导表达,成功诱导表达融合蛋白His6-MBP-3C-HARP1(22~122),蛋白相对分子质量约为55 ×103(图4-A),并用Western blot进行鉴定(图4-B)。

图4 pETDuet1-His6-MBP-3C-HARP1(22~122)诱导表达分析
2.5 HARP1截短融合蛋白的纯化
His6标签对Ni-NTA琼脂糖树脂具有亲和作用,使用Ni-NTA柱对含有融合蛋白的上清液进行纯化,洗脱液中含有大量目的蛋白(图5)。

图5 Ni-NTA柱纯化His6-MBP-3C-HARP1(22~122)SDS-PAGE电泳
2.6 HARP1截短融合蛋白的酶切和纯化
MBP标签能够促进重组蛋白的表达,提高重组蛋白的可溶性,但MBP与HARP1的融合蛋白不利于下一步的蛋白质结晶筛选。为了排除外源标签对蛋白本身结晶的影响,我们在HARP1与MBP之间引入了3C酶切位点,通过3C蛋白酶的特异性切割,切除His6-MBP标签。
用3C蛋白酶酶切洗脱下来的His6-MBP-HARP1(22~122)(图6-A),同时进行透析,酶切后样品用阴离子交换柱进行分离纯化。由于HARP1(22~122)蛋白理论等电点(pI)为10.06,在pH8.0的缓冲液中带正电荷,不会结合在阴离子交换柱上,但His6-MBP标签(相对分子质量约43×103)pI为5.48,在pH8.0的缓冲液中带负电荷,会结合在阴离子交换柱上,可以在流穿中获得较纯的HARP1(22~122)蛋白(图6-B)。
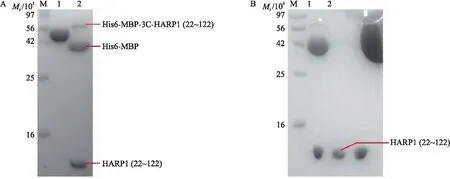
图6 His6-MBP-3C-HARP1(22~122)的酶切与纯化分析
2.7 HARP1截短蛋白的纯化
对HARP1(22~122)蛋白进行凝胶过滤层析,收集样品进行SDS-PAGE分析。由图7可见:获得了较纯的HARP1(22~122),参考标准蛋白层析图判断HARP1(22~122)为单体形式。经计算,最终通过培养1 L的大肠杆菌培养液能产出约5 mg HARP1蛋白,能够满足后续的蛋白质晶体筛选等对蛋白纯度和蛋白量要求较高的试验要求。

图7 HARP1(22~122)蛋白凝胶过滤层析纯化(A)及收集管SDS-PAGE电泳图(B)
3 讨论
JA信号在调节植物对植食性昆虫的防御中起重要作用[15]。除了HopZ1a和HopX1等来源于病原菌的效应蛋白被证实能够与JAZ蛋白互作,操控JA信号之外[16-17],来源于病毒的效应蛋白也被发现能够通过JAZ蛋白操控JA信号。如黄瓜花叶病毒CMV的2b蛋白通过与宿主JAZ蛋白互作,抑制JAZ蛋白的降解从而减弱JA信号的传导[18]。然而,在昆虫效应蛋白中类似的研究较少。因此,对HARP1蛋白的进一步研究有助于加深对昆虫效应蛋白靶向植物免疫系统的分子机制以及昆虫与植物互作方式的理解。
病虫的致病机制一直是昆虫学和植物病理学的研究热点,但针对致病相关蛋白的体外表达和纯化,结合结构生物学研究其致害机制的报道并不多。在本文中,通过对harp1基因进行密码子优化,经蛋白预测软件预测,构建去掉信号肽的pETDuet1-His6-MBP-3C-HARP1(22~122)质粒并进行诱导表达,经过亲和层析、酶切、透析、离子交换层析和凝胶过滤层析等纯化手段,最终获得无标签的HARP1(22~122)单体蛋白,成功建立了棉铃虫效应蛋白HARP1体外表达与纯化体系。
本体系使用原核表达系统,与其他表达系统相比具有成本低、周期短、操作简单、产量大的特点,纯化过程充分利用蛋白自身性质,获得的HARP1蛋白状态单一纯度高,能够满足后续的蛋白质晶体筛选等对蛋白纯度和蛋白量要求较高的试验要求;若对蛋白量有更高的要求,还可以从诱导温度、诱导时间及IPTG浓度等方面进行蛋白表达和诱导体系的优化。在后续的研究中将尝试获得HARP1晶体和HARP1与JAZ的复合体晶体,通过X射线衍射的方法解析其结构,或利用核磁共振的方法直接解析HARP1蛋白和HARP1与JAZ的复合体结构。此外,HARP1蛋白还可用于离体条件下的蛋白互作试验。
除上述使用的原核表达系统以外,针对不同的蛋白性质需采用不同的表达系统。与原核表达系统相比,酵母表达系统也具有使用简单、表达量高的特点,可对异源蛋白进行修饰,但有时会出现蛋白切割问题。昆虫细胞表达系统表达效率高,具备完善的修饰加工能力,但外源蛋白表达处于极晚期病毒启动子的调控下,由于病毒感染,细胞开始死亡,无法进行连续性表达。哺乳动物细胞表达系统可以使蛋白正确折叠并提供复杂的N型糖基化和准确的O型糖基化等加工修饰,更加接近于天然蛋白,但产率低、不易纯化、费用高昂。正常情况下,首先尝试通过原核表达系统来表达目的蛋白,后续通过检测蛋白是否具有生物活性以判断表达系统的适用性。
HARP1蛋白的成功制备为后续的HARP1蛋白三维结构的解析奠定了重要的基础,有助于从蛋白构象水平解析HARP1与JAZ蛋白互作影响JA信号途径的作用机制。同时,对HARP1蛋白的研究有助于理解这一类昆虫与植物的互作机制,为杀虫剂新靶标的发现及作物抗虫育种提供参考。
