大豆根系响应早期缺铁胁迫的转录组分析
2022-04-01王婷婷陈鸽包悦琳金东淳
王婷婷,陈鸽,包悦琳,金东淳
(延边大学农学院,吉林 延吉 133000)
铁是植物必需的微量营养素,在植物生长发育过程中参与光合作用、呼吸作用、叶绿素合成、氧化还原反应、氮固定等多种生理生化反应[1-2]。铁缺乏将会导致植物生理生化发生不利改变,轻度缺铁时植物光合速率降低,叶绿素合成减少,严重时叶片会出现黄化现象[3-4]。重度缺铁时,植物新生叶片变黄,叶绿素合成停止,生物量大幅度下降,导致农作物产量和品质降低[5-6]。铁在地壳中含量很高,但其主要以生物有效性低的三价铁形式存在,特别是在碱性土壤中,碱性和高碳酸盐严重降低了有效铁的溶解度。由于缺铁导致叶绿素生物合成受阻造成的植物缺铁黄化症(IDC),是一种功能性缺铁,叶片失绿变黄[7]。缺铁植物吸收土壤中铁通常分为2种机制:非禾本科单子叶植物和双子叶植物通常采用还原吸收机制,即缺铁时,通过铁螯合还原酶(FCR)将土壤中溶解度较低的Fe3+还原成易被植物吸收的Fe2+[8];禾本科植物主要采用螯合吸收机制,缺铁时,植物会通过合成与分泌麦根酸(mugineic acid,MA)类物质并螯合铁来满足对铁元素的需求[9]。依靠Fe3+还原系统吸收铁的植物,如双子叶植物大豆,往往比使用螯合吸收机制的禾本科植物对缺铁更敏感[10]。在缺铁条件下,大豆地上部幼叶脉间均匀失绿,叶脉正常,无斑、无畸形,随着时间推移,病叶最后干枯;地下部根系发育较差,根短而细少,根瘤数量较少,严重时植株早期枯萎和死亡[11-12]。
近几年,转录组测序技术已广泛应用于大豆对缺铁胁迫响应的研究[13-17]。O’Rourke等[13]通过转录组测序,发现铁高效大豆品种‘Clark’在响应长期(14 d)缺铁胁迫时,根系中与铁吸收和稳态、防御以及DNA复制、甲基化作用相关的基因表达有差异。Atwood等[14]进一步的研究表明,‘Clark’对缺铁胁迫的应激反应中DNA复制基因的沉默导致与防御、免疫、衰老、死亡、蛋白质修饰、蛋白质合成、光合作用以及铁摄取和转运相关基因的大量转录重编程。Lauter等[15]通过转录组测序,发现‘Clark’在响应早期(1和 6 h)缺铁胁迫时,在根系中参与防御、激素信号、铁吸收的基因差异表达,在叶片中参与DNA复制和糖信号传导的基因差异表达。Lauter等[16]通过转录组测序发现,‘Clark’在缺铁胁迫30 min时就能检测到参与铁吸收和稳态、防御以及DNA复制、甲基化作用的差异表达基因。这些研究表明,在长期和短期缺铁胁迫下,铁稳态、防御和DNA复制、甲基化相关基因均参与了‘Clark’的缺铁应激反应,说明大豆可能存在新的机制来响应缺铁胁迫。目前,我国对大豆缺铁胁迫的响应差异研究较少[17]。本研究对不同铁效率大豆品种进行早期缺铁胁迫处理,从分子水平解析我国大豆品种根系早期对缺铁胁迫的响应差异,为了解我国大豆品种铁吸收机制提供理论基础。
1 材料与方法
1.1 试验材料
水培试验于2020年在延边大学农学院人工气候室进行,供试材料为已鉴定的铁高效大豆品种‘吉育99’和铁低效大豆品种‘吉育93’[6]。在铁缺乏(1 μmol·L-1Fe)营养液中培养20 d的2个品种植株表型见图1。

图1 在铁缺乏(1 μmol·L-1 Fe)营养液中培养20 d时铁高效品种‘吉育99’(A)和铁低效品种‘吉育93’(B)V2期叶片颜色对比
1.2 试验设计
为模拟碱性石灰性土壤,本试验建立了一套水培体系。将常规发芽(芽长2~3 cm)且发育良好的大豆幼苗移至1 L含正常铁含量(25 μmol·L-1Fe)的营养液中。营养液由1.5 mmol·L-1KNO3、0.8 mmol·L-1Ca(NO3)2、0.3 mmol·L-1(NH4)H2PO4、0.2 mmol·L-1MgSO4、25 μmol·L-1CaCl2、25 μmol·L-1H3BO3、2 μmol·L-1MnCl2、2 μmol·L-1ZnSO4、0.5 μmol·L-1Na2MoO4、0.1 μmol·L-1CuSO4、1 mmol·L-1MES缓冲液(pH5.5)和25 μmol·L-1Fe(Ⅲ)EDDHA构成,每4 d换1次营养液。水培16 d后即植株长出第1片三出复叶时,将所有幼苗的根系在蒸馏水中冲洗6次,然后分别转入铁正常(25 μmol·L-1Fe)和铁缺乏(1 μmol·L-1Fe)营养液中,处理1 和6 h后取植株的完整根系,装袋标记并在液氮中快速冷冻后置于-80 ℃保存,每个样品3次重复。RNA提取、建库和转录组测序均委托北京百迈客生物科技有限公司完成。
将‘吉育99’和‘吉育93’分别命名为T、S,各时间的处理组合如表1所示。

表1 试验材料的处理组合
1.3 文库构建
样品检测合格后,进行文库构建:用带有Oligo(dT)的磁珠富集真核生物mRNA,加入Fragmentation Buffer将mRNA随机打断,以mRNA为模板,用六碱基随机引物(random hexamers)合成第1条cDNA链,加入缓冲液、dNTPs、RNase H和DNA polymerase Ⅰ合成第2条cDNA链,利用AMPure XP beads纯化 cDNA;纯化的双链cDNA进行末端修复、加A尾并连接测序接头,然后用AMPure XP beads进行片段大小选择;通过PCR富集得到cDNA文库。文库构建完成后,使用Q-PCR方法对文库的有效浓度(>2 nmol·L-1)进行准确定量,以保证文库质量。库检合格后,不同文库按照目标下机数据量进行pooling,用Illumina平台进行测序。
1.4 测序数据质量控制
采用如下过滤方式对数据进行质量控制:去除含有接头的Reads,去除低质量的Reads(包括去除N的比例大于10%的Reads、去除质量值Q≤10的碱基数占整条Read的50%以上的Reads),对高质量的Clean Data进行分析。
1.5 基因表达量与差异基因的筛选
抽取自一个转录本的片段数与测序数据(或Mapped Data)量、转录本长度、转录本表达水平都有关,为了让片段数能真实地反映转录本表达水平,需要对样品中的Mapped Reads数和转录本长度进行归一化。StringTie通过最大流量算法,采用FPKM[18](fragments per kilobase of transcript per million fragments mapped)作为衡量转录本或基因表达水平的指标,FPKM计算公式如下:
式中:cDNA Fragments表示比对到某一转录本上的片段数,即双端Reads数;Mapped Fragments(Millions)表示比对到转录本上的片段总数(106);Transcript Length(kb)表示转录本长度(103个碱基)。
将数据库与大豆基因组数据库(Wm82.a2.v1)进行对比,利用edgeR软件[19]进行样品组间的差异表达分析,在差异表达基因检测过程中,将差异表达倍数(fold change)≥ 2且差异显著性P<0.05作为筛选标准。差异表达倍数表示两样品(组)间表达量的比值。
1.6 差异表达基因GO分类
根据差异基因检测结果,使用Blast2GO软件[20]对差异表达基因进行GO功能注释,再用WEGO软件进行GO功能分类统计并绘图。
1.7 差异表达基因KEGG通路富集分析
根据差异基因检测结果,根据KEGG数据库(http://www.genome.jp/kegg/)对差异表达基因进行KEGG注释,并利用KOBAS软件[21]对检测到的差异基因进行KEGG通路分类以及富集分析,本试验以Q<0.05为阈值,将满足该阈值的代谢通路定义为在差异表达基因中显著富集的通路。
1.8 差异表达基因转录因子分析
对筛选到的差异表达基因进行转录因子分析,将差异表达基因比对到植物转录因子数据库4.0(plant transcription factor database,PlantTFDB 4.0)(http://planttfdb.cbi.pku.edu.cn/),所设阈值为E=1×10-5,获得差异表达基因的转录因子分类与数目。
2 结果与分析
2.1 测序质量分析
本试验分别对铁高效、铁低效大豆24个根系样本进行有参转录组测序(表2),共获得236.33 Gb Clean Data,各样品Clean Data均达到5.81 Gb,GC含量均在44.53%及以上,Q20碱基比例在96.74%及以上,Q30碱基比例在91.60%及以上。以上数据说明全部样品转录组测序质量较高,可为后续的差异表达基因分析提供科学的依据。
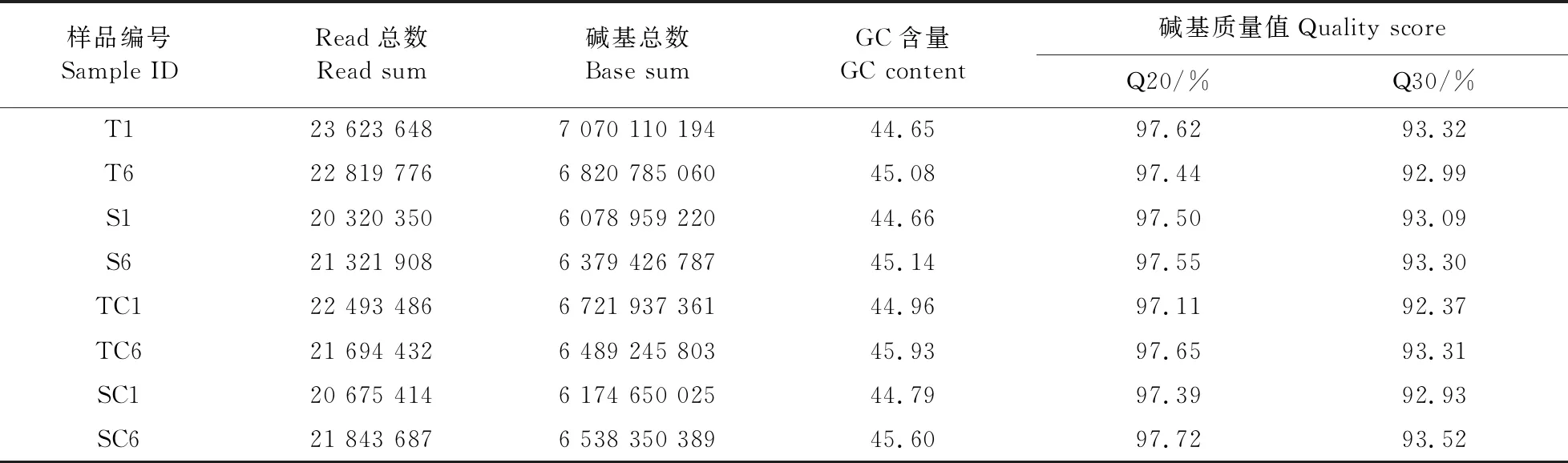
表2 测序数据质量评估统计表
2.2 大豆根系响应早期缺铁胁迫差异表达基因(DEG)数分析
从图2可见:与对照(CK)相比,1 h铁高效组共筛选出2 309个DEG,其中上调1 051个,下调1 258个;1 h铁低效组共筛选出1 512个DEG,其中上调597个,下调915个;6 h铁高效组共筛选出2 320个DEG,其中上调1 346个,下调974个;6 h铁低效组共筛选出1 307个DEG,其中上调637个,下调670个。结果表明,缺铁胁迫1 h时,铁高效和低效大豆品种根系中差异表达基因多数为下调基因;缺铁胁迫6 h时,铁高效大豆品种的差异表达基因多数为上调,铁低效大豆品种下调基因仍占多数。综上,铁高效大豆品种差异基因的数量和表达量随着缺铁胁迫时间的延长而增加,而铁低效品种差异基因数量和表达量随着胁迫时间的延长而降低。

图2 缺铁胁迫下不同铁效率大豆品种差异表达基因数
2.3 大豆根系响应早期缺铁胁迫DEG的GO功能分析
缺铁胁迫处理1 h的铁高效大豆品种在生物学过程中的细胞进程富集的DEG数为739个,代谢过程富集的DEG数为677个;细胞组分中的细胞和细胞成分富集的DEG数均为839个;分子功能中的结合富集的DEG数为841个,催化活性富集的DEG数为804个(图3-A)。铁低效大豆品种在生物学过程中的细胞进程富集的DEG数为449个,代谢过程富集的DEG数为410个;细胞组分中的细胞和细胞成分富集的DEG数均为506个;分子功能中的结合富集的DEG数为570个,催化活性富集的DEG数为513个(图3-B)。

图3 GO功能分类统计
缺铁胁迫处理6 h的铁高效大豆品种在生物学过程中的细胞进程富集的DEG数为734个,代谢过程富集的DEG数为676个;细胞组分中的细胞和细胞成分富集的DEG数均为802个;分子功能中的催化活性富集的DEG数为868个,结合富集的DEG数为857个(图3-C)。铁低效大豆品种在生物学过程中的细胞进程富集的DEG数为430个,代谢过程富集的DEG数为388个;细胞组分中的细胞和细胞成分富集的DEG数均为494个;分子功能中的结合富集的DEG数为521个,催化活性富集的DEG数为466个(图3-D)。
差异表达基因的GO功能分析结果表明,不同铁效率大豆品种根系在响应早期(1和6 h)缺铁胁迫时,产生的差异表达基因均显著富集在细胞进程、代谢过程、细胞和细胞成分以及分子结合和催化活性相关功能基因中,表明缺铁胁迫对大豆的细胞及生理代谢过程存在较大的影响。
2.4 大豆根系响应早期缺铁胁迫DEG的KEGG富集分析
由图4-A可见:与对照相比,缺铁胁迫处理1 h的铁高效大豆品种共有774个DEG富集于117条通路中,铁低效大豆共有522个DEG富集于113条通路中;缺铁胁迫处理6 h的铁高效大豆品种共有807个DEG富集于125条通路中,铁低效品种共有472个DEG富集于115条通路中。在富集显著性(Q<0.05)最可靠的前20条代谢通路中,缺铁胁迫处理1 h的铁高效大豆品种差异表达基因显著富集的代谢通路有苯丙烷生物合成(63个)、倍半萜和三萜生物合成(16个)、植物病原体相互作用(111个)、植物MAPK信号通路(60个)、类黄酮生物合成(18个)、植物激素信号转导(95个)、淀粉和蔗糖代谢(53个)等。缺铁胁迫处理1 h的铁低效大豆品种差异表达基因显著富集的代谢通路有苯丙烷生物合成(36个)、倍半萜和三萜生物合成(9个)、植物病原体相互作用(92个)、植物MAPK信号通路(51个)、类黄酮生物合成(17个)、淀粉和蔗糖代谢(42个)、植物昼夜节律(19个)等(图4-B)。

图4 缺铁胁迫处理1 h差异表达基因的KEGG富集分析
缺铁胁迫处理6 h的铁高效大豆品种差异表达基因显著富集的代谢通路有苯丙烷生物合成(72个)、倍半萜和三萜生物合成(10个)、类黄酮生物合成(24个)、植物昼夜节律(23个)、糖酵解/糖异生(34个)、角质、木栓质和蜡的生物合成(13个)、半乳糖代谢(27个)等(图5-A)。缺铁胁迫处理6 h的铁低效大豆品种差异表达基因显著富集的代谢通路有苯丙烷生物合成(34个)、倍半萜和三萜生物合成(6个)、植物MAPK信号通路(36个)、类黄酮生物合成(10个)、亚油酸代谢(9个)、抗坏血酸和醛酸代谢(12)、谷胱甘肽代谢(14)等(图5-B)。

图5 缺铁胁迫处理6 h差异表达基因的KEGG富集分析
综上可知,不同铁效率大豆品种在响应早期(1和6 h)缺铁胁迫时,产生的差异表达基因均富集于苯丙烷生物合成、倍半萜和三萜生物合成等代谢通路。
2.5 大豆根系响应早期缺铁胁迫的转录因子分析
缺铁胁迫处理1 h,铁高效大豆品种存在转录因子的差异表达基因总共有273个,这些转录因子共划分到41个转录因子家族中,其中,差异表达基因最多的转录因子家族是AP2/ERF-ERF(38个),其次为C2H2(27个)、MYB(26个)、WRKY(23个)、bHLH(23个)、NAC(12个)等(图6-A);铁低效大豆品种存在转录因子的差异表达基因总共有197个,共划分到39个转录因子家族中,其中,差异表达基因最多的转录因子家族是AP2/ERF-ERF(26个),其次为MYB(20个)、WRKY(19个)、C2H2(15个)、bHLH(14个)、NAC(10个)等(图6-B)。缺铁胁迫处理6 h,铁高效大豆品种存在转录因子的差异表达基因总共有217个,这些转录因子共划分到42个转录因子家族中,其中,差异表达基因最多的转录因子家族是bHLH(25个),其次为WRKY(20个)、AP2/ERF-ERF(16个)、NAC(14个)、MYB(13个)、C2H2(12个)等(图6-C);铁低效大豆品种存在转录因子的差异表达基因总共有134个,共划分到39个转录因子家族中,其中,差异表达基因最多的转录因子家族是bHLH(18个),其次为AP2/ERF-ERF(12个)、MYB(12个)、NAC(10个)、WRKY(9个)等(图6-D)。结果表明,铁高效大豆品种在响应缺铁胁迫时,在1和6 h的差异表达基因所涉及的转录因子家族具有高度相似性,受缺铁胁迫调控的转录因子家族主要有AP2/ERF-ERF、C2H2、MYB、WRKY、bHLH、NAC等。同样,铁低效大豆品种也具有高度相似性,受缺铁胁迫调控的转录因子家族主要有AP2/ERF-ERF、MYB、WRKY、bHLH、NAC等。
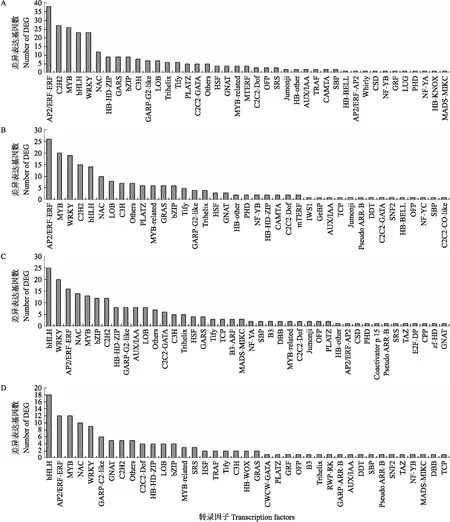
图6 差异表达基因所属转录因子家族分类
3 讨论
不同铁效率大豆品种对缺铁黄化症的耐受性存在显著差异[22],为了解不同铁效率大豆品种根系对早期缺铁胁迫的响应差异,本研究对缺铁胁迫下的铁高效品种(吉育99)和铁低效品种(吉育93)根系进行转录组测序。通过对不同铁效率大豆品种在缺铁胁迫条件下产生的差异基因数进行统计分析,结果表明,与对照(CK)相比,缺铁胁迫处理1 h时,2个大豆品种根系中多数基因表达量降低,少数升高;缺铁胁迫处理6 h时,铁高效大豆品种大部分差异基因表达量显著上升,多数为上调基因,而铁低效大豆品种下调基因仍占多数。本研究发现,铁高效大豆品种差异基因数和表达量随着缺铁胁迫时间的延长而增加,而铁低效品种差异基因数和表达量随着胁迫时间的延长而降低。差异基因在2个大豆品种中表达情况不一致,说明早期缺铁胁迫对大豆相关基因表达量存在一定影响,且对不同铁效率大豆品种的影响存在显著差异。
胁迫可以引发植物的一系列反应。胁迫反应始于植物在细胞水平上对胁迫的识别,这种识别可以激活信号转导途径,从而在个体细胞内及整株植物中传递。在差异表达基因的GO功能分析中,主要涵盖了生物学过程,细胞组分和分子功能三大类。本研究结果表明,不同铁效率大豆品种受早期缺铁胁迫影响产生的差异表达基因在生物学过程中的细胞进程、代谢过程,细胞组分中的细胞和细胞成分以及分子功能中的分子结合和催化活性比例较高。缺铁胁迫处理1和6 h的不同铁效率大豆品种差异表达基因富集情况一致,说明缺铁胁迫对大豆的细胞及生理代谢过程存在一定的影响。翟丽红[17]研究发现,在长期(12 d)缺铁胁迫下,大豆差异表达基因显著富集在细胞功能、分子结合、催化活性、细胞过程、代谢过程。这与本研究中短期(1和6 h)缺铁胁迫差异基因功能注释结果一致,说明该类功能基因在缺铁胁迫1 h后就能对缺铁胁迫作出响应。Lauter等[15]研究发现铁高效大豆品种体内典型铁吸收相关基因在缺铁1 h后就能对缺铁胁迫作出响应,本研究结果与之相一致。
通过差异表达基因的KEGG富集分析发现,缺铁胁迫处理1 h,不同铁效率大豆品种富集的差异表达基因数在苯丙烷生物合成(T1:63个,S1:36个)、倍半萜和三萜生物合成(T1:16个,S1:9个)、植物病原体相互作用(T1:111个,S1:92个)、植物MAPK信号通路(T1:60个,S1:51个)、淀粉和蔗糖代谢(T1:53个,S1:42个)等代谢通路中有显著差异(P<0.05)。缺铁胁迫处理6 h,不同铁效率大豆品种富集的差异表达基因数在苯丙烷生物合成(T6:72个,S6:34个)、倍半萜和三萜生物合成(T6:10个,S6:6个)、类黄酮生物合成(T6:24个,S6:10个)、谷胱甘肽代谢(T6:21个,S6:14个)等代谢通路中有显著差异(P<0.05)。综上,不同铁效率大豆品种差异表达基因富集的代谢通路中苯丙烷生物合成、倍半萜和三萜生物合成等代谢通路在1和6 h富集的差异表达基因数均存在显著差异。说明早期缺铁胁迫对大豆苯丙烷类和萜类等次生代谢产物的生物合成途径有影响,且对不同铁效率大豆品种的影响存在差异。Piotrowska-Niczyporuk等[23]研究发现植物处于铅重金属胁迫时,其生长发育会受到抑制,而植物体内次生代谢产物含量会有显著变化。Waters等[10]研究发现大豆在碱性和低铁条件下,苯丙素合成途径中的基因会显著上调。Schmid等[24]研究发现缺铁条件下拟南芥中苯丙素合成途径的基因表达会增加。本研究发现,苯丙烷生物合成途径是富集差异基因数较多且差异最显著的一条代谢通路,说明不同铁效率大豆品种在响应早期缺铁胁迫时,苯丙烷生物合成途径存在显著差异。
转录因子是植物应答非生物胁迫过程中的关键调控因子,研究表明植物体内某些特定的转录因子表达量变化能提高其适应逆境的能力[25]。当植物铁供应不足或过量时,植物中的转录因子能诱导或抑制许多铁稳态相关基因的表达。对差异表达基因进行转录因子分析,结果表明铁高效大豆品种受早期缺铁胁迫调控的转录因子家族主要有AP2/ERF-ERF、C2H2、MYB、WRKY、bHLH、NAC等,铁低效大豆品种的转录因子家族主要有AP2/ERF-ERF、MYB、WRKY、bHLH、NAC等。Li 等[26]通过对转基因大豆过表达转录因子GmbHLH57和GmbHLH300的研究发现,2个转录因子的过表达上调了下游Fe摄取基因,增加了转基因植物中的铁含量;与野生型相比,这些双过表达的转基因植物对缺铁胁迫的耐受性更强,并发现这 2种转录因子在根和结节中表达,并由铁缺乏诱导。Yuan等[27]研究发现bHLH38蛋白与FIT蛋白相互作用来控制拟南芥中大部分铁摄取反应。bHLH38/39/100/101与 FIT同属于bHLHIb亚家族,bHLH38、bHLH39 在叶和根中都表达,且都被缺铁强烈诱导[28]。Zhang等[29]研究发现bHLH104和bHLH105通过直接激活bHLH38/39/100/101和PYE的转录,正向调控Fe稳态。Stein等[30]发现MYB72基因因拟南芥根部缺铁而上调。Scully等[31]研究发现拟南芥MYB58和MYB63以及高粱MYB60转录因子过表达导致拟南芥和高粱的苯丙烷途径的表达和木质素的合成增加。Waters等[10]研究发现大豆中有些MYB转录因子在缺铁或碱性胁迫下上调,并与苯丙烷类合成基因上调一致。本研究发现缺铁胁迫处理1 h的不同铁效率大豆品种的转录因子数量在AP2/ERF-ERF(T1:38个,S1:26个)、C2H2(T1:27个,S1:15个)、bHLH(T1:23个,S1:14个)等转录因子家族中存在显著差异,缺铁胁迫处理6 h的不同铁效率大豆品种的转录因子数量在WRKY(T6:20个,S6:9个)、C2H2(T6:12个,S6:5个)、bHLH(T6:25个,S6:18个)等转录因子家族中存在显著差异。说明在缺铁胁迫下,不同铁效率大豆品种对转录因子表达的调控存在显著差异。
本研究利用转录组测序技术分析了不同铁效率大豆品种根系响应早期缺铁胁迫的差异表达基因,通过GO功能注释、KEGG代谢通路富集分析、转录因子分析,发现缺铁胁迫1 h后大豆就能对缺铁胁迫作出响应,且不同铁效率大豆品种在苯丙烷生物合成、转录因子调控等相关基因的表达存在显著差异。
