乳腺X线立体定位导丝引导切除活检在触诊阴性乳腺钙化病变诊治中的应用*
2022-03-29田春祥姚惠芳刘泽宇吕欣霖韩晓蓉宁平
田春祥,姚惠芳,刘泽宇,吕欣霖,韩晓蓉,宁平
610091成都,成都市妇女儿童中心医院 乳腺科(田春祥、刘泽宇、吕欣霖、韩晓蓉、宁平),放射科(姚惠芳)
乳腺癌是威胁女性健康最主要的恶性肿瘤之一,研究表明,早期诊断和治疗可提高乳腺癌患者的生存率,改善预后[1]。临床上,有部分癌前病变及早期乳腺癌患者,如非典型增生、导管原位癌和微小浸润性乳腺癌,临床查体及彩超均是阴性,仅在乳腺X线检查时发现可疑钙化灶。将这些病灶准确定位后完整切除进行活检,对乳腺癌及癌前病变的早期诊断和治疗有重要意义。我院探索将乳腺X线引导下使用定位导丝穿刺定位钙化病变后开放切除活检应用于不可触及肿块且彩超阴性的乳腺钙化病变的诊断和治疗,并创新性地引入带刻度的压迫板,旨在探讨该技术在这类特殊乳腺病变患者中的临床应用价值。
1 资料与方法
1.1 一般资料
回顾性收集我院自2017年9月至2021年7月,临床查体阴性而乳腺X线检查BI-RADS分级为4~5级的可疑钙化病变,并进行乳腺钙化灶开放手术切除活检的病例131例;年龄26~64岁,中位年龄46岁。双侧均有钙化病变者7例(双侧均有可疑病灶并分别取活检者算两个病灶),最终138个病灶进行分析。其中22个病灶采用体表定位标记后开放切除活检,116个病灶采用乳腺X线立体定位导丝引导开放切除活检。所有患者均进行了乳腺彩超及X线检查,83例患者接受了乳腺MRI检查。
1.2 方法
1.2.1 体表标记法 首先,在影像系统通过X线片测量钙化灶距乳头位置。根据患者患侧乳房拍摄的X线轴位片(craniocaudal position,CC位)和侧斜位片(mediolateral oblique position,MLO位),以CC位片上经过钙化灶、与乳腺基底部垂直的线为X轴,测量乳头到X轴的距离A(图1),在MLO位片上经过钙化灶、与胸大肌垂直的线为Y轴,测量乳头到Y轴的距离B(图2)。然后,在患者患侧乳房体表定位。以乳腺X线CC位摄片体位,画出距离乳头为A的X轴线,以乳腺X线MLO位摄片体位,画出距离乳头为B的Y轴线,X轴线和Y轴线两者交点C即为钙化灶的体表位置。
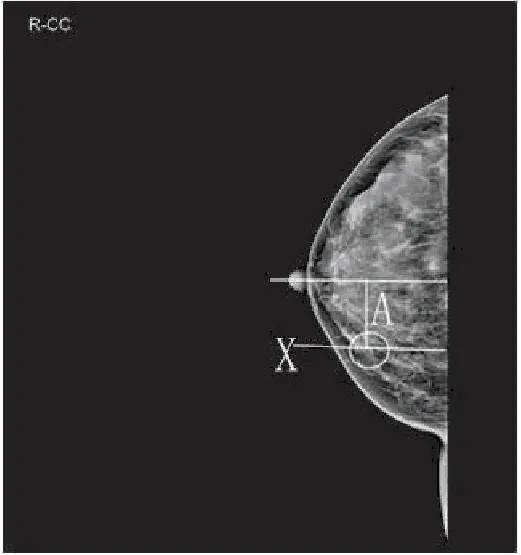
图1 CC位确定钙化灶与乳头的距离
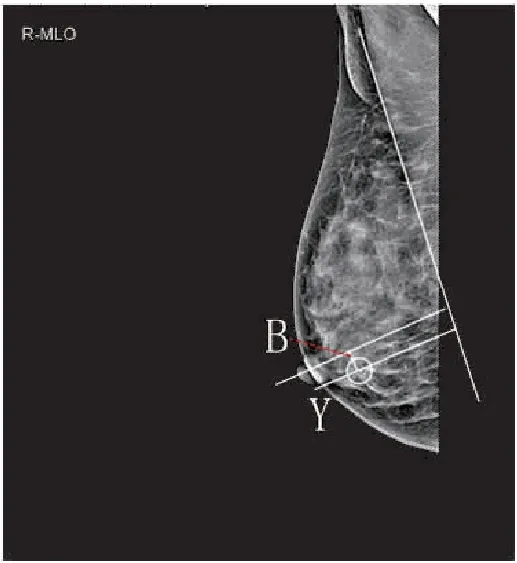
图2.MLO位确定钙化灶与乳头的距离
1.2.2 立体定位导丝引导法 首先同体表标记法,在患者患侧乳房体表标记钙化灶的位置,设计可能的穿刺点和手术切口,以CC位或侧位(medidateral position,ML)穿刺。患者取坐位,以ML位穿刺为例进行说明。将乳腺X线机的压迫板更换为专用多孔板(图3),患侧乳房皮肤及多孔板、摄影平台消毒,摄CC位和ML位片(图4),患者处于ML位摄片体位固定。通过多孔板上的刻度,确定钙化灶位于孔板的位置。确定穿刺点,2%利多卡因局部麻醉后,于预穿刺点垂直刺入内置导丝的定位穿刺针,到达预定钙化灶深度后,立即摄ML位片(图5)和CC位片(图6),确定针尖位于钙化灶中央,退出穿刺鞘,再次摄CC位片(图7)。患者穿刺部位再次消毒,剪去过长的导丝,无菌纱布覆盖固定后等待手术。在影像系统上确定以导丝尖端为中点的钙化灶范围,并告知手术医师,以确定手术切除范围。

图3 多孔压迫板示意图

图4 在ML位确定钙化区域4D

图5 在ML位于钙化区域4D垂直置入穿刺针

图6 在CC位确认穿刺针进针深度位于目标钙化区

图7 拔除穿刺针鞘后摄片确认导丝尖端位于目标钙化区
1.2.3 手术方法 单纯体表定位组,常规消毒铺巾后,以体表定位处做切口,逐层切开皮肤及皮下组织至腺体表面,根据钙化灶范围,柱状切除钙化灶及周围乳腺组织。立体定位导丝引导组,常规消毒铺巾后,结合体表定位和导丝位置选择切口,逐层切开皮肤及皮下组织至腺体表面,以导丝尖端为中心,根据钙化灶范围,柱状切除钙化灶及周围乳腺组织。上述两组切除病灶后,以丝线标记上、下、内、外各切缘,标本送术中X线摄片,保证可疑钙化灶已完整切除,并有足够的切缘(图8)。如摄片显示可疑钙化灶未完整切除,术中继续扩大切除,再次乳腺X线摄片,直至确认所有术前定位的目标钙化灶完全切除。逐层缝合伤口,标本送石蜡病理检查。如病理结果为良性病变,无需再次手术;如为恶性病变,根据患者病情和定位情况,选择再次手术方式。
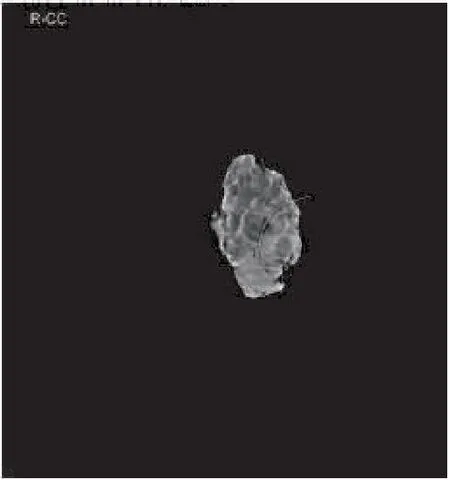
图8 切除标本X线摄片,确认目标钙化灶已被切除
1.3 观察指标
观察比较两种定位标记方法的定位准确性和手术切除便捷性,如术中二次切除率、保乳率,以比较两种标记方法在临床推广的可行性。
2 结 果
2.1 两种定位标记方法的定位准确性
所有病灶均在术中切除,没有发生术中无法找到病灶的情况。单纯体表定位组术中切除标本大小为(5.0±1.4)cm,立体定位导丝引导组术中切除标本为(5.0±2.3)cm;立体定体导丝引导组的二次扩大切除率低于单纯体表定位组[1.7%(2/116)vs9.1%(2/22)],其余患者均一次准确完整切除病灶。立体定位导丝引导组在定位过程中无气胸、血肿形成、定位导丝断裂、迷走神经反应导致无法完成定位等并发症发生;术中有6例患者因牵拉导致定位导丝脱落,但不影响继续手术切除病灶。
2.2 两种定位标记方法的术后病理结果
单纯体表定位组活检20例患者(2例双侧病变,共22个病灶),其中良性病灶15例,包括腺病7例,纤维腺瘤3例,导管内乳头状瘤2例,腺肌上皮瘤1例,导管上皮非典型增生2例;恶性病灶7例,包括导管原位癌3例,导管原位癌伴微浸润1例,浸润性导管癌2例,粘液癌1例,恶性病灶检出率为31.8%。3例患者接受了保乳术,其余患者接受了乳房单纯切除术,保乳率为 42.9%(表1)。
立体定位导丝引导组活检111例患者(5例为双侧病变,共116个病灶),其中良性病灶99例,包括腺病54例,硬化性腺病5例,纤维腺瘤18例,导管内乳头状瘤9例,导管上皮非典型增生13例;恶性病灶17例,包括导管原位癌9例,导管原位癌伴微浸润1例,浸润性导管癌7例。恶性病灶检出率为14.7%;9例患者接受了保乳术,其余患者接受了乳房单纯切除术,保乳率为52.9%(表1)。

表1 两组患者病理结果分析
两组恶性病灶24例,恶性病灶检出率为20.7%。其中导管原位癌占50%,导管原位癌伴微浸润占8.3%,浸润性癌占41.7%。所有浸润性癌灶均小于1 cm,且腋窝淋巴结阴性,均为早期癌,总体保乳率为50%。
全组共83例患者接受MRI检查,38例为BIRADS 3级,其中只有1例为导管原位癌,其余均为良性病灶;45例为BI-RADS 4级,其中13例为恶性,其余均为良性。以MRI BI-RADS 3级及以下为阴性,BI-RADS 4级及以上为阳性,病理结果良性为阴性,恶性为阳性,则本研究中MRI对钙化灶的阴性预测值为97.4%;阳性预测值为28.9%。体表定位组9例接受了MRI检查,8例为BI-RADS 4级,占比为88.9%,立体定位导丝引导组74例接受MRI检查,37例4级以上,占比为50%。
3 讨 论
2020年全球癌症统计报告显示,随着乳腺癌发病率的上升,乳腺癌已成为全球第一大癌种。我国2020年新增乳腺癌42万例,死亡12万例,乳腺癌发病率和死亡率均呈上升趋势[2-3]。欧美发达国家虽然乳腺癌发病率高,但是死亡率呈下降趋势,这得益于乳腺癌筛查带来的早期诊断和早期治疗[4-5]。在欧洲,基于乳腺X线检查的乳腺癌筛查能降低34%的乳腺癌特异性死亡[6]。研究发现70%的临床触诊阴性的导管原位癌是由乳腺X线摄片发现的[7]。早期乳腺癌肿块不明显,临床查体可能阴性,主要表现可能为乳腺钙化灶。乳腺X线摄片对早期乳腺癌微小钙化成像清晰、灵敏度高,有利于发现无临床症状、以微小钙化为主要表现的早期乳腺癌,尤其是导管原位癌。因此欧美国家乳腺癌筛查多以乳腺X线检查为基础。
钙化是乳腺X线影像的常见征象,也是乳腺癌重要的表现,甚至是某些早期乳腺癌唯一的征象[8-9]。研究发现临床查体阴性的乳腺癌中,55%的患者以乳腺X线上的钙化为主要表现[10]。而导管原位癌仅表现为钙化的比例更高,多表现为粗细不均、形态不规则、簇状或线段状分布的钙化。Oligane等[10]对494例乳腺钙化活检,检出了52例(10.5%)乳腺癌,其中导管原位癌35例(67.3%),浸润性癌17例(32.7%),而且浸润性癌的平均肿瘤直径为0.3cm,腋窝淋巴结阴性,均为早期乳腺癌。本研究对138例乳腺钙化活检,检出了恶性病灶24例,恶性病灶检出率为20.7%。其中导管原位癌占50%,导管原位癌伴微浸润占8.3%,浸润性癌占41.7%。所有浸润性癌灶均小于1cm,且腋窝淋巴结阴性,均为早期癌。由此可见,重视对可疑乳腺钙化灶的活检,可以提高早期乳腺癌的检出率,特别是对那些临床查体阴性、以钙化为首要表现的早期乳腺癌极为重要。
对于临床查体阴性、以钙化为主要表现的病变,如何精准定位是完整切除进行活检活检的关键。既要准确切除病变,还要尽量减少切除正常组织。因超声对钙化相对不敏感,主要的活检方式是在X线引导下进行,包括空芯针穿刺活检(stereotactic core needle biopsy,SCNB)、真空辅助活检(stereotactic vacuum-assisted biopsy,SVAB)、X线立体定位导丝引导开放活检(stereotactic wire localized biopsy,SWLB)[11-13]。SCNB损伤小,但获取组织量小,存在活检失败和病理低估的风险。Wahab等[14]的Meta分析显示,SCNB结果为平坦上皮非典型增生的患者,有5%最终活检结果为乳腺癌。SVAB获取组织量大,结果相对准确,但是仍存在较高病理低估风险[15-16]。Huang等[16]的Meta分析比较了SCNB和SVAB对钙化病变活检的优势。结果显示,对钙化病变活检时,SCNB对导管原位癌的低估率为22.98%,明显高于SVAB 的低估率11.05%。SCNB和SVAB的低估率较高,存在二次活检的风险,另外两者需要专用设备,且价格昂贵,限制了在低收入地区和基层医院的应用。
SWLB是在乳腺X线立体定位引导下,将导丝定位于可疑钙化灶中,引导开放手术活检。SWLB将不可扪及的钙化灶变成了可见的导丝,引导精准定位切除活检,可完整切除钙化病灶,获得准确的病理结果。SWLB实现了对钙化病变的定位、活检、切除,集诊断和治疗为一体,在临床中得到了广泛应用[13,17-19]。X线立体定位一般需要专用的定位装置,我们创新性地使用了一个带刻度的多孔板,经济实惠地解决了定位装置问题。但是立体定位放置导丝过程中存在迷走神经反射问题,定位导丝存在移位、脱落的风险,手术过程中勿过度牵拉导丝[19]。我们立体定位导丝引导组在定位过程中无定位导丝断裂、迷走神经反应导致无法完成定位等并发症发生;术中有6例患者因术中牵拉导致定位导丝脱落,但不影响继续手术切除病灶。
本研究在体表定位的基础上采用X线立体定位导丝引导的方法指导钙化病变的开放手术切除活检,而且创新性地采用了带刻度的压迫板,解决了立体定位装置问题,为该技术在基层的推广应用奠定了基础。该方法在准确的立体定位下可取得非常高的活检成功率,二次扩大切除率低。我们在早期病例采用体表定位切除活检,虽然也取得了较高的准确性和恶性病灶检出率,但是立体定位导丝引导组结合了体表定位及导丝引导,因有导丝引导,术中操作更加方便简捷,且术中二次切除率更低。因此后期我们主要采用了立体定位导丝引导的方式来进行钙化病变的切除。因立体定位导丝引导组纳入了更多的MRI BIRADS 3级患者,故其总体恶性检出率较体表定位组低,提示了MRI在钙化病变活检中的指导作用。在临床操作过程中,乳腺外科医生需与放射科医生充分沟通,定位前确定需要定位的病灶、选择穿刺点和手术切口、确定穿刺体位和深度,定位后确定钙化病变与定位导丝尖端的距离和病变范围,在术前对切除范围有准确的立体感,从而达到术中精准切除的目的。
对于临床查体可及的钙化病变,或超声可见肿块伴钙化,因病灶“可见”,诊断和处理都相对简单。而对于临床查体阴性、彩超检查也阴性的钙化灶,因常规手段的“不可见性”,诊断和处理相对困难很多。在X线定位床的引导下,进行SVAB,应是标准治疗手段。但是定位床和SVAB相对价格昂贵,在基层医院难以实施。我们通过改进乳腺X线定位设备,引入多孔板,并进行X线引导下的导丝穿刺,可精准定位可疑钙化病变,将临床医师不可见的钙化,变为可见的导丝,准确切除,是适合在基层医院进行推广的一种诊断和治疗手段。由于本研究纳入的样本量较小,我们将在后续研究中纳入更多患者开展进一步验证。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。
