内镜下全层切除术治疗腔外生长型胃间质瘤的效果评价*
2022-03-29童锦周礼罗智林邓磊
童锦,周礼,罗智林,邓磊
400014 重庆,重庆大学附属中心医院/重庆市急救医疗中心/重庆市第四人民医院 消化内科
胃肠道间质瘤(gastrointestinal stromal tumor,GIST)是世界第五大软组织肉瘤[1],亦是消化道最常见的间叶源性肿瘤,具有一定的恶变潜能[2],且约有10%~30%为恶性肿瘤[3]。GIST可发生在消化道的任何部位,但以胃部最为常见(60%)[4-5],根据其生长方式可分为腔内型、壁内型、腔外型以及腔内-腔外混合型[6]。由于胃间质瘤极少发生淋巴结转移,无需行淋巴结清扫,并且随着微创手术技术的提高及各种新型内镜缝合设备和缝合技术的问世及推广,使得内镜下切除胃间质瘤也能够达到很好的治疗效果[7]。内镜下全层切除术(endoscopic full-thickness resection,EFTR)因实施“主动穿孔”全层切除,能完整切除病变,同时更能实现对起源于固有肌深层或与浆膜层紧密相连的腔外生长型胃间质瘤的完整切除[8]。国内外的研究均认为,EFTR术切除胃间质瘤是安全性有效的方法[9-10]。更有研究认为,与外科手术相比,EFTR术在出血量、术后肠功能恢复,住院时间及治疗费用方面有更大的优势[11]。而与腹腔镜和消化内镜双镜联合治疗相比,EFTR术也有同等的治疗效果,但侵入性更小[12]。然而,也有研究并不推荐将EFTR作为胃间质瘤的一线治疗方式,尤其是当瘤体向腔外生长且瘤体直径大于3 cm时[13-14]。腔外生长型胃间质瘤的瘤体向浆膜面生长为主[6],相比于局限于腔内的胃间质瘤,内镜检查更容易漏诊,且内镜下切除具有更大的挑战。目前行EFTR术切除腔外生长型胃间质瘤国内外研究鲜有报道。为了探讨EFTR术是否适用于腔外生长型胃间质瘤,我科在完成大量内镜微创手术技术上,对严格挑选的腔外生长型胃间质瘤患者开展了EFTR术,并评价其治疗的安全性及有效性。
1 资料与方法
1.1 一般资料
纳入重庆大学附属中心医院消化内镜中心2018年1月至2021年6月期间,行EFTR术治疗的腔外生长型胃间质瘤患者。入选标准为:1)经超声内镜诊断为腔外生长型胃黏膜下隆起;超声内镜表现为起源于固有肌层,瘤体小于50%凸出腔内,以腔外生长为主的低回声灶[15-16];2)肿瘤直径>2 cm且≤5 cm;3)术后病理诊断为胃间质瘤。排除标准:1)严重心肺功能障碍或凝血功能异常,无法耐受麻醉插管及内镜手术;2)具有恶性表现者:白光内镜显示病变不规则,病变表面合并溃疡、出血、坏死,或超声内镜显示肿瘤边界不规则,表面溃疡,囊性变或存在强回声灶,以及具有回声不均匀等表现;3)术前评估有肿瘤远处转移及淋巴转移。收集患者的性别、年龄、肿瘤的直径和部位、临床症状、手术时间,术中出血情况、术前检查结果(血常规、肝肾功、凝血功能、心电图等)、完整切除率(完整切除指瘤体完全切除且切缘阴性)、术中和术后的主要并发症[如皮下气肿、明显临床气腹(诊断标准为:1.腹部膨隆;2.腹部叩诊鼓音;3.腹部穿刺有气体溢出)、急性感染、迟发性穿孔、迟发性出血]、住院天数(入院至出院时间),以及肿瘤的病理类型等资料。所有患者在接受治疗前,被告知内镜治疗获益及风险(内镜手术失败需转外科治疗),患者及家属签署手术知情同意书。本研究已通过重庆市第四人民医院伦理委员会审批。
1.2 治疗方法
1.2.1 手术器械 Olympus GIF-Q260J 电子胃镜;Olympus GF-UE260 电子超声胃镜;Dual刀;IT刀;HOOK 刀;透明帽;FD-410LR止血钳;波士顿科技大钛夹;南京微创小钛夹;尼龙绳;CO2气泵;消化内镜用水泵;VIO 300S高频电切装置。
1.2.2 EFTR手术操作过程 EFTR手术由我院1位经验丰富的内镜医师主刀,助手1名协助完成。所有患者术前禁食12 h,禁水4 h,术前30 min静脉使用抗生素。在气管插管全身麻醉下进行内镜手术。手术全过程使用医用CO2气体作为内镜气源,内镜前端戴透明帽。用无菌生理盐水冲洗胃腔,冲洗后充分吸尽胃腔内液体。在瘤体边缘用HOOK刀或Dual刀分层逐次切开胃壁全层(包括胃壁黏膜层、黏膜下层、固有肌层及浆膜层),切口长约0.3~0.5 cm。胃壁全层切开后,立即换用IT刀由腔外沿瘤体浆膜层完整切除瘤体。术中若有出血,用止血钳电凝止血。在瘤体切除即将完毕时使用带线钛夹夹持瘤体上方的黏膜组织辅助牵引保证瘤体不会掉入腹腔引起种植转移。瘤体完整切除后,胃壁缺损创面用大钛夹或小钛夹联合尼龙皮圈行内镜下缝合(图1)。

图1 内镜下全层切除术治疗腔外生长型胃间质瘤过程
1.3 术后处理及随访
切除标本用10%福尔马林溶液浸泡固定后送病理检查。术后患者禁食48~72 h,所有患者放置胃肠减压管48 h,术后静脉应用抗生素2~3 d,同时给予抑酸、止血、维持水电解质平衡及营养支持治疗。出院后继续口服质子泵抑制剂4~6周。对于危险度分级为中危患者术后追加口服伊马替尼片辅助治疗1年,剂量为400 mg/d,高危患者术后辅助治疗至少维持3年[8,17]。内镜治疗术后1、3、6、12个月后复查胃镜,此后每年复查胃镜。中高危的患者每6个月复查腹部CT及胃镜检查。随访过程中观察创面愈合情况、有无病变残留、复发或远处转移等情况。
1.4 病理诊断及危险度分级标准
病理学诊断应包括肿瘤细胞的形态学、免疫组化和分子诊断,免疫组化检测CD34、 CD117、DOG-1、SDHB、Ki67等标记分子。危险度分级标准参照美国国立卫生研究院(National Institute of Health,NIH)危险度分级。
1.5 统计学方法
所有患者资料采用计量资料或计数资料表示,采用SPSS 20.0软件进行统计学分析,计数资料以百分比表示,计量资料以均数±标准差表示。
2 结 果
2.1 患者基本资料和手术结果
2018年1月至2021年6月期间,共27例符合纳入排除标准的腔外生长型胃间质瘤患者在我院接受EFTR术治疗。其中男性患者10例,女性患者17例,年龄26~75岁,平均(53.67±12.37)岁;16例瘤体位于胃底(59.26%),11例瘤体位于胃体(40.74%),均为单发病例(表1)。20例(74.07%)临床表现为上腹部腹胀、腹部隐痛等非特异性消化道症状,7例(25.93%)无任何临床症状,体检时偶然发现。27例腔外生长型胃间质瘤均经EFTR术完整切除,R0切除率100%,平均手术时间(58.07±19.67)min,切除的病灶直径1.7~3.6cm,平均(2.72±0.51)cm。所有患者术后胃壁全层缺损创面均经内镜下用钛夹及尼龙皮圈缝合。1例(3.70%)术中出血>200 mL,均内镜下止血钳止血成功。16例(59.26%)患者术中出现明显临床气腹症状,经腹壁穿刺抽气后症状消失。
2.2 术后结果
27例患者术后病理均为梭形细胞肿瘤。免疫组化提示CD117阳性率74.07%,DOG-1阳性率59.62%,CD34 阳性率88.89%,CD117和DOG-1阳性率48.15%(表1、图2)。4例(14.81%)为中危险度,5例(18.52%)为低危险度,18例(66.67%)为极低危险度(表1)。4例(14.81%)术后出现颈部及胸部皮下气肿,经保守治疗后恢复。术后患者常规使用抗生素2~3天,5例(18.52%)患者术后24 h内出现感染症状(体温超过38℃,伴有白细胞的升高),经抗生素治疗72 h后好转。无患者出现迟发性穿孔表现或迟发性出血。术后住院时间(5.89±1.15)天。

表1 患者的基本资料、手术结果和病理结果
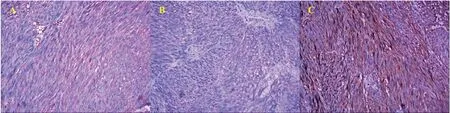
图2 免疫组化染色阳性图(×200)
2.3 术后随访结果
27例患者术后第1年第1、3、6月及每年复查胃镜,术后随访(15.26±13.28)个月(范围:1~42个月),均提示手术创面愈合良好,未见肿瘤局部复发。4例中危险度患者服用伊马替尼,在随访期间未见肿瘤复发及转移。
3 讨 论
我们通过分析27例行EFTR术切除直径在2~5 cm腔外生长型胃间质瘤术前、术中及术后的各项指标,评价该治疗的安全性及有效性。27例腔外生长型胃间质瘤患者发病平均年龄在(53.67±12.37)岁,女性发病率多于男性,区别于既往流行病学研究胃间质瘤平均发病年龄约60~65岁,男女发病率基本相同[18],部分原因可能是由于样本量相对较小的原因所致,另一部分则可能是随着胃镜及超声内镜的普及,越来越多腔外生长型间质瘤被早期发现,且带瘤状态会给患者带来巨大的心理学压力,故而越来越多的患者选择早期进行处理,导致患者的发病平均年龄更年轻。我们的研究发现16例(59.26%)瘤体的位置位于胃底,既往研究也显示胃底为好发部位[19],并有研究发现胃底间质瘤容易向腔外生长[20]。该部位对操作者的要求较高,因为胃底黏膜薄弱,容易穿孔,而且需倒镜观察下进行操作,相对于正镜,操作难度较大,同时胃底部外为膈肌和脾脏,周围血供丰富,手术风险高。
目前国内外指南均推荐,对于>2 cm的局部生长而未发生转移的胃间质瘤,首选外科手术作为根治手段及标准治疗[8,21]。随着内镜下缝合技术及器械的不断发展,患者微创意识的提高及内镜医师水平的提高,医源性的穿孔不再需要外科干预,内镜下治疗也成为胃间质瘤切除的重要选择[22]。EFTR技术可以完整切除固有肌深层或与浆膜层紧密相连的腔外生长型胃间质瘤,但该术式适用的病变最大直径目前国内外尚无统一的共识意见,且存在争议。日本一项研究认为胃间质瘤适合行EFTR术需满足的条件是肿瘤表面无溃疡,病变直径小于3 cm[23]。我国有研究报道,对于直径小于等于3 cm胃间质瘤,行EFTR术对比外科手术在技术成功率、完全切除率及肿瘤破裂发生率及病理R0切除率方面相当,是安全有效的方法[24]。我们的研究通过EFTR术完整切除的腔外生长型为间质瘤,病变平均直径(2.72±0.51) cm,与国内外研究结果相似。对于病变直径大于3 cm且有腔外生长的胃间质瘤,为了防止并发症,目前建议行腹腔镜辅助胃镜的双镜联合的治疗[25]。我们纳入的有10例腔外生长型胃间质瘤瘤体最大直径3~3.6 cm,未使用腹腔镜辅助,行EFTR术成功完整切除。目前国内部分内镜治疗专家认为局限且无转移直径≤5 cm 的黏膜下肿物均可行EFTR术[25-27],甚至有研究认为EFTR术能完整切除大于5 cm的胃黏膜下病变[11],但相关报道较少。虽然从技术层面上来说这种方法是可行的,但需考虑是否可完整取出病变。既往研究显示,直径小于3.5 cm的病灶标本可顺利通过食道的3个狭窄处从口咽部取出,而超过4.5 cm的标本完整通过贲门较困难[28],并且分块取出可能会导致肿瘤破裂,增加肿瘤种植风险。因此我们的研究结果显示,在考虑行EFTR术治疗腔外生长型胃间质瘤时,需充分权衡病变直径的问题;病变直径小于等于3 cm时该技术可能是安全可行的,而直径超过3 cm的病灶还需长期的大样本多中心临床研究进一步探索是否可采用EFTR。
腔外生长型胃间质瘤在行EFTR切除过程中关键问题是:1)避免瘤体假包膜的破裂,完整切除瘤体;2)主动穿孔后如何保持清晰的手术野;3)防止瘤体掉入腹腔形成腹腔种植;4)对胃壁缺损创面完全闭合。本研究中27例患者腔外生长型的胃间质瘤全部采用EFTR术完整切除,R0切除率100%,手术时间平均(58.07±19.67)分钟,住院时间(5.89±1.15)天,随访期间未观察到肿瘤的复发或转移。手术完整切除率、手术时间、住院时间与既往国内行EFTR术切除胃间质瘤的研究类似[29-31]。我们对于胃壁缺损创面处理与既往研究相同[11],采用钛夹联合尼龙皮圈成功缝合,对于大于2 cm的胃壁缺损,选择使用内镜荷包线缝合方法,无迟发性穿孔,迟发性出血发生。术后有5例(18.52%)出现急性感染,均可予以内科保守治疗处理,该5例患者切除的病变直径大于3 cm,且手术时间较长,闭合难度更高,考虑主动穿孔后胃内的气体,液体会溢出腹腔造成腹膜炎的可能。基于国内的一项研究[32],我们采用在瘤体切除即将完毕时使用带线钛夹夹持瘤体上方的黏膜组织辅助牵引,其优点在于既可以充分暴露手术视野,提供肿瘤浆膜侧的直接视图,最小面积化切除浆膜侧的黏膜,同时更好地显露血管,提前预防或有效止血,又可以防止肿瘤在完整切除后掉入腹腔。我们的研究结果显示瘤体均未破裂,病变均完整切除,术中出血率低,仅1例(3.70%)术中出血>200 mL,考虑为术中损伤动脉血管所致,予以内镜下止血钳止血成功。
本研究中27例腔外生长型胃间质瘤术后病理均为梭形细胞肿瘤。既往流行病学研究显示,胃间质瘤组织学形态大部分梭形细胞肿瘤,小部分为上皮样细胞[8]。我们的免疫组化结果提示CD117阳性率74.07%,DOG-1阳性率59.26%,CD34阳性率88.89%,CD117和DOG-1共阳性率48.15%,而既往该结果显示CD117阳性率94%~98%,CD117和DOG-1阳性率85%~95%[33]。我们的结果不同于既往的研究,考虑与样本量小有一定的关系。大部分患者为极低危或低危,其中4例(14.81%)为中危,予以术后口服伊马替尼药物辅助治疗1年,随访期间无肿瘤的转移。既往对于中危胃间质瘤患者是否真正从术后伊马替尼辅助治疗中获益还存在争议,但目前国内外指南均推荐中高危患者术后使用该药物作为辅助分子靶向药物治疗[8,34]。
针对EFTR治疗腔外生长型胃间质瘤,我们的经验是:1)术前的评估非常重要。需通过超声内镜或CT检查仔细评估,包括肿瘤的大小、边界、位置、生长方式、有无恶性征象或远处转移、患者的意愿等,针对个体选择适合的手术方式;2)切除瘤体时需在瘤体边缘一定距离下(>5 mm)将瘤体切除,以保证不破坏瘤体包膜;3)瘤体切除即将完毕时,可用带线钛夹牵引瘤体,充分暴露手术视野,减少手术时间,同时保证瘤体不会掉入腹腔引起种植转移;4)胃壁创面用钛夹联合尼龙皮圈紧密缝合,若胃壁缺损创面较大,可行间断缝合以减小胃壁张力,避免迟发性穿孔;5)对直径大于3 cm的病变,手术时间长的患者术后需严密观察患者的腹部体征及生命体征,术前30 min及术后24~72小时使用抗生素,术后禁食,予以抑酸剂,胃肠减压48小时,可以减少术后并发症如感染、迟发性出血的发生,同时降低胃壁张力,有利于创面愈合;6)因EFTR手术需部分胃壁全层切除,内镜气源需选择CO2气体,有利于术后体内残留气体快速的吸收,降低气体相关并发症,减少术后腹胀腹痛等不适感。
EFTR能够在保证瘤体完整的基础上切除腔外生长型胃间质瘤,近期临床效果显著,是安全且有效的替代手术方式。但本研究样本量较小,单中心,随访时间较短且没有对照,该术式后期还需通过大样本量,多中心随机对照试验且长期随访以进一步证实其安全性及有效性。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。
