ESC-HFA非专科医务人员管理左心室辅助装置植入者的共识(二)
2022-03-21黄刚游月婷刘晓翰张悦徐俊波
黄刚 游月婷 刘晓翰 张悦 徐俊波
(成都市第三人民医院心内科 成都市心血管病研究所 西南交通大学附属医院 重庆医科大学附属成都第二临床学院,四川 成都 610031)
前期介绍了ESC-HFA共识中左心室辅助装置(left ventricular assist device,LVAD)的植入指征、主要参数、植入者的首诊处理和转诊等内容[1],现续前重点介绍LVAD作为一种体内植入术的医疗器械相对常见的并发症及其处理策略等内容[2-4]。
1 常见并发症及其处理
LVAD植入者常见并发症的处理是专科和非专科医务人员所必需面临的临床场景。LVAD相关常见的并发症包括:泵衰竭、低流量报警、传导线感染、心律失常、出血、卒中、和泵血栓形成等。
1.1 泵衰竭
常见原因是电源断开或传导线故障。应按照患者的传导线出口部位、控制器、电池和电源的顺序进行检查。如果发现电源有问题需重新连接电源。
1.2 低流量报警
目前的LVAD控制器上显示的流量值是基于转速和功率参数计算所得的估计值。因此,低流量报警并不一定意味着植入者心输出量低。报警常见的原因有急性右心衰竭、肺栓塞或容量不足。低流量报警时,建议植入者以Trendelenburg姿势(头低足高位)躺下,双腿抬高,若警报未停止,提示可能是容量不足引起报警。应评估植入者血流动力学,若无明显容量负荷过重,可进行500 mL生理盐水液体复苏治疗。
1.3 传导线感染
传导系统是LVAD的一个易损组件,感染也是LVAD系统的致命弱点,其中传导系统感染最常见,LVAD植入后3年内发生率为15%~40%。若怀疑传导系统有任何外部损坏,需联系LVAD团队或制造商。系统袋跌落或拉出是导致感染的主要原因,良好的传导系统固定可降低传导线感染的发生率。出现任何严重的导线拔出(常因袋掉落所致),医护人员均应对伤口进行评估,启动经验性抗感染,并咨询LVAD专家。传导线感染包括浅表和深部感染。浅表传导线感染的特征为传导线出口周围软组织发红和压痛,偶伴积液。在从伤口深处取样进行细菌培养后,无须待检验结果就应开始经验性抗感染治疗。经验性抗感染治疗首选联用一代头孢菌素(针对葡萄球菌)和喹诺酮类(针对假单胞菌),可根据当地致病菌群调整用药,并据最终培养结果调整治疗方案,监测相关感染指标并频繁更换敷料。深部传导线感染则涉及传导线出口深处的组织,可出现脓性,时伴恶臭的积液。皮下电缆上方和沿线的皮肤可有疼痛感、水肿和红斑,红斑向近端扩展提示深部感染恶化。在行分泌物培养并采取4份血培养样本后,深部传导线感染的LVAD植入者应立即入院启动经验性静脉抗感染治疗。中央静脉置管有助于院外数周、数月甚至更长时间的长期抗感染治疗。超声和CT有助于评估随访皮下电缆隧道内深部感染的广度和深度以及有无脓肿形成。PETCT则是准确评估抗感染治疗反应最可靠的成像方式。应每日更换敷料以评估传导线出口处伤口。深部感染药物治疗不佳不断进展时需进行手术清创。
1.4 心律失常
LVAD植入前40%~60%的患者罹患心房颤动(房颤)。对于绝大多数接受维生素K拮抗剂作为LVAD常规治疗的患者而言抗凝不是问题。房颤的治疗遵循非LVAD植入者的治疗原则,应尽量尝试恢复窦性心律,但很少考虑消融手术。在LVAD植入前或术后阶段许多患者已接受胺碘酮治疗,因此在新发房颤的LVAD植入者中应排除甲亢。
LVAD植入后2年内30%~40%的患者再入院系因心律失常。心律失常与基础心脏疾病、心脏手术(LVAD流入管道周围的瘢痕)或泵对左心室壁的机械刺激有关。
20%~50%的LVAD植入者可出现室性心动过速(室速)/心室颤动(室颤)。LVAD植入后出现室性心律失常的主要预测因素是植入前已有室性心律失常。室速/室颤可由潜在的心脏疾病、LVAD手术相关的瘢痕组织或左心室流入管道的机械刺激引起(“抽吸”事件)。持续性室速/室颤并不一定导致LVAD植入者出现急性血流动力学障碍。伴室颤的植入者可能只有如呼吸急促、虚弱和头晕等轻微症状,甚至完全无症状。在持续室速或室颤发作期间,尽管右心室功能受影响,但若左心室能借LVAD维持前负荷,则全身血流灌注仍可维持。室速/室颤的患者处于Fontan样循环状况,因此体循环的维持取决于肺循环阻力和中心静脉压之间的平衡。在肺循环阻力低且静脉充盈充足的植入者中,LVAD可维持静息状态下的正常心输出量,因而出现室速/室颤时,植入者只有轻微或完全无症状。若LVAD植入者也植入了植入型心律转复除颤器( implantable cardioverter defibrillator,ICD),则可能在完全清醒时经历多次除颤。最终室速/室颤会导致右心衰竭和循环损害,因此需及时干预。
LVAD植入者合并室速/室颤的处理取决于患者的临床表现。首先必须确保心电(心电图)监护和静脉通路。如果患者有ICD且清醒,应立即在ICD上放置磁铁以防止放电。如因室速/室颤导致血流动力学不稳定,则需立即镇静和紧急电复律。除颤不会损害LVAD设备,胸部放置垫的位置与非LVAD植入者一样。血流动力学稳定的患者,建议静脉注射胺碘酮(300 mg)并降低转速(尽可能超声引导)。若患者容量不足,超声心动图显示左心室未充盈,则给予静脉补液。对上述措施无反应者,镇静和电复律的同时必须纠正酸中毒、低钾血症和低镁血症。进一步的治疗包括优化β受体阻滞剂剂量,延长抗心律失常治疗(常为胺碘酮)和考虑对难治性病例射频消融。
1.5 出血
LVAD植入者出血事件发病率为22%~44%,多不致命,大出血占LVAD植入者死亡原因的2%。现有LVAD装置HeartWareTM(HW)、HeartMateⅡTM(HM Ⅱ)和HeartMate 3TM(HM 3)的出血发生率相似,离心泵(HM 3与HW)植入者胃肠道出血发病率低于轴流泵植入者。出血常需调整抗凝和抗血小板治疗方案,这可能会增加形成泵血栓的可能性。出血的原因包括抗凝和抗血小板治疗、获得性血管性血友病综合征、可能因动脉搏动性下降而出现的(胃肠道)动静脉畸形等。出血的危险因素包括高龄和女性、低体重指数、LVAD植入前出血史、吸烟、高国际标准化比值(international normalized ratio,INR)和低血小板计数。
LVAD植入者消化道出血发病率为25%~35%,系LVAD植入者再入院的主要原因之一。消化道出血可发生在消化道的任何部位,最常发生于上段小肠十二指肠悬韧带近端。诊断措施包括上、下消化道内窥镜和胶囊内镜等检查。若上述检查不能定位出血部位,建议行血管造影(若患者不稳定,咨询介入放射科)或标记红细胞核素显像。此外,LVAD植入者鼻黏膜血管的异常丰富与胃肠道出血有关,鼻内镜可作为诊断胃肠道动静脉畸形的潜在替代方法。治疗手段包括静脉使用质子泵抑制剂(尤其怀疑胃黏膜出血),奥曲肽可用于对其他措施无反应的胃肠道出血。同时根据出血的严重程度和再出血的风险,考虑停用阿司匹林和调整/停用华法林。需拮抗抗凝治疗时,选择如口服维生素K或新鲜冷冻血浆等方法可降低血泵血栓形成的风险。拟行心脏移植前或待移植期间过渡治疗的患者中度失血时,应尽量避免输血而选择静脉补铁。预防出血及降低出血严重程度的措施主要包括优化抗凝方案维持INR于目标范围内(多数中心2.0~2.5,亦有2.0~3.0),注意药物间相互作用、食物对药物的影响等。其他出血包括鼻或口腔黏膜出血、拔牙后出血、皮肤瘀伤或血尿等。
1.6 卒中
卒中是LVAD植入者主要致残原因之一。INTERMACS研究示发病率约为10%,出血性和缺血性卒中比例约为1:1,感染增加卒中的发生率。连续性(HM Ⅱ)和搏动性辅助装置2年的致残卒中发生率为17%和14%(P=0.56),HW和HM Ⅱ卒中发生率为29.7%和12.1%(P<0.001),HM 3和HM Ⅱ的2年卒中发生率为10.1%和19.2%(P=0.02)。卒中的原因可能与流经装置的血栓、因非搏动性血流而出现的血管改变,如获得性血管性血友病综合征等血液流变学原因有关。新发神经系统症状的LVAD植入者,应高度怀疑有脑血管损伤并立即进行头颅CT。
1.6.1 缺血性卒中
来源于主动脉瓦氏窦瓣膜表面、颈动脉球部的血栓或脓毒症性血栓可导致缺血性卒中。离心泵LVAD植入者中全身性感染可使卒中发生率增加一倍(39.5% vs 19.3%,P=0.003)。术前卒中危险因素包括女性和既往心脏手术史,术后危险因素包括感染和消化道出血。重组组织型纤溶酶原激活剂在LVAD植入者中治疗卒中的疗效尚未得到证实。因来自LVAD内的栓子可能含如纤维蛋白和变性蛋白等无法进行溶解的成分,溶栓治疗可能无效。介入治疗(特定患者机械取栓)可能对LVAD植入者有益。介入治疗和溶栓治疗缺血性卒中出血性转化发生率相似。LVAD植入者合并缺血性卒中应根据如梗死大小、心源性栓塞病因、血管再通情况和肝素治疗等已知危险因素进行风险评估后恢复抗栓药物治疗。
1.6.2 出血性卒中
LVAD植入者患出血性卒中后生存率显著降低(1、6和12个月生存率分别为45.3%、34.8%和30.3%)。出血性卒中可能的原因包括抗凝治疗、缺血性卒中后出血性转化、获得性血管性血友病综合征和非生理性连续无脉冲血流所致的脆弱血管破裂。出血性卒中的植入前危险因素包括肝素所致血小板减少、主动脉内球囊反博治疗和女性。LVAD植入者出血性卒中的症状可从轻微神经体征至深昏迷,并可因连续无脉冲性血流而误认为循环衰竭。出血性卒中的主要治疗方法是降低升高的血压和逆转凝血功能障碍,同时须排除感染和缺血性卒中后出血性转化。降低血压有利于预防出血性卒中,但出血性卒中植入者血压升高的急性治疗尚不确定,建议将平均动脉压(mean artery pressure,MAP)降低至<90 mm Hg(1 mm Hg=0.133 3 kPa),降压须平稳以避免血压波动过大。拮抗华法林可用新鲜冷冻血浆、凝血酶原复合酶浓缩物、维生素K或联合使用。出血性卒中应避免常规使用血小板。一些植入者据严重程度需如开颅和引流等外科手术治疗。
1.7 泵血栓形成
不同LVAD装置植入者终身泵血栓形成的发病率有所不同,最高可为10%。泵血栓形成是指在泵的任何部件(流入管道、转子或流出管道)内形成血栓。血栓可在LVAD内形成,也可从左心房或左心室移动进入任何泵组件(表1)。目前尚无处理LVAD植入者泵血栓形成的随机对照研究,基于病例研究对其处理有如下建议:调整INR至2.5~3.5;尝试连续输注肝素,部分凝血酶时间的目标值为80~100 s。一些中心选择比伐卢定,通常可避免肝素诱导的血小板减少。若无反应或病情不稳定,尝试溶栓治疗,若还无反应或变得更不稳定,可能需更换血泵。泵血栓形成是一个危及生命的事件,必须立即联系植入中心解决。同时稳定患者,确认诊断,及时启动治疗,对流出管道血栓可强化抗凝治疗及支架植入。若治疗失败,联系植入中心进一步治疗。
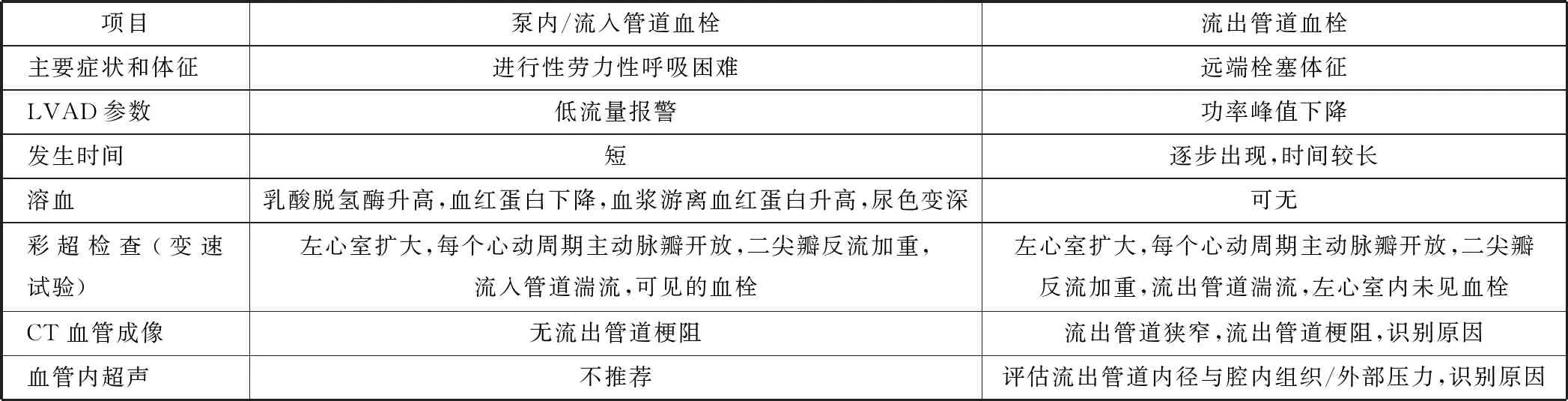
表1 泵内/流入管道血栓和流出管道血栓的鉴别
1.8 胸痛
LVAD植入者中胸痛很常见,可于术后出现或长期存在。原因包括心源性和非心源性,病因诊断多较困难,多数情况下系非心源性病因,如心包切开术后综合征、患者瘦小或儿童中装置与胸腔内壁接触产生的机械性疼痛、肺炎/胸膜炎、气胸、纵隔气肿、食管痉挛或食管炎、胆囊炎或胆绞痛、胰腺炎、消化性溃疡、肋软骨炎或肋骨损伤或骨折。如果疼痛伴发热或炎症表现则必须排除局部感染。心源性原因所致LVAD植入者胸痛不常见,但应立即排除。心肌梗死更少见,如证实有心肌梗死,应及时进行经食管超声心动图检查排除主动脉根部血栓。
1.9 晕厥
LVAD植入者易于出现晕厥,其鉴别诊断包括体位性低血压和心律失常等心源性、血管抑制神经源性和设备特异性机械因素所致晕厥。LVAD植入者中晕厥和如头晕、视力模糊、意识混乱和恶心等体位性低血压的症状较难鉴别。30%的植入者可有体位性低血压。体位性低血压潜在的原因包括:低血容量状态、使用扩血管药物、右心室功能差和糖尿病相关的继发性自主神经功能衰竭等。导致晕厥的设备特定因素尤其需要注意流入管道位置不当(“抽吸”现象)。诊断包括详细的病史、全面的体格检查、卧位和立位血压、心电图监测和常规血液检查(排除贫血)。晕厥应进行病因治疗,如纠正低血容量状态(增加液体摄入量和输血)。去除扩血管和/或影响自主神经功能的药物(胺碘酮)可能有益。
1.10 主动脉瓣关闭不全
恒流式LVAD植入后可出现主动脉瓣关闭不全,LVAD泵出的部分血液可经主动脉瓣回流至左心室再流经装置,形成一个无效的循环回路,进而出现正向血流无效、器官灌注不良和左心室舒张压增加。新发或进展性主动脉瓣关闭不全可导致LVAD植入者心力衰竭症状恶化,因而需行经胸或经食管超声心动图检查明确。LVAD植入时中度以上的主动脉瓣关闭不全需进行瓣膜置换术(生物瓣膜)或主动脉瓣封闭(很少);而对于新发严重主动脉瓣关闭不全的LVAD植入者,也可选择经导管主动脉瓣置换术。
(待续)
