咪达唑仑上调miR-382-3p表达抑制IL-1β诱导的软骨细胞炎性因子表达和细胞凋亡的机制
2022-03-17丁志刚
丁志刚
骨关节炎是一种多发生于中老年人的炎症性关节疾病,严重影响中老年人的生活质量。骨关节炎病理变化主要表现为关节软骨组织退化、软骨细胞消失、软骨下骨反应性增生和关节滑膜组织炎性反应等[1,2]。软骨细胞是软骨内唯一存在的细胞成分,在维持软骨正常功能和形态中发挥重要作用[3]。目前,骨关节炎的发病机制尚未明确。有研究表明,软骨细胞损伤是骨关节炎发生发展的重要原因,降低软骨细胞损伤对于骨关节炎的治疗具有重要意义[4]。咪达唑仑是γ-氨基丁酸A受体激动剂,具有镇痛、镇静等功效。研究表明,咪达唑仑可通过调控JAK2/STAT3信号通路促进氧糖剥夺诱导的星形胶质细胞增殖并抑制其凋亡[5];咪达唑仑预先给药可能通过抑制细胞炎性反应和细胞凋亡减轻小鼠肠缺血再灌注损伤[6]。miR-382-3p是一种微小RNA(miRNA),参与调控细胞增殖、凋亡和炎性反应等生理或病理过程,与多种疾病的发生发展密切相关[7,8]。Lei等[9]研究显示,白介素1β(IL-1β)的刺激可导致软骨细胞中miR-382-3p的表达下调,上调miR-382-3p通过靶向CX43调控TLR4/MyD88/NF-κB信号通路抑制IL-1β诱导的软骨细胞炎性反应。因此,本研究采用IL-1β诱导小鼠软骨细胞ATDC5建立软骨细胞损伤模型,主要探讨咪达唑仑对IL-1β诱导的软骨细胞炎性因子表达和凋亡的影响及其能否调控miR-382-3p发挥作用。
1 材料与方法
1.1 细胞与试剂 小鼠软骨细胞株ATDC5,上海雅吉生物科技有限公司;咪达唑仑,江苏恩华药业有限公司;IL-1β,美国Sigma公司;胎牛血清(FBS),浙江天杭生物科技公司;RPMI 1640培养基、Annexin V-FITC/PI细胞凋亡试剂盒和二喹啉甲酸(BCA)蛋白检测试剂盒,北京索莱宝公司;LipofectamineTM2000试剂盒和Trizol试剂,美国Invitrogen公司;miR-382-3p模拟物(mimics)、模拟对照序列(miR-NC)、miR-382-3p抑制剂(anti-miR-382-3p)、抑制剂阴性对照序列(anti-miR-NC)和PCR引物,上海生工生物工程有限公司;白介素6(IL-6)、肿瘤坏死因子α(TNF-α)和干扰素γ(IFN-γ)试剂盒,南京建成生物工程研究所;兔抗小鼠B淋巴细胞瘤-2(Bcl-2)、B淋巴细胞瘤-2相关蛋白(Bax)和甘油醛-3-磷酸脱氢酶(GAPDH)多克隆抗体,美国Santa Cruz公司;逆转录试剂盒和PCR试剂盒,大连宝生物工程有限公司。
1.2 方法
1.2.1 细胞培养和转染:复苏ATDC5细胞,加含10% FBS的RPMI 1640培养基(常规培养基)培养。将对数生长期的ATDC5细胞以5.0×105个/孔接种于6孔板中,采用LipofectamineTM2000脂质体法,分别转染miR-NC、miR-382-3p mimics、anti-miR-NC、anti-miR-382-3p。转染6 h后,更换培养基。再培养24 h,收集细胞备用。
1.2.2 细胞分组处理:将ATDC5细胞和转染后的细胞均以2.5×104个/孔接种于24孔板中。ATDC5细胞分为Con组、IL-1β组、IL-1β+MDZ-L组、IL-1β+MDZ-M组、IL-1β+MDZ-H组,其中Con组细胞常规培养基培养,IL-1β组细胞用含10 ng/ml[10]IL-1β的培养基培养,IL-1β+MDZ-L组、IL-1β+MDZ-M组、IL-1β+MDZ-H组细胞分别用含1、3、10 μmol/L[5]MDZ与10 ng/ml IL-1β的培养基共同培养。转染miR-NC、miR-382-3p mimics的细胞用常规培养基培养,记为IL-1β+miR-NC组、IL-1β+miR-382-3p组。转染anti-miR-NC、anti-miR-382-3p的细胞用含10 μmol/L MDZ与10 ng/ml IL-1β的培养基共同培养,记为IL-1β+MDZ+anti-miR-NC组、IL-1β+MDZ+anti-miR-382-3p组。培养24 h后,分别收集各组细胞培养上清液和细胞,进行后续检测。每组设3个复孔,实验重复3次。
1.2.3 试剂盒法检测细胞中IL-6、TNF-α和IFN-γ的表达水平:将1.2.2中收集的各组细胞培养上清液进行检测,3 500 r/min离心5 min,保留上清。分别参照IL-6、TNF-α和IFN-γ试剂盒说明书,检测上清液中其含量。
1.2.4 流式细胞仪检测细胞凋亡:将1.2.2中收集的各组细胞用PBS清洗2次,调整浓度为2.5×104个/ml。取1.0 ml细胞悬液,1 000 r/min离心5 min。弃上清,加入500 μl结合缓冲液,重悬细胞。加入10 μl Annexin V-FITC,避光孵育10 min。加入5 μl PI,避光孵育5 min,上流式细胞仪检测细胞凋亡。
1.2.5 Western Blot法检测Bax和Bcl-2蛋白表达:将1.2.2中收集的各组细胞用PBS清洗2次,RIPA试剂提取细胞中总蛋白,BCA法定量,以20 μg/孔蛋白行SDS-PAGE电泳。电泳后,将分离蛋白转至PVDF膜,置于5%脱脂奶粉溶液中封闭1 h。分别于Bax(1∶500)、Bcl-2(1∶500)和GAPDH(1∶800)一抗孵育液中4℃过夜。再于山羊抗兔二抗(1∶3 000)孵育液中37℃孵育1 h。最后加显影液避光显影,曝光拍照。
1.2.6 RT-qPCR检测miR-382-3p表达:将1.2.2中收集的各组细胞用PBS清洗2次,Trizol试剂提取细胞中总RNA,逆转录为cDNA后,行PCR扩增。引物序列:miR-382-3p上游5’-ACACTCCAGCTGGGAATCA
TTC-3’,下游5’-CCAGTGCAGGGTCCGAGGT-3’;内参U6上游5’-GGAACCUAGCGAAUAC-3’,下游5’-CGT
AAGATGCCGATACCGAC-3’。2-△△Ct法计算miR-382-3p相对于内参U6的表达水平。

2 结果
2.1 咪达唑仑对IL-1β诱导的软骨细胞炎性因子表达的影响 与Con组比较,IL-1β组IL-6、TNF-α和IFN-γ水平均升高(P<0.05)。与L-1β组比较,IL-1β+MDZ-L组、IL-1β+MDZ-M组、IL-1β+MDZ-H组中IL-6、TNF-α和IFN-γ水平均降低(P<0.05),且3组间各检测指标两两比较差异均有统计学意义(P<0.05)。见表1。

表1 咪达唑仑对IL-1β诱导的软骨细胞炎性因子表达的影响
2.2 咪达唑仑对IL-1β诱导的软骨细胞凋亡的影响 与Con组比较,IL-1β组细胞凋亡率、Bax蛋白水平均升高(P<0.05),Bcl-2蛋白水平降低(P<0.05)。与L-1β组比较,IL-1β+MDZ-L组、IL-1β+MDZ-M组、IL-1β+MDZ-H组中细胞凋亡率、Bax蛋白水平均降低(P<0.05),Bcl-2蛋白水平升高(P<0.05),且3组间各检测指标两两比较差异均有统计学意义(P<0.05)。见图1,表2。
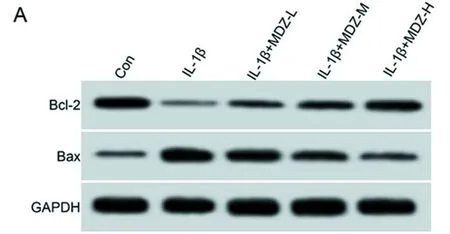
表2 咪达唑仑对IL-1β诱导的软骨细胞凋亡的影响
2.3 咪达唑仑对IL-1β诱导的软骨细胞中miR-382-3p表达的影响 与Con组比较,IL-1β组miR-382-3p水平降低(P<0.05)。与L-1β组比较,IL-1β+MDZ-L组、IL-1β+MDZ-M组、IL-1β+MDZ-H组中miR-382-3p水平均升高(P<0.05),且3组间miR-382-3p水平两两比较差异均有统计学意义(P<0.05)。见表3。
表3 咪达唑仑对IL-1β诱导的软骨细胞中miR-382-3p表达的影响
2.4 过表达miR-382-3p对IL-1β诱导的软骨细胞炎性因子表达和凋亡的影响 与IL-1β+miR-NC组比较,IL-1β+miR-382-3p组miR-382-3p水平升高(P<0.05),IL-6、TNF-α和IFN-γ水平均降低(P<0.05),细胞凋亡率、Bax蛋白水平均降低(P<0.05),Bcl-2蛋白水平升高(P<0.05)。见表4,图2。
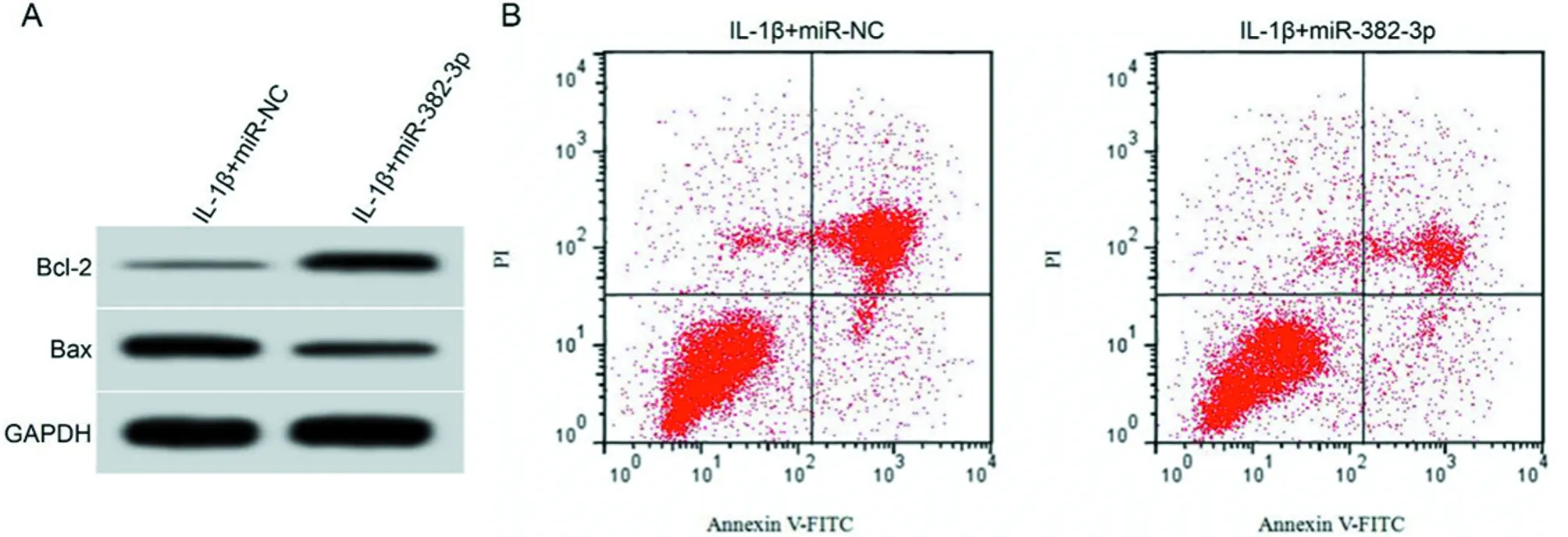
图2 过表达miR-382-3p对IL-1β诱导的软骨细胞凋亡的影响;A 过表达miR-382-3p对IL-1β诱导的软骨细胞中Bcl-2和Bax蛋白表达的影响;B IL-1β诱导的过表达miR-382-3p的软骨细胞流式凋亡图
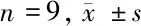
表4 过表达miR-382-3p对IL-1β诱导的软骨细胞炎性因子表达和凋亡的影响
2.5 敲减miR-382-3p表达逆转咪达唑仑对IL-1β诱导的软骨细胞炎性因子表达及凋亡的影响 与IL-1β+MDZ+anti-miR-NC组比较,IL-1β+MDZ+anti-miR-382-3p组miR-382-3p水平降低,差异有统计学意义
(P<0.05),IL-6、TNF-α和IFN-γ水平均升高,差异有统计学意义(P<0.05),细胞凋亡率、Bax蛋白水平均升高(P<0.05),Bcl-2蛋白水平降低(P<0.05)。见图3,表5。
图3 敲减miR-382-3p逆转咪达唑仑对IL-1β诱导的软骨细胞凋亡的作用;A 敲减miR-382-3p逆转咪达唑仑对IL-1β诱导的软骨细胞中Bcl-2和Bax蛋白表达的影响;B 咪达唑仑干预的IL-1β诱导的敲减miR-382-3p的软骨细胞流式凋亡图
表5 敲减miR-382-3p逆转咪达唑仑对IL-1β诱导的软骨细胞炎性因子表达和凋亡的影响
3 讨论
作为机体中骨关节软骨中的唯一细胞,软骨细胞参与调节细胞外基质的合成和降解,维持软骨结构和功能,其功能异常是骨关节炎发生发展的重要因素[11]。IL-1β可诱导软骨细胞凋亡、炎性反应及基质降解,损伤软骨组织,促进骨关节炎的发展进程,常用于诱导软骨细胞建立软骨细胞损伤模型[12]。本研究显示,IL-1β作用于软骨细胞后,细胞对IL-6、TNF-α和IFN-γ炎性因子的分泌增加,且细胞凋亡加剧,与已有的相关报道结果[13,14]一致,表明IL-1β诱导的软骨细胞损伤模型建立成功。
咪达唑仑是手术常用的镇痛剂。研究显示,咪达唑仑可通过下调β-淀粉样前体蛋白水解酶1(BACE1)进而减少Aβ1-42的表达减轻氧糖剥夺诱导的神经细胞损伤[15]。IL-1β作为炎症的始动因子,可通过刺激TNF-α、IL-6等炎性因子的分泌和抑制胶原蛋白、基质金属蛋白酶抑制因子等的合成来干扰软骨细胞代谢,抑制软骨细胞基质合成,引发关节炎症[16]。IFN-γ也是介导骨关节炎等多种炎症疾病发生发展的炎性因子,其还可刺激细胞分泌IL-6等炎性因子[17]。本研究显示,咪达唑仑抑制了IL-1β诱导的软骨细胞分泌IL-6、TNF-α和IFN-γ炎性因子,说明咪达唑仑可降低软骨细胞炎性损伤。
细胞凋亡是一种受多种基因调控的程序性死亡过程。Bax和Bcl-2在细胞凋亡中发挥重要调控作用。Bax表达升高时形成同源二聚体,改变线粒体膜通透性,导致细胞色素C释放增加,进而激活Caspase凋亡途径,诱导细胞凋亡[18]。而Bcl-2是一种抗凋亡分子,其表达增加可与Bax结合形成异源二聚体,抑制Bax的促凋亡作用。本研究显示,咪达唑仑可呈剂量依赖性降低IL-1β诱导的软骨细胞凋亡率及细胞中Bax蛋白表达,而促进Bcl-2蛋白表达,说明咪达唑仑可抑制IL-1β诱导的软骨细胞凋亡。
miRNA是一类长18~25个核苷酸的小分子非编码RNA,在真核生物中广泛存在,与人类多种疾病的发生发展密切相关。研究表明,miR-145[19]、miR-124[20]、miR-155[21,22]等多种miRNA参与调控软骨细胞炎性因子表达及细胞凋亡,可作为软骨损伤治疗的分子靶点。研究显示,上调miR-382-3p表达可抑制RhoC/ROCK1信号通路降低N-甲基L-D-天冬氨酸(NMDA)诱导的HT22细胞氧化应激和细胞凋亡,减轻了HT22细胞损伤[23]。
本研究显示,过表达miR-382-3p可降低IL-1β诱导的软骨细胞分泌IL-6、TNF-α和IFN-γ炎性因子,并抑制细胞凋亡,与焦建宝等[24]报道的结果一致,说明miR-382-3p可作为软骨细胞损伤的治疗靶点。本研究还显示,咪达唑仑呈剂量依赖性降低了IL-1β诱导的软骨细胞中miR-382-3p的表达,而敲减miR-382-3p部分逆转了咪达唑仑对IL-1β诱导的软骨细胞炎性因子IL-6、TNF-α和IFN-γ的表达及细胞凋亡的抑制作用,提示咪达唑仑可能通过下调miR-382-3p来抑制IL-1β诱导的软骨细胞炎性因子表达及细胞凋亡。
综上所述,咪达唑仑可降低IL-1β诱导的软骨细胞炎性因子表达及细胞凋亡,减轻软骨细胞损伤,其作用机制可能与上调细胞中miR-382-3p表达有关。
