SHP2抑制剂PHPS1通过调节MAPK通路对ApoE基因敲除小鼠动脉粥样硬化斑块的影响
2022-03-17帖彦清霍丽静马倩赵培于悦卿路永刚于芳
帖彦清 霍丽静 马倩 赵培 于悦卿 路永刚 于芳
动脉粥样硬化是心脑血管发病的病理基础。其中,脂质代谢异常和炎性损伤是导致动脉粥样硬化的主要诱因[1,2]。因此,改善动脉粥样硬化患者体内的脂质代谢和阻止炎性因素进一步损伤是改善动脉粥样硬化形成的主要方法。目前,针对动脉粥样硬化的治疗主要为应用降脂药物,但因其具体发病机制尚未完全清楚,故降脂并不能从根本上治愈动脉粥样硬化引起的心脑血管疾病。丝裂原活化蛋白激酶(MAPK)是引起细胞生物学反应所必需的一类重要的信号通路,可调控多种心脑血管疾病的发病过程,其主要包括C-Jun氨基末端激酶(JNK)、p38及细胞外信号调节激酶(ERK)[3]。相关研究表明,MAPK参与内皮细胞的激活、泡沫细胞的形成、内皮祖细胞的凋亡和多种促动脉粥样硬化细胞因子的表达[4]。PHPS1(phenyl hydrazonopyrazolone sulfonate1)是一种具有细胞渗透性的SHP2抑制剂,能够有效抑制SHP2磷酸化并阻断其参与的细胞活动和疾病进程[5]。已有的相关研究表明,PHPS1可通过抑制p-SHP2和p-ERK蛋白的表达,进而减少病变肺部中性粒细胞及巨噬细胞的浸润,最终改善实验小鼠的肺炎症状[6]。那么,PHPS1在动脉粥样硬化中发挥什么作用,它是否可调控动脉粥样硬化炎性因子的释放,笔者发现相关研究较少。因此,本研究以ApoE-/-小鼠为研究对象,探讨PHPS1对ApoE-/-小鼠动脉粥样硬化的作用及作用机制,以期为临床提供一种新的治疗靶点。
1 材料与方法
1.1 实验动物及处理方法 将8周龄雄性C57BL/6J-ApoE-/-小鼠(动物合格证号:201721850)随机选取10只作为对照组,不做其他特殊处理,其余小鼠对其进行6周的高脂饲料喂养建立动脉粥样硬化模型,建模成功后将其随机分为模型组(腹腔注射0.9%氯化钠溶液3 mg·kg-1·d-1,n=10)和PHPS1组(腹腔注射PHPS1剂量3 mg·kg-1·d-1,n=10),同时对照组也给予腹腔注射0.9%氯化钠溶液3 mg·kg-1·d-1,1次/d,持续20 d。
1.2 实验细胞来源及分组 小鼠巨噬细胞RAW264.7购自美国ATCC公司。将RAW264.7细胞培养于含10%胎牛血清、1%青链霉素DMEM培养基,37℃、5% CO2细胞培养箱内培养。待RAW264.7细胞生长达到80%时,根据培养基中加入的成分不同将RAW264.7分为3组,即对照组(未予特殊处理的DEME培养基)、模型组(给予ol-LDL处理的DEME培养基)及PHPS1组(同时给予ol-LDL和PHPS1处理的DEME培养基)。
1.3 实验材料与仪器 p-PI3K、p-AKT、p-mTOR均购自abcam公司;DMEM/高糖培养基、PBS缓冲液、胰蛋白酶购自美国Hyclone公司;胎牛血清购自美国GIBCO公司;组织包埋机(型号:EG11508)、石蜡切片机型号(型号:RM2135)均购自Leica公司;荧光倒置显微镜(型号:Axio Vert A1)购自德国Carl Zeiss Jena;Western Blot用电泳槽(型号:DYCZ-24DN型)、转移电泳仪(型号:DYY-7B型)及恒温循环器(型号:WD-9412A型)均购自北京六一生物科技有限公司;全自动凝胶成像系统(型号:8845-S型)购自美国Bio-rad公司;电子天平(型号:MP200A型)购自上海精科仪器厂;制冰机(型号:SIM-F124型)购自日本5ANY0有限公司;全自动生化分析仪(型号贝克曼5800,美国贝克曼公司);酶标仪(型号 ELX800,北京Bio-Tek公司)等相关试剂及仪器。
1.4 动物实验方法
1.4.1 全自动生化仪检测小鼠体内TG、TC、HDL-C及LDL-C的表达水平:小鼠腹主动脉取血后放入离心机内3 500 r/min 离心 25 min,获得血清后采用全自动生化分析仪检测3组小鼠血清中TG、TC、HDL-C及LDL-C的表达水平。
1.4.2 Movat染色评估主动脉根部斑块面积:取小鼠主动脉根部血管制成石蜡切片,常规脱腊至水后行Movat染色,显微镜下评估动脉斑块大小,数据通过Image Pro Plus-6软件(Media Cybernetics,Inc.)进行分析。
1.4.3 Western blot检测3组p-SHP2、p-JNK、p-p38 MAPK及p-ERK蛋白的表达水平:将上述所取主动脉根部组织研磨提取蛋白后,进行WB检测,聚丙烯酰胺凝胶电泳 (SDS-PAGE) 电泳分离蛋白后再转膜至PVDF膜上,5%脱脂奶粉封闭2 h,4℃冰箱中一抗孵育过夜,PBST充分洗涤后加入相应二抗(ab97080)室温孵育1 h,ECL显色,化学发光凝胶成像系统中显影,IPP 6.0软件行灰度扫描分析,以GAPDH为内参校正目的蛋白表达量。
1.5 细胞实验方法 Western blot检测3组RAW264.7细胞p-SHP2、p-JNK、p-p38 MAPK及p-ERK蛋白水平:将上述各组细胞研磨提取蛋白后,进行Western blot检测,聚丙烯酰胺凝胶电泳 (SDS-PAGE) 电泳分离蛋白后再转膜至PVDF膜上,5%脱脂奶粉封闭2 h,4℃冰箱中一抗孵育过夜,PBST充分洗涤后加入相应二抗(ab97080)室温孵育1 h,ECL显色,化学发光凝胶成像系统中显影,IPP 6.0 软件行灰度扫描分析,以GAPDH为内参校正目的蛋白表达量。
2 结果
2.1 体内实验结果
2.1.1 全自动生化仪检测小鼠体内TG、TC、HDL-C及LDL-C的表达水平:全自动生化仪结果显示,模型组小鼠中TG、TC及LDL-C表达最高,HDL-C 表达最低,其次依次为PHPS1组、对照组,差异均有统计学意义(P<0.05)。见表1。

表1 血脂水平比较
2.1.2 Movat染色评估主动脉根部斑块面积:Movat染色结果显示,PHPS1组主动脉根部显示斑块面积较对照组和模型组明显减小,模型组斑块较对照组明显增加,差异均有统计学意义(P<0.05),对照组动脉粥样硬化斑块较少,可忽略。对照组内膜未见增厚,基本没有泡沫细胞及斑块,模型组的内膜明显增厚且伴有大量的泡沫细胞聚集及炎性细胞浸润,中膜细胞的排列紊乱,PHPS1组的内膜增厚程度较模型组明显减轻并且泡沫细胞聚集及炎性细胞浸润明显。见表2,图1。
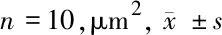
表2 主动脉根部斑块面积比较
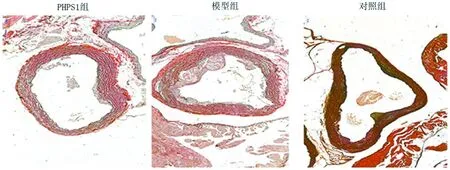
图1 主动脉根部的斑块面积(Movat染色×40)
2.1.3 Western blot检测3组p-SHP2、p-JNK、p-p38 MAPK及p-ERK蛋白的表达水平:Western blot检测结果显示,模型组p-SHP2、p-JNK、p-p38 MAPK及p-ERK的蛋白表达水平最高,其次依次为PHPS1组、对照组的p-SHP2、p-JNK、p-p38 MAPK及p-ERK的蛋白表达水平,差异均有统计学意义(P<0.05)。见表3,图2。

表3 组织中p-SHP2、p-JNK、p-p38 MAPK及p-ERK蛋白的表达水平

图2 Western blot检测组织中p-SHP2、p-JNK、p-p38 MAPK及p-ERK蛋白的表达水平
2.2 细胞实验结果 Western blot检测3组细胞p-SHP2、p-JNK、p-p38 MAPK及p-ERK蛋白水平:Western blot检测结果显示,模型组p-SHP2、p-JNK、p-p38 MAPK及p-ERK蛋白的表达水平最高,其次依次为PHPS1组、对照组,3组间4种指标比较差异均有统计学意义(P<0.05)。见图3,表4。

图3 Western blot检测细胞中p-SHP2、p-JNK、p-p38 MAPK及p-ERK蛋白水平

表4 细胞中p-SHP2、p-JNK、p-p38 MAPK及p-ERK蛋白的表达水平
3 讨论
动脉粥样硬化是老年人最常见的死亡原因之一。动脉粥样硬化的主要病变的特征是脂质在动脉部分沉积,并伴有平滑肌细胞和纤维基质增生,并逐渐发展成动脉粥样硬化斑块的形成[7]。动脉粥样硬化通常被认为是一种慢性炎症性疾病,其相关炎症是由促炎细胞因子、炎症信号通路、生物活性脂质和粘附分子共同介导的[8]。由于动脉粥样硬化发生机制尚未完全清楚,故并不能从根本上治愈动脉粥样硬化引起的心脑血管疾病。因此,本研究以MAPK促炎信号通路为线索,通过应用SHP2抑制剂PHPS1观察对ApoE-/-小鼠动脉粥样硬化斑块的影响。
SHP2(Src homology 2 domain-containing protein tyrosine phosphatase)是蛋白酪氨酸磷酸酶(protein tyrosine phosphatase,PTP)家族成员之一,由PTPN11基因编码在人类细胞和组织中广泛表达,主要有2个酪氨酸磷酸化结合位点SH2结构域和1个具有催化功能的PTP结构域构成[9]。SHP2参与多种细胞信号的调节作用。相关研究表明,SHP2可通过相关信号通路调控巨噬细胞炎性反应和细菌清除中的作用。PHPS1是一种针对SHP2特异性抑制剂,可有效抑制SHP2磷酸化并阻断其参与的细胞活动和疾病进程[10,11]。
本研究发现给予PHPS1治疗后ApoE-/-小鼠动脉粥样硬化斑块面积明显减小且小鼠体内炎性因子的表达水平同样明显降低。既往研究显示,PHPS1能够抑制炎性反应、减轻或延缓AS的发生[6]。
丝裂原活化蛋白激酶(MAPK)信号通路是细胞中一条重要的分子通路,MAPK由多种同工酶组成,包括ERK,JNK和p38 MAPK[12]。JNK 通路和 p38 MAPK 通路主要对炎性细胞因子和多种类型的细胞应激信号进行转导,而ERK通路主要对细胞的生长、分裂和分化信号进行转导,他们之间可以通过不同因素刺激激活,形成不同的转导通路,激活不同的转录因子,介导不同的生物学效应,通路间可产生相互协同或抑制作用[13-16]。
活化的p38能促进细胞表达分泌炎性因子,而JNK能被TNF-α和IL-1β等炎性因子激活;ERK1/2有促进炎性细胞因子表达的作用,并与细胞增殖、转化和分化密切相关[17-19]。动物实验及细胞实验研究发现,模型组WB检查提示p-SHP2、p-JNK、p-p38 MAPK及p-ERK蛋白的表达明显升高且斑块面积明显增大,说明MAPK信号通路可促进ApoE-/-小鼠动脉粥样硬化的形成。
给予PHPS1药物治疗后,动物实验及细胞实验WB结果均提示p-SHP2、p-JNK、p-p38 MAPK及p-ERK蛋白的表达明显降低且斑块面积明显减小,说明PHPS1可通过抑制MAPK信号通路从而抑制炎性因子的释放,最终抑制动脉粥样硬化的形成。给予PHPS1药物治疗后,小鼠体内TG、TC及LDL-C明显下降,HDL-C表达明显上升。既往研究同样表明,其余干预因素作用于MAPK信号通路后即可引起小鼠体内TG、TC及LDL-C表达的下降,HDL-C表达的上升[4,20,21]。说明MAPK信号通路可调节小鼠体内脂质的代谢状态。
综上所述,SHP2抑制剂PHPS1通过下调MAPK信号通路从而抑制ApoE-/-小鼠动脉粥样硬化斑块的形成。
