鸡白痢、鸡伤寒沙门菌分子分型方法的验证
2022-03-14龚建森徐敬潇祁克宗窦新红董永毅
龚建森,徐敬潇,张 笛,祁克宗,徐 步,窦新红,董永毅
(1.江苏省家禽科学研究所,扬州 225125;2.安徽农业大学 兽医病理生物学与疫病防控安徽省重点实验室,合肥 230036; 3.江苏省动物疫病预防控制中心,南京 210036)
鸡白痢和禽伤寒可导致家禽败血性疾病,是兽医学界较早发现的两种烈性传染病,其病原分别是鸡白痢沙门菌和鸡伤寒沙门菌,分别由Rettger(1900年)和Klein(1889年)发现并报道[1]。由于20世纪执行的家禽改良计划,目前发达国家已控制了这两种疾病,但是包括中国在内的发展中国家,鸡白痢和禽伤寒仍然是家禽养殖业中的顽症[2]。
鸡白痢、鸡伤寒沙门菌均属于无运动性的沙门菌,在流行病学、临床症状、控制和净化措施方面具有相似之处。此外,在病原学方面,两种病原具有相同的抗原因子(9,12:-:-),因此很难通过常规诊断或血清学方法进行区分。国外学者通过多年研究发现了几种适合区分这两种病原的生化指标,包括葡萄糖产气、麦芽糖、鸟氨酸、卫矛醇等[3],但其缺点是无法满足快速、批量化检测的要求。
随着鸡白痢、鸡伤寒沙门菌基因组序列的逐步公开,相关的分子生物学鉴别方法开始报道,例如基于glgC和speC基因可变区的二重PCR方法[4],基于fimH基因和fliC基因的单核苷酸多态性的PCR-RFLP方法[5-6],基于ratA基因可变区的PCR方法[7],基于rfbS序列等位基因的PCR方法[8]等。上述分子鉴别方法虽提升了鸡白痢、鸡伤寒沙门菌的分型效率,但其特异性仍需通过大量的菌株进行验证。本研究以3株鸡白痢、鸡伤寒沙门菌国际参考菌株和306株国内分离株为研究对象,对5种已知分子分型方法进行验证性实验。
1 材料与方法
1.1 供试菌株 鸡白痢沙门菌ATCC10398、ATCC19945和鸡伤寒沙门菌ATCC 9184由江苏省家禽科学研究所保存提供;306株临床分离株为本实验室1953年以来分离自国内部分养殖场的病死家禽[9-10];上述菌株均具有典型的沙门菌生化特性,血清型为9,12:-,-,不具有运动能力。
1.2 主要试剂 鸟氨酸脱羧酶、卫茅醇生化鉴定管购自广东环凯微生物科技有限公司;Premix PrimeSTAR HS高保真聚合酶预混液、rTaq DNA聚合酶预混液、6× Loading Buffer、pMDT-19载体、TA克隆试剂盒、DNA marker购自宝生物工程(大连)有限公司;琼脂糖凝胶DNA回收试剂盒、DH5α感受态细胞购自天根生化科技(北京)公司;SacⅠ、Hinp1Ⅰ限制性内切酶购自NEB公司。
1.3 细菌基因组提取 采用煮沸法提取细菌基因组DNA,将菌液经PBS清洗后用0.1 mLddH2O重悬,沸水浴10 min,迅速置于-20℃冷却10 min,离心取上清液-20℃保存备用。
1.4 鸡白痢、鸡伤寒沙门菌生化分型 根据参考文献[3]报道的方法,使用鸟氨酸脱羧酶和卫茅醇生化鉴定管进行生化分型。将新鲜菌液稀释至0.5个麦氏比浊浓度后加入西林瓶内,37℃培养24 h后判定结果。两种试剂反应均为阳性者为鸡伤寒沙门菌,反之为鸡白痢沙门菌。
1.5 鸡白痢、鸡伤寒沙门菌分子分型 根据参考文献[4-8]报道的分子分型方法,合成引物、引物序列见表1。以鸡白痢沙门菌ATCC10398、ATCC19945和鸡伤寒沙门菌ATCC 9184 3株参考菌株基因组为模板,摸索反应条件后,进一步对306株临床分离株进行分型。

表1 本研究所用引物Table 1 Primers used in this study
1.6 分子分型可疑菌株的序列分析 对分子分型实验中的可疑菌株,将扩增产物回收、克隆至pMD-19T载体,挑取阳性克隆测序,测序结果上传GenBank数据库,并与已知序列比对分析。
2 结果
2.1 鸡白痢、鸡伤寒沙门菌生化分型结果 生化反应结果显示,12株鸟氨酸脱羧酶和卫茅醇生化反应结果均为阳性,其余294株均为阴性,未发现仅1种生化反应结果为阳性的可疑菌株。上述结果表明,306株分离株中,鸡白痢沙门菌为294株,鸡伤寒沙门菌为12株。
2.2 鸡白痢、鸡伤寒沙门菌分子分型结果 分别使用5种分子分型方法对实验菌株进行验证。glgC、speC二重PCR分型结果如图1所示,其中speC引物可同时扩增鸡白痢、鸡伤寒沙门菌(产物大小252 bp),而glgC引物仅扩增鸡伤寒沙门菌(产物大小174 bp)。对306株分离株的检测结果与生化分型一致。
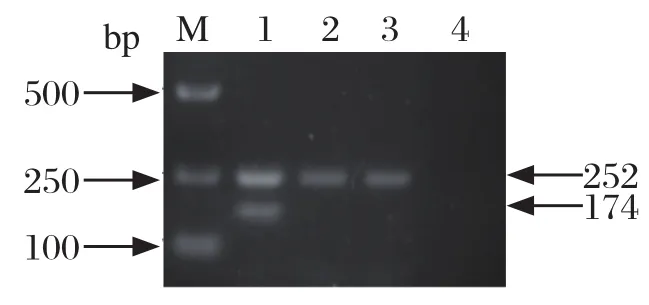
图1 鸡白痢、鸡伤寒沙门菌speC、glgC二重PCR分型Fig.1 Duplex PCR assay of Salmonella pullorum and Salmonella gallinarum
ratA-PCR分型结果如图2所示。其中鸡白痢沙门菌可扩增出243 bp的条带,鸡伤寒沙门菌可扩增出1047 bp的条带。对分离株的检测结果与生化分型一致。
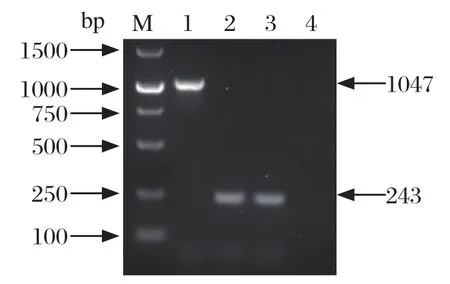
图2 鸡白痢、鸡伤寒沙门菌ratA-PCR分型Fig.2 ratA-PCR assay of Salmonella pullorum and Salmonella gallinarum
rfbS allele-specific PCR分型结果如图3所示,其中以rfbS-F/rfbS-RG扩增时,3株参考菌株中仅有鸡伤寒沙门菌ATCC 9184出现特异性条带(图3A);以rfbS-F/rfbS-RP扩增时,只有鸡白痢沙门菌ATCC 10398和ATCC 19945出现特异性条带(图3B)。进一步对临床分离株的检测结果发现,有295株分离株仅对一种鉴别引物有条带,且结果与生化鉴定结果一致;而11株分离株检测结果可疑(两对引物检测结果均为阳性),包括2株鸡伤寒沙门菌和9株鸡白痢沙门菌。

图3 鸡白痢、鸡伤寒沙门菌rfbS allele-specific PCR分型Fig.3 rfbS allele- specific PCR assay of Salmonella pullorum and Salmonella gallinarum
fliC PCR-RFLP分型结果如图4所示。3株参考菌株均可扩增出198 bp的特异性条带,经Hinp1Ⅰ限制性内切酶消化后,鸡伤寒沙门菌fliC基因的PCR产物可被酶切为82 bp与116 bp两个片段,而鸡白痢沙门菌不能被消化。对临床分离株的检测结果发现,有1株鸡白痢沙门菌的扩增产物,酶切后出现鸡伤寒沙门菌的酶切图谱,其余305株分离株的酶切结果与生化分型一致。
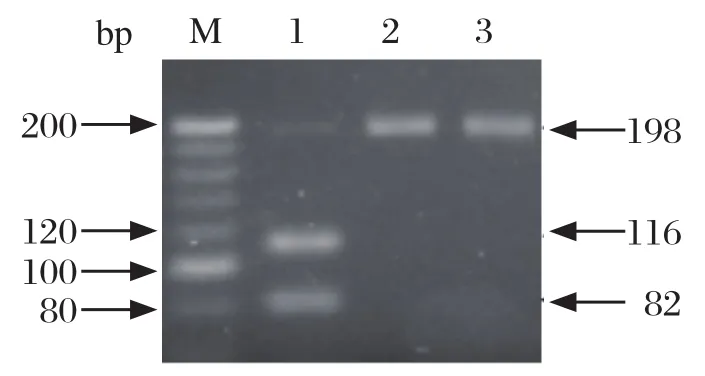
图4 鸡白痢、鸡伤寒沙门菌f l iC PCR-RFLP分型Fig.4 fliC PCR-RFLP assay of Salmonella pullorum and Salmonella gallinarum
fimH PCR-RFLP分型结果如图5所示。3株参考菌株均可扩增出1026 bp的特异性条带,但PCR产物均不能被SacⅠ限制性内切酶酶切,与文献报道的结果不符(鸡白痢沙门菌不能被酶切,鸡伤寒沙门菌可以被酶切为554 bp和472 bp两个片段)。进一步对306株临床分离株的检测结果发现,所有菌株均可扩增出1026 bp的特异性条带,但12株鸡伤寒沙门菌均不能被SacⅠ酶切。
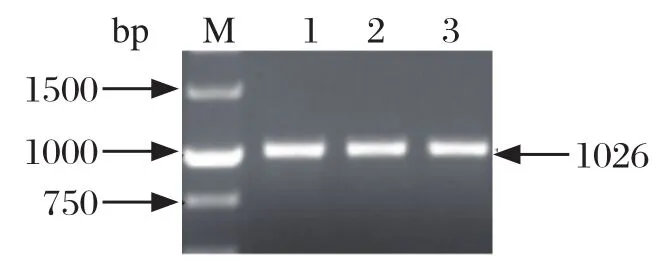
图5 鸡白痢、鸡伤寒沙门菌fimH PCR-RFLP分型Fig.5 fimH PCR-RFLP assay of Salmonella pullorum and Salmonella gallinarum
2.3 分子分型中可疑菌株的序列分析 对分子分型实验中出现的可疑菌株进行基因克隆与序列比对分析。将11株rfbS allele-specific PCR结果可疑菌株序列(GenBank登录号:MW159678~MW159688)与3株参考菌株序列比对,结果如图6A所示。结果发现,11株可疑菌株在反向鉴别引物(rfbS-RG或rfbS-RP)区域内均存在1个碱基突变(鸡伤寒沙门菌为G→C,鸡白痢沙门菌为A→C),导致出现假阳性结果。

图6 可疑菌株基因序列分析Fig.6 Sequence analysis of suspicious strains
将fliC PCR-RFLP分型中的1株可疑分离株序列(GenBank登录号:MW159674)与3株参考菌株序列进行比对分析,结果如图6B所示。结果发现SP1220菌株fliC序列第82位碱基由“A”突变为“C”,导致Hinp1Ⅰ可以识别该位点(G*CGC)进行酶切,因而出现了与鸡伤寒沙门菌相同的假阳性结果。
将3株参考菌株的fimH基因序列(GenBank登录号:MW159675~ MW159677)与文献[5]中的2株对照菌株(GenBank登录号:AY486389、AY486388)的序列进行比对分析,结果如图6C所示。与文献中报道的鸡伤寒沙门菌AY486389相比,ATCC9184序列内的酶切位点发生突变(T→A),导致SacⅠ无法酶切,致使本研究中鸡伤寒沙门菌均为假阴性结果。此外,检索GenBank中已知的4株鸡伤寒沙门菌fimH基因序列可以发现,除文献报道的AY486389(GenBank登录号:AY486389)外,其他3株ATCC 9184(GenBank登录号:CP019035)、ATCC 700623(GenBank登录号:EU445778)和287/91(GenBank登录号:AM933173)均不存在SacⅠ酶切位点。
3 讨论
对鸡白痢和鸡伤寒的有效控制主要依赖于及时发现并淘汰感染家禽,血清学实验通常仅用于病原感染的检测,对于感染的最终确认仍需通过病原学实验[3]。因此,准确区分鸡白痢或鸡伤寒沙门菌感染可以为进一步的净化工作提供帮助。为此,国外多名学者在探索有效区分这两种病原方面开展了大量工作,并成功筛选出鸟氨酸、卫矛醇等生化鉴定指标,为准确区分上述两种病原提供了可靠依据,并成为国际公认的鸡白痢、鸡伤寒沙门菌鉴定标准[1,3]。
虽然生化鉴定方法是目前官方认可,使用最广泛的经典方法,但存在耗时、繁琐、成本偏高的缺点,尤其无法满足大批量样品快速分析的需求。而以PCR为代表的分子生物学方法具有敏感、特异和快速的优点,存在取代传统生化鉴定方法的潜力[11-13]。由于鸡白痢、鸡伤寒沙门菌序列之间存在高度相似性,导致大多数分子分型方法依赖于特定基因的单核苷酸多态性,对于方法的特异性验证通常仅限于少量菌株,缺乏实际应用效果的报道。
为了检验鸡白痢、鸡伤寒沙门菌分子分型方法的实际应用效果,本研究以实验室收集、保存的3株鸡白痢、鸡伤寒沙门菌国际参考菌株与306株国内分离株为研究对象,分别使用生化分型与分子分型的方法进行比对验证。结果发现,基于糖原合成基因glgC与鸟氨酸脱羧酶基因speC可变区的二重PCR和基于编码假定蛋白基因ratA可变区的PCR均具有良好的特异性,其检测结果与生化分型完全一致;而基于脂多糖基因(rfbS)、Ⅰ相鞭毛基因(fliC)和Ⅰ型菌毛黏附素基因(fimH)单核苷酸多态性的3种分型方法均出现了不同数量的假阳性/假阴性结果,特别是fimH PCR-RFLP方法对本研究中所有鸡伤寒沙门菌均无法正确判别,可能与该文献中所使用的实验菌株均为波兰分离株[5],与ATCC参考株及中国分离株在fimH基因序列上存在差异有关。
综上所述,本研究对鸡白痢、鸡伤寒沙门菌国内分离株进行了分子分型方法验证,结果发现部分方法在特异性方面存在误差,因而对上述方法的使用尤需谨慎。而对于尚未发现问题的方法,其准确性仍需要范围更广、数量更多的菌株进行验证。为了更准确的应用分子分型方法,建议同时使用两种以上方法进行鉴定,此外对于可疑菌株仍需通过生化方法进行最终确认。
