狂犬病病毒G蛋白的克隆表达及其抗体胶体金检测试纸条的研制
2022-03-14邓柏林郑雪莹范君文郑金来郭俊林张守峰
邓柏林,郑雪莹,范君文,郑金来,王 培,郭俊林,张守峰
(1.北京市动物疫病预防控制中心,北京 102629;2.北京标驰泽惠生物科技有限公司,北京 102629;3.军事科学院军事医学研究院军事兽医研究所,长春 130122)
狂犬病是(Rabies)由狂犬病病毒(Rabies virus,RV)感染中枢神经系统引起的的急性人畜共患病,主要引起急性脑炎或脑膜脑炎,几乎所有的温血动物均易感,一旦发病,其病死率几乎100%[1],据测算,全世界每年因狂犬病可导致59 000多人死亡,95%发生在非洲和亚洲,原因是被已感染的犬只咬伤[2-3]。近年来,我国狂犬病发病数和死亡数虽在一直下降,但仍处于我国法定报告传染病前列,给人民群众生命健康造成威胁。目前我国17个狂犬病主要流行省区的62个狂犬病病毒代表流行株均为基因1型,毒株相对稳定[4]。北京市自2005年以来均有人感染狂犬病,其中2013年是13例,达到了近年来的高峰,而近几年对伤人犬的病原学检测中均发现了狂犬病确诊病例,大部分确诊病例均为流浪犬。世界卫生组织(World Health Organization,WHO)及世界动物卫生组织(office international des épizooties,OIE)规定血清中和抗体效价高于0.5 IU/mL表明机体对狂犬病病毒感染具有抵抗力,疫苗免疫覆盖率达到70%以上时,才能有效控制动物狂犬病的流行[5]。当前国内检测犬狂犬病病毒抗体的诊断方法主要是免疫荧光抑制灶实验(rapid fluorescent focus inhibition test,RFFIT)、荧光抗体病毒中和试验(fluorescent antibody virus neutralization test,FAVN)和酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)方法等[6-8],但这些方法存在场地设备要求高、操作难度大、检测时间长以及需要专业人员操作等问题,因此,本研究基于胶体金方法的简便、快速,开展了狂犬病病毒G蛋白的重组纯化及狂犬病病毒IgG抗体胶体金试纸条的研制,为宠物诊疗机构、实验室监测和流行病学调查工作带来便利。
1 材料和方法
1.1 细胞、菌株及试剂 供体质粒pcDNA3.1(+)、大肠杆菌Mach1-T1感受态细胞购自TaKaRa公司;CHO-S细胞购自Invitrogen公司;试验用各类抗体血清由疫控中心保存提供;DL2000 DNA marker、T4 DNA连接酶、限制性内切酶Hind Ⅲ和EcoRⅠ(NEB)购自北京博迈德生物技术有限公司;氯金酸溶液、柠檬酸三钠溶液国药集团化学试剂有限公司;硝酸纤维素膜(NC膜)购自上海捷宁生物科技有限公司。
1.2 狂犬病病毒G蛋白重组载体构建 将克隆载体pcDNA3.1(+)与目的基因置于4℃条件,在T4 DNA连接酶作用下过夜,然后将连接产物转化大肠杆菌感受态细胞Mach1T1菌株,涂布含氨芐的LB固体培养基筛选阳性克隆,37℃条件下扩大培养12~15 h后提取重组质粒。
1.3 CHO-S细胞转染 1×107细胞与10 μg重组质粒混匀于200 μL电击杯中,电击条件为1100 V/30 ms,取出电击后的细胞悬液转移至含有30 mL CD08无血清培养基的125细胞培养瓶中,37℃条件下5%CO2培养箱中、65 rpm持续培养。
1.4 Western blot鉴定 转染48 h后4000×g 离心20 min,分别收集培养基和胞体,培养基电泳上样50 μL,取适量胞体进行还原处理后上样50 μL。SDS-PAGE结束转膜(300 mA/1 h),5%脱脂奶粉封闭1 h,加入Anti-6His-HRP抗体孵育1 h,再利用TBST洗涤5次后进行显色处理。
1.5 纯化 培养基共收集约60 mL进行亲和纯化。亲和纯化后的样品利用10 kDa超滤管进行超滤浓缩换液至1×PBS,终体积约500 μL、80 μg,-20℃保存。
1.6 狂犬病病毒IgG抗体胶体金检测试纸条的制备
1.6.1 胶体金溶液的制备 氯金酸溶液煮沸后匀速搅动下加入柠檬酸三钠溶液,继续加热煮沸5 min后冷却至室温,2~8℃避光保存。
1.6.2 重组抗原的标记 取1 mL胶体金溶液于离心管中,加入0.2 mol/L碳酸钾15 μL。取10 μg纯化的重组G蛋白,加入到胶体金溶液中,迅速混匀,室温放置30 min。加入20%牛血清白蛋白溶液10 μL,混匀,室温平衡5 min。加入20% PEG20000溶液10 μL,混匀,室温平衡30 min。将金标抗体溶液转移至离心管中,以10 000 ×g离心10 min,弃上清液。沉淀中加入100 μL金标复溶液,混匀,2~8℃避光保存。
1.6.3 金垫的制备 将用胶体金标记好的重组G蛋白与金标复溶液1∶1稀释混匀后均匀喷在浸泡过的干净的玻璃纤维素膜上,置干燥室干燥过夜(16~24 h),备用。
1.6.4 硝酸纤维素包被膜的制备 用PBS(0.1 mol/L,pH值7.2)将鼠抗G蛋白调整浓度为0.5 mg/mL,制备质控(C线),将鼠抗犬IgG、鼠抗猫IgG 1∶1调整浓度为1.0 mg/mL,喷于PVC底板的NC膜上,制备检测线(T线)。将所划膜的板子置干燥室(相对湿度≤35%)干燥过夜(16~24 h)。
1.6.5 样品垫的制备 玻璃纤维素膜置样品垫处理液中浸泡完全后干燥备用。
1.6.6 试纸条组装 在相对湿度≤35%的条件下,将试纸条按要求进行组装后,将组装好的板子修剪整齐,切成宽3.0 mm的试纸条。挑取印膜无划痕、无污染、边缘整齐的试纸条,装入塑料卡中压紧制成测试卡,其中样品垫区域对应于测试卡的加样孔;硝酸纤维素膜区域对应于塑料卡的视窗位置。
1.7 试纸条质量的评估
1.7.1 特异性 用狂犬病病毒抗体检测试纸条检测狂犬病毒IgG抗体阳性血清、狂犬病病毒IgG抗体阴性血清、犬细小病毒IgG抗体阳性血清、犬冠状病毒IgG抗体阳性血清和SPF犬血清各1份。观察检测结果,评价试纸条的特异性。
1.7.2 灵敏性 采用中和抗体方法检测出狂犬病病毒抗体血清滴度,并按比例稀释后,用于评价试纸条的灵敏性。
1.7.3 重复性 制备三批狂犬病病毒IgG抗体检测试纸条,用同一批次内和不同批次的试纸条同时检测相同狂犬病病毒IgG抗体阳性血清和狂犬病病毒IgG抗体阴性血清各三份,重复三次,观察检测结果,评价试纸条的批内和批间重复性。
1.7.4 稳定性 将组装好的试纸条连同一个干燥剂一起放入铝箔袋,封口。同一批次试纸条,先使用标准血清检测抗体,再分别在4℃环境和37℃环境下放置1、2、3、4、5、6个月后检测,检验试纸条的检出效果。
1.7.5 临床样品检测 收集100份犬血清样品,分别使用本试纸条和市售的两种狂犬病病毒G蛋白胶体金试纸条进行检测。比较本试纸条与其他产品的符合程度。
2 结果
2.1 核酸序列 通过对NCBI(GenBank登录号:NC_001542.1)和UniProt(P03524-strain ERA)等数据库的查询,同时为了提高G基因在真核生物的表达量,以同义密码子替换的方式,进行了多处密码子优化(图1)。在所示基因对应氨基酸的前面设计了促进真核表达体系分泌表达的信号肽(MVPQALLFVP LLVFPLCFG)和利于后期纯化的His标签(HHHHHH)。将上述编码目的蛋白的基因通过化学合成法由北京博迈德基因技术有限公司进行全基因合成。

图1 优化后的核苷酸序列Fig.1 The optimized nucleotide sequence
2.2 重组表达载体的构建 将目的基因导入到pcDNA3.1(+)载体中,并将连接产物转化大肠杆菌感受态细胞Mach1T1菌株,培养后,用Hind Ⅲ和EcoRⅠ双酶切鉴定,可见2条大小分别为5500 bp和1500 bp的片段,与预期结果一致(图2),命名为pcDNA3.1(+)-G。
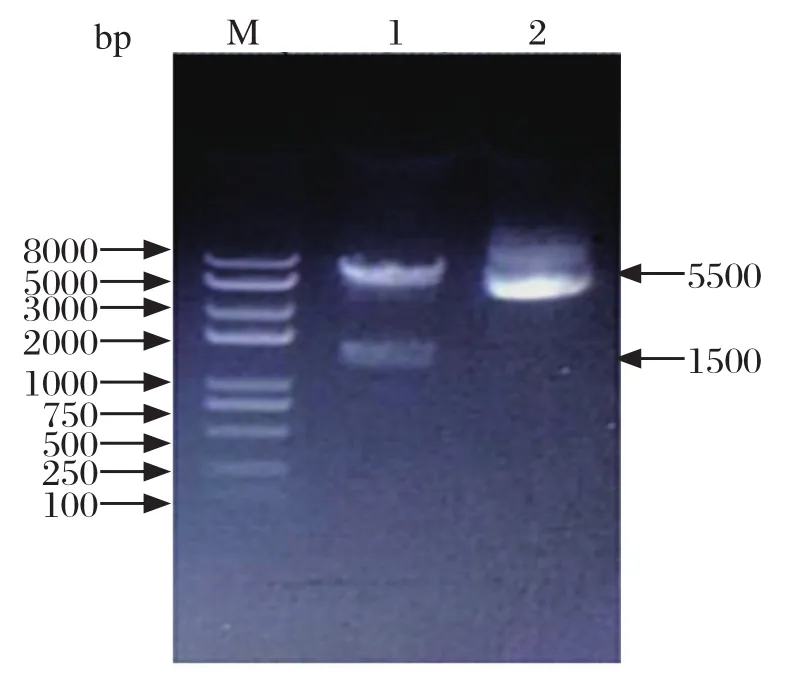
图2 重组质粒酶切鉴定Fig.2 Identification of recombinant plasmid enzyme digestion
2.3 目的蛋白鉴定和纯化 收集细胞培养基进行镍柱亲和纯化(图3),亲和纯化后的样品利用10 kDa超滤管进行超滤浓缩换液至1×PBS,终体积约500 μL,约80 μg,-20℃保存,得到的重组G蛋白即为人工合成狂犬病病毒G基因(RV-G基因)经重组质粒在真核表达系统CHO-S细胞表达、纯化后的G蛋白(图4)。使用NanoDrop2000超微量分光光度计外测定G蛋白浓度为1.3 mg/mL。
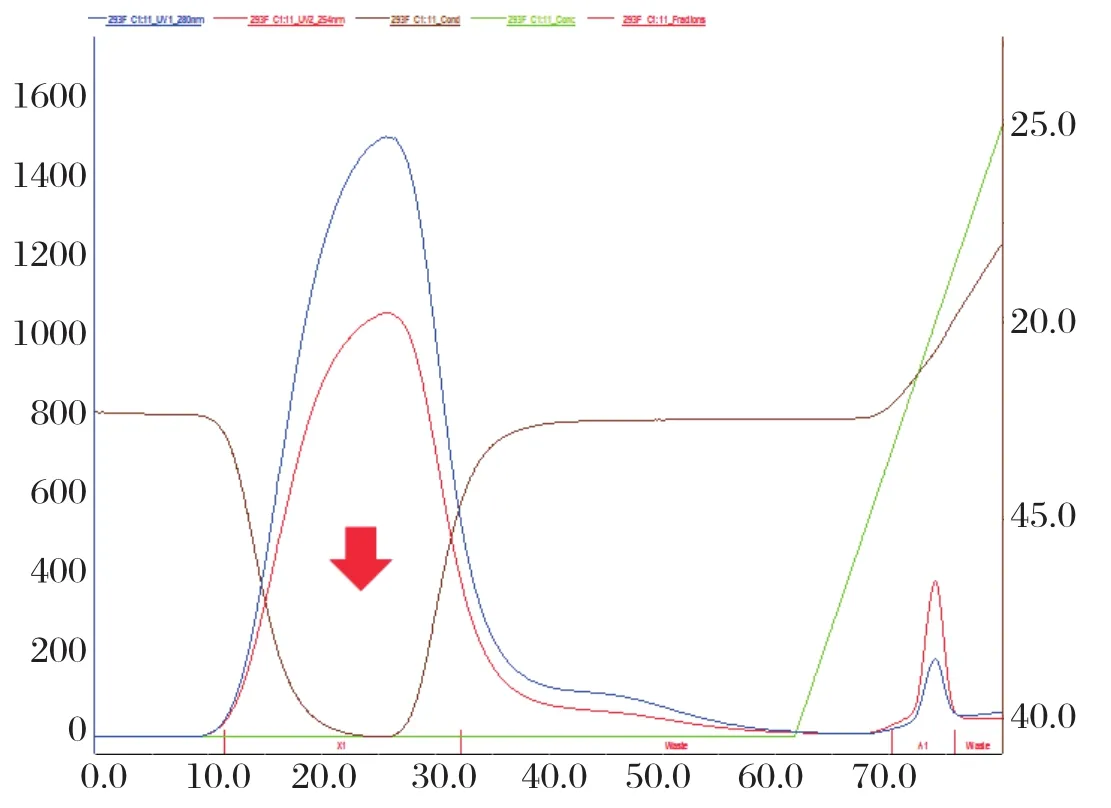
图3 镍柱亲和图谱Fig.3 Ni affinity purification
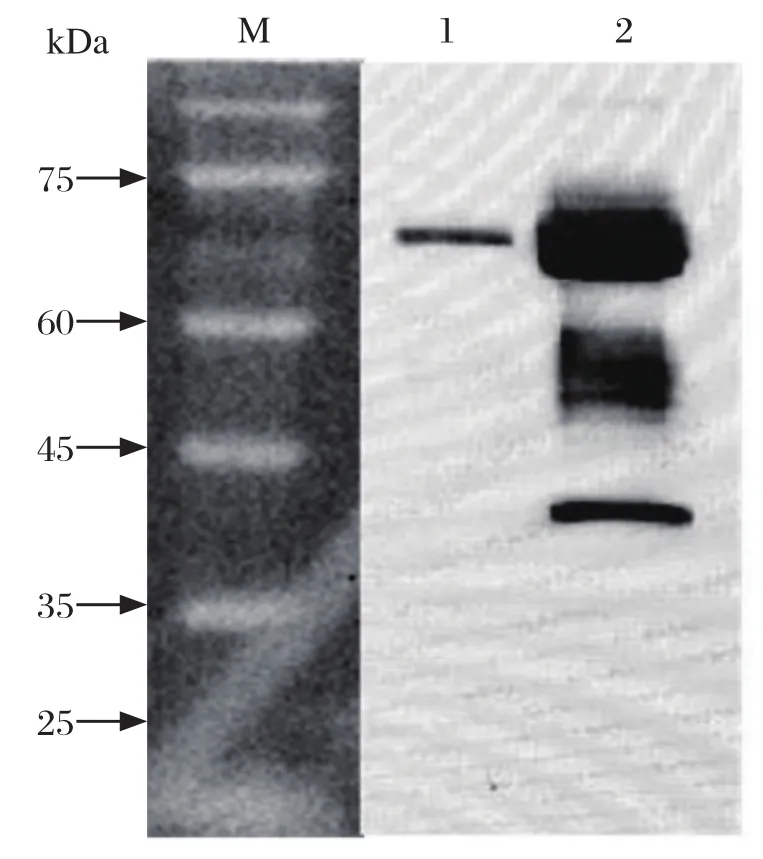
图4 Western blot检测结果Fig.4 Test result of Western blot
2.4 试纸条特异性 狂犬病病毒IgG抗体检测试纸条检测狂犬病病毒IgG抗体阳性血清为阳性,狂犬病病毒IgG抗体阴性血清和SPF犬血清为阴性,同时不与犬细小病毒IgG抗体阳性血清、犬瘟热病毒IgG抗体阳性血清、犬冠状病毒IgG抗体阳性血清发生交叉反应,表明该试纸条具有较好的特异性(图5)。
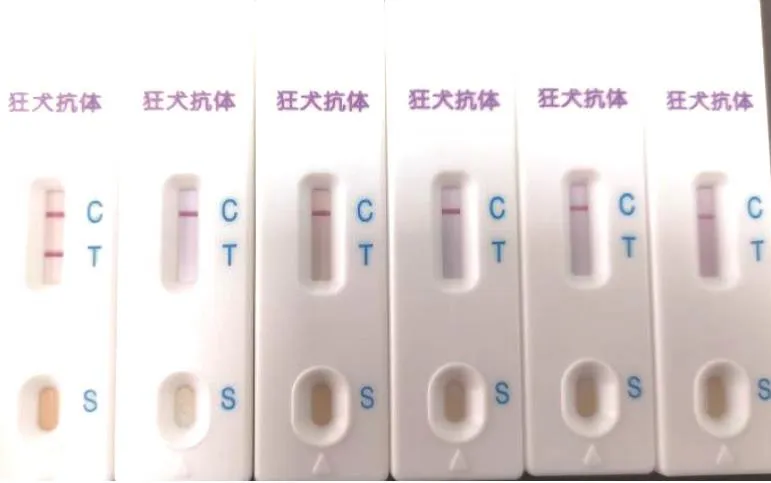
图5 试纸条特异性检测结果Fig.5 Strip specificity test results
2.5 试纸条敏感性 使用中和抗体方法(FAVN)测得犬狂犬病病毒IgG抗体浓度为为40 IU/mL的阳性血清分别做1∶10、1∶20、1∶40、1∶80、1∶160、1∶320、1∶640倍比稀释,当稀释血清为1∶160时检测线仍可见,表明该试纸条敏感性良好。

图6 试纸条敏感性检测结果Fig.6 Strip sensitivity test results
2.6 试纸条重复性 用同一批次内的试纸条检测相同狂犬病病毒IgG抗体阳性血清3份,检测结果为阳性,用同一批次内的试纸条检测相同狂犬病病毒IgG抗体阴性血清3份,检测结果为阴性。重复3次检测结果相同。不同批次的试纸条检测相同狂犬病病毒IgG抗体阳性血清3份,检测结果为阳性,不同批次内的试纸条检测相同狂犬病病毒IgG抗体阴性血清3份,检测结果为阴性,重复3次检测结果相同。表明该试纸条重复性好。
2.7 试纸条稳定性 使用稀释浓度相同的标准血清检验试纸条的稳定性,6个月后仍可检测出抗体水平呈阳性,稳定性较好。
2.8 临床样品检测 100份犬血清样品,试验试纸条共检测出阳性样品75份,阴性样品25份,市售试纸条A共检测出阳性样品73份,阴性样品27份,试纸条B共检测出阳性样品72份,阴性样品28份(表1)。试验试纸条和市售试纸条A总符合率为94%,和市售试纸条B总符合率为91%。
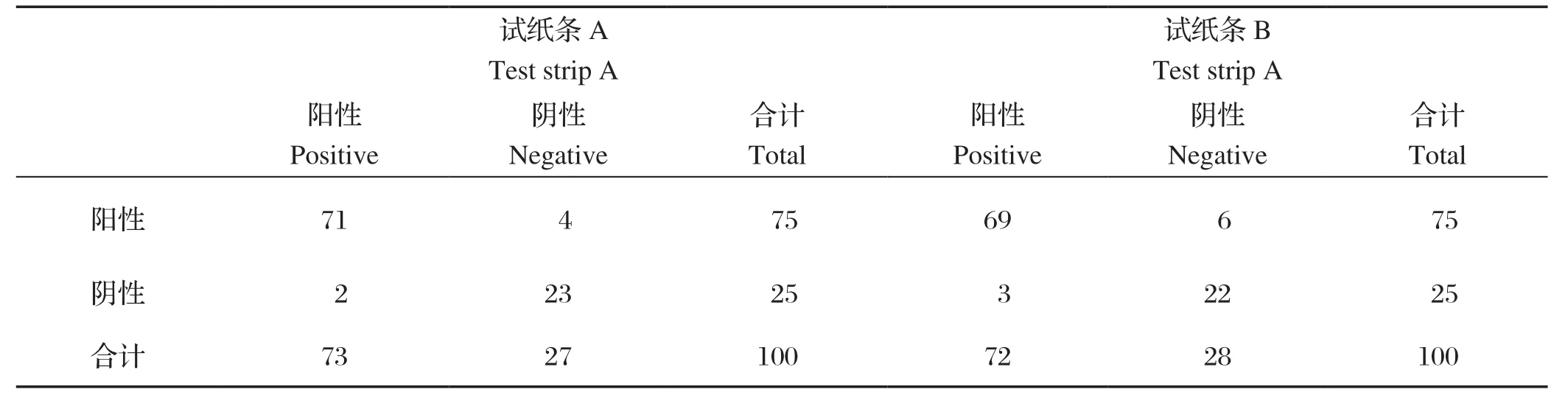
表1 狂犬病病毒抗体检测方法符合率试验Table 1 Coincidence rate test of Rabies virus antibody detection method
3 讨论
G蛋白由524个氨基酸组成,相对分子质量为56 kDa,其抗原性主要依赖于空间构象表位,主要的抗原位点有GⅠ区、GⅡ区和GⅢ区[9]。G蛋白作为狂犬病病毒唯一的糖蛋白,糖基化对其稳定性、抗原性、生物活性及糖蛋白的表达与分泌起关键作用,因此在利用现代生物技术手段表达G蛋白时必须采用真核表达体系才能相对接近的表达出RV在侵入机体后所翻译表达的G蛋白结构。市场上常用的狂犬病病毒抗体检测主要是ELISA和胶体金方法,胶体金免疫层析技术已经在多种动物疾病诊断中应用,柳旭伟等[10]统计表明该方法已用于多种动物细菌性疾病、病毒性疾病和寄生虫病的诊断,哈登触日亚等[11]也通过在专利数据中检索中发现上述三个领域目前已申请专利161项,占胶体金技术申请专利总数的31.45%。本实验室曾做过狂犬病ELISA试剂盒的比对试验,结果表明目前市场上的常用ELISA试剂盒一致性有差异且整体一致性不高[12],其中G蛋白包被的盒子效果明显好于N蛋白标记的盒子,因此本研究制备的狂犬病病毒重组糖蛋白,作为抗原包被效果好。胶体金检测技术无需对标记物进行分离,省去了ELISA中洗涤等繁琐步骤,极大的缩短了检测时间,抗体滴度高时5 min即可出结果。该试纸条不仅检测时间短且检测的一致性与ELISA相仿。
近几年,随着宠物犬数量的增长,犬活动区域不断扩大,宠物扰民、伤人、污染社区环境等一系列问题也随之产生,在全球范围内,为一只犬免疫的平均支出是4美元,但治疗被犬咬伤的患者平均需要108美元,这是前者的27倍[13]。通过暴露前后检测抗体水平,以科学检测数据结果为依据,可准确掌握动物个体免疫状况,一方面指导宠物医生为犬、猫制定个性化的免疫程序,确保犬、猫得到有效保护;另一方面犬、猫接种狂犬疫苗并获得有效保护,是人类在狂犬病暴露前和暴露后进行预防的一项重要的、可行的、有效的措施,它进一步降低了狂犬病病毒传播给人的几率,更好地消除被动物咬伤(或者抓伤)人员的担心与恐惧为人类狂犬病防控建立一道坚实的屏障。此外,根据当前航空以及跨境运输犬、猫相关规定,必须出具相关犬、猫狂犬病免疫情况的检测报告,达到保护水平方可运输。因此本研究制备的试纸条检测狂犬病毒IgG抗体操作简单、快速得到检测结果,可检测出犬是否获得中和保护抗体,对接种狂犬病疫苗动物的免疫接种效果进行评估,以消除免疫不确实动物带来的潜在威胁。
