RSV感染气液相界面培养人支气管上皮细胞模型的建立及其对HMGB1和pMLKL表达的影响
2022-03-14廖焕金李延宁戈伊芹
王 娟,廖焕金,李延宁,戈伊芹,李 佳
(上海交通大学附属第一人民医院检验医学中心,上海 200080)
人支气管上皮细胞(Human bronchial epithelial cell,hBEC)是气体交换、呼吸道湿润和病原体防御的第一道物理和化学屏障,主要由纤毛细胞、杯状细胞和基底细胞等不同类型上皮细胞组成,属于假复层上皮[1]。各种类型细胞各司其职,杯状细胞是产生黏液的主要细胞,产生的黏液起捕获吸入的颗粒及病原体的作用[2-3];纤毛细胞通过纤毛摆动将捕获了颗粒或病原体的黏液推动到支气管敏感部位或咽部,最终清除到肺外[3];基底细胞排列于基底膜,具有干细胞特性,在一定条件下可化生为纤毛细胞和杯状细胞[4],是机体黏膜维持正常黏液产生、表层细胞更新和功能维持的生理机制,可被高度调节[2]。当在某些刺激条件下细胞化生失衡时,基底细胞可大量化生为杯状细胞,使其数量激增,并大量分泌黏液;同时,黏液组成比例失衡、黏性增加,黏液排出困难,导致气道堵塞,上皮损伤可导致纤毛细胞脱落,气体弥散至肺泡,引发缺氧,上皮进一步过氧化物聚集、死亡并脱落,形成恶性循环,最终发生呼吸窘迫综合征[5-6]。这是呼吸道合胞病毒(respiratory syncytial virus,RSV)等多数呼吸道病毒致病的病理基础[1]。在当下全球大流行的严重急性呼吸综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)致病性中也尤为明显,新型冠状病毒肺炎(corona virus disease 2019,COVID-19)病死者尸检报告显示,肺解剖可见大量灰白色黏稠分泌物溢出,气管腔内可见白色泡沫状黏液和胶冻状黏液附着[7-8]。
目前,最常见的hBEC研究模型为永生化细胞系液体浸没式培养模型,该模型简单、易操作,但仅为单层生长细胞,且细胞类型单一,无法还原hBEC在人体内多细胞类型、假复层、细胞化生等特征。因此,开发一种能确切复制人体内支气管上皮状态和功能,尤其是其假复层分化及气液相界面生长特征的体外模型,是目前呼吸道病毒相关研究所亟需的。本研究采用支气管上皮细胞培养的金标准方法——气液相界面(air-liquid interface,ALI)培养法[9]建立原代hBEC体外培养模型,探究RSV感染该细胞模型的条件,及其对高迁移率族蛋白1(high mobility group box protein 1,HMGB1)和磷酸化混合系列蛋白激酶样结构域(phosphorylated mixed-lineage kinase domain-like protein,pMLKL)表达的影响,进而分析RSV感染致hBEC损伤的机制,为呼吸道病毒致病机制研究提供关键的体外细胞模型。
1 材料和方法
1.1 实验材料与试剂
原代hBEC购自瑞士LONZA公司,RSVA2株购自美国标准生物品收藏中心。CorningTranswell板(美国Corning公司;24孔,带6.5 mm直径、0.4 μm孔径Transwell小室)。PneumaCult-Ex Basal Medium、PneumaCult-Ex 50×Supplement、PneumaCult-ALI Basal Medium、PneumaCult-ALI 10×Supplement、PneumaCult-ALI Maintenance Supplement(加拿大STEMCELL Technologies公司)。氢化可的松原液(美国Sigma-Aldrich公司),0.2%肝素溶液(美国Invitrogen公司);羊多克隆抗RSV抗体(货号20745,英国Abcam公司),鼠抗人HMGB1抗体(货号MAB1690,美国R&D公司),兔抗人pMLKL抗体(货号187091,英国Abcam公司)。Alexa Fluor 555标记驴抗羊IgG(货号A-21432,美国Invitrogen公司),Alexa Fluor 555标记羊抗鼠IgG(货号A-21422,美国Invitrogen公司),Alexa Fluor 488标记羊抗兔IgG(货号A-11008,美国Invitrogen公司)。
1.2 hBEC培养
1.2.1 培养液配制 (1)扩展期培养液。室温融化10 mL PneumaCult-Ex 50×Supplement,将其加入490 mL PneumaCult-Ex Basal Medium中,加入0.5 mL氢化可的松原液和1%青霉素-链霉素混合液,轻柔颠倒混匀。配制好的扩展期培养液可在4 ℃条件下保存4周。(2)ALI培养期培养液。将50 mL PneumaCult-ALI 10×Supplement置于4 ℃冰箱过夜融化,轻柔颠倒混匀后,加入450 mL PneumaCult-ALI Basal Medium中,再加入1%青霉素-链霉素混合液,轻柔混匀,然后取39.32 mL上述混合液(其余可分装后-20 ℃冻存),加入400 μL 室温融化的PneumaCult-ALI Maintenance Supplement、80 μL 0.2%肝素溶液和200 μL氢化可的松原液。配制好的ALI培养液可在4 ℃保存2周。
1.2.2 hBEC的复苏及扩展期培养 首先,在培养板下室中加入500 μL扩展期培养液,然后用无菌镊子放入Transwell插件备用。将细胞冻存管37 ℃水浴快速融化细胞,将500 μL细胞悬液无菌转移至10 mL离心管中,加入1.1 mL 37 ℃温热的扩展期培养液重悬细胞,200 μL/孔分别种植于8孔Trans孔膜上(细胞密度为30 000个/孔)。将培养板置于37 °C、5% CO2培养箱中培养。24 h后Transwell上室和下室同时换液,上室换液时需轻柔操作,勿触及Transwell膜,此后隔天换液。当细胞汇合度达到100%时,将其转入ALI培养液中培养。见图1。
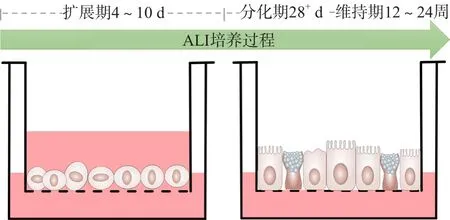
图1 hBEC的ALI培养过程示意图
1.2.3 hBEC的ALI培养 使用扩展期培养液浸没式培养至单层细胞汇合度达100%,更换下室培养液为500 μL ALI培养期培养液,吸去上室培养液建立的ALI,37 ℃、5% CO2培养箱中培养,隔天更换下室培养液。ALI培养的第1周,上室细胞表面出现少量液体,换液时需及时吸除保持上室干燥。
1.2.4 RSV感染ALI培养的hBEC (1)细胞分组。将ALI培养成熟的hBEC分为以下6组,每组3个复孔:6 h对照组,6 h感染复数(multiplicity of infection,MOI)1.0组,6 h MOI 3.0组,24 h对照组,24 h MOI 1.0组,24 h MOI 3.0组。(2)RSV感染。感染前24 h更换下室培养液为无氢化可的松的ALI培养液。向上室加入200 μL/孔 Hanks Buffer,37 ℃ 5% CO2培养箱中孵育5 min后取出,用枪头吹打Transwell膜清洗细胞表面的黏液,完全弃去洗液。RSV毒株滴度为1.44×108pfu/mL,加入根据MOI值稀释的RSV悬液100 μL/孔,对照组加入100 μL/孔 Hanks Buffer,37 ℃ 5% CO2培养箱中感染6或24 h。吸除上室液体,将Transwell插件转至已加入500 μL 10%福尔马林的培养孔中,向Transwell上室中也加入200 μL 10%福尔马林,固定10 min。固定结束将Transwell插件转至已加入500 μL磷酸盐缓冲液的新孔中,上室加入200 μL磷酸盐缓冲液,轻轻晃动培养板清洗Transwell膜,重复清洗2次后,将Transwell插件浸入磷酸盐缓冲液,4 ℃过夜。
1.3 HE染色及免疫荧光染色
将Transwell插件倒扣于纸巾上,用手术刀片沿插件底部边缘切下Transwell膜,石蜡包埋切片。脱蜡后,分别进行HE常规染色和免疫荧光染色。免疫荧光染色使用穿膜液0.1% Triton室温作用10 min,10%山羊血清室温孵育30 min,以封闭非特异性抗原;加入一抗(羊多克隆抗RSV抗体1∶250稀释,鼠抗人HMGB1抗体1∶300稀释,兔抗人pMLKL抗体1∶200稀释),室温孵育过夜;滴加二抗(Alexa Fluor 555标记驴抗羊IgG 1∶500稀释,Alexa Fluor 555标记羊抗鼠IgG 1∶500稀释,Alexa Fluor 488标记羊抗兔IgG 1∶500稀释),室温避光孵育60 min;用4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)复染细胞核,中性树胶封片。
2 结果
2.1 hBEC 扩展期培养
于倒置显微镜下观察接种到Transwell膜上的hBEC形态规则,贴壁良好,此后细胞增殖迅速,种植3 d后细胞汇合度约80%[图2(a)]。不同供者来源的hBEC生长速度略有差异,4~10 d后可观察到细胞汇合度达100%。
2.2 hBEC ALI 培养
转为ALI培养后第1周,换液时可见Transwell上室表面有少量液体来自蒸发的下室培养液,用枪头轻轻吸去,保持上室干燥,使细胞充分接触气体环境[图2(b)]。ALI培养2周后,镜下观察可见淡黄色云雾状黏液形成[图2(c)],此后黏液逐渐增多。约3周后肉眼可见上室细胞表面出现1层淡黄色覆盖物,镜下可见覆盖物随培养板晃动出现黏稠状流动[图2(d)]。ALI培养第4周,镜下开始出现条索状细胞[图2(e)],随后条索状分布越来越清晰[图2(f)],此时hBEC假复层上皮结构分化成熟,HE染色可见其假复层结构及纤毛[图2(g)、(h)]。之后持续隔天换液,ALI培养细胞可稳定维持3~6个月。

图2 光镜下观察Transwell膜上培养的hBEC
2.3 RSV感染ALI培养的hBEC
为构建并验证RSV感染ALI培养的hBEC模型,分别设置RSV病毒MOI为1.0和3.0,感染时间分别设置为6和24 h。细胞经固定制片,通过抗RSV抗体免疫荧光染色后显示,MOI为3.0感染24 h的hBEC细胞质内可见红色荧光,证实RSV病毒感染成功;而MOI为1.0感染6和24 h及MOI 3.0感染6 h的hBEC中未见红色荧光,未检测到感染RSV病毒。见图3。
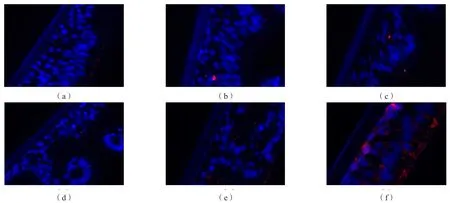
图3 ALI培养的hBEC中的RSV免疫荧光染色(×400)
2.4 RSV感染对hBEC中HMGB1及pMLKL表达的影响
为探讨RSV感染后hBEC胞表达HMGB1和pMLKL的变化,采用免疫荧光双染色,结果显示,与对照组、MOI 1.0组(6、24 h)、6 h MOI 3.0组相比,MOI 3.0感染24 h后,hBEC细胞核内出现粉色荧光(为蓝色DAPI和红色HMGB1荧光Merge结果),证实RSV感染后HMGB1出现核表达;而RSV感染前后均未见pMLKL(绿色)荧光,说明hBEC未表达pMLKL。见图4。
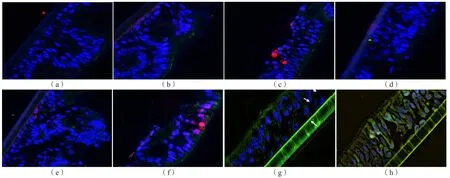
图4 ALI培养的hBEC HMGB1和pMLKL免疫荧光双染色(×400)
3 讨论
hBEC是空气与机体内环境的完美分界,是阻止病毒感染呼吸道的第1道重要防御屏障[10-11]。呼吸道病毒致病机制与支气管上皮细胞功能失调密切相关[12-14],因此,良好的hBEC体外模型是研究呼吸道病毒感染以及哮喘、慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)等常见呼吸道疾病的重要研究基础[10]。
目前,多数呼吸道疾病研究采用的体外模型为液体浸没式培养的永生化支气管上皮细胞系,如NCI-H292和A549,这些细胞大多来自肺癌细胞,其生理特点并不完全接近正常细胞,且液体浸没式培养的细胞呈单层单一生长,不能还原体内假复层上皮的特性及功能。本研究采用的ALI培养法是目前公认的支气管上皮细胞培养金标准方法[9],该方法使细胞营养供给方式发生变化,即将细胞从周围吸收营养物质改为仅从底部吸收营养物质;另外,通过培养液中氢化可的松的作用来引起细胞分化[15]。有少数研究采用酶消化法或组织块贴壁法尝试分离原代支气管或鼻黏膜上皮细胞,并进行ALI培养,种族来源以小鼠和人为主,也有猪、兔、牛来源的原代细胞。但原代细胞培养存在伦理、供体健康状态、取材繁琐、细胞量少、纯度低、成活率低、易污染等问题,一般实验室较难操作,因此该方法仍处于探索阶段。本实验室在前期也尝试采用酶消化法分离原代细胞,但同样存在上述问题,且获得的细胞无法满足大量后续实验的需求,在实际操作中,自行分离方法可行性较低。经过多次比较和探索,本研究最终采用了瑞士LONZA公司的原代hBEC,该细胞分离自儿童供者健康肺组织,我们将该P1代细胞经液体浸没式培养7~10 d,细胞大量增殖后冻存P2代细胞,作为hBEC的细胞库,不仅可用于后续ALI培养及病毒相关实验研究,还可再次复苏,进行液体浸没式培养,用于前期实验条件测试。该方法使后续实验均以同批次P2代细胞为来源,避免了多次传代细胞的去分化,保证了数据的可再现性和可靠性。本研究以RSV为研究对象,此病毒以儿童为主要感染对象,因此选择儿童来源的原代细胞。如研究SARS-CoV-2,根据其成人易感的流行病学特征[16],可选择成人来源的原代hBEC,培养方式与本研究相同。
ALI培养体系培养的hBEC在完美体现细胞体内状态和功能的同时,其自身的黏液-纤毛清除系统也为病毒感染体外模型的建立带来了困难[3]。为克服细胞本身对病毒的防御清除,本研究在实验中采用了Hanks Buffer清洗黏液,增加RSV用量及延长感染时间的措施,通过RSV免疫荧光染色显示,这些措施有效增加了病毒的感染效率。
HMGB1是一种典型的核蛋白,在人体内广泛表达,作为转录调控因子,其具有调节基因转录活化的作用[17]。当细胞发生pMLKL介导的程序性坏死时,pMLKL可通过激活离子通道或在细胞膜上穿孔破坏离子流,从而诱导膜损伤,最终导致细胞死亡[18-19];HMGB1作为一种警报蛋白或损伤相关分子蛋白(damage associated molecular pattern,DAMP),被转移到细胞质中,并从细胞中被释放出来,可起到趋化因子或细胞因子的作用[20-21]。为进一步探讨HMGB1在RSV感染的hBEC损伤及致病中的作用,本研究通过免疫荧光双染色发现,RSV MOI 3.0感染24 h后,HMGB1在细胞核高表达,未见细胞质转移及胞外释放,也未见pMLKL表达,推测hBEC在感染24 h后开始出现细胞损伤,但尚未达到坏死水平。有研究发现,RSV感染的A549细胞 HMGB1表达增加[22],RSV支气管肺炎患儿鼻咽拭子中HMGBl水平升高[23],在RSV感染小鼠的肺组织中HMGB1表达和释放明显增加[24],与本研究结果一致。但要进一步研究pMLKL通路介导的程序性坏死在RSV感染损伤中的作用,需要后续增加更多、更长的感染观察时间点。
综上所述,本研究构建了ALI培养的hBEC模型,该模型在生长状态及功能上更接近支气管上皮细胞的体内状况。本研究以RSV为对象,分析了不同病毒效价及感染时间对感染效果的影响,并通过免疫荧光染色证实RSV感染的hBEC损伤后HMGB1表达增加;为呼吸道病毒感染、哮喘、COPD等呼吸道常见疾病研究提供了重要的体外模型,为RSV感染治疗提供了新思路及新靶点。
