依据CLSI EP07-A3文件评价血清指数对免疫散射比浊法检测前白蛋白的干扰
2022-03-14徐琼峰段淑敏骆嘉欢王云秀张秀娟万泽民柯培锋黄宪章
韩 光,徐琼峰,段淑敏,骆嘉欢,王云秀,张秀娟,万泽民,柯培锋,黄宪章
(1.广东省中医院,广东 广州 510120;2.中国南方航空股份有限公司航空卫生中心,广东 广州 510400;3.广州中医药大学金沙洲医院,广东 广州 510168;4.中山大学孙逸仙纪念医院,广东 广州 510120)
血清样本的质量是临床检测中常见的干扰因素。血清指数是指对脂浊(浊度)、溶血[血红蛋白(hemoglobin,Hb)]和黄疸(胆红素)的定量或半定量估计值[1]。血清指数较高会对较多项目检测产生干扰[2],严重影响检测结果的准确性。前白蛋白(prealbumin,PA)由于相对分子质量小、半衰期短、敏感性高,对诊断早期肝功能损伤有重要价值,同时也是衡量肝功能损伤患者预后的良好指标[3]。免疫散射比浊法是测定PA的常用方法,也是推荐方法[4]。本研究参照美国临床实验室标准化协会(the Clinical and Laboratory Standards Institute,CLSI)EP07-A3文件[5],探讨不同浓度的内源性干扰物质对免疫散射比浊法检测PA是否能产生干扰,以及干扰误差的大小和方向,以明确免疫散射比浊法检测PA的血清指数限定值,并据此建立不合格样本的退检标准。
1 材料和方法
1.1 样本来源
收集广东省中医院体检者体检当天的新鲜血清样本作为基础样本,依据CLSIEP07-A3文件要求,样本无肉眼可见的溶血、脂血、黄疸,且三酰甘油(triglyceride,TG)、胆红素、丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)均处于参考区间内,PA检测值为100~400 mg/L。
1.2 仪器与试剂
cobas c702全自动生化分析仪(瑞士罗氏公司)。血清指数检测试剂(分光光度法,批号0768707)购自瑞士罗氏公司。PA试剂(免疫散射比浊法,批号2019021B)购自上海科华公司。人胆红素参考物质标准品干粉由深圳迈瑞生物医疗电子股份有限公司惠赠。
1.3 干扰物配制
1.3.1 干扰样本和对照样本 干扰样本为基础样本添加一定浓度的干扰物质,对照样本为基础样本添加等体积的干扰物质的溶剂。加入的干扰物体积不超过测试物总体积的5%。干扰物体积所占比例见表1。
1.3.2 干扰物配制 (1)Hb配制:将体检者全血样本破坏红细胞后离心,取上层Hb,获得Hb浓缩液。(2)胆红素配制:在纯化的人胆红素参考物质标准品干粉中加入0.1 mol/L NaOH。(3)脂浊浓缩液:收集脂浊样本,用低温高速离心机4 ℃、6 574×g离心30 min,洗涤后收集上层浓缩的脂质,获得脂浊浓缩液。
1.3.3 干扰物浓度确定 Hb和脂质均采用血清指数检测试剂确定干扰物浓度,胆红素干扰物浓度通过计算得出。脂浊干扰物(以TG为代表)浓度一般为16.90 mmol/L[6],本研究采用的脂浊工作液中的TG浓度为5.15 mmol/L,脂浊指数为988,虽低于常见脂浊干扰物(TG)浓度,但已达临床高值。干扰物浓度见表1。

表1 干扰物配制基本情况
1.4 配对差异实验
1.4.1 重测次数的计算 计算最大允许干扰值(dmax)与批内标准差(s)的比值,查dmax/s比值与重测次数对应表。重复测定10次基础样本,计算批内s。dmax为各项目临床意义差异的标准。
1.4.2dmax的确定 依据国家卫生健康委临床检验中心2019年临床检验室间质量评价计划,PA的允许总误差(allowable total error,TEa)为25%,本研究设定PA的dmax为样本均值(x)±1/3 TEa[7],即样本±8.33%。
1.4.3dobs的确定dobs为测试样本均值(T)和对照样本(C)均值之间的差值。dc为对照样本最大允许偏移。通过公式计算Cut-off值dc(双侧检验)[5]。如|dobs|≤Cut-off值dc,可以得出某种物质引起的偏移<dmax,对检测结果无显著影响;反之则说明由该物质引起干扰的假设成立。
1.5 剂量效应实验
1.5.1 样本准备 干扰样本和对照样本分别记为高浓度脂浊血清(A)和低浓度脂浊血清(B)。按照B、3/4B+1/4A、1/2B+1/2A、1/4B+3/4A、A配制成5个浓度的测试样本。
1.5.2 重测次数的计算 重测次数的计算步骤与配对差异实验一致。要求5个浓度的测试在同一个分析批内进行检测,为了平均系统偏移,第1次测定时测试样本浓度由低到高,第2次测试时测试样本浓度由高到低,第3次测试时测试样本浓度由低到高。
1.5.3 判断标准 结果判断与配对差异实验一致。以1/3 TEa(8.33%)为判断标准,以干扰率>8.33%为产生干扰。
2 结果
2.1 配对差异实验
2.1.1 重测次数 计算dmax/s比值后,查表得到样本重测次数为3次。PA高、低值样本的dc分别为6.60和2.19 mg/L。见表2。

表2 PA高、低值样本的dmax/s比值和dc
2.1.2 干扰效应分析 在PA高、低值样本中,加入10 g/L Hb(溶血指数为1 000)、200 mg/L(340 μmol/L)胆红素(黄疸指数为20)对免疫散射比浊法检测PA无干扰,加入脂浊指数为988的脂浊干扰物后对PA检测有负干扰。见表3。

表3 配对差异实验结果
2.2 剂量效应实验
随着脂浊指数的逐渐增大,脂浊对免疫散射比浊法PA检测的干扰率逐步增大。见图1。
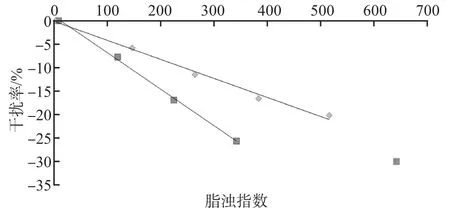
图1 脂浊对PA干扰的剂量效应实验
对于PA低值样本,排除最高浊度可能产生基质效应引起的检测偏差,脂浊指数为0~342时与干扰率呈线性关系,线性方程为Y=-0.077X+0.979(r2=0.999)。以1/3 TEa(8.33%)作为干扰的评价标准,根据线性方程计算出脂浊指数为120,即脂浊指数≤120时,对PA检测无显著干扰。见表4。

表4 脂浊对PA低值样本的剂量效应实验结果
对于PA高值样本,脂浊指数为0~516时与干扰率呈线性关系,线性方程为Y=-0.040X-0.168(r2=0.992)。以1/3 TEa(8.33%)作为干扰的评价标准,根据线性方程计算出脂浊指数为203,即脂浊指数≤203时对PA检测无显著干扰。见表5。

表5 脂浊对PA高值样本的剂量效应实验结果
3 讨论
溶血、黄疸和脂血是常见的干扰临床检测的因素。试剂厂商一般会将常见的血清指数干扰结果纳入试剂配置参数中。但如果使用非配套检测系统,或试剂厂商未做相关血清指数干扰的研究,那么溶血、黄疸和脂血导致的干扰就会对检测结果的准确性产生影响。为此,本研究分析了在非配套检测系统中,血清样本质量对免疫散射比浊法检测PA产生的干扰。
本研究使用的PA试剂说明书中声明:样本中Hb<12 g/L、胆红素<700 mg/L、脂类<1 000 mg/L对PA测定无干扰,但极度脂血影响较大。本研究参照CLSI EP07-A3文件,采用配对差异实验和剂量效应实验对非配套检测系统的抗干扰能力进行了验证。
干扰物的选择应尽量与临床实际干扰物一致,因此本研究溶血干扰物选择Hb,黄疸干扰物选择胆红素;在临床高脂浊样本中,产生影响的微粒除了TG外,还包括极低密度脂蛋白[8],且脂浊指数与TG水平的相关性较差,因此本研究未使用TG作为脂浊干扰物,而是采用分离自脂浊样本的脂质层作为脂浊干扰物,血清浊度也采用脂浊指数表示,更加贴近临床脂浊样本。本研究配对差异实验结果显示,10 g/L Hb和340 μmol/L胆红素对PA检测无显著干扰,与试剂说明书声明基本一致。但该试剂对脂浊的抗干扰能力不强,试剂说明书声明脂类<1 000 mg/L对PA测定无干扰,但极度脂血影响较大。本研究结果显示,脂浊对PA高、低值样本均有负干扰,因此采用剂量效应实验来确定干扰物浓度和干扰率之间的关系。
在脂浊对PA低值样本的剂量效应实验中,可能是由于产生基质效应或其他原因引起了检测偏差,导致高浓度脂浊,产生的干扰率结果呈现明显的离群现象,排除此离群值后,显示脂浊浓度与干扰率呈线性关系。以1/3 TEa(8.33%)为评价标准,在PA低值样本的检测中,脂浊指数>120即可对PA检测产生干扰;在PA高值样本的检测中,脂浊指数>203可对PA检测产生干扰。
本研究的不足之处在于PA高值基础样本未能覆盖行业标准[9]中PA的男性参考区间上限(430 mg/L),后续将继续收集PA高值样本进行相关研究。
综上所述,临床常见的溶血和黄疸样本不会对免疫散射比浊法检测PA造成干扰,但脂浊指数L>120的样本会对PA检测造成负干扰。
