复发性尿路感染患者致病性大肠埃希菌分子分型、毒力基因及药物敏感性分析
2022-03-14潘允琪李运改王坚镪
潘允琪,李运改,王坚镪,吴 琼,汤 瑾
(上海市第六人民医院检验科,上海 200233)
尿路感染是临床常见的泌尿系统感染性疾病之一,有25%~40%的成年女性在初次感染后6个月内会再次感染[1]。非复杂性尿路感染经过药物治疗后,仍会有定植于尿道口的肠道细菌上行至膀胱,引起复发性尿路感染(recurrent urinary tract infection,rUTI)。尿路致病性大肠埃希菌(uropathogenicEscherichiacoli,UPEC)是社区获得性尿路感染(70%~95%)和大部分医院获得性尿路感染(50%)的主要致病菌[2]。UPEC入侵膀胱上皮后,可产生毒素和蛋白酶,并合成铁载体,通过黏附素或菌毛附着到肾上皮细胞定植,产生组织损伤毒素,进而引起反复感染[3]。随着致病菌对抗菌药物耐药率的增加,rUTI的治疗变得越来越具有挑战性。为了更好地了解UPEC分离株的系统发育、毒力因子和耐药性,及其与rUTI的相关性,本研究对分离自复发和再感染rUTI患者的UPEC临床分离株进行比较,并分析其异同。
1 材料和方法
1.1 研究对象
选取2010年1月—2013年12月上海市第六人民医院6个月内被诊断为非复杂性尿路感染2次及以上的rUTI患者。纳入标准:(1)2次感染期间中段尿培养均分离出大肠埃希菌,且细菌菌落数均>105CFU/mL;(2)患者在首次感染使用抗菌药物治疗后,至少有1次中段尿培养阴性,或尿常规检测白细胞数正常,在6个月内发生再次感染,且2次感染的致病菌均为大肠埃希菌。排除患有其他病原体感染、无症状菌尿、留置导尿管和尿路结石等复杂性尿路感染患者[4]。所有培养阳性病原菌经分离纯化后,采用法国生物梅里埃公司VITEK 2 Compact60全自动细菌鉴定仪进行鉴定。最终纳入60例rUTI患者。
1.2 方法
1.2.1 种系发育分型 参照CLERMONT等[5]的研究方法,采用多重聚合酶链反应(polymerase chain reaction,PCR),根据2个基因(chuA和yjaA)结合1个DNA片段(TSPE4.C2)确定大肠埃希菌的主要系统发育群,即A、B1、B2和D。采用Primer 5.0软件和Oligo 5.0软件设计引物,引物序列见表1,由生工生物工程(上海)股份有限公司合成。

表1 UPEC系统发育分型引物序列和PCR条件
1.2.2 脉冲场凝胶电泳(pulsed-field gel electrophoresis,PFGE) 采用CHEF系统(美国Bio-Rad公司)进行PFGE。通过XbaⅠ消化制备基因组DNA,用BioNumerics 6.0(比利时Applied-Maths公司)进行条带分析,并将其划分为同源组(PFGE类型)。具有85%的遗传相似性或不多于4段PFGE差异的菌株被判定为同源的克隆体。
1.2.3 多位点序列分型(multi-locus sequence typing,MLST) 采用PCR扩增7个大肠埃希菌管家基因(adk、fumC、gyrB、icd、mdh、purA、recA)并测序,引物设计参考MLST网站(http://mlst.ucc.ie/mlst/dbs/Ecoli)。测序结果提交MLST网站进行序列比对。采用基因序列相关分型软件(enhanced based upon related sequence types,eBURST)进行MLST分析。
1.2.4 毒力因子检测 根据文献[6-8]筛选10个大肠埃希菌毒力基因,采用PCR扩增90株大肠埃希菌的10个毒力基因,包括feoB、chuA、iutA、iroN、ireA、fimH、foc、sfa、aer和cnf,引物序列及PCR反应条件参考文献[6-9]。
1.2.5 体外药物敏感性试验 采用VITEK 2 GN卡(法国生物梅里埃公司)进行体外药物敏感性试验。质控菌株大肠埃希菌(ATCC 25922)药物敏感性根据2014年美国临床实验室标准化协会(the Clinical and Laboratory Standards Institute,CLSI)标准进行判定。检测的药物包括氨苄西林、哌拉西林、氨苄西林-舒巴坦、哌拉西林-他唑巴坦、头孢他啶、头孢唑啉、头孢吡肟、亚胺培南、美罗培南、阿米卡星、庆大霉素、环丙沙星和复方磺胺甲噁唑13种抗菌药物。
1.3 统计学方法
采用SPSS 19.0软件进行统计分析。正态分布计量数据以±s表示。计数数据以例或率表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 一般情况
根据PFGE结果将60例rUTI患者分为复发组和再感染组。复发组初次感染与再次感染病原菌为同源菌株;再感染组2次感染病原菌为非同源菌株。复发组与再感染组各30例,剔除同一患者同源性重复菌株,共纳入30株分离自复发组的大肠埃希菌和60株分离自再感染组的大肠埃希菌。复发组有73.3%为女性,年龄(70.0±14.4)岁;再感染组有70.0%为女性,年龄(72.0±16.7)岁。复发组感染间隔时间为(90.2±66.8)d,再感染组2次感染间隔时间为(134.7±88.3)d。。
2.2 系统发育分型
系统发育分型结果显示,在90株UPEC中,有55.6%属于D型,B1型、B2型和A型分别占21.1%、20.0%和3.3%。复发组中除D型外,B2型所占比例较高,2个组之间系统发育分型无明显差异(P>0.05)。见表2。
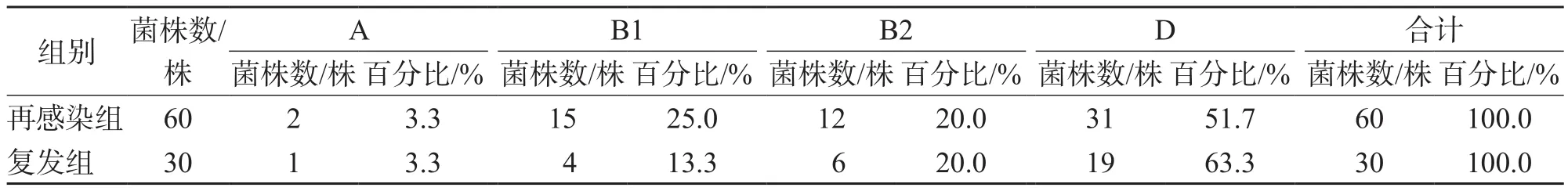
表2 复发组与再感染组UPEC系统发育分型
2.3 MLST结果
90株UPEC共检出27种ST型别,其中复发组13种,再感染组24种,ST131所占比例最高(31.1%);复发组中其他ST型别依次为ST405(16.7%)、ST648(10.0%)、ST1193(6.7%)和ST38(6.7%);再感染组其他ST型别依次为ST405(10.0%)、ST410(10.0%)和ST69(6.7%)。其他ST型别(110、14、1415、1434、155、1585、3492、354、361、457、46、4676、48、5020、57、617、711、73、744和95) 均检出1~5 株(1.1%~5.6%)。系统发育分析验证各ST型别间的遗传异质性结果见图1。
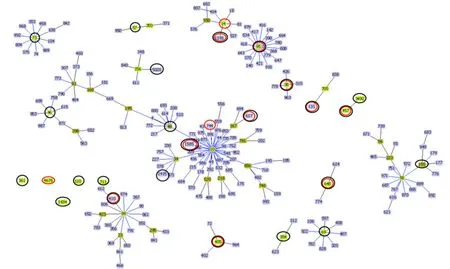
图1 90株UPEC各ST型别的遗传异质性分析结果
2.4 体外药物敏感性试验结果
90株UPEC对环丙沙星、氨苄西林、哌拉西林、头孢唑啉的耐药率较高,对哌拉西林-他唑巴坦、亚胺培南、美罗培南的耐药率较低。复发组中有3.3%的UPEC对美罗培南耐药,但再感染组UPEC对美罗培南完全敏感。总体来看,2个组UPEC的抗菌药物耐药性模式无明显差异(P>0.05)。
2.5 毒力基因检测结果
复发组与再感染组UPECiutA携带率差异有统计学意义(P=0.020),其余毒力基因差异无统计学意义(P>0.05)。对于无症状细菌尿路感染和反复出现的复杂尿路感染患者,其个体差异和易感性,以及不同病原菌特点是影响感染的重要因素。见表3。
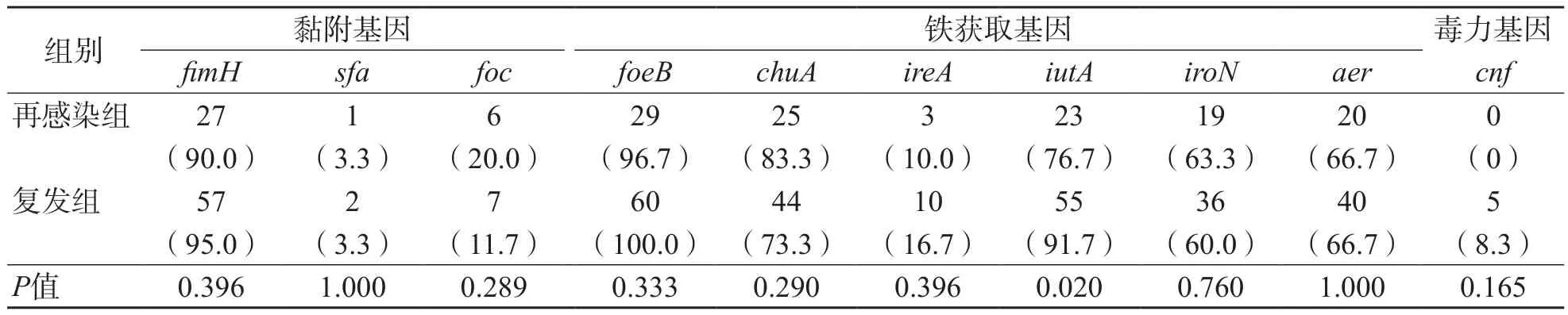
表3 90株UPEC毒力基因携带情况 株(%)
3 讨论
UPEC是细菌性尿路感染的主要病原菌之一。有研究发现,性别(女性)、既往尿路感染病史、性活动、阴道感染、糖尿病、肥胖以及遗传易感性与尿路感染相关[1]。有研究结果表明,尿路感染的复发是由胞内细菌储存库内的UPEC释放,并定植于尿道上皮细胞持续数周至数月引起的[10]。本研究中,复发组UPEC的PFGE模式不同,提示其可能来自不同的克隆;复发组中具有相似PFGE模式的大肠埃希菌的ST型别相似,但再感染组有7株大肠埃希菌具有不同的PFGE模式,但其ST型别相同,其他23株PFGE模式不同,ST型别也不同;ST131型是本研究中最常见的MLST型别,ST型别间的相关性可揭示遗传异质性,即2个组UPEC菌株没有克隆传播。
本研究中,90株UPEC系统发育分型结果显示,D型是UPEC的主要系统发育群,且系统发育型在复发组和再感染组UPEC中无差异(P>0.05)。大肠埃希菌根据系统发育分为A、B1、B2和D型,在东亚地区,D型菌株在社区获得性尿路感染中占优势[11]。有多中心研究结果显示,分别有54%和19%的尿路感染由D型和B2型UPEC菌株引起[12],与本研究系统发育分型结果一致。而欧美国家的研究发现,B2型菌株是rUTI持续存在的主要原因,提示应进一步了解疾病流行率差异背后的机制,除VF外,B2型菌株可能在rUTI持留的发病机制中起重要作用[4]。
与大多数大肠埃希菌菌株不同,UPEC具有特殊的黏附因子、铁获取系统、宿主防御机制等毒力因子,这些机制被统称为外毒力因子。本研究检测的UPEC毒力基因中,有6种基因的携带率高于50%,分别为fimH(93.3%)、chuA(76.7%)、iutA(86.7%)、iroN(61.1%)、foeB(98.8%)和aer(66.7%),而在铁获取相关基因中只有ireA基因携带率低于20%。相关研究结果表明,UPEC临床菌株中的所有大肠埃希菌菌株共有的铁获取相关基因都高度表达[13],提示铁获取系统在UPEC分离株中的表达非常普遍。本研究复发组与再感染组之间铁获取基因iutA差异有统计学意义(P=0.02)。有研究结果表明,黏附素和铁吸收系统与大肠埃希菌在共生肠道菌群中的持续存在有关,具有高度黏附力和铁捕获能力的UPEC菌株可能通过形成病原菌储存库进一步导致rUTI持续存在[14]。iutA因子是泌尿道中最关键的铁捕获因子,有助于UPEC的膀胱定植,铁获取系统在细胞内细菌群落(intracellular bacterial community,IBC)的发展中起着关键作用[15]。此外,UPEC可以从血红素中清除铁,缺乏血红素转运蛋白chuA的突变体在体内形成更小的IBC[16],铁载体和血红素相关的三价铁表达系统促进了IBC的形成[17]。因此,调节膀胱中的铁水平可以有效地控制UPEC的持留、上皮细胞死亡,有利于rUTI的治疗[3,18]。
本研究中,fimH基因是最常见的毒力基因,检出率≥90%。1型菌毛黏附素fimH通过诱导肌动蛋白重排导致细菌侵入,对其定植、侵袭和持留有重要作用[1]。本研究中,有14%(13/90)的菌株检出foc基因,有3%(3/90)的菌株中检出sfa基因。foc基因所占比例与以往研究接近,但sfa基因所占比例明显低于RAHDAR等[19]报道的81%。本研究复发组与再感染组UPEC黏附基因携带率差异无统计学意义(P>0.05)。UPEC还可分泌细胞毒性坏死因子1,可在体外增强UPEC对尿路上皮细胞的侵袭[20],但没有研究结果表明细胞毒性坏死因子在体内发挥作用[21]。相关研究都强调了没有单一的UPEC毒力因子引起感染反复发作[17]。
本研究中,UPEC菌株对大多抗菌药物具有较高的耐药性,包括氨基糖苷类、β-内酰胺类、氟喹诺酮类和磺胺类,耐药率均>70%。氟喹诺酮是经验性治疗尿路感染的一线药物,其高耐药水平与当地抗菌药物使用的频率有一定的相关性。在本研究中,绝大多数菌株对碳青霉烯类药物和磷霉素较敏感。也有研究结果显示,上海地区UPEC菌株对美罗培南(99.5%)、亚胺培南(99.0%)有较高的敏感性[22]。有学者建议将磷霉素和呋喃妥因用于尿路感染的经验性治疗[23-24],但无限制地使用这些抗菌药物会导致细菌耐药性逐渐增强。另外,本研究发现,再感染组对抗菌药物的敏感性略高于复发组,但差异无统计学意义(P>0.05),可能提示UPEC对临床常用抗菌药物高度耐药,但其并不是导致尿路感染反复发作的原因。
综上所述,上海市第六人民医院UPEC的主要ST型别为ST131和ST405型,UPEC常见毒力基因feoB和fimH携带率较高,UPEC对临床常用抗菌药物高度耐药,但其并不是导致尿路感染反复发作的原因。尿路感染的高流行率、反复使用抗菌药物、未使用严格的尿路感染诊断标准可能会导致病原菌对抗菌药物耐药性增强。对rUTI的病原体进行详细的流行病学调查,并确定泌尿道内UPEC的致病机制,有助于制定新的治疗策略,以消除UPEC。多重耐药UPEC引起的rUTI高发率与高耐药率相关,必须合理使用抗菌药物,有效地治疗rUTI。了解UPEC耐药谱和毒力因子与疾病复发率的相关性对rUTI的临床诊断、治疗和预后具有重要的意义。
