肌肽联合超高压对黑鱼肉脂质氧化及肌原纤维蛋白的影响
2022-03-06孙良格徐佳美吕经秀张新笑徐为民李鹏鹏王道营
孙良格,徐佳美,2,吕经秀,2,张新笑,徐为民,2,李鹏鹏,2, ,王道营,2
(1.江苏省农业科学院农产品加工所,江苏南京 210014;2.江苏大学食品与生物工程学院, 江苏镇江212013)
黑鱼(Ophiocephalus argusCantor)是我国常见的淡水经济鱼类,黑鱼肉营养价值丰富,富含人体所需的钙、铁等多种微量元素,具有很好的药用价值,可促进伤口愈合[1]。随着人们生活水平的提高,特别是随着我国生鲜超市的发展、销售冷链的形成,消费者对冷鲜鱼肉的需求日益增大,并对其鲜度、安全品质等的要求也越来越高。黑鱼肉富含不饱和脂肪酸,但在冷藏期间极易发生氧化。脂肪氧化不仅会导致肉品风味改变、褪色,也是淡水鱼腥味产生的主要原因[2]。此外,脂质氧化产物也可诱导蛋白质氧化反应,増加蛋白质间的交联,从而导致肉的持水力下降[3]。因此,控制冷藏期间黑鱼肉的脂质氧化对提高冷鲜鱼肉品质具有重要意义。
肌肽是一种由β-丙氨酸和L-组氨酸两种氨基酸组成的二肽,天然存在于动物肌肉中。肌肽通过螯合金属离子、清除自由基和供氢、供电子能力等方式来抑制氧化[4]。邢子鑫等[5]研究发现肌肽将肉的冷藏期由9 d延长至15 d,对脂类氧化抑制效果显著。超高压技术是将密封于弹性容器内的食品置于以水或其他液体作为传压介质的压力系统中,经100 MPa以上压力处理,在常温下达到杀菌、钝酶改善食品品质等目的[6]。食品加工中超高压技术主要应用于果蔬、果汁及食品包装材料的研究,近年来开始被用于肉品品质提高的研究。肉制品中的内源酶在超高压作用下构象改变,酶活性降低甚至失活[7]。用超高压处理冷藏肉类产品时可以延缓肉品冷藏期间的脂肪氧化速率,保持冷藏肉类产品的风味等[8]。Bajovic等[9]研究表明,超高压处理冷藏牛肉制品时加入天然抗氧化剂能够延缓脂肪氧化。然而,肌肽联合超高压处理对黑鱼肉的冷藏品质的研究尚未有报道。
本研究采用肌肽联合超高压处理分析其对黑鱼肉冷藏期间的脂质氧化、蛋白氧化的影响,并进一步采用扫描电镜、SDS-PAGE和圆二色谱等研究超高压联合肌肽预处理对黑鱼肉肌原纤维蛋白的影响,以明确冷藏期间黑鱼肉品质变化的机理,为黑鱼鱼肉的保鲜和冷藏提供理论依据。
1 材料与方法
1.1 材料与仪器
新鲜黑鱼 质量为400~600 g,南京下马坊华润苏果;肌肽 上海源叶生物公司;亚油酸 Sigma公司;戊二醛、硫代巴比妥酸、吐温20、β-巯基乙醇、三氯乙酸、柠檬酸、磷酸氢二钾、磷酸二氢钾(均为分析纯)、BCA蛋白浓度试剂盒、考马斯亮蓝蛋白浓度试剂盒、羰基含量试剂盒 南京建成有限公司;荧光蛋白酶分析试剂盒 G-Biosciences。
超高压食品处理装置 包头科发高压科技有限责任公司;Biofugestratos高速离心机 德国Heraeus公司;T25高速匀浆机 德国IKA公司;HI-9025酸度计 意大利Hanna;Mini-PROTEANTetra Cell电泳仪 美国Bio-Rad公司;BioTekSynergy2多功能酶标仪 美国BioTek公司;UniCenMR台式冷冻离心机 英国Herolab公司。
1.2 实验方法
1.2.1 原料处理 将新鲜黑鱼宰杀、去头、去内脏,取背部肌肉洗净切碎,分成4组:对照组(Control)、肌肽组(CAR)、超高压组(UHP)、超高压+肌肽组(UHP+CAR)。每组20 g鱼肉分装于真空袋中,对照组和超高压组分别加入8 mL PBS缓冲液后真空包装,肌肽组和超高压+肌肽组分别加入8 mL肌肽溶液(PBS缓冲液配制)后真空包装,超高压+肌肽组和超高压组再进行超高压(压力300 MPa,保压时间900 s)处理。各组处理后放4 ℃冷藏,每隔3 d随机取样测定丙二醛含量、羰基含量和TCA-溶解肽含量,同时进行SDS-PAGE、SEM和CD分析。
1.2.2 肌肽浓度的选择 将浓度为0、10、15、20、25、30 mmol/L[5]的肌肽溶液分别加入装好鱼肉的真空袋中放置4 ℃冷藏,3 d后测定丙二醛含量,确定最优浓度。
1.2.3 丙二醛含量的测定 参照国标GB5009.181-2016《食品安全国家标准食品中丙二醛的测定》。称取5 g样品(精确至0.01g)放入100 mL带塞锥形瓶中,准确加入50 mL三氯乙酸混合物,充分摇匀,加塞密封,置于恒温振荡器上,50 ℃振摇30 min,取出,冷却至室温,用双层定量慢滤纸过滤,弃去初滤液,继续滤液备用。分别准确吸取上述滤液和标准系列溶液各5 mL至25 mL带塞比色管中,另取5 mL三氯乙酸混合物作为样品空白,加入5 mL硫代巴比妥酸(TBA)水溶液,置于90 ℃水浴中反应30 min,取出,冷却至室温。用样品空白调零点,在1 cm光程532 nm处测量样品溶液和标准系列溶液的吸光度值,以标准系列溶液的质量浓度为横坐标,绘制标准曲线。吸光度值作为纵坐标。
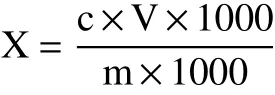
式中,X为样品中丙二醛的含量,mg/kg;c为标准系列曲线得到的样品溶液中丙二醛的浓度,μg/mL;V为试样溶液的定容体积,mL;m为最终试样溶液所代表的试样质量,g;1000为换算系数;计算结果表示为在重复性条件下获得的两个独立测定结果,结果保留两位有效数字。
1.2.4 脂肪氧合酶及总蛋白酶活的测定 鱼肉内源蛋白粗酶提取参照Gate等[10]方法,脂肪氧合酶活测定:在离心管中称取2 g样品,加入20 mL 0.05 mol/L pH7.0磷酸盐缓冲液(含1 mmol/Lβ-巯基乙醇和2 mmol/L EDTA),在冰中使用高速匀浆器12000×g水浴匀浆4×10 s,10000×g离心15 min,取上清,四层纱布过滤,得酶粗提液,分装0.1 mL小瓶,保存在-20 ℃。
底物溶液制备:将140 mg(0.05 mmol)亚油酸溶于5 mL(含180 μL吐温20)脱氧重蒸馏水中调匀;滴加1 mol/L氢氧化钠充分混匀至体系为澄清透明液体,直至亚油酸完全溶解,最后用脱氧重蒸馏水稀释至50 mL,分装于-20 ℃保存。
将0.1 mL酶原液、0.2 mL 亚油酸底物溶液和2.9 mL 0.05 mol/L 柠檬酸盐缓冲液(pH5.5)在234 nm稳定混合1 min,读取增加的吸光度值。脂肪氧化酶的相对活性单位(U)表示为1 min内酶活性单位增加0.001。空白为0.2 mL亚油酸底物溶液与2.9 mL柠檬酸缓冲液混合作为空白。
总蛋白酶活测定:内源蛋白粗酶用G-Biosciences荧光蛋白酶分析试剂盒检测酶活。
1.2.5 羰基含量的测定 采用南京建成羰基试剂盒检测样品。准确称取0.1 g肉样加入0.9 mL的试剂一,冰水浴下机械匀浆,2500 r/min,离心10 min,取上清450 μL,加入50 μL试剂二,混匀,室温放置10 min后,11000 r/min离心10 min,取上清进行蛋白羰基的测定,同时测定部分上清用双缩脲法测定匀浆的总蛋白浓度。上清液分别取0.1 mL加入测定管和对照管,测定管加入0.4 mL试剂三,对照管加入0.4 mL试剂四,分别涡旋1 min,37 ℃准确避光反应30 min。反应后同时加入0.5 mL试剂五,涡旋1 min,离心(4 ℃,12000 r/min,10 min)去上清取沉淀。两管分别加入无水乙酸乙酯混合应用液1 mL,离心(4 ℃,12000 r/min,10 min),去上清,留沉淀。两管此过程重复3次后,加入1.25 mL试剂六,混匀后,37 ℃准确水浴15 min。涡旋混匀后。将全部沉淀溶解,以12000 r/min离心15 min,取上清液在370 nm处(紫外),0.5 cm光径石英比色皿,试剂六调零,测定各管OD值。

1.2.6 总三氯乙酸(total trichloroacetic acid,TCA)-溶解肽含量的测定 将样品去除肌膜、结缔组织后切碎,称量2.00 g肉糜,与18 mL预冷的5%三氯乙酸溶液进行混合,冰水浴10000 r/min匀浆40 s,在12000 r/min离心5 min后取上清液,采用BCA法测定小肽含量。
1.2.7 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDSPAGE)分析 根据Shi等[11]方法首先提取肌原纤维蛋白后,再进行SDS-PAGE测定。取2.0 g碎肉组织,添加4倍(w/v)体积的MP分离缓冲液A(0.1 mol/L NaCl,2.0 mmol/L MgCl2,1.0 mmol/L EGTA,6.1 mmol/L Na2HPO4,3.9 mmol/L NaH2PO4·H2O,pH7.0,4 ℃)冰浴匀浆60 s(10000 r/min,30 s/次,2次),冷冻离心15 min(2000×g,4 ℃)后取沉淀,重复该步骤2次。将沉淀与8倍体积缓冲液B(0.1 mol/L NaCl,1.0 mmol/L NaN3,pH6.0)混合,冰浴10000 r/min匀浆60 s后,离心后(同上)取沉淀,该步骤重复2次后过4层纱布,离心得到提纯的MP沉淀。沉淀溶于适量PB缓冲液(0.6 mol/L KCl,10 mmol/L K2HPO4,pH6.0)中,待用。
SDS-PAGE测定:100 μL MP溶液(调节蛋白浓度为1.0 mg/mL)中加入25 μL的上样缓冲液后于95 ℃气浴5 min灭酶,离心(12000×g,5min)后取上清用于电泳测定(12%分离胶与5%浓缩胶)。每孔等体积上样5 μL,120 V恒压约50 min。采用宽分子量蛋白(20~250 kDa,Thermo Scientific™)作为Marker参照。考马斯亮蓝染色液染色凝胶块15 min,于摇床上均匀脱色,全自动凝胶成像分析仪对脱色凝胶块成像分析。
1.2.8 扫描电镜(SEM)分析 在鱼肉表面下1 mm处切取的3 mm×3 mm×1 mm的小样品块,在含3%戊二醛固定1 h后,分别置于10%、40%、70%、100% 乙醇中梯度脱水并在室温下挥干溶剂后喷金,最后使用SEM对样品肌肉结构进行观察。
1.2.9 圆二色谱(CD)分析 根据Zou等[12]方法测定肌原纤维蛋白二级结构变化。使用圆二色谱仪分析MP于185~250 nm处的光谱图(25 °C)。测定前,采用PBS缓冲液(20 mmol/L,pH7.0)将MP浓度调整至200 μg/mL,并置于1.0 mm长的CD石英槽中进行光谱扫描(相应的缓冲液为参比)。扫描速率、反应时间和狭缝宽度分别为100 nm/min、0.50 s和2.0 nm。利用带旋光仪的蛋白质二级结构估算程序计算相应百分率。
1.3 数据处理
所有实验均重复3次,结果均以平均值±标准差表示。采用Microsoft Excel 2016软件对数据进行处理分析,SPSS 22软件进行显著性分析(多重比较采用Duncan检验),并用Origin 9.1软件作图。
2 结果与分析
2.1 肌肽联合超高压处理对冷藏期黑鱼肉脂质氧化的影响
黑鱼鱼肉富含不饱和脂质,极易发生氧化。脂质氧化产生的挥发性物质是鱼肉冷藏期间腥味产生的主要原因[13]。动物宰后肌肉脂质氧化主要由活性氧和脂肪氧合酶引起。清除活性氧和抑制脂肪氧合酶活性对抑制冷藏期鱼肉脂质氧化并提高鱼肉品质具有重要意义。肌肽作为新型食品添加剂,具有清除活性氧、抑制氧化的作用。如图1所示,肌肽能显著抑制冷藏鱼肉的脂质氧化(P<0.05),肌肽浓度在25 mmol/L时,对鱼肉脂质氧化抑制作用最强,所以选定25 mmol/L肌肽溶液完成后续储藏实验。

图1 添加不同浓度肌肽溶液的鱼肉4 ℃冷藏3 d后MDA含量Fig.1 MDA content of snakehead fish with different concentrations of carnosine solution added after 3 days of refrigerated storage at 4 ℃
超高压技术是一种非热加工钝酶技术,在此条件下酶分子结构中的氢键、疏水离子作用等发生变化,最终导致酶的分子构象改变而失活。Gavan等[14]研究发现,随着压力和保压时间的增加,超高压钝酶效果增强。王帮国等[15]研究发现,随着压力和保压时间增加,脂肪氧合酶分子结构发生显著变化,酶活不断降低。如图2A所示,超高压(压力300 MPa,保压时间900 s)作用下脂肪氧合酶的酶活降低了64.46%。
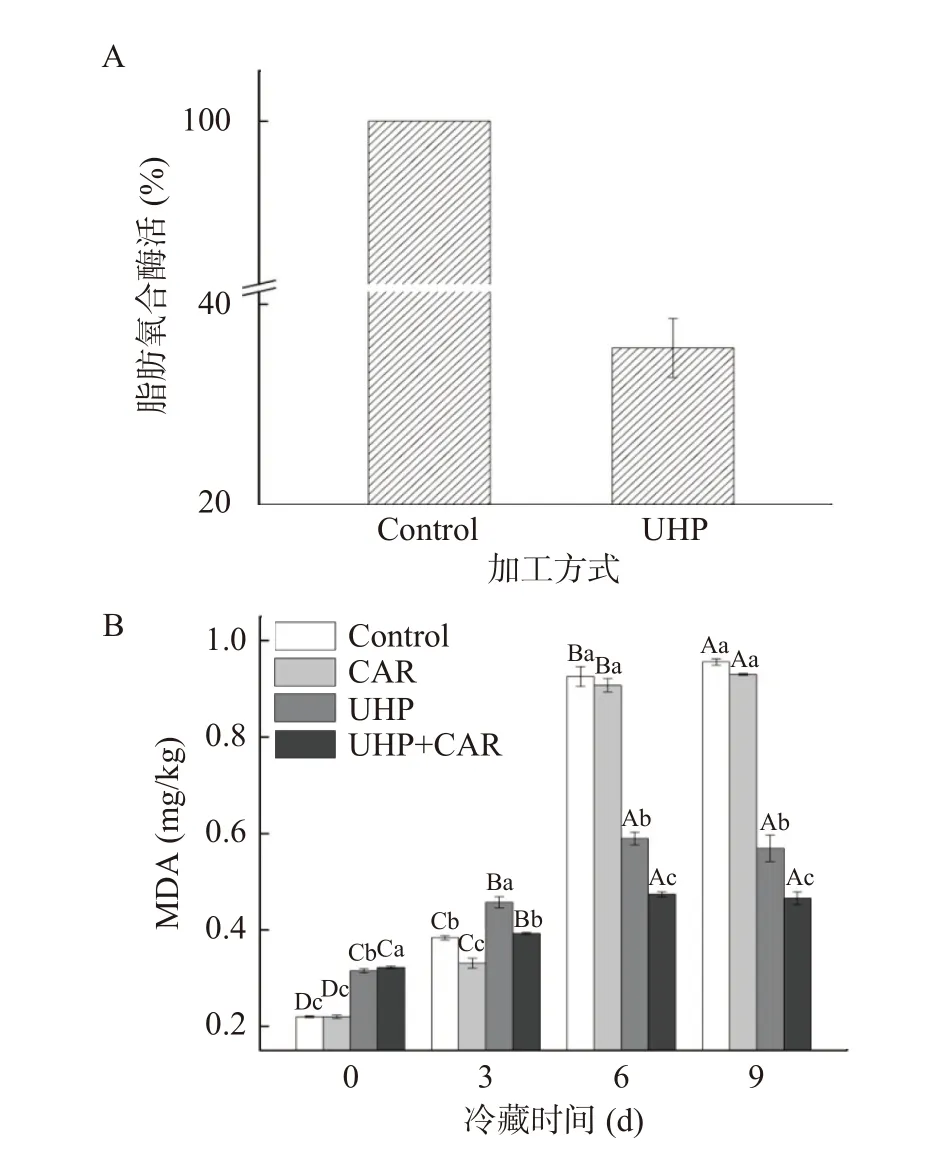
图2 鱼肉超高压对脂肪氧合酶活影响及肌肽联合超高压处理对冷藏期黑鱼脂质氧化的影响Fig.2 Effects of lipoxygenase activity after UHP treatment and lipid oxidation with carnosine combined with ultrahigh pressure treatment of snackhead during cold storage
MDA为脂质氧化过程产生的丙二醛,用于检测鱼肉在冷藏期间发生脂质氧化程度。如图2B所示,对照组MDA值随着冷藏时间的延长不断升高,到第9 d的MDA值由初始的0.22 mg/kg上升到0.956 mg/kg。CAR组MDA值在冷藏期间一直低于对照组,在第3 d时显著低于对照组(P<0.05)。肌肽通过清除活性氧、螯合金属离子来抑制脂质氧化。Gopalakrishnan等[16]通过添加不同浓度的肌肽于猪肉中,也发现肌肽能显著抑制猪肉的脂质氧化。在冷藏后期CAR组值显著增加(P<0.05),可能是微生物的大量繁殖加速了脂质氧化[17]。与对照组和CAR组相比,UHP和UHP+CAR两组冷藏期间MDA值上升速率缓慢,到第9 d分别比对照组MDA值低0.387、0.490 mg/kg。超高压钝化脂肪氧合酶活性,减少了冷藏期间鱼肉的脂质氧化。此外,超高压处理还能抑制微生物的活性,在一定程度上减缓了微生物活动对脂质氧化的作用[17]。在冷藏第9 d,UHP+CAR组较UHP组低0.103 mg/kg,说明肌肽联合超高压能协同抑制冷藏鱼肉的脂质氧化。Marcos等[18]的研究表明,抗氧化剂联合超高压处理肉制品,比只添加抗氧化剂的肉制品保鲜效果好,该结论与本文结果一致。经过超高压处理的两组样品的MDA值高于另外两组,可能是由于高压促使部分复合物释放出游离金属离子,导致部分脂质发生氧化[19]。
2.2 肌肽联合超高压处理对黑鱼肉冷藏期间蛋白质氧化的影响
蛋白氧化影响肉的滋味、嫩度、色泽、多汁性等感官品质,还影响肌肉的组织结构和功能特性。朱文慧等[20]研究发现鱿鱼蛋白氧化过后肌纤维间隙增大、结构疏松,肌原纤维小片化指数增加,保水性降低。动物宰后肌肉蛋白质的氧化多由活性氧直接引发或由脂质氧化产物诱导引起的蛋白质肽链骨架重置和氨基酸侧链共价修饰间接引发[21],其中氨基酸侧链被氧化形成的羰基常用于检测蛋白质氧化的程度。如图3所示,各组样品的羰基含量在冷藏期间均呈上升趋势。CAR组羰基含量一直低于对照组,在冷藏期间第3 d CAR组羰基抑制率为22.08%,达到最高。UHP+CAR组在冷藏期第3 d羰基含量较UHP组减少10.85%,差异显著。以上说明肌肽在冷藏期前3 d发挥抑制蛋白氧化作用最强。肌肽可以清除活性氧减少氨基酸侧链的氧化,也可以与活性醛反应,减少蛋白质氧化的诱导物,抑制冷藏期间的脂质氧化,从而降低蛋白质的羰基化。此外,肌肽还能结合蛋白质前体上的羰基,形成蛋白质-羰基-肌肽复合物,防止蛋白形成损伤性交联[22]。UHP组和UHP+CAR组初始羰基含量高于对照组与CAR组,可能是超高压在处理鱼肉过程中释放的自由基引起的蛋白氧化。UHP组和UHP+CAR组的羰基值在冷藏期间增速较缓,UHP+CAR组第9 d羰基含量较对照组减少21.70%。结合2.1中结果,说明抑制脂质氧化能减少蛋白质氧化的诱导剂,有利于抑制蛋白质的氧化。此外,有研究表明肉品贮藏过程中微生物增长能促进肌肉蛋白氧化,超高压处理能在一定程度上灭活腐败微生物[6],也有助于抑制蛋白质的氧化。
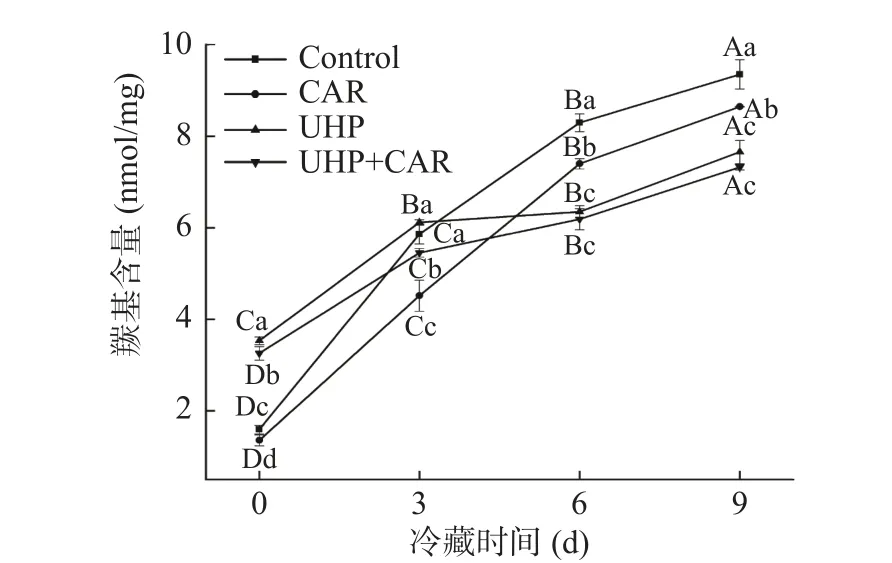
图3 肌肽联合超高压处理对冷藏期黑鱼羰基含量的影响Fig.3 Effects of CUH treatment on carbonyl content of snakehead fish during refrigerated storage
2.3 肌肽联合超高压处理对黑鱼肉冷藏期间蛋白质降解的影响
肌原纤维蛋白包括肌球蛋白、肌动蛋白、原肌球蛋白、肌原蛋白以及多种微量调节蛋白,其中肌球蛋白重链(MHC)和肌动蛋白(Actin)是最主要的蛋白条带。如图4所示,超高压处理之后,MHC和Actin的条带强度明显减弱。马海建[23]在对草鱼鱼糜中的肌动球蛋白进行超高压处理后,发现MHC带和Actin带变化不大。UHP和UHP+CAR组在超高压处理后,35 kDa附近(肌钙蛋白T、原肌球蛋白)的条带变浅/消失。结合前文结果及文献报道,推测超高压处理后鱼肉部分蛋白发生了氧化和变性,导致部分蛋白成为不可溶蛋白[24]。冷藏后期,对照组与CAR组样品在9 d时15 kDa附近出现了新的条带,可能是在内源蛋白酶和微生物分泌的蛋白酶作用下,肌原纤维蛋白发生降解。UHP和UHP+CAR组较对照组和CAR组的肌原纤维蛋白在冷藏期未出现明显变化,可能由于超高压作用抑制了蛋白酶活性。葛黎红[25]研究表明,内源蛋白酶和微生物是造成鱼肉蛋白降解和质构劣化的主要因素,而超高压作用既能降低内源蛋白酶活,又可以有效灭活微生物,从而减少肌原纤维蛋白的降解。

图4 冷藏期间鱼肉肌原纤维蛋白SDS-PAGE的变化Fig.4 Changes of SDS-PAGE of myofibrillary protein in snakehead fish during refrigerated storage
TCA-溶解肽是常用的蛋白水解参数,能体现SDS-PAGE难以分析的低分子肽的变化。如图5A所示,对照组及CAR组的溶解肽含量随着冷藏时间的延长逐渐升高,9 d后CAR组溶解肽含量减少了12.20%。UHP和UHP+CAR组第0 d小肽含量高于对照组,可能是超高压作用使鱼肉部分蛋白质发生降解。UHP+CAR组冷藏期间溶解肽含量的变化平稳且保持在较低水平,9 d后含量为0.15 mg/mL,分别比对照组、CAR组、UHP组低了63.41%、53.33%、6.25%。组织蛋白酶B、H、L等鱼肉冷藏期间最活跃的溶酶体蛋白酶,对肌肉组织降解具有重要作用[26]。微生物分泌的蛋白酶也能够加速肌肉蛋白的水解作用。由图5B所示,高压过后的总蛋白酶活降低了25.75%,所以9 d后UHP+CAR组能够保持较低水平的溶解肽含量。此外,脂质氧化生成的自由基、某些羰基化合物具有很高的反应活性,能够促进蛋白质降解[27]。马海建[23]也研究发现在超高压300 MPa及以上压力条件下,组织蛋白酶B活性显著下降,同时微生物活性降低。肌肽能延缓自由基及羰基化合物的生成,抑制蛋白氧化引起的蛋白质降解。因此超高压和肌肽能协同作用抑制冷藏鱼肉的蛋白质降解。
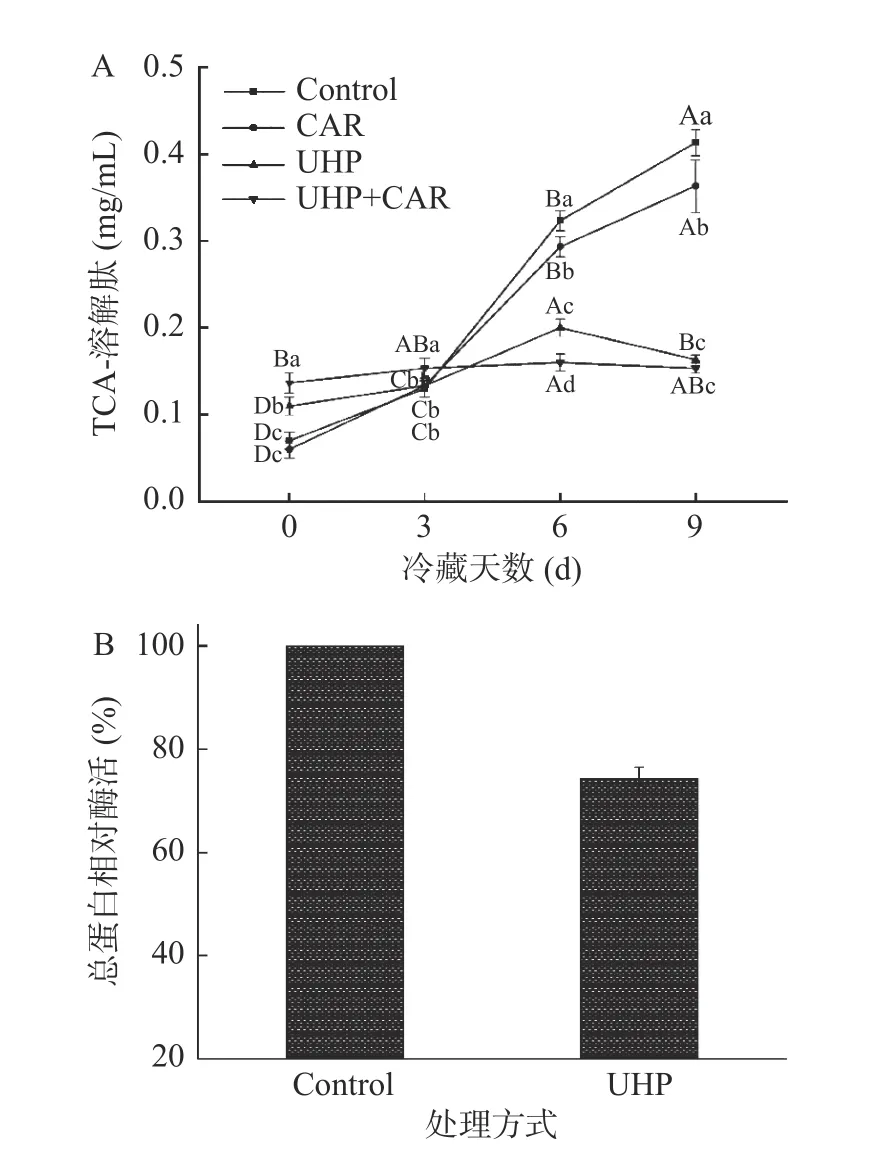
图5 肌肽联合超高压处理对冷藏期黑鱼TCA-溶解肽的影响及黑鱼肉超高压后总蛋白酶活情况Fig.5 Effects of TCA-soluble peptides with carnosine combined with ultra-high pressure treatment and the total protease activity after UHP treatment of fish meat during cold storage
2.4 肌肽联合超高压处理对冷藏期黑鱼肉及肌原纤维蛋白结构的影响
鱼体肌肉组织中内源蛋白酶活性较强,淡水鱼在冷藏过程中极易腐败变质。如图6所示,对照组及CAR组的肌肉组织线条纹理紧凑清晰,排列有序,而经超高压处理的UHP和UHP+CAR组样品表面纹理变得模糊,并出现少量的小分子颗粒,可能是高压的作用使肌浆蛋白变性凝聚成小分子[28]。冷藏6 d时,对照组纤维表面出现空洞及蛋白网络松散坍塌,纤维间隙增大,肌内膜与肌纤维分离。冷藏期内源蛋白酶及微生物的作用下蛋白被分解利用,造成质构劣化。CAR组较对照组的表面结构损坏较小,纤维表面出现少量空洞。肌肽能够抑制鱼肉在冷藏期发生的脂质、蛋白氧化及蛋白分解,但冷藏后期微生物大量繁殖分泌蛋白酶加速了蛋白降解。UHP组在冷藏期间肌束排列有序,肌纤维表面结构空隙较少。UHP+CAR组表面肌束清晰,纤维表面未出现明显空洞及蛋白网络松散状态,可能是由于超高压抑制鱼肉中总蛋白酶活和微生物活性。如图6A所示,在超高压作用下总蛋白酶活降低25.75%,减少了鱼肉中肌原纤维蛋白的降解。上文又验证了肌肽在鱼肉冷藏期间显著抑制脂质氧化、蛋白氧化和微生物分解蛋白速率,有利于延缓鱼肉在冷藏期间腐败速率。

图6 不同处理下组织超微结构电镜图Fig.6 Ultrastructural electron microscopy of tissue under different treatments
为进一步研究肌肽联合超高压对冷藏鱼肉蛋白质品质变化的影响,本研究通过圆二色谱分析了肌肽联合超高压对黑鱼肌肉蛋白质二级结构的影响。220 nm和209 nm两个负峰是α-螺旋结构的特征吸收峰,216 nm是β-折叠的吸收峰,220~230 nm是β-转角吸收峰,198 nm是无规则卷曲的吸收峰[29-30]。如图7和图8所示,对照组和CAR组蛋白0 d在209和220 nm附近两个负峰明显,冷藏期间负峰逐渐减少。对照组和CAR组蛋白α-螺旋比例在冷藏期间整体呈现先减少后增多的趋势。在0 d对照组和CAR组MP结构以α-螺旋为主,分别占44.3%和45.6%。对照组和CAR组α-螺旋比例第3 d分别下降了73.36%、67.98%。蛋白质氧化可引起蛋白质的骨架和侧链的改变,从而导致蛋白质的一级、二级和三级结构发生改变[31]。可能是由于冷藏期间微生物繁殖及脂质氧化加强,导致蛋白氧化,进而引起蛋白结构改变[32]。0与3 d CAR组α-螺旋比例较对照组分别提高2.93%和23.72%。对照组和CAR组α-螺旋比例在9 d出现明显的上升,同时CAR组较对照组具有更低的无规则卷曲比例和更高的α-螺旋结构比例。说明肌肽在冷藏的前3 d能够显著抑制蛋白结构改变。该结论与上文肌肽在冷藏前期能够显著抑制蛋白氧化的结论相契合。肌肽通过清除活性氧、螯合金属离子等方式减少MP结构损伤,有利于蛋白保持有序结构。
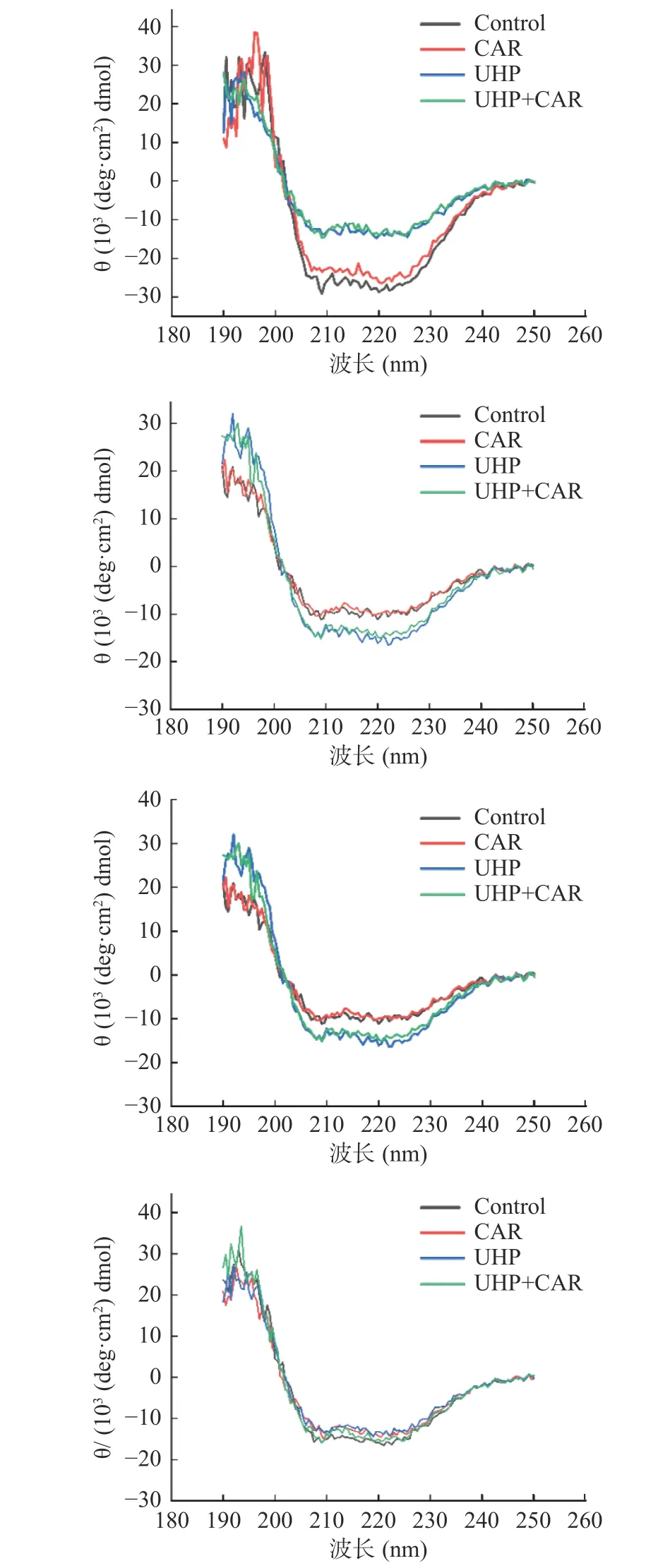
图7 肌肽联合超高压处理对冷藏期肌原纤维蛋白结构的影响Fig.7 Effect of CUH treatment on MP structure during refrigerated storage
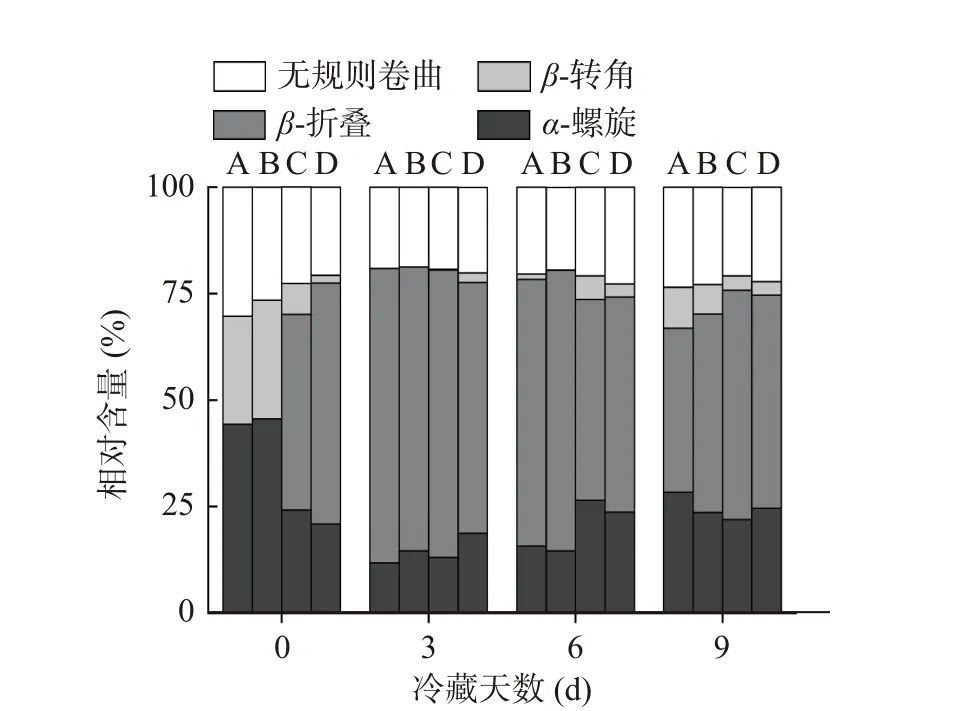
图8 肌肽联合超高压处理对冷藏期肌原纤维蛋白二级结构相对百分含量的影响Fig.8 Effects of CHU treatment on the relative percentage of secondary structure of MP during refrigerated storage
UHP和UHP+CAR组在0 d时220和209 nm两个负峰较对照组变小。冷藏期间,UHP+CAR和UHP组220 nm和209 nm负峰比较稳定。UHP组在0 d时α-螺旋比例较对照组减少了45.37%,β-折叠比例升高为45.9%。王玮等[33]发现超高压处理降低了酶蛋白结构中α-螺旋的比例,与本结果相同。Tan等[34]认为高压通过影响蛋白质分子间的相互作用键(氢键、疏水相互作用、静电力),导致蛋白质变性。UHP+CAR组0 d时较CAR组的β-折叠上升了56.6%,无规则卷曲比例减少21.89%。UHP+CAR组0 d时β-折叠比例较UHP组上升了23.31%,无规卷曲比例减少8.81%。UHP+CAR组与CAR组、UHP组相比具有较高β-折叠和较低的无规则卷曲比例,初始肌原纤维蛋白处于更有序状态。在冷藏期间UHP+CAR组的α-螺旋比例先减少后增多,第3 d UHP和UHP+CAR组α-螺旋比例下降率明显低于对照组和CAR组。超高压抑制内源蛋白酶和微生物活性降低了肉品的氧化,从而减弱了蛋白结构的变化。在第6 dα-螺旋比例出现明显增高,较CAR组提前3 d。表明超高压处理作用后鱼肉蛋白结构展开,在冷藏第6 d后逐渐呈现有序化,超高压处理使鱼肉体系中形成新的氢键形成,蛋白质结构更加有序化。第9 d时的UHP+CAR组较对照组、CAR组和UHP组具有更高的α-螺旋比例和较低的无规则卷曲。超高压抑制内源蛋白酶和微生物活性及肌肽抑制蛋白的氧化分解的作用下,蛋白的结构性破坏减少,UHP+CAR处理促进肌原纤维蛋白结构的有序化。
3 结论
研究表明,采用不同浓度的肌肽溶液处理鱼肉,在肌肽溶液为25 mmol/L时,鱼肉的抗脂质氧化能力最强。本论文采用肌肽联合超高压处理后的鱼肉的脂肪氧合酶及总蛋白酶活显著降低,脂质氧化程度及TCA-溶解肽含量受到显著抑制(P<0.05)。冷藏期间鱼肉肌原纤维蛋白的羰基含量显著减少,蛋白氧化程度显著降低(P<0.05)。SEM表明,肌肽联合超高压处理后的黑鱼肉在冷藏期间鱼肉纤维表面结构空隙较少,未出现蛋白网络松散状态。SDS-PAGE和TCA-溶解肽结果表明,超高压不会引起肌原纤维蛋白大量降解,肌肽联合超高压处理显著降低了鱼肉冷藏期间肌原纤维蛋白的降解(P<0.05)。圆二色谱分析发现,肌肽联合超高压处理后黑鱼肉的肌原纤维蛋白的二级结构发生变化,冷藏期间α-螺旋的比例先减少后增加,说明冷藏后期有新的氢键生成,蛋白结构呈现有序化。因此,肌肽联合超高压处理既能够改善鱼肉冷藏品质,又能延长鱼肉制品冷藏货架期,同时本文研究结果可为调控鱼肉品质提供理论基础。
