基于网络药理学及分子对接技术探讨绞股蓝防治肥胖的作用机制
2022-03-06常相娜杨文娟崔丹丹
苏 瑶,王 兰,常相娜,龚 频,杨文娟,崔丹丹
(陕西科技大学食品与生物工程学院,陕西西安 710021)
肥胖症(Obesity,OB)是指机体生理生化机能改变引起体内脂肪沉积量过多,体重增加,并伴随一系列病理变化的慢性代谢疾病。肥胖的诱因有多种,如家族遗传、环境因素、内分泌异常导致的低代谢率、一些药物副作用及能量摄入与消耗的不平衡等[1]。随着人民生活水平的提高,高能量、高脂肪的饮食习惯使得肥胖发病率呈现明显上升趋势,而且研究显示肥胖会显著提高患心脑血管疾病、2型糖尿病、高血压及癌症等疾病的风险[2],肥胖症已成为一个主要健康问题。由于脂肪组织是人体极其复杂且高度活跃的内分泌组织,脂肪形成期间受多种激素、基因表达和信号通路的调控,涉及糖脂代谢异常、慢性炎症以及诱发氧化等[3]病理机制,故有必要探究治疗肥胖多靶点药物。而中药有着“多成分、多靶点”作用特点,并且市场上出现的降脂中药如葛根,荷叶等[4]在肥胖治疗中显示出的良好疗效大大提高了人们对中药减肥的认可度,使得中药减肥药及减肥功能食品的开发正逐渐成为一个重点发展方向。
绞股蓝(Gynostemma pentaphyllum(Thunb.)Makino),又名七叶胆、五叶参等,是葫芦科绞股蓝属的多年生草质藤本植物。据《本草纲目》记载,绞股蓝有清热解毒、益气健脾、生津止渴和化浊降脂等之效[5]。现代药理研究证明绞股蓝具有抗疲劳、降血脂、降血压、增强免疫等作用,在药品、保健食品、畜牧业饲料添加及防疫中被广泛应用,是一种具有较大开发价值的药食两用植物资源[6]。在临床症状中,肥胖病人多数有浮肿肢沉、神疲乏力、胸闷气短、痰多喘促等症状,故中医学认为脾失健运、湿痰、气虚,是引起肥胖的主要因素[7]。而绞股蓝有益气、健脾、化浊功效,符合治疗肥胖特点。并且现代研究表明绞股蓝中多种成分有降脂活性,如绞股蓝皂苷可通过改变胆固醇胶束结构降低肠道对胆固醇的吸收[8],减少脂肪酶与脂质底物的亲和力,促进胆汁酸的合成与分泌促进脂质代谢[9];绞股蓝黄酮可通过抑制脂肪前体细胞和肝细胞等的成脂过程[10],调节慢性炎症引起的脂肪代谢紊乱[11],促进胆固醇的外排及胆固醇向胆汁酸转化[12]等;绞股蓝多糖可调节脂肪代谢相关基因表达,降低胰岛素抵抗作用[13]等达到调节脂肪代谢。故利用绞股蓝化学成分及作用途径多样特点,可将其作为潜在抑制肥胖多靶点药物。但另一方面,在绞股蓝降脂机制探究中,上述活性成分药理研究多依赖于某一降脂指标、单一通路或靶点进行探究,缺乏对绞股蓝多靶点、多通路防治肥胖的整体认识和各机制间协同作用系统性分析,而且使用传统实验方法系统全面检测出绞股蓝的减肥降脂机制过程漫长且复杂,因此有必要探索新方法来阐明绞股蓝降脂作用机制。
网络药理学是融合生物信息学、计算机技术、网络科学和系统药理学为一体的新兴学科[14]。其疾病与化合药物靶点网络全局化、系统化思路与中医的整体观念一脉相通,已成为中药研究的一种有效技术手段,如:利用网络药理学分析丹参治疗微循环障碍[15],利用网络药理学预测黄芪治疗糖尿病肾病[16]等诸多报道对中药治疗疾病提供了方向。因此,为针对性研究绞股蓝防治肥胖主要药效成分及作用机制间关系,本研究利用网络药理学构建“中药活性成分-靶点”、蛋白互作(PPI)网络、靶基因功能通路等多层次生物信息网络,并结合分子对接技术系统分析绞股蓝抑制肥胖的物质基础、潜在降脂靶点及作用机制,为绞股蓝防治肥胖方向的基础研究及后续应用提供新思路。
1 材料与方法
1.1 材料与仪器
TCMSP数据库(http://lsp.nwu.edu.cn/tcmsp.php);Pubchem数据库(https://pubchem.ncbi.nlm.nih.gov);GeneCards数据库(https://www.genecards.org);OMIM数据库(https://www.omim.org/);Drug-Bank数据库(https://www.drugbank.com);STRING 11.0数据库(https://www.string-db.org);David数据库(https://david.abcc.ncifcrf.gov);Cytoscape3.7.2软件。
1.2 实验方法
1.2.1 绞股蓝活性成分的筛选 通过TCMSP数据库(http://lsp.nwu.edu.cn/tcmsp.php)检索关键词“绞股蓝”,得到其活性成分信息。根据药动学参数中的口服生物利用度(oral bioavailability,OB)和类药性(drug-likeness,DL),筛选出同时满足OB≥20%和DL≥0.1的化学成分[17],并结合文献[18-20]报道的成分,整理得到绞股蓝活性成分。
1.2.2 活性成分与肥胖交集靶点筛选及成分-交集靶点网络构建 通过Pubchem数据库(https://pubchem.ncbi.nlm.nih.gov)下载每个活性成分的Smiles化学式,上传到Swiss Target Prediction(http://www.swisstargetprediction.ch/index.php)平台,以“人类”为研究物种收集靶点,整理得绞股蓝活性成分作用靶点。
在GeneCards数据库(https://www.genecards.org)、OMIM数 据 库(https://www.omim.org/)、DrugBank数据库(https://www.drugbank.com),输入关键词“obesity”,可得与肥胖相关靶点,合并3大数据库肥胖靶点,去除重复基因和假阳性基因得肥胖靶点。将收集到的肥胖靶点与绞股蓝活性成分靶点匹配,其中共同靶点即为绞股蓝潜在抑制肥胖作用靶点。将交集靶点导入Cytoscape3.7.2软件进行可视化,构建绞股蓝活性成分-肥胖作用靶点网络。
1.2.3 PPI网络构建 将绞股蓝的蛋白靶点导入STRING11.0数据库(https://www.string-db.org),参考文献方法参数设置[21-22],并以P<0.01为显著临界值得蛋白相互作用关系。将筛选后分析文件导入Cytoscape3.7.2,将蛋白相互作用网络图(proteinprotein interaction,PPI)可视化。
1.2.4 分子对接验证 从PDB数据库下载上述PPI网络中度值靠前的靶点蛋白3D结构,通过加氢准备、赋予CHARMm力场后,定义原激酶域的ATP活性位点为对接口袋。选取有核心靶点化合物进入3D模式运行能量最小化计算,之后导入Discovery studio 3.5的CDocker模块进行柔性分子对接。运行结束后分析化合物与蛋白的对接模式。评价绞股蓝活性成分与靶点之间的结合活性,并且筛选出潜在主要药效化合物。
1.2.5 生物过程与通路分析 通过David数据库(https://david.abcc.ncifcrf.gov)对绞股蓝抑制肥胖靶点进行GO(Gene Ontology,基因本体)分析和KEGG(Kyoto Encyclopedia of Genes and Genomes,京都基因与基因组百科全书)通路分析,按关联靶点数目由高到低排序,并以P<0.01作为明显功能与通路的界定值,选取排名前10通路。
1.2.6 绞股蓝防治肥胖成分-靶点-通路网络及靶点间相互作用网络构建 为进一步研究成分、靶点与信号通路之间的相互作用关系,利用Cytoscape3.7.2软件进行可视化,构建绞股蓝降脂成分-靶点-通路网络图及靶点间相互作用网络图。
2 结果与分析
2.1 绞股蓝活性成分筛选
根据TCMSP数据库中OB≥20%和DL≥0.10的标准筛选后,共有59种活性化合物,连同文献报道的活性成分5种,共64种,具体信息见表1。

表1 绞股蓝活性成分信息Table 1 Active ingredient information of Gynostemma pentaphyllum
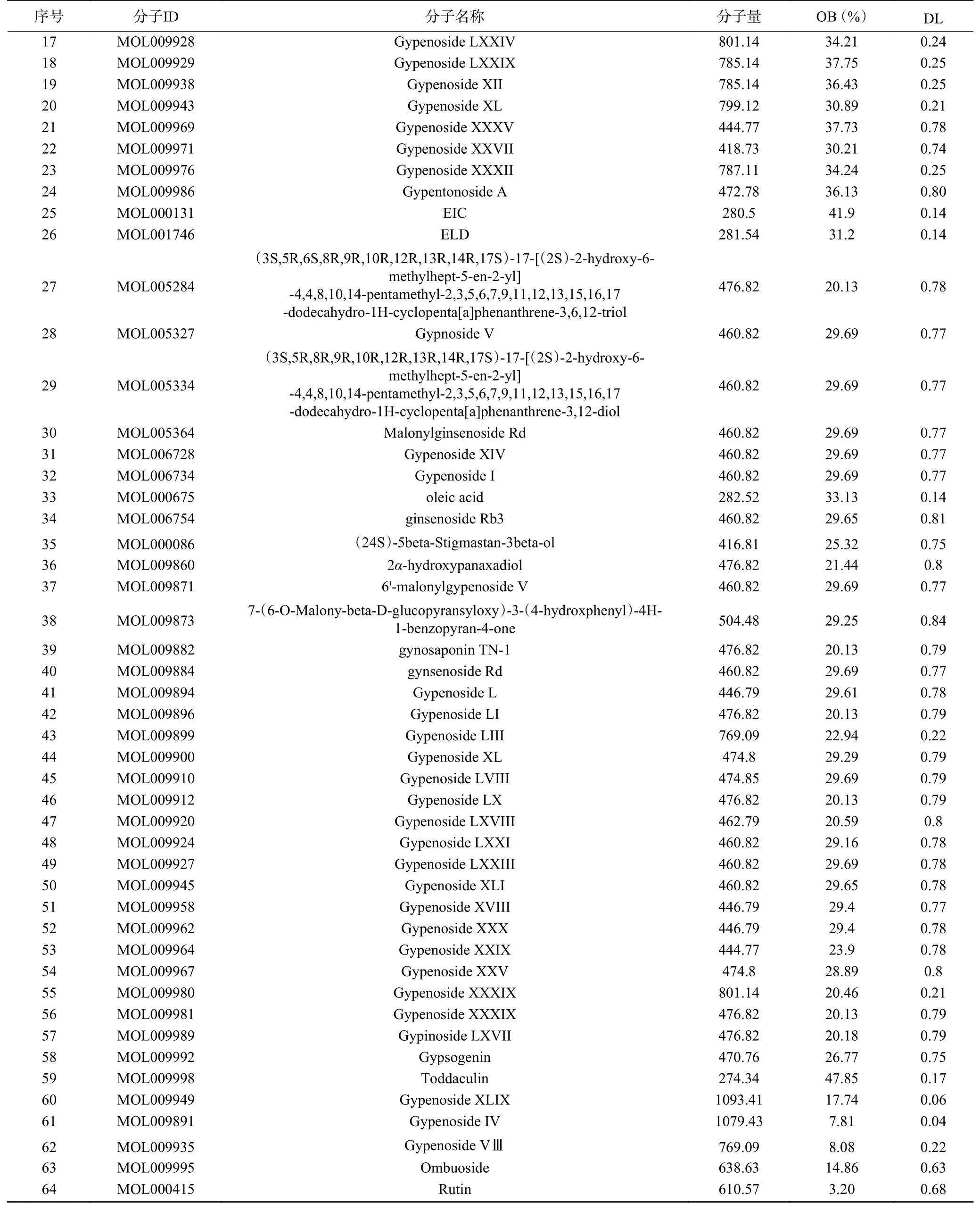
续表 1
2.2 绞股蓝抑制肥胖潜在作用靶点预测及绞股蓝活性成分-靶点网络构建
将上述64个绞股蓝活性成分在Swiss Target Prediction平台中检索得到的作用靶点整合,得到作用靶点291个。从GeneCards、OMIM、DrugBank数据库检索整合得到肥胖靶点1419个,绞股蓝活性成分作用靶点与肥胖靶点交集共有107个,如图1所示。将活性成分与肥胖交集靶点导入Cytoscape3.7.2软件进行可视化后,得绞股蓝-活性成分-作用靶点网络图,如图2所示。图中矩形表示活性成分与疾病交集靶点,圆形表示绞股蓝活性成分,图形面积越大代表其潜在活性靶点越多。由图2可以看出绞股蓝抑制肥胖活性成分共16种,有槲皮素(quercetin)、芦丁(rutin)、人参皂苷f2(ginsenoside f2)、绞股蓝皂苷XXVIII(Gypenoside XXVIII)、3'-甲基柔二醇(3'-methyleriodictyol)、3-甲基鼠李素(Rhamnazin)、谷甾醇(sitosterol)、黄夹次甙丙(Ruvoside)、a-菠菜甾醇(Spinasterol)、菜油甾醇(campesterol)、异氟固醇(Isofucosterol)、胆甾醇(CLR)、绞股蓝皂苷XLIX(Gypenoside XLIX)、脂凝素(Gypsogenin)、亚油酸(EIC)、油酰胺(ELD)。
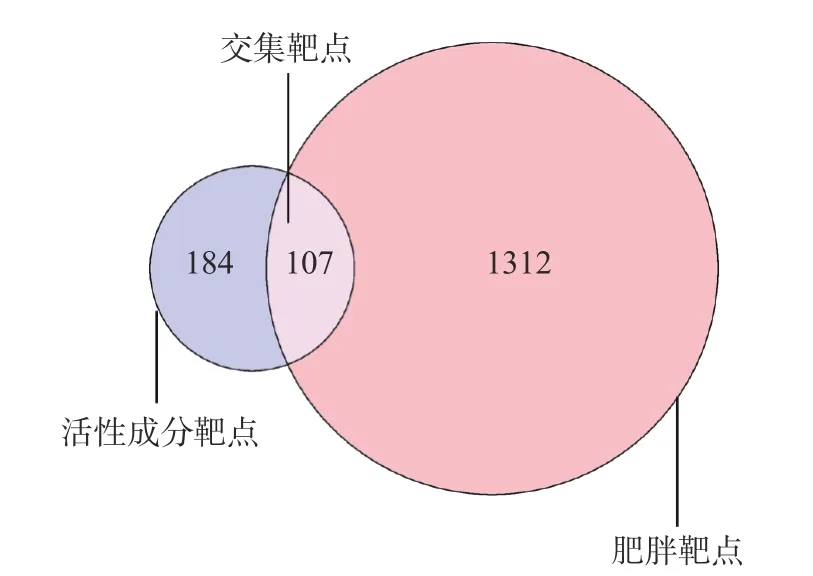
图1 绞股蓝活性成分靶点和肥胖靶点交集靶点的韦恩图Fig.1 Venn diagram of intersection genes of active ingredient related targets of Gynostemma pentaphyllum and anti-obesity targets
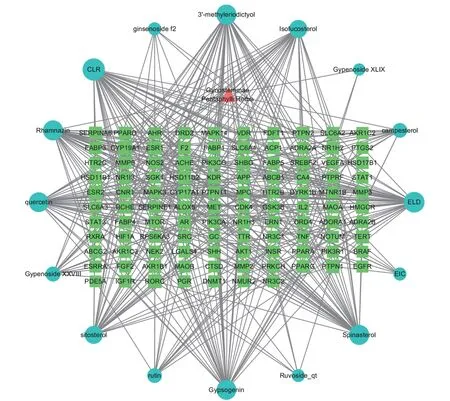
图2 绞股蓝-活性成分-肥胖作用靶点网络图Fig.2 Active ingredients of Gynostemma pentaphyllum anti-obesity target network
2.3 PPI网络构建与分析
将107个共同靶点上传至STRING11.0,经规范后得到靶蛋白相互作用网络(PPI),详细见图3。图中圆圈代表该基因度值,圆圈越小Degree值越小,连线越粗Combined score值越大。根据网络拓扑学性质将靶点按照度值由高到低排序,结果显示共有107个节点,419条边,平均度值是7.83,其中超过平均度值的靶点有38个,推测这38个靶点为绞股蓝作用于肥胖的关键靶点。由这38个靶点可知绞股蓝在防治肥胖过程中有转录因子、信号分子、受体、蛋白(转移/载体蛋白)、酶(激酶、转移酶、蛋白酶)等多种物质的参与。其中STAT3、SRC、EGFR、AKT1、MAPK3、VEGFA的节点度值排名前六位,推测这些靶点可能是治疗肥胖的核心靶点。

图3 绞股蓝治疗肥胖作用靶点的蛋白互作网络Fig.3 Protein interaction network of Gynostemma pentaphyllum anti-obesity
2.4 分子对接验证结果
选取PPI中度值前6位靶点与有这6个靶点的化合物进行分子对接验证。表2为活性成分与相对应关键靶点信息,由表可知3'-甲基柔二醇(3'-methyleriodictyol)、3-甲基鼠李素(Rhamnazin)、黄夹次甙丙(Ruvoside)、槲皮素(quercetin)、人参皂苷f2(ginsenoside f2)、绞股蓝皂苷XXVIII(Gypenoside XXVIII)、a-菠菜甾醇(Spinastero)、胆甾醇(CLR)8个化合物有对应核心靶点,推测这8个化合物可能是绞股蓝抑制肥胖关键药效成分。在对接中,小分子与靶点蛋白相互作用能量打分<0表示有一定结合作用,相互作用能量打分<-30表示有较强结合作用[23]。由表3可知蛋白与化合物对接相互作用能量分数在-22.8832~-49.6606,表明这8个化合物与对应核心靶点蛋白结合普遍较好,提示本实验的数据与结果较为可靠,具有较高的参考价值。图4为8个化合物与肥胖核心靶点的分子对接模式图。

图4 绞股蓝8个化合物与对应肥胖核心靶点的分子对接模式图Fig.4 Molecular docking patterns of eight Gynostemma pentaphyllum compounds with key obesity targets
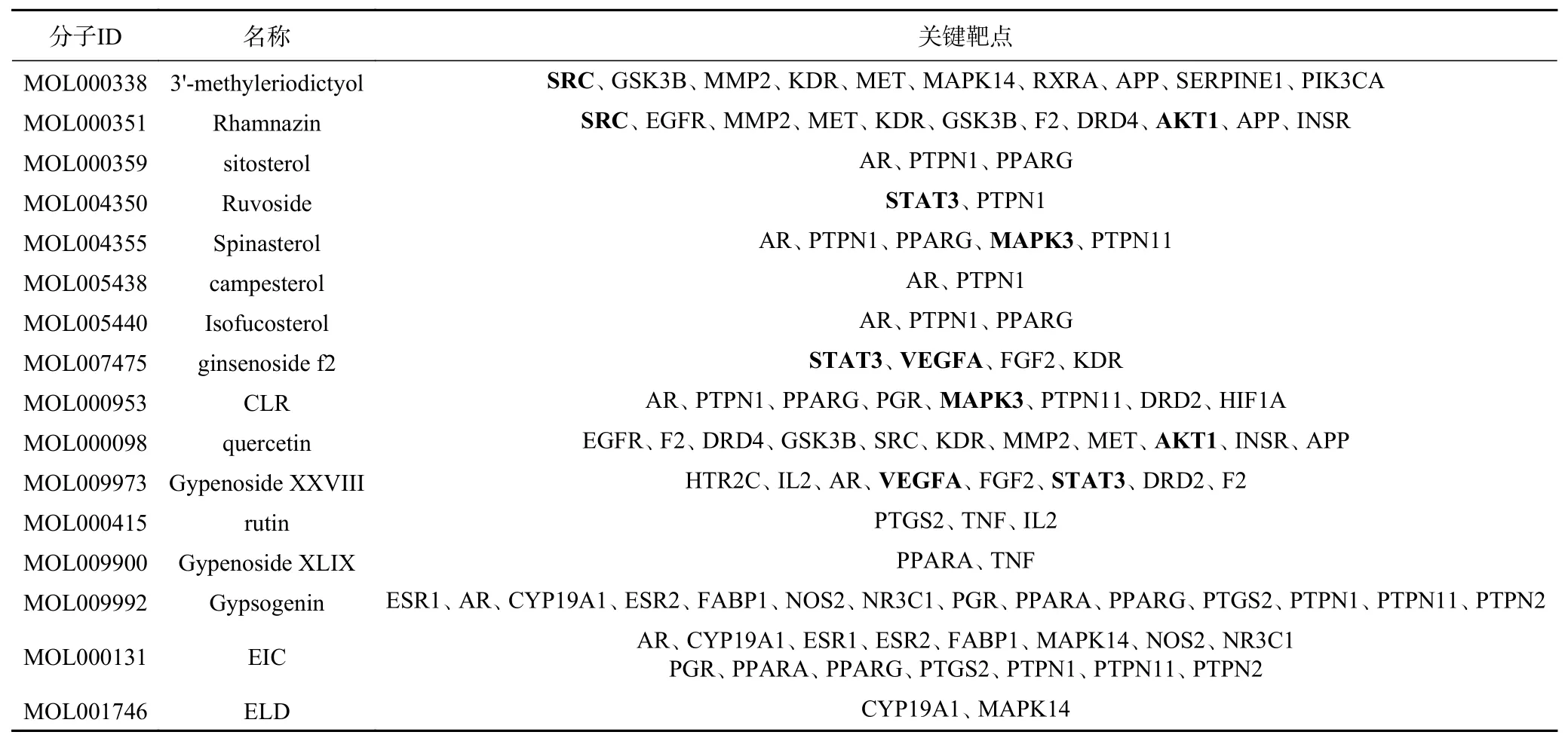
表2 各活性成分对应防治肥胖关键靶点基因Table 2 Corresponding gene of each active ingredient
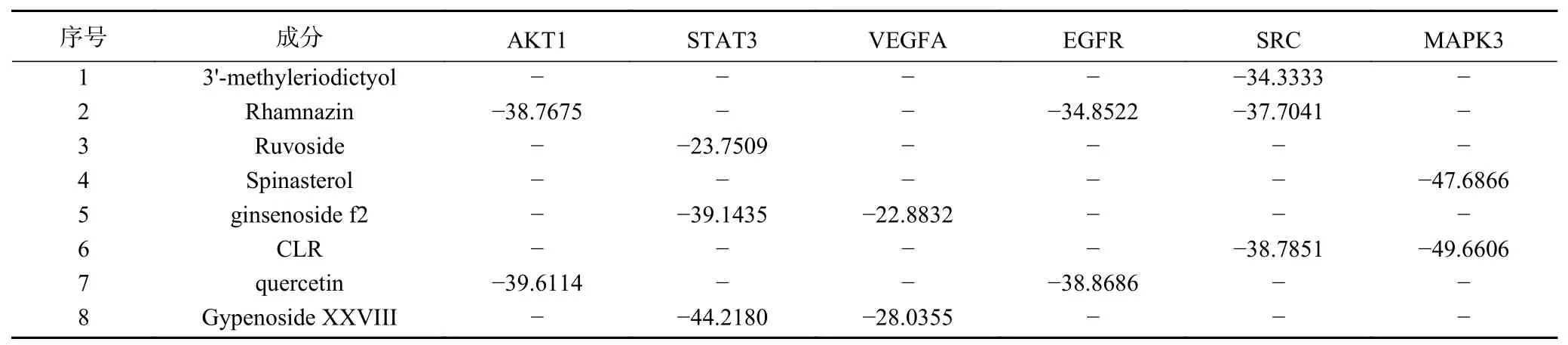
表3 绞股蓝关键成分与对应核心靶点相互作用能量打分表Table 3 Key components and the corresponding core target interaction energy score table
2.5 GO和KEGG富集分析
通过DAVID数据库对交集靶点进行GO富集分析,各过程富集排名前10位分析结果详细见图5(P<0.01),图中X轴代表靶基因中属于该过程的基因数量,Y轴3种颜色代表生物过程(Biological process,BP)、细胞组分(Cellular components,CC)、分子功能(Molecular function,MF)。图5结果显示绞股蓝抑制肥胖靶点参与的生物过程包括细胞生长增殖过程、代谢过程、激素调节过程等,如RNA聚合酶Ⅱ启动子转录的正/负调控(positive/negative regulation of transcription from RNA polymerase II promoter)、DNA模板转录调控(transcription, DNA-templated)、信号传导(signal transduction)、凋亡过程的正/负调控(positive/negative regulation of apoptotic process)、蛋白质磷酸化(protein phosphorylation)、氧化还原过程(oxidation-reduction process)、类固醇激素介导的信号通路(steroid hormone mediated signaling pathway)等;参与的细胞组成主要包括核(nucleus)、质膜(plasma membrane)、细胞质(cytoplasm)、胞质溶胶(cytosol)、核质(nucleoplasm)、细胞外泌体(extracellular exosome)、线粒体(mitochondrion)等;分子功能主要富集于蛋白质结合(protein binding)、锌离子结合(zinc ion binding)、ATP结合(ATP binding)、转录因子活性序列特异性DNA结合(transcription factor activity, sequence-specific DNA binding)、DNA结合(DNA binding)、酶结合(enzyme binding)、类固醇激素受体活性(steroid hormone receptor activity)等。
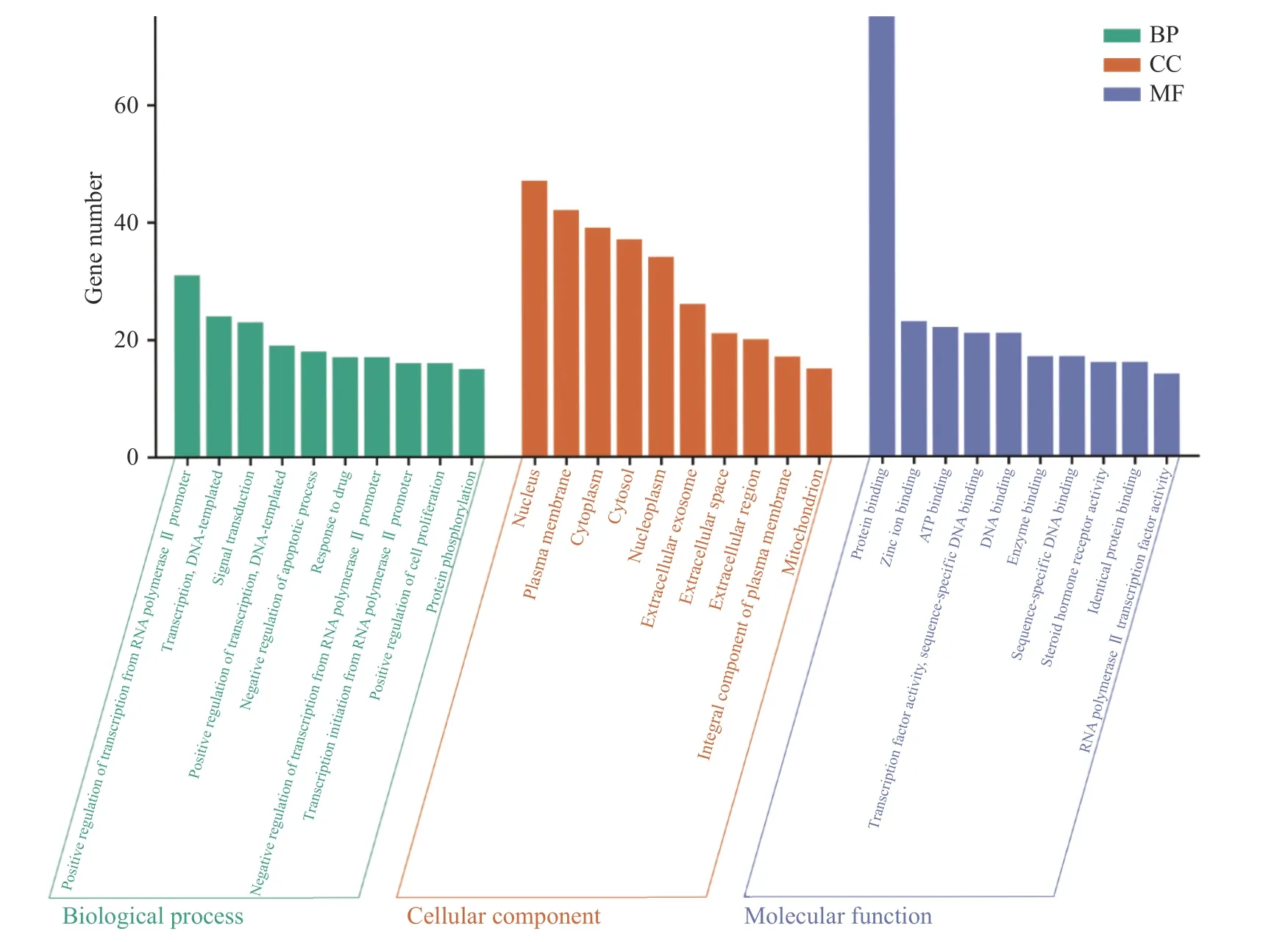
图5 绞股蓝防治肥胖基因GO富集分析结果Fig.5 Gynostemma pentaphyllum prevention and treatment of obesity gene GO enrichment analysis diagram
KEGG通路分析结果详见图6,图中气泡颜色代表富集显著性(P-value)的大小;气泡大小代表目标基因集中属于该pathway的基因数量。表4为KEGG富集排名前10通路信息表(P<0.01)。由图表可知绞股蓝治疗肥胖的靶点主要集中在癌症信号通路、癌症中蛋白多糖信号通路、PI3K-Akt信号通路、Rap1信号通路、HIF-1信号通路等。
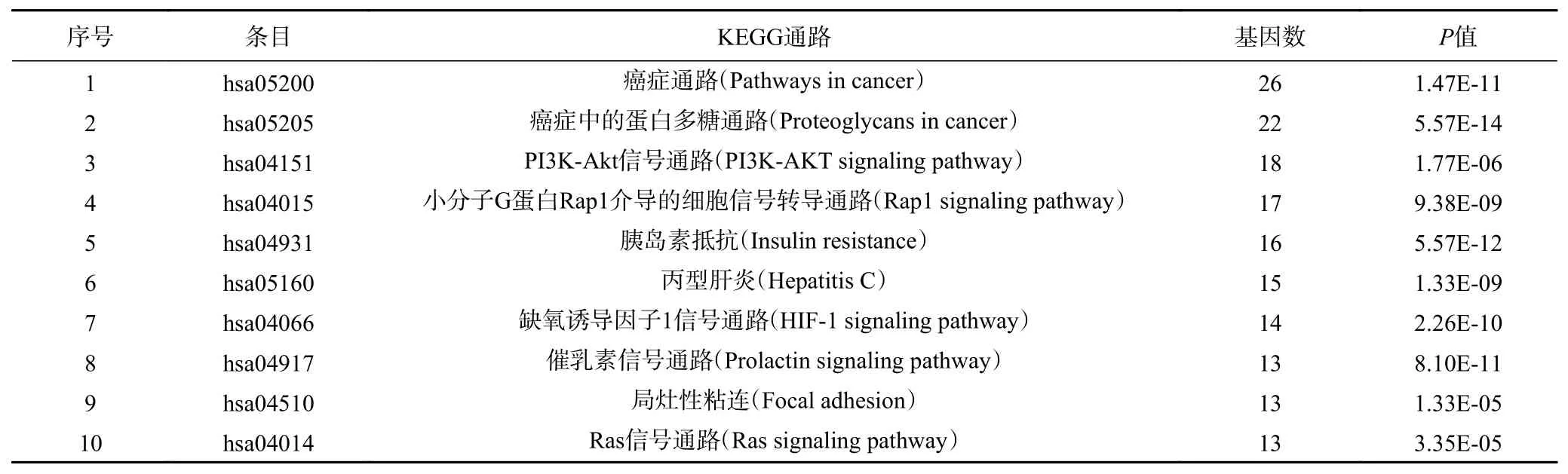
表4 绞股蓝防治肥胖KEGG通路排名前10位富集分析Table 4 Enrichment analysis of the top 10 KEGG pathways

图6 绞股蓝活性成分防治肥胖的KEGG通路富集气泡图Fig.6 KEGG pathway enrichment bubble chart of the active ingredients of Gynostemma pentaphyllum preventing and treating obesity
2.6 绞股蓝降脂成分-靶点-通路网络构建
为进一步研究成分、靶点与信号通路之间的相互作用关系,将分子对接中筛选的8个潜在降脂关键药效成分、38个关键作用靶点及排名前10的作用通路采用Cytoscape 3.7.2软件构建“成分-靶标-通路”网络,详细见图7,图中蓝色圆形表示降脂成分,绿色矩形表示作用靶点,橙色三角形表示作用通路,图内连线表示各点之间的相互关系。由图7可得绞股蓝治疗肥胖有多个成分作用于同一靶点,同一靶点调节多个信号通路,体现出绞股蓝多成分、多靶点及多种作用通路协同防治肥胖。
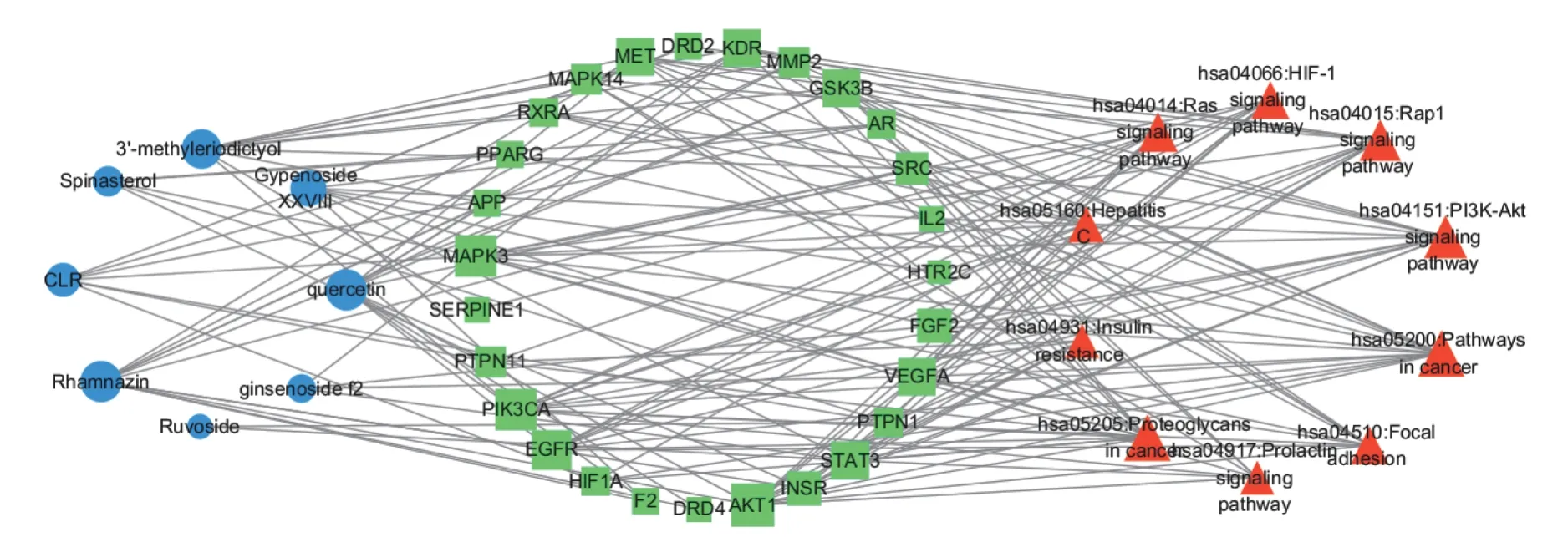
图7 绞股蓝防治肥胖成分-靶点-作用通路网路图Fig.7 Gynostemma pentaphyllum prevents obesity components-target-action pathway network diagram
使用KEGG数据库搜索靠前信号通路,联合Cell Signaling数据库,得到关键靶点相互作用网络图,详细见图8。由图可知,绞股蓝可通过多个信号通路协同治疗肥胖,各通路间存在上下游关系,各靶点间存在相互作用关系。通过靶点与通路间网络,绞股蓝可调节细胞增殖、分化、存活、代谢等途径起到防治肥胖作用。如图中HIF-1通路受上游通路PI3K-Akt通路、STAT3通路调控,在这3条通路中绞股蓝防治肥胖靶点AKT1、STAT3、HIF-1处于关键节点,通过3条通路上靶点在细胞间、细胞质、细胞核内的相互作用,调控着细胞增殖、分化、代谢等过程。
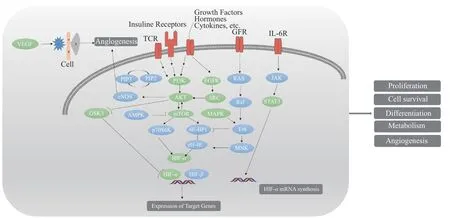
图8 绞股蓝防治肥胖靶点相互作用网络图Fig.8 Interaction network diagram of Gynostemma pentaphyllum preventing and treating obesity targets
3 讨论
本研究筛选出绞股蓝中16个活性成分有对应肥胖靶标,这16个活性成分可能为绞股蓝防治肥胖物质基础。结合筛选出的核心靶点蛋白与对应化合物分子对接结合良好,分析出槲皮素、人参皂苷f2、绞股蓝皂苷XXVIII、3'-甲基柔二醇、黄夹次甙丙、3-甲基鼠李素、a-菠菜甾醇、胆甾醇8个化合物可能为防治肥胖关键药效成分。同时文献调研结果显示,如槲皮素可明显改善糖尿病肥胖大鼠体内的总胆固醇含量及体内的氧化应激反应[24],可调节MAPK信号转导中转导因子ERK1/2、JNK、P38MAPK、MCP-1及TNF-α表达量来抑制肥胖,还可提高脂肪组织中UCP1(内膜上解偶联蛋白1)水平来增加能量消耗,并在肥胖引起的炎症中,抑制炎症细胞因子IL-1、IL-6和刺激抗炎因子IL-10的分泌,达到防治肥胖目的[25]。人参皂苷f2可抑制脂肪生成标记物PPARγ表达进而阻止脂肪细胞分化起到降脂作用[26]。芦丁可抑制PPARγ和C/EBPα等成脂转录因子表达进而干扰脂肪前体细胞和肝细胞等的成脂过程[27],故本研究筛选结果有一定理论依据,可为绞股蓝治疗肥胖的药效成分研究提供方向。
药物靶点的预测揭示了药物与分子作用机制重要信息,对促进药物研发有着重要意义。在对绞股蓝降脂靶点筛选中,通过构建PPI网络图,筛选出节点相关性最强的靶点有AKT1、STAT3、VEGFA、SRC、EGFR、MAPK3。其中,AKT激酶是在脂肪细胞中具有关键体内功能的胰岛素效应器,可刺激葡萄糖摄取和糖原合成,以及蛋白质合成[28]。AKT1是AKT主要亚型之一,可介导胰岛素、IGF-1、IL-3以及其他生长因子的多种代谢、促有丝分裂和抗凋亡作用,是参与脂肪形成的重要致病因子[29]。相关实验已证明AKT1可增加CDK2(AKT磷酸化周期蛋白依赖性激酶)的活性使得3T3-L1细胞的生长周期变快影响其增殖和生长[30];STAT3是一种信号传导及转录激活蛋白,属于与DNA结合的STAT蛋白质家族。在机体内,白色脂肪组织向棕色脂肪组织转化对于改善肥胖具有重要意义[31],而STAT3作为减肥作用靶点时,STAT3能够进入线粒体,调节电子传递链,增加线粒体ATP生成,进而促进棕色脂肪生成,调节能量以维持正常能量稳态[32]。并且有研究报道STAT3可作为直接靶标通过调控脂肪酸代谢相关基因影响脂肪细胞增殖和分化[33]。VEGFA在脂肪发育和能量代谢中起重要调节作用。VEGFA属于VEGF家族,参与血管形成、调节血管通透性、维持血管生理功能等过程。而VEGFA与调节机体肥胖也有直接关系,脂肪组织会刺激内皮细胞的扩大产生VEGFA,进而促进新生毛细血管的形成,随后机体通过提高血清瘦素水平去控制血管生成,对抗脂肪细胞中脂质的积累[34]。在筛选的核心靶点中,SRC(非受体酪氨酸激酶)、EGFR(表皮生长因子受体)、MAPK3(丝裂原活化蛋白激酶3)这3个靶点可参与细胞增殖、分化、迁移和存活,且主要集中在癌症机制研究中[35]。文献显示癌细胞通常被大量脂肪细胞包围,这些脂肪细胞会产生富含脂肪酸的环境作为癌细胞生长的外部刺激,使得癌细胞对葡萄糖和谷氨酰胺异常高需求,继而表现出脂质代谢的改变即脂肪生成增加、脂肪酸摄取增加[36],因此筛选出这三个靶点有可能是其影响了癌细胞脂质代谢。通过上述文献调研可得绞股蓝的靶点筛选与目前大量药理学实验研究结果相吻合,后期可根据预测结果进一步探究药效成分与靶点作用关系。
在绞股蓝治疗肥胖的分子机制中,KEGG分析得富集靶点较多并且显著性较高的为癌症通路、癌症中的蛋白多糖通路、PI3K-Akt信号通路、Rap1信号通路、HIF-1信号通路等。在肥胖发展过程中,细胞水平上表现为脂肪细胞数目增多、体积增大,这些变化导致脂质在脂肪组织中过量积累。而在肿瘤的发展过程中,机体同样发生增殖过度,期间肿瘤细胞增加促进生长的信号因子,改变对生长抑制提示的反应,下调保护性凋亡机制,增强肿瘤灌注和不受控制的复制遗传物质的能力等最终导致细胞无限制、无序增殖、组织侵袭和转移[37]。结合前面PPI筛选绞股蓝防治肥胖关键靶点,推测绞股蓝可能是通过调控如STAT3、AKT1、EGFR、VEGFA等靶点,参与细胞增殖和细胞凋亡的过程,达到抑制脂肪细胞不受控制分化、增殖目的。细胞外基质(ECM)是介导代谢和炎症信号转导,确保细胞功能完整性的中心枢纽。而蛋白多糖是胞外基质的重要组成部分,在胚胎发生、组织修复、炎症和癌症相关的信号通路中起到关键角色[38]。其中炎症与肥胖的相关性已得到广泛认可,尤其是中枢性肥胖,内脏脂肪的过度沉积与血清促炎细胞因子如IL-6、CRP、TNF水平升高有关[39]。故推测绞股蓝中活性成分可能通过癌症蛋白多糖通路影响由肥胖引起的慢性炎症的发展。PI3K-Akt信号通路在脂肪形成中影响脂肪细胞增殖,并且是调控血糖平衡的重要通路[40]。在该通路中PI3K激活后,在磷酸肌醇依赖性激酶的帮助下,导致Akt结合到细胞膜上,紧接着PI3K-Akt通过磷酸化糖原合酶激酶3β的N端丝氨酸来抑制糖原合酶激酶3β的活性增加细胞周期蛋白D1的积累,导致糖原的合成减少,增加糖酵解,促进葡萄糖摄入细胞,进而促进脂肪合成,故推断绞股蓝中活性成分可能通过抑制该通路影响机体糖脂代谢[41]。Rap1信号通路在PI3KAkt通路上游,其中Rap1在各种代谢和信号通路中作为基因表达的分子决定因素,Rap1缺乏可导致多系统代谢紊乱,表现为葡萄糖不耐受、血脂异常、肝脏脂肪变性和过量脂肪堆积[42]。在PI3K-Akt通路下游mTOR靶向蛋白是细胞生长和增殖的关键调节分子,其通过PI3K-Akt或Ras-ERK信号通路接收生长因子、营养、能量等多种信号促进细胞生长增殖,而对mTOR信号通路的抑制可以使细胞停滞在G1期而触发细胞凋亡。在肥胖相关研究中,有文献报道药物可通过调节PI3K-Akt-mTOR信号通路,显著降低脂肪生成标记PPARγ、FASN和FABP4的表达水平,抑制前脂肪细胞增殖和分化[43]。由此结合KEGG分析推测绞股蓝活性成分很可能通过Rap1通路及PI3K-Akt-mTOR通路调控细胞增殖、生长及生成脂质基因发挥防治肥胖作用。在KEGG分析中胰岛素抵抗通路排第五位,病理研究显示肥胖会通过诱导胰岛素抵抗来增加2型糖尿病的风险,且由于机体能量代谢不平衡,脂肪细胞变大,增生,内质网应激和线粒体功能障碍等,使得炎性因子水平升高,机体呈现一种慢性炎性反应进而影响全身各器官[44]。由此推测绞股蓝活性成分可能通过胰岛素抵抗通路影响机体糖脂代谢及炎症因子分泌达到防治肥胖作用。在KEGG分析中HIF-1信号通路显著性也较高,其中绞股蓝降脂靶点HIF-α处在PI3K-Akt-mTOR通路和STAT3通路下游,其蛋白水平受PI3K-AktmTOR和STAT3调节[45],同时HIF-α也可调控众多下游基因,包括血管生成基因(VEGF),红细胞生成和能量代谢基因(GLUT1,ALDOA,ENO1,LDHA,PFK2,PGK1和HK),细胞增殖和分化基因(FGFs,TGF和IGF)。在肥胖状态下,脂肪细胞可通过增加HIF-α来控制线粒体的生物发生和糖酵解,增加胰岛素抵抗来控制脂肪细胞消耗氧气维持机体稳态[46]。因此如果绞股蓝中活性成分通过HIF-1通路激活HIF-α将是治疗肥胖和胰岛素抵抗的重要药物研发方向。
综上,本研究利用网络药理学方法及分子对接技术对绞股蓝防治肥胖的活性成分、潜在靶点和作用机制进行了初步预测分析,阐述了绞股蓝通过多成分、多靶点、多通路的协同作用,影响机体脂肪细胞增殖分化、脂质基因表达、糖脂代谢及机体炎症等发挥疗效,为后续更深层次的挖掘绞股蓝防治肥胖机制及绞股蓝药物的开发利用提供了新思路和方向。
