miR-141-3p对卵巢癌的作用及其机制
2022-03-04王秋宇付小玲李和丽
王秋宇 姜 平 郭 哲 付小玲 李和丽
(南阳市中心医院妇科,南阳 473000)
微小RNA(microRNA,miRNA)是一类小的非编码RNA,包含20~25 个核苷酸,由含70~100 个核苷酸的发夹状的前体加工而成[1-3],参与调节包括细胞增殖、组织分化、癌症形成和转移等多个生物学过程[4-6],与癌症的发生和发展密切相关。miRNA 在卵巢癌中异常表达[7],其中miR-141 在多种癌症中都存在异常表达,包括结肠癌[8]、胃癌[9]和肾细胞癌[10]。Tamagawa 等[11]研究证实,miR-141 在调控头颈部鳞状细胞癌迁移和上皮-间质转化中发挥着重要的作用。此外,在肾细胞癌中,过表达miR-141 能通过Wnt 信号通路抑制细胞的侵袭和增殖[12-15],但是miR-141 在卵巢癌转移和耐药中的作用仍有待于研究。本研究旨在通过一系列的实验研究卵巢癌细胞系SKOV3 中miR-141 的作用,并确定其与潜在靶点表皮生长因子受体(epidermal growth factor receptor,EGFR)的关联。
1 材料和方法
1.1 样本收集
收集2018年5月至2020年12月南阳市中心医院妇科收治的接受卵巢囊肿手术(30例)及卵巢癌手术(30例)患者。根据国际妇产科联合会诊断标准[6]将患者分为正常卵巢组(接受卵巢囊肿手术患者)和卵巢癌组(接受卵巢癌手术患者),所有患者术前均未接受任何的化疗和放疗。本研究经医院伦理委员会批准,患者及家属均签署知情同意书。
1.2 细胞培养和质粒构建及分组
卵巢癌细胞系SKOV3 细胞购于国家实验细胞资源共享平台(北京),细胞用含有10%胎牛血清(浙江天杭生物科技股份有限公司)的RPMI-1640培养基(Gibco,美国)进行培养。HEK293T 细胞用含10%胎牛血清的DMEM 培养基(Gibco,美国)进行培养。
突 变 的EGFR 3'-UTR(带 有miR-141-3p结合区域的)被克隆至带有萤火虫荧光素酶的pcDNA3.0 载体中,用于双荧光素酶活性的检测。
1.3 萤光素酶报告基因检测
通过分析StarBase 数据库发现,EGFR 的3'UTR区域存在miR-141-3p 的结合位点,在HEK293T 细胞中进行双荧光素酶报告基因实验。将SKOV3 细胞接种至96 孔板中,然后按照说明书中的操作步骤加入miR-141-3p和阴性对照(普洛麦格北京生物技术有限公司),48 h后按照仪器的操作说明,使用双荧光素酶检测报告系统(普洛麦格北京生物技术有限公司)进行检测。以海肾荧光素酶活性为标准将每个样品的荧光素酶活性进行标准化处理。
1.4 细胞转染
取对数生长SKOV3 细胞株接种于6 孔板中。细胞培养至80 %~90 %,采用Lipofectamine 2000 将miR-141-3p-NC、miR-141-3p 和miR-141-3p+LV-EGFR 转染至SKOV3 细胞,将细胞悬液加入6 孔板,转染5 h 后,继续培养,SKOV3 细胞株分为4 组,NC 组(无转染的SKOV3 细胞),miR-141-3p 组(SKOV3 细胞转染miR-141-3p),LVEGFR 组(SKOV3 细胞转染LV-EGFR)及miR-141-3p+LV-EGFR 组(SKOV3 细胞转染miR-141-3p 及LV-EGFR)。
1.5 免疫印迹检测
各组SKOV3细胞采用RIPA裂解液进行裂解,12 000 r/min离心15 min,取上清即为蛋白。用BCA试剂盒进行蛋白浓度的定量,之后加入Loading buffer进行蛋白的变性。每孔加入等体积的蛋白,用SDS-PAGE凝胶进行电泳,然后转移到NC膜上(密理博中国有限公司)。5%脱脂牛奶室温封闭1 h,一抗孵育过夜。磷酸化蛋白激酶B(phosphorylated protein kinase B,p-AKT)、蛋白激酶B(protein kinase B,AKT)、磷酸化信号转导子和转录激活子
3(phosphorylated signal transducer and activator of transcription 3,pSTAT3)、信号转导子和转录激活子3(signal transducer and activator of transcription 3,STAT3)、磷酸化细胞外信号调节激酶(phosphorylated extracellular signal-regulated kinases,p-ERK)、细胞外信号调节激酶(extracellular signal-regulated kinases,ERK)、磷酸化黏着斑激酶(phosphorylated focal adhesion kinase,p-FAK)、粘着斑激酶(focal adhesion kinase,FAK)、Src、p-Src(Tyr416)、基质金属蛋白酶9(matrix metalloproteinase-9,MMP-9)和c-Jun抗体购于Abcam(美国),GAPDH抗体购于北京中杉金桥生物技术有限公司。TBS-T清洗3次,每次10 min,然后用HRP偶联的二抗(中杉金桥生物技术有限公司)室温孵育1 h,TBS-T清洗3次,每次10 min。用ECL进行显影,化学发光成像仪采集图像(Bio-Rad,美国)。
1.6 实时荧光定量PCR 检测miR-141-3p 和EGFR 表达量
按照试剂盒(天根生化科技北京有限公司)的说明书提取正常卵巢和卵巢癌组织的总RNA,用逆转录试剂盒(天根生化科技北京有限公司)合成cDNA,利用SYBGreen(罗氏公司,美国)进行实时定量PCR 检测,ABI PRISM 7500 仪器(Applied Biosystem,美国)检测荧光信号。miR-141-3p 和EGFR 引物由上海生工合成,以U6 的表达量作为内参。
1.7 四氮唑蓝盐化合物(MTS)法检测细胞增殖
将SKOV3 细胞消化吹散,按照每孔5 000 个接种到96 孔板中,检测时每孔加入20 μL 的MTS(普洛麦格北京生物技术有限公司),4 h 之后用酶标仪测量490 nm 处的吸光度。以空白对照孔为调零孔,计算活细胞数。
用不同浓度的紫杉醇(0.000 1、0.000 3 和0.001 μg/mL)和顺铂(2.5、5、10 µmol/L)分别处理miR-141-3p-NC、miR-141-3p、LV-EGFR 和miR-141-3p+LV-EGFR 组中SKOV3 细胞48 h,之后通过MTS 的方法检测存活的细胞数,从而计算紫杉醇和顺铂对细胞增殖的抑制率。
1.8 Transwell 法检测细胞侵袭和迁移
体外SKOV3 细胞侵袭和转移实验按照文献[7]进行。在进行侵袭实验时,首先在迁移小室(密理博中国有限公司)上铺上30 μg 的基质胶(BD,美国),37 ℃放置30 min 形成重构的基质膜。每孔中加入200 μL 无血清的RPMI-1640 培养基,使其含有1×106的细胞,下小室中加入600 μL 含血清的RPMI-1640 培养基。培养48 h 后,检测细胞的侵袭情况。4%多聚甲醛固定30 min,苏木精染色15 min,然后用棉签小心移除非迁移的细胞。利用显微镜(×200)(Nikon,日本)拍摄图像,随机选择5 个视野进行计数,平均值即为发生侵袭的细胞数。迁移的步骤和侵袭类似,只是迁移小室中未加基质胶。
1.9 统计学处理
数据处理采用SPSS 22.0 统计学软件,计量资料以±s表示,用t检验或方差分析或重复测量设计的方差分析或秩和检验。相关性分析用Pearson法。P<0.05 为差异有统计学意义。
2 结果
2.1 卵巢癌组织中miR-141-3p 与EGFR 的表达
正常卵巢组中miR-141-3p 及EGFR 相对表达分别为1.29±0.22、2.30±1.05,卵巢癌组织中miR-141-3p 及EGFR 相对表达分别为0.50±0.27、15.25±3.01;卵巢癌组织中miR-141-3p 表达水平低于正常卵巢组织(图1A),EGFR 表达水平高于正常卵巢组织,差异均有统计学意义(P<0.01)(图1C)。与正常卵巢组相比较,Ⅰ~Ⅱ期和Ⅲ~Ⅳ期卵巢癌组织miR-141-3p 表达水平均降低(P<0.05)(图1B)。与正常卵巢组相比较,Ⅰ~Ⅱ期和Ⅲ~Ⅳ期卵巢癌组织EGFR 表达水平均升高(P<0.05)(图1D)。卵巢癌组织中EGFR 与miR-141-3p 的表达水平呈负相关(r=0.696 7,P<0.01)(图1E)。
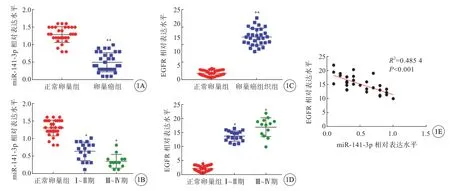
图1 卵巢癌组织中miR-141-3p 与EGFR 表达情况。A:卵巢癌组织和正常卵巢组织中miR-141-3p 的表达情况;B:不同肿瘤分期卵巢癌组织中miR-141-3p 的表达情况(Ⅰ~Ⅱ期17 例,Ⅲ~Ⅳ期13 例);C:卵巢癌组织和正常卵巢组织中EGFR 的表达情况;D:不同肿瘤分期卵巢癌组织中EGFR 的表达情况(Ⅰ~Ⅱ期17 例,Ⅲ~Ⅳ期13 例);E:miR-141-3p 与EGFR 表达的相关性分析,*P<0.05,**P<0.01 vs 正常卵巢组.
2.2 miR-141-3p 抑制细胞的侵袭和转移
NC 组SKOV3 细胞miR-141-3p 表达、迁移数目及侵袭数目分别为1.06±0.15、137.00±13.00 及52.33±9.29,miR-141-3p 组的分别为2.00±0.13、81.33±10.06 及26.00±7.00,且miR-141-3p 表达水平高于NC 组(P<0.001)(图2A);NC 组与miR-141-3p 组在24 h 及48 h 时SKOV3 细胞吸光度比较无统计学意义(P>0.05),在72 h 及92 h 时与NC组相比,miR-141-3p 组SKOV3 细胞吸光度显著降低(P<0.001)(图2B);miR-141-3p 组细胞侵袭能力低于NC 组(P<0.05),转移能力低于NC 组(P<0.01)(图2C)。
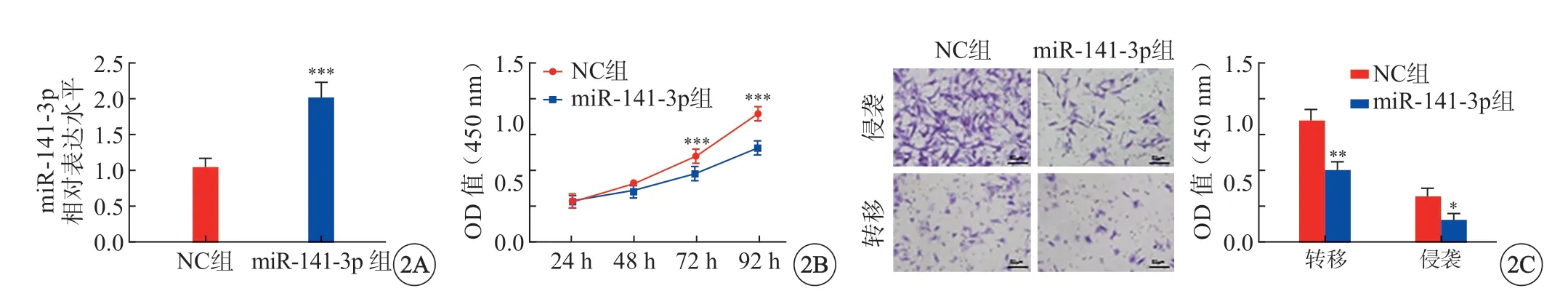
图2 miR-141-3p 抑制细胞的侵袭和转移。A:miR-141-3p 过表达情况;B:细胞增殖情况;C:细胞侵袭和转移情况(×200)。*P<0.05,**P<0.01 vs NC 组.
2.3 miR-141-3p 抑制卵巢癌细胞中p-AKT、p-FAK、p-Src 和MMP-9 的表达
NC 组和miR-141-3p 组SKOV3 细胞中p-AKT、p-FAK、p-Src 和MMP-9 蛋白表达水平差异有统计学意义,miR-141-3p 组SKOV3 细胞中p-AKT、p-FAK、p-Src 和MMP9 的蛋白表达水平均低于NC 组(P<0.01),但miR-141-3p 组与NC 组相比p-STAT3、p-ERK 和c-Jun 蛋白表达比较无统计学意义(P>0.05)(图3A、3B)。
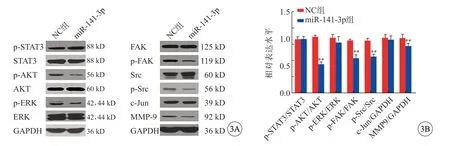
图3 p-STAT3、STAT3、ERK、p-AKT、p-FAK、p-Src 和MMP-9 等蛋白表达情况(A)以及灰度分析直方图(B),**P<0.01 vs NC 组.
2.4 EGFR的3'UTR区域存在miR-141-3p的结合位点
EGFR 的3'UTR 区域存在miR-141-3p 的结合位点,见图4A。NC 组和miR-141-3p 组荧光素酶活性比较差异有统计学意义(P<0.001),过表达miR-141-3p 能够抑制细胞中荧光素酶的活性;将预测的EGFR 结合位点突变后,其抑制作用消失(图4B)。miR-141-3p 组SKOV3 细胞中EGFR 蛋白表达低于NC 组(P<0.001)(图4C、D);LV-EGFR组SKOV3 细胞中EGFR 表达高于NC 组(P<0.01)(图4E)。miR-141-3p+LV-EGFR 组SKOV3 细胞中p-AKT、p-FAK、p-Src、MMP-9 及EGFR 蛋白表达均高于miR-141-3p 组(P<0.001)(图4F)。

图4 miR-141-3p 与EGFR 的3’UTR 区域相互作用。A:miR-141-3p 与EGFR 的3'UTR 区域结合位点;B:双荧光素酶报告系统验证结合位点;C、D:免疫印迹检测EGFR 表达(C)和灰度分析直方图(D);E:EGFR 表达情况;F:p-AKT、p-FAK、p-Src 和MMP-9 等蛋白表达免疫印迹检测以及灰度分析直方图。***P<0.001 vs NC 组.
2.5 miR-141-3p 增加卵巢癌细胞对药物的敏感性
与NC 组相比,不同浓度顺铂及紫杉醇干预后miR-141-3p 组SKOV3 细胞抑制率均升高(P<0.01)(图5A)。miR-141-3p+LV-EGFR 组与miR-141-3p组在10 μmol/L 顺铂干预后SKOV3 细胞抑制率比较无统计学意义(P>0.05);与miR-141-3p 组相比,在2.5、5 μmol/L 顺铂干预及不同浓度紫杉醇干预后miR-141-3p+LV-EGFR 组SKOV3 细胞抑制率均降低(P<0.05,P<0.01))(图5B)。说明同时过表达miR-141-3p 和EGFR 之后会减弱过表达miR-141-3p 对顺铂和紫杉醇的敏感性。

图5 miR-141-3p 增加了卵巢癌细胞对顺铂(A)和紫杉醇(B)的敏感性。**P<0.01 vs NC 组;#P<0.05,##P<0.01 vs miR-141-3p+LV-EGFR 组.
3 讨论
卵巢癌在全球妇科癌症中排名第5,是一种高度侵袭性的癌症,每年导致近15 万人死亡[23-24]。卵巢癌的高死亡率主要是由于卵巢癌被诊断时大多即为晚期,导致患者的预后较差,5年的生存率较低,仅为20%~30%。EGFR 通常在卵巢癌中高表达,这种高表达在每种病理类型中都有出现[16]。此外,EGFR 的异常表达发生在肿瘤分级高、细胞增殖指数高、p53 异常表达和预后不良的患者中[17]。
miRNAs 在细胞生长、凋亡和分化等多种生物学过程中起着重要作用,并且在多种人类癌症中都存在着异常表达。miR-141-3p 在前列腺癌细胞和癌组织中表达均增加,miR-141-3p 的过表达与前列腺癌细胞的异常增殖相关[18]。Huang 等[19]进一步研究表明,miR-141-3p 通过直接调控肿瘤坏死因子受体相关因子5 和6 显著降低了前列腺癌细胞的骨转移。miR-141-3 还可通过直接调节细胞分裂周期25A 来抑制人类基质干细胞的生长,并抑制其碱性磷酸酶活性和矿化基质形成[20]。Ishibashi 等报道,食管鳞状细胞癌细胞系中miR-141-3p 的表达水平高于正常食管上皮细胞系[21]。此外,miR-141-3p 通过靶向PHLPP2 调节AKT/PI3K 信号途径[22]。本研究结果显示,卵巢癌组织中miR-141-3p 的表达降低,而EGFR 的表达增加,并且miR-141-3p的表达与EGFR 的表达呈负相关。在卵巢癌细胞系SKOV3 中过表达miR-141-3p 抑制细胞的增殖、侵袭和转移,可能与miR-141-3p 调控AKT、FAK、Src 和MMP-9 的表达有关。EGFR 可以调控MAPK/ERK 和PI3K/AKT 等信号通路,从而调控细胞的增殖、侵袭、转移和凋亡等。双荧光素酶报告基因检测实验证实,miR-141-3p 可以与EGFR 的3'UTR区域相互作用,通过靶向EGFR 调控AKT、FAK、Src 和MMP-9 蛋白的表达。
近年来,卵巢癌的手术和化疗方面取得了很大进展,但是耐药性仍然是治疗卵巢癌的巨大挑战。因此,发现一种新的治疗方法对降低耐药性具有重要意义。先前的研究表明,miR-141 有助于促进各种癌症的化学耐药性。它通过抑制真核起始因子4E(eukaryotic initiation factor 4E)引起肺癌或乳腺癌细胞的多西他赛和肝癌的5-FU 化学耐药性[23-24]。Han等[25]研究表明,在曲妥珠单抗耐药的细胞中,miR-141 降低了ERBB4 和p-AKT 的水平,并增加曲妥珠单抗耐药细胞的凋亡。本研究表明,miR-141-3p 可以通过靶向EGFR 增强卵巢癌细胞对一线化疗药物的敏感性,并且以miR-141-3p 为靶点治疗癌症已用于临床[26],因此,miR-141-3p 可能为卵巢癌的治疗提供一个潜在靶点。