心传导束相关特异性抗体制备及其在心脏疾病检测中的初步应用
2022-03-04张昕霞潘红阳毛峥嵘
任 帆 陆 辉 李 耀 张昕霞 潘红阳 毛峥嵘 周 韧△
(1 浙江大学医学院病理学与病理生理学系,病理学与法医研究所,杭州 310058;2 宜康(杭州)生物技术有限公司,杭州 310015;3 浙江大学司法鉴定中心,杭州 310058)
长期以来,窦房结、传导束一直缺少特异、有效的分子检测工具,导致相应的研究难以深入进行。多年来病理学和生物学界一直在寻找窦房结、传导束的形态学标志物和相关的特异性抗体,曾有报道过一些鼠抗[1],但由于特异性不够理想,至今未普及应用,而报道过的兔单抗则更少。本研究成功研发了抗心钠肽(natriuretic peptides A,ANP)兔单克隆抗体(ab225873),并用此抗体对临床应用进行了初步探讨,现报道如下。
1 材料和方法
1.1 检测样本
12 例正常大鼠,取心、肝、脾、睾丸、胰、结肠等6 种组织,每种组织2 例。大鼠购自浙江大学实验动物中心,符合浙江大学实验动物伦理标准。
22 例正常人标本,取11 种组织,包括肝、脾、肺、骨骼肌、扁桃体、乳腺、子宫、睾丸、甲状腺、胰、结肠,每种组织2 例;24 例病例人心组织(左心室肌、右心房肌)包含窦房结,每个病例选取2 个部位以上的心脏组织。标本来源于浙江大学病理学与法医研究所和浙江大学司法鉴定中心尸体解剖的人体组织(表1)。所有人体组织的获取均符合浙江大学医学院医学伦理学标准。
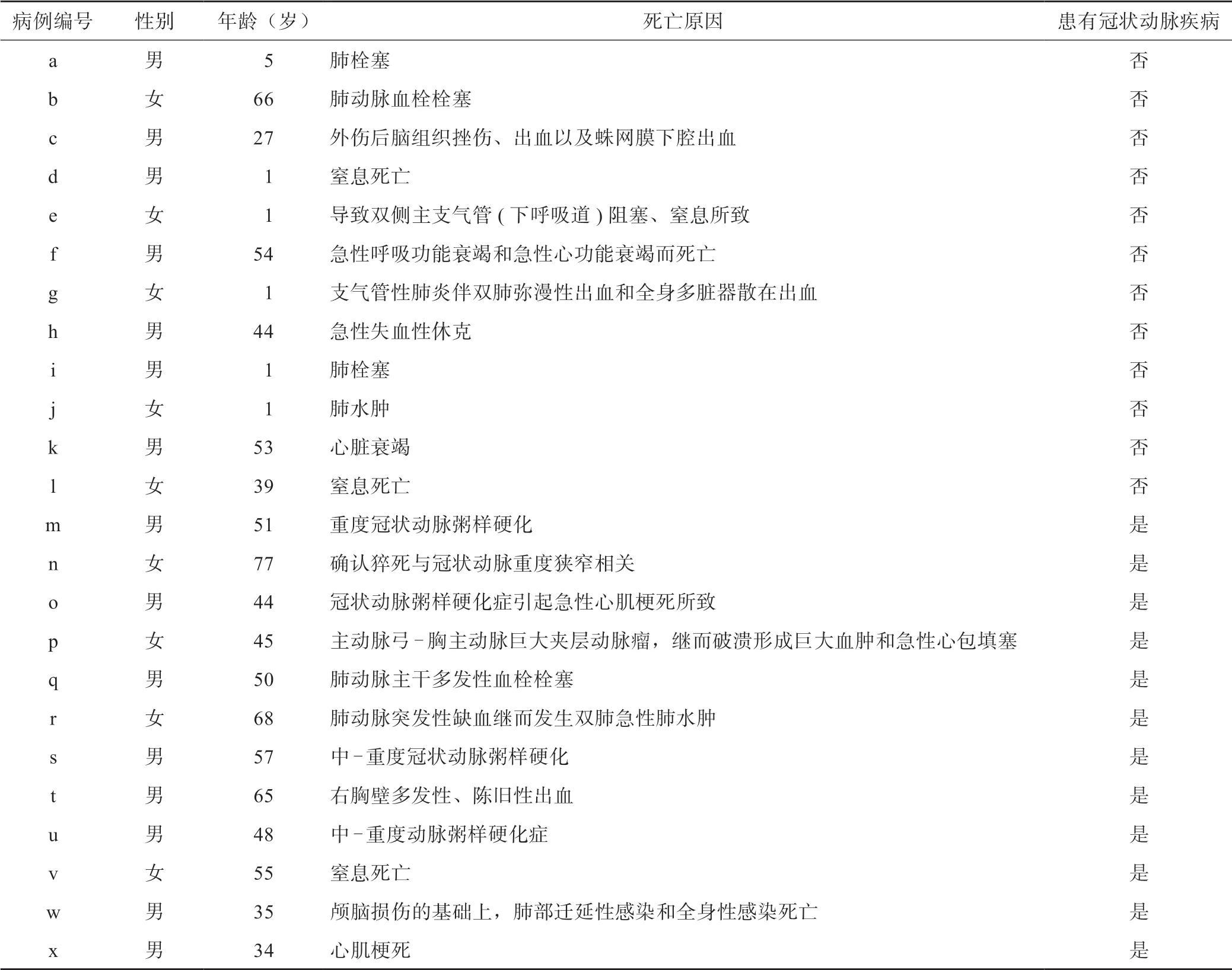
表1 24 例人心组织的临床病理资料
1.2 人心窦房结、左心室肌取材
按流水号选取尸体解剖病例24 例,排除窦房结、房室束的病变(如出血坏死等)。其中含12例冠状动脉疾病病例,12 例非冠状动脉疾病病例。病例由2 位高年资医生背靠背病理诊断。
右心房(含窦房结)取材参考《心脏传导系统病理图谱》《临床心脏构造学》《Forensic Medicine》[2-4]。主要解剖路径:左手示指从下腔静脉口伸入右心房,经腔静脉窦至上腔静脉口,顺左手示指外侧沿腔静脉窦(贴心房壁)长轴自上而下剪开,在右心房前侧距界沟1.0~1.5 cm 处,自下腔静脉断端向右心耳界嵴方向剪开。继续向前,剪至右心耳界嵴,从右心耳界嵴背后向前剪至尽头(近主动脉弓处),贴着心房壁剪断,取得组织块。
左心室(含传导束)取材如下:按常规心解剖,与室间隔长轴平行从房室间隔膜部前缘开始,每隔3 mm 切一刀直至房室间隔膜部后缘,可切2~4 刀。从第2 或第3 刀向下移1.5~1.8 cm 处,取约1.0 cm长条状左心室组织。而不带有传导束组织的心肌为不带有心内膜的深层心室肌。
1.3 实验动物和主要试剂
2月龄新西兰大耳白兔4 只,购自浙江省农科院。
ANP多肽由杭州中肽生化有限公司合成;完全弗氏佐剂和不完全弗氏佐剂购自Sigma公司;BCA试剂盒购自Pierce公司;羊抗兔IgG(#31460)和磷酸对硝基苯酯(PNPP)底物(#34045)购自Thermo公司;ECL化学发光试剂盒(RPN2106)购自GE Healthcore公司;酶底物显色剂(DAB)(DAB-1031)购自福州迈新生物技术开发有限公司。
1.4 抗体制备
首先将ANP 多肽与血蓝蛋白(KLH)交联,接着与等体积完全弗氏佐剂混合乳化,剂量为每只400 μg,免疫4 只新西兰大耳白兔,将皮下注射法对其进行初次免疫;之后每隔2 周,将等量的多肽与不完全弗氏佐剂混合乳化后,并免疫3 次,每次免疫剂量为每只200 μg。然后再间隔10 d,对4 只新西兰大耳白兔进行耳静脉采血,通过酶联免疫(ELISA)测定血清效价。
选取4 次免疫后血清效价最高的新西兰大耳白兔,将ANP 多肽和等体积的完全弗氏佐剂混合乳化,免疫量为每只400 μg,进行耳缘静脉注射加强免疫;12 d 后断头处死兔,无菌取脾,收集脾淋巴细胞,并与兔骨髓瘤细胞240E-W3 在PEG4000作用下融合。用含1% HAT 的完全RPMI-1640 培养液进行培养筛选,于融合后的第14 天进行换液处理;融合14 d 后用ELISA 方法筛选40 板96 孔板上清液,从每块96 孔板取效价最高的3 孔(共120孔)转至24 孔的深孔板培养,7 d 后再取上清液行ELISA 检测。选取ELISA 检测为阳性的克隆进行免疫印迹检测,再选取免疫印迹条带最清晰的克隆进行免疫组织化学检测,最终根据免疫组织化学特异性和敏感性选取最好的5 个克隆进入下一个阶段。克隆经有限稀释法建株,转瓶培养生产单克隆抗体,选择特异性最好的克隆作为本次实验抗体,并用液氮冷冻保存该单克隆细胞株,且将其分泌的抗体命名为ab225873。
1.5 ELISA 检测
使用1 μg/mL 的ANP 蛋白片段包被酶标板,每一板5 mL,抗原在板壁形成固相抗原,清洗后,去除没有结合的抗原和杂质。加入待检样品液,特异性的抗体会与固相抗原结合形成固相抗原抗体结合物,然后再次洗涤。加入辣根过氧化物酶标记的羊抗兔IgG(#31460,Thermos),洗涤后加PNPP显色(#34045,Thermos)15 min,最后使用2 mol/L 的硫酸终止反应,用酶标仪(BIORAD680,BIORAD 公司)读取结果,数值>0.3 则为阳性,读数越高,敏感度越强。
1.6 免疫印迹检测
将人和大鼠的心(包含窦房结和左心室)、脑、结肠、肝的组织裂解液用适量的含4% SDS 上样缓冲液超声提取总蛋白,用BCA 试剂盒(Pierce,23228)对蛋白样进行定量。采用每泳道20 μg 进行SDS-PAGE 电泳,电转移至PVDF 膜上,用含5%脱脂奶粉的Tri-HCl(pH7.2)室温封闭1 h。用含5%脱脂奶粉的Tri-HCl 溶液1∶1 000 稀释ANP(ab225873)和1∶10 000 稀释内参甘油醛-3-磷酸脱氢酶(GADPH)(Abcam,ab181602),室温孵育1 h。然后,用含5%脱脂奶粉的Tri-HCl溶液1∶5 000稀释辣根过氧化物酶(HRP)标记羊抗兔IgG(Thermo,#31460),室温孵育30 min。然后用ECL化学发光试剂盒(GE healthcore,RPN2106)显色液孵育5 min,暗室内X光胶片曝光。
1.7 免疫组织化学检测
制备人22 例正常组织、12 例正常大鼠组织以及24 例病例资料完整的人心组织(包含窦房结、左心室)的石蜡切片。组织切片经Histo-clear(National Diagnostics,SG HS-202)以及梯度乙醇溶液进行脱蜡、脱水处理后,对组织切片进行抗原修复(0.01 mol/L Tris-EDTA 溶液,pH9.0)。待其自然冷却至室温后,将切片浸泡于3%H2O2溶液10 min 以去除内源性过氧化物酶。再用山羊血清,室温封闭30 min。在组织切片上,滴加1∶4 000 稀释的anti-ANP(ab225873),4℃孵育过夜。然后,在组织切片上滴加HRP 标记羊抗兔IgG(Abcam,ab209101),室温孵育30 min。最后,用DAB(福州迈新生物技术开发有限公司,DAB-1031)显色,苏木精复染,TBST 返蓝冲洗后,复水,透明,封片。
2 结果
2.1 兔单克隆抗体制备
首先完成对新西兰大耳白兔的5 次免疫,静脉取血2 mL,检测ELISA 值,评估兔血清中ANP抗体的效价(表2)。取效价最高的兔1 的脾细胞与兔骨髓瘤细胞株240E 融合,合计40 块96 孔板,融合率达90%以上。然后通过ELISA、免疫印迹以及免疫组织化学的方法,筛选得到一株能够稳定分泌ANP 抗体的兔杂交瘤细胞,将抗体命名为ab225873。
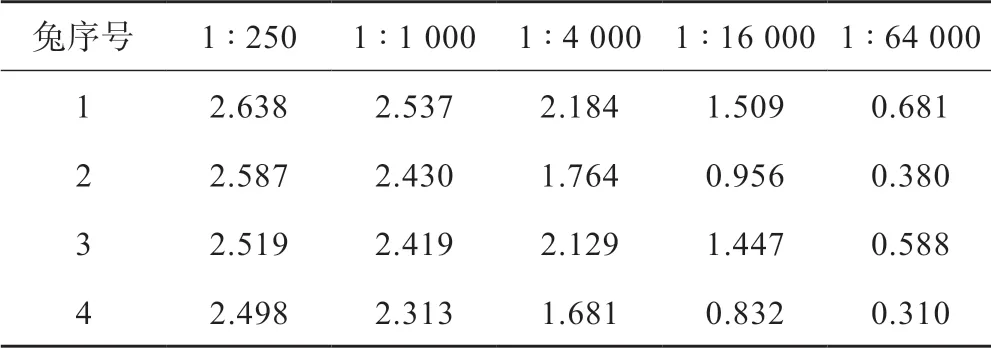
表2 免疫兔血清的ELISA 值
2.2 ANP 兔单克隆抗体在免疫印迹上的特异性鉴定
为了验证ANP 的特异性,首先采用免疫印迹检测该抗体在人组织裂解液中所识别的抗原分子量大小。结果显示,ANP 兔单克隆抗体(ab225873)特异表达于人心组织,条带大小为16 kD,而在人的其他组织,比如脾、结肠、肝的组织裂解液中均没有条带。使用相同的方式,测试该抗体在大鼠组织裂解液中的表达,免疫印迹检测结果显示在大鼠的心组织有特异性16 kD 的条带,而在大鼠的脾、结肠、肝组织裂解液中,均没有条带(图1)。
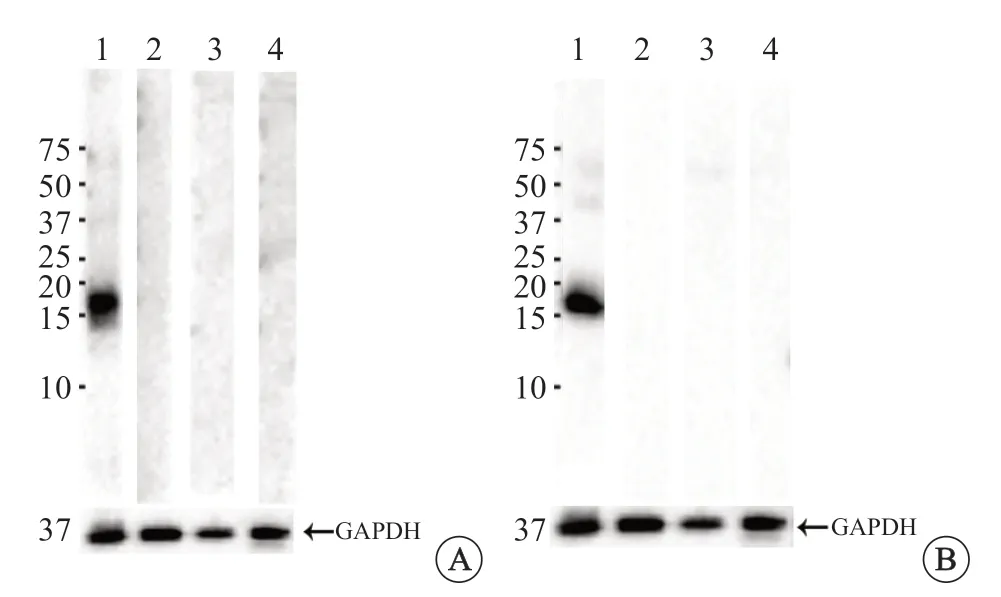
图1 ANP 兔单抗(ab225873)分别在人(A)和大鼠(B)的心、脾、结肠、肝裂解液中的免疫印迹检测结果
2.3 ANP 兔单克隆抗体的特异性免疫组织化学表达
免疫组织化学结果显示:ANP 兔单抗(ab225873)在大鼠左心室的传导束中特异性表达,而其他组织如肝、脾、睾丸、胰、结肠均不表达(表3,图2,见封三)。同时,ANP 兔单抗(ab225873)仅在部分人的左心室中的传导束特异性表达,呈颗粒状定位于细胞质内,如病例a、病例c、病例d(图3,见封三)。其他组织如肝、脾、肺、骨骼肌、扁桃体、乳腺、子宫、睾丸、甲状腺、胰、结肠均不表达(表4,图4,见封三)。

表3 ANP(ab225873)在大鼠组织中的免疫组织化学表达结果
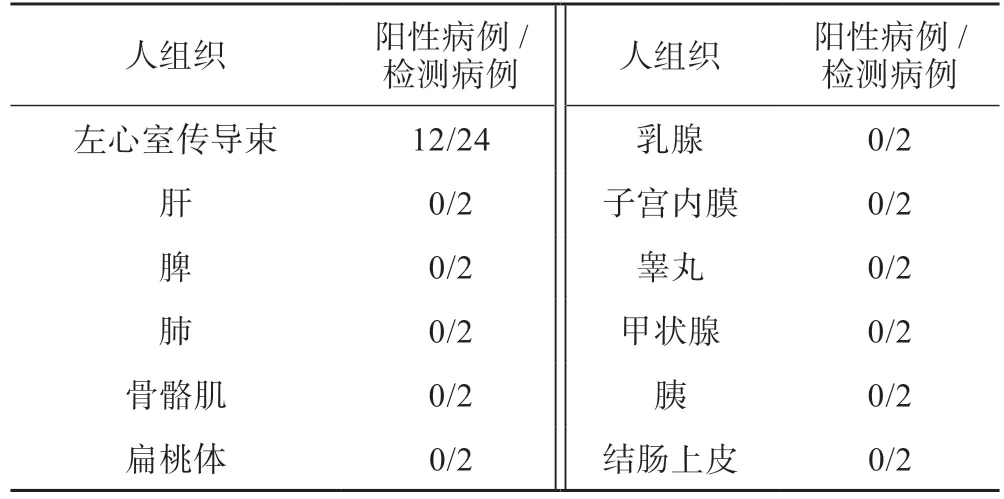
表4 ANP 兔单抗(ab225873)在人组织中的免疫组织化学结果

图2 ANP 在大鼠6 种组织中的表达情况,标尺=200 μm。A:左心室(↑示ANP 表达于传导束细胞);B:肝;C:脾;D:睾丸;E:胰;F:结肠.
图3 ANP 在左心室传导束上的表达情况。A1、B1、C1 分别为病例a、c、d 的左心室肌及左心室中传导束,H-E 染色,×10;A2、A3、B2、B3、C2 和C3 分别为病例a、c、d 左心室肌及左心室中传导束,免疫组织化学显色(↑为ANP 表达于传导束细胞)。A1、A2、B1、B2、C1、C2:标尺=200 μm;A3、B3、C3:标尺=50 μm.

图4 ANP 在人12 种组织中的表达情况,标尺=200 μm。A:左心室(↑示ANP 表达于传导束细胞);B:肝;C:脾;D:肺;E:骨骼肌;F:扁桃体;G:乳腺;H:子宫;I:睾丸;J:甲状腺;K:胰;L:结肠.
ANP 广泛表达在人的心房肌(病例a~f,图5,见封三)。为进一步探究ANP 在人心其他部位的表达情况,本研究分别选取24 例病例人心组织中窦房结(含窦房结动脉)和深层左心室肌(去掉心内膜,不含传导束组织)进行免疫组织化学显色,结果ANP 兔单抗(ab225873)表达于所有人心组织的窦房结,而不表达于心室肌。在研究中采用已知广泛表达心室肌的神经细胞黏附因子(NCAM1)抗体(ab133345)进行平行对照,以比较ANP 兔单抗(ab225873)在心室肌中阴性表达的真实性(图6,见封三)。

图5 ANP 在右心房肌的表达情况,标尺=200 μm。A~F 分别为病例a、b、c、d、e、f 右心房肌,免疫组织化学显色.
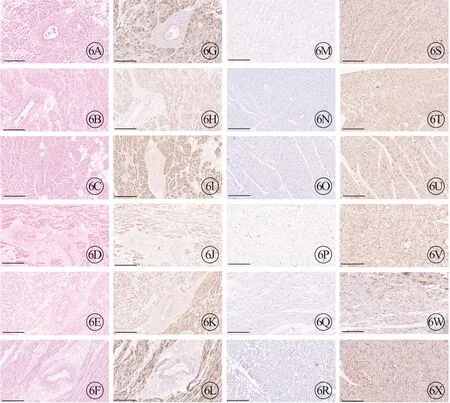
图6 ANP 在心窦房结、左心室肌的表达情况以及NCAM1 在左心室肌的表达情况,标尺=200 μm。A~F 分别为病例f、r、t、u、v、w 的窦房结组织,H-E 染色;G~L 和M~R 分别为病例f、r、t、u、v、w 的窦房结和左心室肌ANP 免疫组织化学显色,S~X 分别为病例f、r、t、u、v、w 的左心室肌NCAM1 免疫组织化学显色.
综合上述结果,ANP 在心组织的表达分布为:在右心房肌中ANP 阳性率100%(24/24),在窦房结中ANP 阳性率为100%(24/24),在左心室的传导束中,ANP 阳性率仅为50%(12/24),而左心室肌的阳性率为0(0/24),并且所有ANP 传导束阴性染色的病例,均为冠状动脉疾病病例。在24 例心室组织中,平行对照NCAM1 在左心室肌的阳性率为100%(24/24)(表5)。

表5 24 例心组织中ANP 和NCAM1 的表达情况汇总
3 讨论
ANP 是一种由心细胞分泌的利钠肽激素[5],功能是通过增加肾钠的排泄来减少细胞外液的体积。市面上ANP 鼠抗大多数没有特异性的表达在心组织,并且在心室肌上有很强的非特异性染色,要求抗体的工作浓度高[6]。如今市面上特异性的ANP 兔单抗非常少[7],本研究制备的兔单克隆抗体在组织水平上,不仅特异性表达在心,且心室肌阴性,工作浓度仅需0.2 μg/mL,有非常好的敏感性与特异性。现已有文献证明,兔单克隆抗体具有以下优点:①兔单克隆抗体具有较高的亲和力;②兔和小鼠来源的抗体对同一种抗原可能会识别不同的表位;③兔的脾更大,可以产生更多的脾细胞进行融合实验;④相对于小鼠杂交瘤细胞,兔杂交瘤细胞适用于高密度培养,细胞的传代间隔时间较短,且可筛选到更多单克隆抗体[8]。
ANP 表达在心组织,分子量为16 kD[9]。免疫印迹检测结果显示,兔单抗(ab225873)在人和大鼠的心组织有16 kD 的特异性条带,在其他组织中无条带。心正常的节律跳动,受神经系统的调控。目前报道较多的是ANP 主要表达在人的心房肌组织[10],本研究使用免疫组织化学的检测方法,分析ANP 在人心组织中的表达情况,证明ANP 特异表达于人心组织的右心房(100%),窦房结(100%)、左心室的传导束(50%),不表达在心室肌,也不表达于人的其他正常组织。在本次研究中,为了比较ANP(ab225873)的表达情况,本研究设计了以NCAM1 抗体(ab133345)作为平行对照。NCAM1参与心肌细胞间的相互作用,且广泛表达在心肌组织中[11]。使用NCAM1 作为阳性对照,用相同免疫组织化学的方法染色24 例人心组织,结果显示NCAM1 在人心组织的左心室肌阳性率为100%。使用2 个抗体进行平行试验,可以证实ANP 特异性表达在左心室传导束,不表达在左心室肌。在大鼠组织中,ANP 同样特异性表达于左心室传导束,其他组织如大鼠的肝、脾、睾丸、胰、结肠组织均不表达。
多年来研究者无法找到特异性的窦房结-传导束标记,它是导致窦房结-传导束相关疾病(如心律失常)的形态学研究处于瓶颈的关键原因之一[13]。即便近年来一直在进行研发窦房结-传导束免疫标记的研究工作,相关抗体仍少有报道,且因其特异性不佳而不能被普及应用。ANP 兔单抗(ab225873)在心组织的窦房结、左心室传导束表达阳性,心室肌表达阴性,且在其他组织表达均为阴性,因此该抗体已具备较好的窦房结-传导束特异性,可能可以作为窦房结-传导束的免疫标志物应用于临床。
心传导异常通常表现为电流脉冲在心传导系统的任何部位的传导发生增速、减慢或者阻滞,它不仅常发生于心传导系统疾病中,如各种心律失常性心脏病,也可以发生于非传导系统心脏疾病中,如冠状动脉疾病、高血压性心脏病等疾病的并发症[14-15]。本研究分析了24例病例人心组织,其中呼吸系统疾病导致死亡的比例占33%,心血管系统疾病导致死亡的比例占54%,其他疾病导致死亡占的比例为13%。结果表明左心室传导束ANP表达阴性(排除出血坏死等病变)的患者,均患有不同程度的冠状动脉疾病,吻合率达100%;而左心室传导束ANP表达阳性的患者,病理学诊断均没有患冠状动脉疾病。故ANP表达(阳性/阴性)与冠状动脉疾病的关联性仍需要增加更多的病例验证来进一步明确。
综上所述,ANP 单克隆抗体(ab225873)有望作为窦房结-传导束的一种分子标志物。考虑到本研究心组织病例样本量并不大,希望今后收集更多的尤其是心律失常的病例,进一步分析研究ANP在传导束相关疾病中的作用。