短暂缺氧对3日龄SD大鼠海马胰岛素受体和β-catenin及NeuroD1表达的影响*
2022-03-04林如英周小敏徐伟伟徐剑文
林如英 周小敏,2 徐伟伟 郭 玮 王 玲 林 凌 王 玮 徐剑文△
(1 福建医科大学基础医学院人体解剖学系,福建医科大学临床应用解剖学研究室,脑老化与神经变性疾病福建省高校重点实验室,福州 350122;2 厦门医学院基础医学部人体解剖学与组织学胚胎学教研室,厦门 361023;3 福建医科大学公共技术中心,福州 350122)
当前我国三胎政策全面开放,高龄孕产妇增多,早产的发生率逐年升高。早产往往伴随着围生期缺氧[1-2],各种围生期窒息引起的部分或完全缺氧、脑血流减少或暂停而导致胎儿或新生儿脑损伤称为缺氧缺血性脑损伤(hypoxic-ischemic brain damage,HIBD)[3-4]。早期临床上常见的治疗措施为控制惊厥、治疗脑水肿、亚低温治疗、高压氧等对症治疗[5],但是仍旧缺乏有效的对因治疗方法。近年来有研究表明胰岛素与受体结合后能对缺血缺氧性脑损伤起到一定的修复作用[6]。本研究以短暂缺氧3日龄SD 大鼠为模型,探讨胰岛素受体在缺氧条件下的表达,以及缺氧调控其表达的机制,以期为临床治疗早产儿围生期缺氧性脑损伤提供理论依据。
1 材料和方法
1.1 实验动物
清洁级SD大鼠雄鼠 12 只、雌鼠24 只,体质量(220±20) g,由福建医科大学实验动物中心提供[许可证号:SCXK(闽)2016-0002]。大鼠置于鼠笼常规适应性喂养 1 周,雌雄2∶1 合笼,母鼠受孕,待其生产后,取3 d SD 大鼠,雌雄随机。
1.2 主要试剂
牛血清白蛋白(BSA)(碧云天生物技术研究所);active-β-catenin兔抗大鼠单克隆抗体(美国Cell-Signaling);NeuroD1山羊抗大鼠多克隆抗体、胰岛素受体小鼠抗大鼠单克隆抗体(美国Santa-Cruz);DAPI(北京索莱宝生物科技有限公司);Dylight488驴抗兔 IgG H&L、Dylight550驴抗小鼠 IgG H&L、Dylight650驴抗山羊 IgG H&L(美国Abcam)。
1.3 动物缺氧模型建立
改良陈惠金等[7]、王琍琍等[8]的方法,有机玻璃缺氧箱内通入8%O2+92%N2混合气体,3日龄SD 大鼠在缺氧箱内缺氧2 h 后移出,室温环境下恢复15~20 min 后返还至母鼠身边(模型组)。对照组将3日龄SD 大鼠置于有机玻璃缺氧箱内2 h,不通入混合气体。
1.4 免疫印迹检测active-β-catenin、NeuroD1、胰岛素受体的表达
模型组与对照组大鼠分别于建模后 2、4、24 h断头取脑,冰上裂解提取组织蛋白。BCA 法检测各组蛋白质浓度,等质量蛋白上样。SDS-PAGE 电泳后用湿转法将蛋白质转到PVDF 膜上,5% BSA溶液室温封闭1.5 h,分别加入一抗active-β-catenin兔抗大鼠单克隆抗体(1∶1 000)、NeuroD1 兔抗大鼠单克隆抗体(1∶1 000)、胰岛素受体兔抗大鼠单克隆抗体(1∶1 000)、β-actin 小鼠抗大鼠抗体(1∶1 000) 4 ℃孵育过夜,加入二抗HRP 标记的山羊抗兔IgG(1∶5 000)、HRP 标记的山羊抗小鼠IgG(1∶5 000)室温孵育 2 h。凝胶成像系统采集图像。用Image J 对图像进行灰度值统计分析。
1.5 免疫荧光检测active-β-catenin、NeuroD1、胰岛素受体的表达
模型组与对照组大鼠分别于建模后2、4、24 h断头取脑,修块后置于4%多聚甲醛溶液固定,4℃ 24 h,梯度脱水,冷冻切片机以视交叉为界进行连续冠状切片,片厚5 μm。10% BSA 室温封闭30 min,分别加入active-β-catenin 兔抗大鼠(1∶100)、Neuro D1 山羊抗大鼠(1∶100)、胰岛素受体小鼠抗大鼠(1∶200)抗体混合液,室温孵育30 min 后4℃过夜。分别加入二抗混合液[Donkey-anti-Rabbit IgG H&L(Dylight®488)、Donkey-anti-goat IgG H&L(Dylight®650)、Donkey-anti-mouse IgG H&L(Dylight®550)1∶500],避光孵育1.5 h。滴加DAPI,防荧光猝灭剂封片,Leica SP8 激光共聚焦显微镜下摄片。
1.6 统计学处理
应用SPSS 20.0 软件进行统计分析。所有数据经过方差齐性检验和正态性检验,计量资料以±s表示,组间比较采用方差分析,两两比较采用LSD-t检验。P<0.05 为差异有统计学意 义。
2 结果
2.1 2 组大鼠海马组织active-β-catenin、NeuroD1、胰岛素受体表达量比较
免疫印迹结果(图1)显示,缺氧后2 h,模型组与对照组active-β-catenin、NeuroD1、胰岛素受体蛋白表达量差异均无统计学意义;缺氧后4 h,模型组active-β-catenin 和NeuroD1 的表达量增高,差异有统计学意义(P<0.05),而胰岛素受体表达量差异无统计学意义;缺氧后24 h,模型组activeβ-catenin、NeuroD1 和胰岛素受体蛋白表达量均增高,差异有统计学意义(P<0.05)。
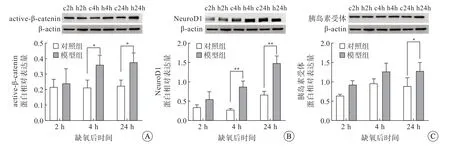
图1 大鼠海马组织active-β-catenin(A)、NeuroD1(B)、胰岛素受体(C)表达情况,免疫印迹
2.2 2 组大鼠海马组织active-β-catenin、NeuroD1、胰岛素受体表达部位比较
免疫荧光染色结果显示,与对照组比较,缺氧后2 h,模型组active-β-catenin、NeuroD1、胰岛素受体蛋白荧光强度无明显差别;active-β-catenin 和NeuroD1 蛋白主要分布于细胞质中,但在CA1 区中仍有少量分布于细胞核中,与细胞核存在共定位现象;而胰岛素受体既分布于细胞核中,又在细胞质中可见,并且CA1 区中胰岛素受体细胞核内含量较DG 区高。
缺氧后4 h,模型组active-β-catenin、NeuroD1蛋白CA1区和DG区的荧光强度均有增高;activeβ-catenin 蛋白主要分布于细胞质中;对照组NeuroD1 蛋白主要位于CA1 区和DG 区细胞质中,但模型组NeuroD1大量分布于CA1 区和DG 区细胞核中;而胰岛素受体蛋白荧光强度无明显差异,基本分布于细胞质中(图2A)。
缺氧后24 h,active-β-catenin、NeuroD1、胰岛素受体蛋白荧光强度均增高,其中active-βcatenin 蛋白在模型组CA1 区和DG 区内的荧光强度明显高于对照组,且蛋白主要分布于细胞质内;NeuroD1 蛋白在模型组CA1 区和DG 区内的荧光强度高于对照组,且DG 区荧光强度高于CA1 区,主要分布于细胞核内;模型组胰岛素受体蛋白荧光强度高于对照组,也主要分布于细胞核内(图2B)。

图2 缺氧后4 h(A)、24 h(B),大鼠海马组织active-β-catenin、NeuroD1、胰岛素受体表达情况,免疫荧光染色,标尺=50 μm
3 讨论
临床上早产儿发生围产期缺氧的概率比足月儿高,虽然现代化的医疗技术能提高早产儿的存活率,但是目前围产期缺氧给早产儿带来的脑损伤仍无较好的根治方法[9-10]。本研究探讨短暂缺氧对海马胰岛素受体的影响,以期通过基础实验数据为临床治疗提供新的思路。
经典Wnt 信号途径是细胞内的重要调节机制之一,能够参与许多下游靶基因的表达,并由此调控细胞增殖、分化、凋亡及迁移[11]。最近研究表明,在成年鼠下丘脑中Wnt3a 通过经典的Wnt3a/β-catenin 信号通路 上调NeuroD1 促进胰岛素受体表达[13]。Wnt3a 与细胞膜上的LRP 和Frizzed 受体结合激活经典的的Wnt 通路。GSK3 可使β-连环蛋白(β-catenin)磷酸化并诱导其降解;而Wnt3a 入胞抑制GSK3 的活性,使β-catenin 去磷酸化而活化。活化的β-catenin 进入细胞核中,与T 细胞转录因子结合,增强NeuroD1 的表达。上调的NeuroD1 也转移到细胞核中,刺激胰岛素的产生[12-13]。
本研究免疫印迹结果显示,缺氧后2 h,模型组active-β-catenin、NeuroD1、胰岛素受体蛋白表达较对照组均无明显差异,可能由于轻度缺氧后机体的应激性反应无法短时间内完全出现[14],此时主要体现为细胞的氧感受器被激活,使体内各种低氧敏感基因表达上调,从而促使细胞适应低氧环境[15]。
缺氧后4 h,模型组active-β-catenin 和NeuroD1的蛋白表达量有所升高,胰岛素受体蛋白无显著变化。Active-β-catenin 作为Wnt 通路中的关键因子,出现缺氧后表达增高的现象,推测缺氧可能激活了Wnt 通路,同时抑制了β-catenin 蛋白的磷酸化,使得β-catenin 蛋白的非磷酸化程度上升,为后续靶基因的调控作准备。NeuroD1 是碱性螺旋一环一螺旋(basic Helix-loop-Helix,bHLH)家族成员之一,能促进神经元提前分化[16]。缺氧后4 h,模型组NeuroD1的蛋白表达量增高,推测短暂轻度缺氧激发机体的自我保护机制,高表达的NeuroD1能加快未成熟神经元分化速度,更新受损神经元,减轻缺氧给中枢神经带来的损伤,起到代偿作用。胰岛素受体作为胰岛素功能体现的载体,缺氧后4 h蛋白无显著变化,可能其蛋白量的变化有一定的滞后性。
缺氧后24 h,模型组active-β-catenin、NeuroD1和胰岛素受体蛋白表达量均增高,推测增高的3 组目的蛋白仍旧起到代偿缺氧引起的脑损伤的作用,缺氧对Wnt/β-catenin/NeuroD1 信号通路及胰岛素受体的表达产生影响。
Zhang 等[17]报道宫内缺氧导致新生鼠海马组织内Wnt3a 表达上调。本研究免疫荧光染色结果与免疫印迹结果趋于一致:缺氧后2 h,activeβ-catenin 和NeuroD1 主要分布于细胞质内,胰岛素受体在细胞质和细胞核内均可见。缺氧后4 h,active-β-catenin 蛋白在细胞质内大量积聚,NeuroD1 作为β-catenin 的下游靶基因在细胞核内蛋白表达量增高,而胰岛素受体基本分布于细胞质。缺氧后24 h,NeuroD1 在细胞核内的含量持续增高,且胰岛素受体可见大量分布于细胞核中。蛋白在细胞质与细胞核内含量的变化提示新生鼠海马中可能有某一特定的转导通路在缺氧条件刺激下对机体的能量代谢和神经再生做出相关调控。推测缺氧激活了Wnt/β-catenin 途径,并且激活方式为上调通路中的关键因子。
中枢神经内,胰岛素/胰岛素受体在糖代谢这一生理活动中发挥重要作用[18-19]。胰岛素受体作为胰岛素发挥功能的载体,在缺氧后24 h 蛋白表达量增高,并且主要分布于细胞核内,在缺氧后表达量非但没有减少,反而出现了增加的现象。徐蔚海[20]报道3-NP 急性化学性缺氧后的12 h 内,小鼠纹状体胰岛素受体会出现先减少后增高的现象,本研究结果与之相 似。
综上,短暂缺氧后Wnt/β-catenin/ NeuroD1 可能参与胰岛素受体的表达,但是具体调控机制尚不明确,若进一步使用Wnt/β-catenin/ NeuroD1 通路的抑制剂或增强剂探讨胰岛素及其受体表达的变化,可能有助于深入理解Wnt/β-catenin/ NeuroD1通路对胰岛素受体表达的调控。