彩色稻叶片光合特征及其与抗氧化酶活性、花青素含量的关系
2022-03-04陈婷婷符卫蒙余景奉保华李光彦符冠富陶龙兴
陈婷婷,符卫蒙,余景,奉保华,李光彦,符冠富,陶龙兴
彩色稻叶片光合特征及其与抗氧化酶活性、花青素含量的关系
陈婷婷,符卫蒙,余景,奉保华,李光彦,符冠富*,陶龙兴*
中国水稻研究所水稻生物学国家重点实验室,杭州 310006
【目的】近年来,彩色稻因其独特的外观和特殊的营养价值在观光农业和专用营养大米产业中快速发展。本研究旨在阐明彩色稻叶片光合作用对光的响应机理。【方法】以4个叶色不同的水稻品种,包括深紫叶(deep purple,DP),淡绿叶(pale green,PG),深绿叶/常规叶色(dark green,DG)及淡紫叶(pale purple,PP)为材料,研究不同叶色叶片光合作用的变化特征,并揭示其作用机制。【结果】深紫叶水稻叶片叶绿素、类胡萝卜素含量最高,其次分别是深绿叶及淡紫叶水稻品种,而淡绿叶水稻叶片叶绿素、类胡萝卜素含量最低。淡绿叶水稻叶片实际光量子效率(PSII)、净光合速率、核酮糖-1,5-二磷酸羧化酶(Rubisco)活性和干物质积累量最高,显著高于其他品种,但其过氧化氢和丙二醛含量显著低于其他叶色水稻品种。深紫叶与深绿叶水稻叶片叶绿素、类胡萝卜素含量没有显著性差异,但深紫叶水稻叶片PSI和PSII实际荧光量子效率、净光合速率、Rubisco活性均显著高于深绿叶水稻。相应地,深紫叶水稻叶片抗氧化酶活性显著高于深绿叶水稻,但其过氧化氢和丙二醛含量显著低于深绿叶水稻,推测与深紫叶水稻叶片花青素含量显著高于深绿叶水稻有关。外源喷施花青素试验进一步证实了这个假设,即外源花青素可一定程度上降低过氧化氢含量,提高叶片光合速率。【结论】花青素可减轻自然条件下光量子过剩对水稻叶片光合作用的抑制,研究结果可为水稻高光效育种及彩色稻产量、品质协同提高栽培技术研发提供理论基础。
彩色水稻;叶绿素;光合作用;抗氧化力;花青素
0 引言
【研究意义】近年来,随着生活水平的提高,在基本满足人们生活需要的基础上,景观水稻及优质稻米正成为未来水稻生产的重要发展方向[1-2]。由于色素含量的差异,彩色稻叶片、茎杆或籽粒具有特殊紫色、黑色、红色等色泽,因而广泛应用于观光农业。此外,彩色稻大米富含氨基酸、维生素、锌、硒等物质,可作为功能性大米进行开发应用[3]。虽然彩色稻受到的关注日趋增加,但目前相关研究较少,尤其在光适应方面。研究不同叶色水稻叶片光合作用的变化特征及其作用机制,对指导彩色稻种质资源挖掘及相应栽培技术研究具有重要意义。【前人研究进展】光合作用是水稻生长发育的基础,决定干物质积累、产量及品质的形成。众所周知,叶绿素是植物进行光合作用的主要色素,类胡萝卜素作为辅助色素同样在光合作用形成中发挥重要作用[4]。研究表明,自然光照条件下也存在光量子过剩的现象[5]。光能过剩导致单线态氧、超氧阴离子等强氧化剂的产生,诱导气孔关闭,增加核酮糖-1,5-二磷酸羧化酶(Rubisco)对氧的亲和性,抑制Rubisco羧化能力,导致光呼吸增加而消耗大量能量(ATP及NADPH)。此外,烟云雨等因素造成光的波动可严重影响植物叶片光合作用的形成[6],其中原因主要在于与碳固定相关的酶活性下降。总体而言,叶色越深,叶绿素含量越高,吸收的光量子越多,光量子过剩造成光抑制可能性越大。彩色稻与传统常规水稻最大不同主要表现在叶色上,其中淡绿色叶及紫色叶较为常见。不同彩色稻叶片叶绿素含量差异较大,对光能的利用也不尽相同,存在明显的品种间差异。研究表明,淡绿叶水稻叶绿素含量明显低于正常叶色水稻,但不会影响到净光合速率的形成,甚至还有所增加,尤其在夏季高温高光照的长江中下游稻区[4-5, 7-8]。此外,王丹英等[9]的研究表明,与正常叶色的水稻相比,淡绿叶水稻品种生育后期叶片不易发生早衰,具有较高增产潜力。紫色叶水稻花青素含量比较高,而花青素与生物体抗氧化活性密切相关。有研究认为,高温、缺氮或遮阴处理下对照品种花青素含量及其代谢途径相关基因表达显著下调,而黑米突变体对环境胁迫的氧化损伤有较好的抵御作用[10]。【本研究切入点】目前有关紫色稻叶片光合作用变化特征方面的研究较少,花青素在光适应中的作用还有待阐明。【拟解决的关键问题】本研究以4个叶色不同的水稻品种为材料,研究不同叶色水稻叶片光合作用变化特征及其对干物质积累的影响,明确花青素影响光合作用形成与抗氧化能力之间的关系。
1 材料与方法
1.1 供试材料与种植状况
本试验分别于2018年5—9月及2019年5—10月在中国水稻研究所富阳基地进行。供试品种为4个叶色不同且生育期相近的粳型彩色稻,即深紫叶(deep purple,DP)、淡绿叶(pale green,PG)、深绿叶/常规叶色(dark green,DG)及淡紫叶(pale purple,PP)(表1)。种子由中国水稻研究所稻作逆境与调控研究课题组提供,4个品种均未进行品种区试审定,在本研究中均以叶色命名。
盆栽塑料桶高20 cm,内径20 cm,定量装入经风干粉碎混匀后的稻田黏壤土5 kg。该土壤有机质含量36.2 g·kg-1,全氮2.80 g·kg-1,全磷0.60 g·kg-1,全钾21.3 g·kg-1,碱解氮228 mg·kg-1,铵态氮9.5 mg·kg-1,速效磷23.6 mg·kg-1,速效钾65 mg·kg-1,pH为6.5。种子于恒温箱30℃浸种48 h,随后于37℃度下催芽24 h,萌发的种子直接播种于盆中。盆栽水稻于具有自然光照条件的人工气候室(浙江求是人工环境有限 公司)中培养,温度及相对湿度分别设置为30℃/25℃(昼/夜)及70%。于秧龄25 d(3叶期)挑选长势均匀的3株秧苗移栽至塑料桶,移栽前每盆施入5 g复合肥(有效成分含量>45%,N﹕P2O5﹕K2O= 14﹕16﹕15)做基肥。分蘖始期(约移栽后10 d左右)每盆追施尿素0.5 g(总氮含量>46.4%),钾肥0.2 g(K2O含量>46.4%);穗分化始期(约移栽后35 d左右)再次每盆追施尿素0.5 g。除分蘖末期排水控干水分外(持续时间约一周),整个生育期保持1—2 cm浅水层,水分管理及病虫草害防治参照常规大田生产。

表1 供试水稻品种的生育期
DP:深紫叶;PG:淡绿叶;DG:深绿叶/常规叶色;PP:淡紫叶。下同 DP: deep purple; PG: pale green; DG: dark green; PP: pale purple. The same as below
1.2 试验设计
本试验不同叶色水稻品种间光合作用差异及其机理分析设计为单因素(品种)随机区组试验,每处理10盆重复。为进一步揭示花青素在叶片光合作用形成中的作用,2019年分蘖期(移栽后20 d左右)外源喷施0.05%(m/v)花青素溶液。裂区设计,以品种为主区,外源药剂喷施为副区。喷清水为空白对照,且均加入0.1%(v/v)吐温-20作为表面活性剂,每处理3盆重复。喷施后第2天,测定水稻叶片净光合速率及过氧化氢含量。
1.3 测定项目及方法
于水稻分蘖期,测定叶片净光合速率及叶绿素荧光参数,取样测定干物质积累量以及抗氧化酶活性等与光合作用相关生理指标。成熟期选取代表性植株4盆,考察株高、穗长等农艺性状,并调查穗数、每穗粒数、结实率及粒重。
1.3.1 净光合速率及叶绿素荧光 采用美国Li-Cor 6800便携式光合仪测定顶部最新完全展开叶的净光合速率[11]。设定的测定参数为:光照强度1 500 μmol·m-2·s-1,CO2浓度 400 μmol·mol-1,叶面积为6 cm2,气流为500 μmol·s-1,温度为30℃。叶绿素荧光参数采用德国Walz公司的Dual-PAM-100叶绿素荧光仪测定[12]。选取水稻顶部最新完全展开叶,遮光30 min后进行测定,测定的参数分别为最大荧光量子效率(v/m),光合系统PSI和PSII的实际荧光量子效率。
1.3.2 叶绿素、类胡萝卜素含量 称取0.1 g新鲜水稻叶片,剪碎后于20 mL 95%乙醇提取48 h至叶片完全褪色,随后采用日本岛津公司UV-4802型分光光度计测定波长为663 nm、645 nm和470 nm处吸光值。叶绿素a、叶绿素b、叶绿素a+b含量采用Arnon的方法[13]测定。类胡萝卜素含量测定参照Wellburn的方法[14]。
1.3.3 Rubisco活性 称取0.2 g液氮速冻过的水稻叶片,剪碎后加入2 mL 0.1 mol·L-1磷酸盐缓冲液进行研磨。随后提取的粗酶液离心5 min,转速为13 000×。Rubisco活性参照试剂盒说明进行测定(上海酶联生物科技有限公司)。
1.3.4 抗氧化酶活性、丙二醛及过氧化氢含量 称取0.2 g液氮速冻后的水稻叶片样品置于预冷的研钵中,加入2 mL 50 mmol·L-1预冷的磷酸缓冲液(pH 7.8)在冰浴上研磨成匀浆,转入离心管中在4℃、12 000×下离心20 min,上清液即为酶液。按比色法[15]测定过氧化物酶(POD)和过氧化氢酶(CAT)活性,用NBT光化还原法[16]测定超氧化物歧化酶(SOD)活性。称取1 g液氮速冻后的水稻叶片样品并剪碎,加入2 mL 10%三氯乙酸和少量石英砂,研磨至匀浆。再加8 mL三氯乙酸进一步研磨,匀浆在4 000×离心10 min,上清液为样品提取液。参照赵世杰等[17]的方法测定丙二醛(MDA)含量。参照Brennan等[18]的硫酸钛比色法测定水稻叶片中过氧化氢的含量。
1.3.5 花青素含量 0.1 g新鲜水稻叶片样品剪碎加入10 mL 0.1mol·L-1盐酸乙醇,60℃水浴浸提30 min。冷却将上清液倒入25 mL容量瓶,样品中再加入5 mL盐酸乙醇,继续浸提15 min。冷却合并上清液,再重复提取15 min,总共提取3次。合并上清液定容至25 mL,并于530 nm、620 nm、650 nm处测定吸光度。花青素含量(nmol·g-1)=(OD530-OD620)-0.1(OD650-OD620)。
1.3.6 干物质积累 选代表性水稻植株3盆,取地上部并分为叶片和茎鞘,于烘箱中80℃烘干至恒重,并称重。
1.4 统计分析
试验数据采用Excel和SPSS11.5软件进行统计分析。使用LSD多重比较法进行方差分析,比较处理间在<0.05水平上的差异。年度间的数据差异趋势基本一致,故以2019年的数据为主。
2 结果
2.1 不同叶色水稻产量及农艺性状差异
4个不同叶色水稻中,以PG产量最高,其次为PP,两者间没有显著性差异,但DG产量显著低于其他3个品种。与DG相比,DP、PG和PP产量分别增加11.3%、27.7%和22.3%。在产量构成方面,品种间的穗数和结实率没有显著差异,而PG和PP每穗粒数显著高于DP和DG。此外,DG粒重也显著低于其他3个品种(表2)。
水稻成熟期籽粒颜色与叶色稍有不同,DP籽粒颜色偏浅色,其他3个品种则均为深紫色(图1-a、b)。PG和PP两品种成熟期株高显著高于DP和DG,平均增幅为6.0%(图1-a、c)。PG穗最长,依次比DP、DG和PP增加16.4%、27.9%和33.0%(图1-b、d)。
2.2 不同叶色水稻叶绿素含量差异
由图2可知,4个水稻品种叶色差异较大,其对应的叶绿素及类胡萝卜素含量也不同。总叶绿素和类胡萝卜素含量均以DP最高,分别比DG高7.7%和5.0%,但差异不显著。PG总叶绿素和类胡萝卜素含量显著低于其他品种,分别比DP低59.1%和49.4%(图2-c、d)。然而,PG叶绿素a与叶绿素b比值显著高于其他3个品种,平均增幅约38.2%(图2-c)。

(a)成熟期植株表型;(b)穗型;(c)株高;(d)穗长。DP,深紫叶;PG,淡绿叶;DG,正常叶;PP,淡紫叶。柱上不同字母表示品种间差异显著。下同

表2 不同叶色水稻品种的产量及其构成
不同字母表示同一栏不同品种间在<0.05水平上差异显著
Values followed by different letters within the same column and the different varieties are significantly different at<0.05

(a)分蘖期生长表型;(b)叶片表型;(c)叶绿素含量;(d)类胡萝卜素含量。Chl:叶绿素
2.3 不同叶色水稻叶绿素荧光特性分析
图3所示,不同叶色水稻叶片最大荧光量子效率差异不显著,但实际荧光量子效率存在品种间差异。DP、PG及PP叶片PSI实际荧光量子效率没有显著性差异,但均显著高于DG,增幅分别为29.08%、21.63%和24.78%(图3-b)。然而,PSII实际荧光量子效率以PG最高,与PP没有显著性差异,但显著高于DP和DG,增幅分别为15.43%和81.22%(图3-c)。
2.4 不同叶色水稻干物质量、净光合速率及Rubisco活性差异
由图4-a可看出,淡绿叶PG干物质量最高,显著高于其他品种,分别比DP、DG和PP高36.44%、48.82%和27.17%;其次为PP和DP,二者间干物质重没有显著差异;而深绿叶DG干物质重最低,与DP没有显著差异,但显著低于PG和PP。叶片净光合速率和Rubisco活性的变化趋势与干物质量比较一致,均以PG最高,
其次分别为PP及DP,而DG最低(图4-b、c)。
2.5 不同叶色水稻抗氧化酶活性差异
图5所示,水稻叶片抗氧化酶活性包括SOD、POD和CAT,均以DG最低,而DP或PG最高;在SOD上,DP最高,其次为DG,品种间差异不大,但显著高于其他品种。DG叶片SOD活最低,分别比DP、PG和PP低43.41%、23.0%及15.64%(图5-a);DG叶片POD活性分别比DP、PG和PP低16.88%、22.59%和8.27%,而其他3个品种间的POD活性差异不大(图5-b);DP叶片CAT活性最高,但与PG和PP相比,没有显著差异。DG叶片CAT活性最低,分别比DP、PG和PP低36.04%、19.35%及21.0%(图5-c)。

图3 不同叶色水稻叶片叶绿素荧光参数
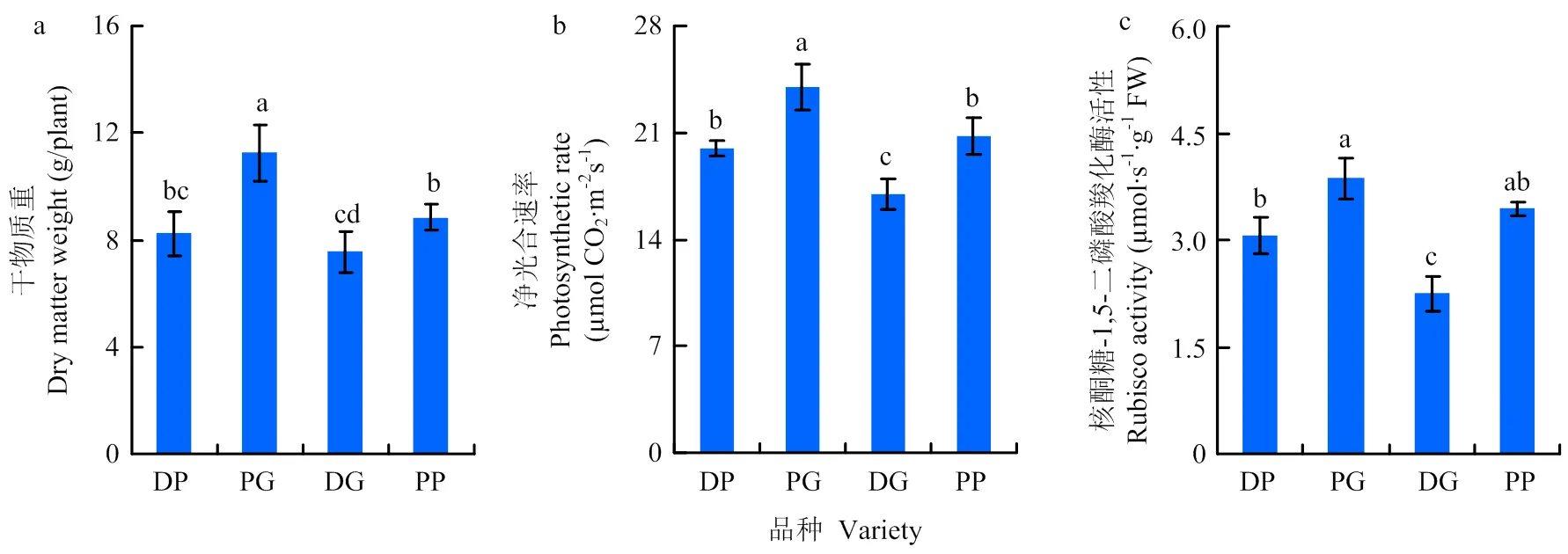
图4 不同叶色水稻干物质积累及叶片光合作用

图5 不同叶色水稻叶片抗氧化酶活性
2.6 不同叶色水稻过氧化氢及MDA含量差异
不同叶色水稻叶片过氧化氢及MDA含量变化趋势基本一致(图6)。由图可看出,深绿叶品种DG叶片H2O2及MDA含量最高,均显著高于其他品种。PG叶片过氧化氢及MDA含量最低,其过氧化氢含量依次比DP、DG和PP低2.25%、61.44%及27.0%,而在MDA含量上则分别为9.37%、49.55%及25.58%。PG与DP的过氧化氢及MDA含量差异不显著。
2.7 不同叶色水稻花青素含量变化
不同叶色水稻品种叶片花青素含量差异显著,其中DP含量最高,其次分别为PP及DG,而PG含量最低(图7)。DP叶片花青素含量分别是PG、DG和PP的11.23、3.91及1.40倍。PP叶片花青素含量也显著高于DG和PG,分别是DG和PG的8.02倍和2.79倍。PG叶片花青素含量显著低于DP、DG及PP,其降幅分别为8.90%、34.80%和12.48%。
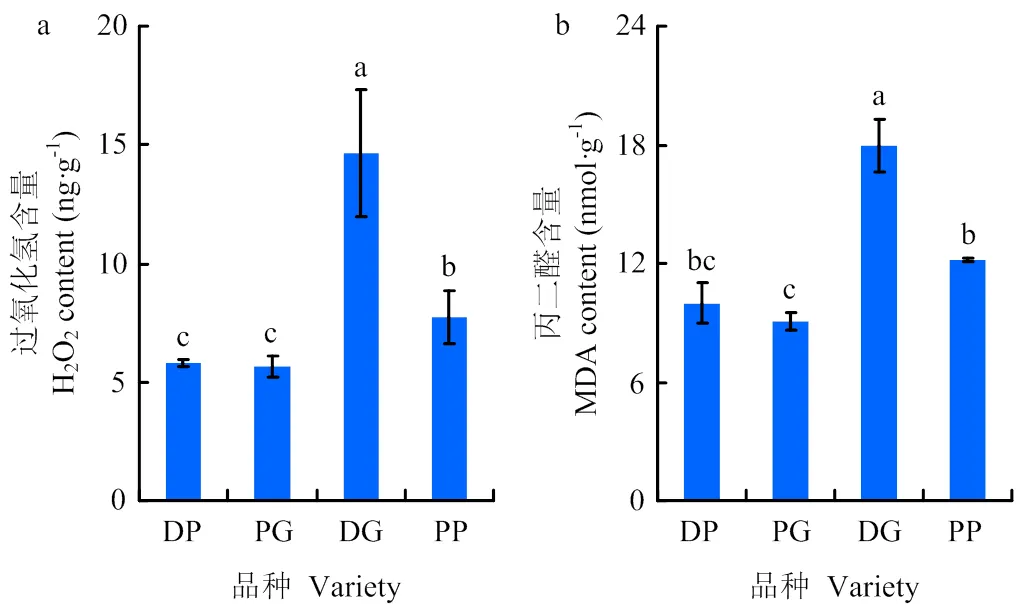
图6 不同叶色水稻叶片过氧化氢及丙二醛的含量

表3 水稻叶片花青素含量与光合荧光参数、抗氧化酶活性、过氧化物含量、干物质重和产量的相关性
*,0.05水平上差异显著;**,0.01水平上差异显著 *, significant at 0.05 probability level; **, significant at 0.01 probability level
2.8 花青素含量与光合等生理参数的相关性分析
鉴于DP和DG两品种分蘖期叶片叶绿素及类胡萝卜素含量没有显著性差异,而DP花青素含量则显著高于DG(图2-c、d;图7),推测DP品种叶片PSI和PSII实际荧光量子效率、净光合速率、Rubisco活性较DG显著增加可能与其较高的花青素含量密切相关。相关分析表明,两品种叶片花青素含量与光合速率、Rubisco活性、PSI和PSII实际荧光量子效率,以及抗氧化酶类(包括POD、SOD和CAT)活性呈显著或极显著正相关,而与过氧化氢和丙二醛含量呈极显著负相关(表3)。另外,分蘖期叶片花青素含量与相同时期干物质重、成熟期产量相关性呈极显著和显著正相关。叶绿素和类胡萝卜素含量与上述光合生理参数的相关性不显著。
2.9 外源喷施花青素对水稻叶片光合速率及过氧化氢含量的影响
为进一步明确花青素在影响净光合速率中的作用,外源叶片喷施0.05%花青素溶液。图8显示,花青素能一定程度上提高水稻叶片净光合速率,但存在品种间差异。除淡绿叶品种PG花青素处理的叶片净光合速率比对照增加不显著外(增幅4.60%),DP、DG和PP叶片净光合速率在喷施花青素后均显著增加,增幅分别为9.95%、22.22%和11.94%(图8-a)。水稻叶片过氧化氢含量在喷施花青素后有不同程度的下降,DP、PG、DG和PP的降幅分别为10.34%、21.05%、18.03%和32.95%,其中PG、DG和PP降幅均达显著水平(图8-b)。

图7 不同叶色水稻叶片花青素含量

H2O:喷清水;Atc:喷花青素 H2O: Foliar application of water; Atc: Foliar application of anthocyanin
3 讨论
3.1 水稻叶绿素含量与光合及干物质积累的关系
高等植物叶绿体基粒片层结构的薄膜(类囊体膜)
主要含有叶绿素(叶绿素a、叶绿素b)和类胡萝卜素(胡萝卜素、叶黄素)两种色素。叶绿素主要负责光能的捕获、吸收、传递和转化,其中只有少数特殊激发状态下的叶绿素a才能将光能转化成化学能。叶绿素含量降低不利于叶绿体发育,叶色发黄、白化,生长迟缓,光合效率降低,甚至导致植株死亡[19-20]。然而,近年来的研究表明,淡绿叶的水稻突变体叶绿素含量较低,但其光合能力与正常叶色野生型水稻相当,甚至显著增加[5,7,21]。在水稻生长季温度及光照强度较高的长江中下游稻区,浅色水稻更有利于光合及产量的形成[9]。水稻等C3作物光能利用率只有2.2%,吸收的光能只有小部分用于光化学反应,大部分需要通过热耗散或叶绿素荧光消除,以维持光能转化与利用的平衡,是植物不可或缺的光防御机制[21]。
叶绿素含量较高的水稻品种,光量子吸收量较大,由于光能利用有限,若同时热耗散能力(NPQ)不足,将出现光抑制的现象,导致叶片活性氧积累增加,严重抑制光合速率的形成[22]。相反,淡绿叶水稻叶绿素含量较低,光能吸收利用率高,NPQ较高,光量子处于平衡状态,有利于叶片光合物质的积累及产量的形成。本试验条件下,PG为淡绿叶品种,叶绿素和类胡萝卜素含量均为最低,但净光合速率及干物质量最高,与前人的研究结果一致[5,7,9]。PG较高的净光合速率与其较高的叶绿素a与叶绿素b比值,较大的实际荧光量子效率有关,由此说明PG光能利用率高,不容易出现光抑制的现象[23]。另外,PG叶片中较高的Rubisco活性可能与较高的抗氧化酶活性及较低的过氧化氢及丙二醛含量有关。从中也反映出PG受到光能过剩的伤害比较小。与之相反,DP、DG和PP叶绿素含量均高于PG,相应地其过氧化氢及MDA含量、Rubisco活性、净光合速率及干物质积累均低于PG,表明叶色较深的水稻品种在长江中下游稻区容易出现光抑制的现象。
3.2 花青素在光合调节中的作用及其与抗氧化力的关系
花青素是一种广泛存在于植物体内的水溶性色素,与类胡萝卜素、叶绿素作为主要色素共同影响植株茎、叶等器官的颜色。花青素属于具有天然抗氧化生理活性的黄酮类次生代谢物质,可提高植物对干旱、低温、重金属等逆境及虫害等生物胁迫的抗性[24-25]。Naing等[26]研究表明,干旱胁迫下花青素合成相关基因表达上调,植物抗旱性显著提高。油菜、拟南芥中过表达花青素相关基因,可明显提高耐盐性[27-28]。此外,通过调节花青素含量,可显著增强烟草、拟南芥耐低温胁迫、耐低氮胁迫能力[29]。本试验研究表明,深紫叶品种DP叶绿素含量高于DG(正常叶色水稻),虽然差异不显著,但前者净光合速率、PSII实际荧光量子效率,Rubisco,SOD、POD及CAT活性和干物质重均显著高于DG(图2—图5),笔者推测花青素含量可能是不同叶色品种叶片光合作用差异的主要因素。对此,Steyn等[30]的研究表明,花青素以碳水化合物为底物应急合成,可提高植物的光保护能力。此外,植物组织表层花青素可以反射、屏蔽部分过剩光能,减轻强光对植物叶片内部组织的伤害[31-32]。更为重要的是花青素能有效清除自由基,对叶片起到抗氧化保护作用[33]。相关分析表明,DP叶片光合、荧光特性的改善,抗氧化系统酶活性增强以及过氧化物积累的减少,与其花青素含量较高密切相关(表3)。外源喷施花青素试验结果进一步证实这个假设,即外源花青素均能一定程度上降低过氧化氢含量、提高叶片净光合速率(图8)。
植物体内的抗氧化系统主要包括SOD、CAT、POD等酶类和谷胱甘肽、抗坏血酸等非酶类物质两类防御保护系统[34]。此外,一些次生代谢物质,例如花青素本身也具有清除活性氧等过氧化物的能力。已有研究报道表明,花青素不仅本身能够起到清除自由基的能力,更重要的在于调控植物体自身的抗氧化性能[35]。由以上分析可知,花青素可从以下两个途径减轻过剩光量子对光合作用抑制(图9):(1)花青素通过自身和诱导抗氧化酶类活性,显著提高水稻叶片抗氧化能力,清除过量的过氧化物积累;(2)花青素极有可能通过诱导叶片NPQ的产生,耗散过剩光能,减少过氧化氢积累。然而花青素与NPQ之间的关系还未见报道,其作用机制还有待阐明。
需要说明的是,与PP相比较,DP的叶绿素含量显著提高,但叶绿素含量的显著增加并没有引起相应的光量子过剩程度的加重和过氧化物积累的增多,也未最终引起二者光合荧光参数、光合速率的显著差异,推测叶片光合过程是由叶绿素和花青素等协同作用的过程,DP虽然叶绿素含量高,但其较高的花青素含量在清除过氧化物中起着不可或缺的作用。相应地,叶片中过氧化氢和丙二醛含量在三者间以DG最高,其次为PP,DP含量最低。另外,从产量构成来看,本试验中使用的4个叶色水稻品种穗型偏小,每穗粒数、结实率、粒重及产量均较低(表2,图1)。这些结果与前人研究的彩色稻品种产量低、抗性差的报道结果较一致[3]。因此本试验设计在温度、湿度保持恒定的人工气侯室进行,避免不可控的高温等逆境对试验结果产生影响。水稻产量形成的过程不仅取决于各个生育时期的生长发育与产量构成因素间的协调,也与光合物质的积累以及同化物的转运等生理过程密切相关[36]。本试验条件下分蘖期水稻的光合速率与干物质积累和成熟期籽粒产量相关性显著,有关不同叶色水稻品种在开花抽穗期叶片的光合特性及其与籽粒灌浆、产量形成的关系,有待进一步研究验证。

图中红色→表示促进,绿色┤表示抑制 Red → indicates the effect of promotion, and green ┤indicates inhibition in the figure
4 结论
不同叶色水稻叶片光合作用存在品种间显著差异,其中浅绿叶水稻品种(PG)叶片净光合速率最高,其次分别为深紫叶水稻品种(DP)和浅紫叶水稻品种(PP),而深绿叶水稻品种(DG)最低。浅绿叶水稻品种(PG)叶片叶绿素及类胡萝卜素含量显著低于其他品种,但其抗氧化酶、Rubisco活性及干物质量高于其他品种。相应地,PG叶片过氧化氢和丙二醛含量显著低于其他品种,表明PG受光量子过剩伤害较小。DP和DG叶绿素含量、类胡萝卜素差异不大,但DP叶片的花青素含量、实际荧光量子效率、净光合速率、Rubisco及抗氧化酶活性显著高于DG。相应地,DP过氧化氢及丙二醛含量显著低于DG,表明花青素可能参与光响应过程。外源花青素可有效降低叶片过氧化氢含量,明显提高叶片净光合速率。
[1] HUANG J, PAN Y, CHEN H, ZHANG Z, FANG C, SHAO C, AMJAD H, LIN W, LIN W. Physiochemical mechanisms involved in the improvement of grain-flling, rice quality mediated by related enzyme activities in the ratoon cultivation system. Field Crops Research, 2020, 258: 107962.
[2] 肖人鹏, 唐永群, 刘强明, 张现伟, 姚雄, 文明, 张巫军, 段秀建, 李经勇. 优质红米恢复系渝恢 9341 的选育与应用. 杂交水稻, 2021, 36(1): 28-30.
XIAO R P, TANG Y Q, LIU Q M, ZHANG X W, YAO X, WEN M, ZHANG W J, DUAN X J, LI J Y. Breeding and application of restorer line Yuhui 9341 with red grains and good quality in rice. Hybrid Rice, 2021, 36(1): 28-30. (in Chinese)
[3] 谢成林, 唐建鹏, 姚义, 孔祥英, 闵思桂, 韩光明. 彩色稻新品种(系)农艺性状比较与分析. 中国稻米, 2019, 25(5): 87-92.
XIE C L, TANG J P, YAO Y, KONG X Y, MIN S G, HAN G M. Comparison and analysis of agronomic trait of new colored rice. China Rice,2019, 25(5): 87-92. (in Chinese)
[4] LI Y, REN B, GAO L, DING L, JIANG D, XU X, SHEN Q, GUO S. Less chlorophyll does not necessarily restrain light capture ability and photosynthesis in a chlorophyll-deficient rice mutant. Journal of Agronomy and Crop Science, 2013, 199(1): 49-56.
[5] 周振翔, 李志康, 陈颖, 王志琴, 杨建昌, 顾骏飞. 叶绿素含量降低对水稻叶片光抑制与光合电子传递的影响. 中国农业科学, 2016, 49(19): 3709-3720.
ZHOU Z X, LI Z K, CHEN Y, WANG Z Q, YANG J C, GU J F. Effects of reduced chlorophyll content on photoinhibition and photosynthetic electron transport in rice leaves. Scientia Agricultura Sinica, 2016, 49(19): 3709-3720. (in Chinese)
[6] 孙佳莉. 氮素和干旱胁迫对水稻动态光合作用的影响与机理研究[D]. 武汉: 华中农业大学, 2018.
SUN J L. Studies on the mechanisms for the effects of nitrogen and water deficit on dynamic photosynsthesis in rice crops[D]. Wuhan: Huazhong Agricultural University, 2018. (in Chinese)
[7] ZHAO X, CHEN T, FENG B, ZHANG C, PENG S, ZHANG X, FU G, TAO L. Non-photochemical quenching plays a key role in light acclimation of rice plants differing in leaf color. Frontiers in Plant Science, 2017, 7: 1968.
[8] 胡巍, 高云, 张强, 张彬, 江奕君. 浅绿叶水稻突变体的特性与遗传分析. 植物遗传资源学报, 2021, 22(1): 194-204.
HU W, GAO Y, ZHANG Q, ZHANG B, JIANG Y J. Genetic analysis and characteristics of pale-green leaf rice mutant. Journal of Plant Genetic Resources, 2021, 22(1): 194-204. (in Chinese)
[9] 王丹英, 章秀福, 邵国胜, 钱前, 徐春梅. 不同叶色水稻叶片的衰老及对光强的响应. 中国水稻科学, 2008, 22(1): 77-81.
WANG D Y, ZHANG X F, SHAO G S, QIAN Q, XU C M. Leaf senescence of different leaf color rice and its response to light intensity. Chinese Journal of Rice Science, 2008, 22(1): 77-81. (in Chinese)
[10] ZAIDI S H R. 有色稻颖果色素积累的生理生态特点及其与逆境胁迫响应间关系[D].杭州: 浙江大学, 2019.
ZAIDI S H R. Effects of abiotic stress on physiological properties of pigment accumulation in filling grain for color rice (L.)[D].Hangzhou: Zhejiang University, 2019. (in Chinese)
[11] ZHANG C, FU G, YANG X, YANG Y, ZHAO X, CHEN T, ZHANG X, JIN Q, TAO L. Heat stress effects are stronger on spikelets than on flag leaves in rice due to differences in dissipation capacity. Journal of Agronomy and Crop Science, 2016, 202(5): 394-408.
[12] CISSE A, ZHAO X, FU W, KIM R E R, CHEN T, TAO L, FENG B. Non-photochemical quenching involved in the regulation of photosynthesis of rice leaves under high nitrogen conditions. International Journal of Molecular Sciences, 2020, 21(6): 2115.
[13] ARNON D I. Copper enzymes in isolated chloroplasts polyphenoloxidase in Betavulgaris. Plant Physiology, 1949, 24(1): 1-15.
[14] WELLBURN A R. The spectral determination of chlorophyll a andb, as well as total carotenoids, using various solvents withspectrophotometers of different resolution. Journal of Plant Physiology,1994, 144(3): 307-313.
[15] CHANCE B, MAEHLY A. Assay of catalases and peroxidases. Methods in Enzymology, 1955, 2: 764-775.
[16] GIANNOPOLITIS C N, RIES S K. Superoxide dismutases: I. Occurrence in higher plants. Plant Physiology, 1977, 59(2): 309-314.
[17] 赵世杰, 许长成, 邹琦, 孟庆伟. 植物组织中丙二醛测定方法的改进. 植物生理学通讯, 1994, 30(3): 207-210.
ZHAO S J, XU C C, ZOU Q, MENG Q W. Improvements of method for measurement of malondialdehvde in plant tissues. Plant Physiology Communication, 1994, 30(3): 207-210. (in Chinese)
[18] BRENNAN T, FRENKEL C. Involvement of hydrogen peroxide in the regulation of senescence in pear. Plant Physiology, 1977, 59(3): 411-416.
[19] 夏家平, 郭会君, 谢永盾, 赵林姝, 古佳玉, 赵世荣, 李军辉, 刘录祥. 小麦叶绿素缺失突变体Mt135的叶绿体基因差异表达分析. 作物学报, 2012, 38(11): 2122-2130.
Xia J P, Guo H J, Xie Y D, Zhao L S, Gu J Y, Zhao S R, Li J H, Liu L X. Differential expression of chloroplast genes in chlorophyll- deficient wheat mutant Mt135 derived from space mutagenesis. Acta Agronomica Sinica, 2012, 38(11): 2122-2130. (in Chinese)
[20] ZHAO X, FENG B, CHEN T, ZHANG C, TAO L, FU G. Transcriptome analysis of pale‑green leaf rice reveals photosynthetic regulatory pathways. Acta Physiologiae Plantarum, 2017, 39(12): 274.
[21] WU Z M, ZHANG X, WANG J L, WAN J M. Leaf chloroplast ultrastructure and photosynthetic properties of a chlorophyll-deficient mutant of rice. Photosynthetica, 2014, 52(2): 217-222.
[22] 赵霞, 杨华伟, 刘然方, 陈婷婷, 奉保华, 张彩霞, 杨雪芹, 陶龙兴. 水稻热耗散对逆境的响应. 中国水稻科学, 2016, 30(4): 431-440. Zhao X, Yang H W, Liu F R, Chen T T, Feng B H, Zhang C X, Yang X Q, Tao L X. Response of heat dissipation in rice to stress. Chinese Journal of Rice Science, 2016, 30(4): 431-440. (in Chinese)
[23] 宋陶玉. 化学诱变水稻叶色突变体的光合生理特性研究[D]. 长沙: 湖南师范大学, 2019.
SONG T Y. Studies on photosynthetic physiological characteristics of rice leaf color mutants induced by chemical mutants[D]. Changsha: Hunan Normal University, 2019. (in Chinese)
[24] HOSODA K, SASAHARA H, MATSUSHITA K, TAMURA Y, MIYAJI M, MATSUYAMA H. Anthocyanin and proanthocyanidin contents, antioxidant activity, and in situ degradability of black and red rice grains. Asian-Australasian Journal of Animal Sciences, 2018, 31(8): 1213-1220.
[25] SHEN X, GUO X, GUO X, ZHAO D, ZHAO W, CHEN J, LI T. PacMYBA, a sweet cherry R2R3-MYB transcription factor, is a positive regulator of salt stress tolerance and pathogen resistance. Plant Physiology and Biochemistry, 2017, 112: 302-311.
[26] NAING A H, PARK K I, AI T N, CHUNG M Y, HAN J S, KANG Y W, LIM K B, KIM C K. Overexpression of snapdragon() gene in tobacco enhances antho-cyanin accumulation and abiotic stress tolerance. BMC Plant Biology, 2017, 17(1): 65.
[27] KIM J, LEE W J, VU T T, JEONG C Y, HONG S W, LEE H. High accumulation of anthocyanins via the ectopic expression of AtDFRconfers significant salt stress tolerance inL. Plant Cell Reports, 2017, 36(8): 1215-1224.
[28] 王鸿雪, 刘天宇, 庄维兵, 王忠, 朱林, 渠慎春, 翟恒华. 花青素苷在植物逆境响应中的功能研究进展. 农业生物技术学报, 2020, 28(1): 174-183. WANG H X, LIU T Y, ZHUANG W B, WANG Z, ZHU L, QU S C, ZHAI H H. Research advances in the function of anthocyanin in plant stress response. Journal of Agricultural Biotechnology, 2020, 28(1): 174-183. (in Chinese)
[29] AKHTER D, QIN R, NATH U K, ESHAG J, JIN X, SHI C. A rice gene,, encoding a MYB family transcription factor confers anthocyanin synthesis, heat stress response and hormonal signaling. Gene, 2019, 699: 62-72.
[30] STEYN W J, WAND S J E, HOLCROFT D M, JACOBS G. Anthocyanins in vegetative tissues: A proposed unified function in photoprotection. New Phytologist, 2002, 155(3): 349-361.
[31] ZHANG K M, YU H J, SHI K, ZHOU Y H, YU J Q, XIA X J. Photoprotective roles of anthocyanins in. Plant Science, 2010, 179: 202-208.
[32] HUGHGS N M. Winter leaf reddening in ‘evergreen’ species. New Phytologist, 2011, 190(3): 573-581.
[33] AGATI G, TATTINI M. Multiple functional roles of flavonoids in photoprotection. New Phytologist, 2010, 186(4): 786-793.
[34] 张俊霞, 刘晓鹏, 向极钎. 植物抗氧化系统对逆境胁迫的动态响应. 湖北民族学院学报(自然科学版), 2015, 33(4): 435-439.
ZHANG J X, LIU X P, XIANG J Q. Dynamic response of antioxidant systems to adversity stress in plants. Journal of Hubei University for Nationalities (Natural Science Edition), 2015, 33(4): 435-439. (in Chinese)
[35] ZAIDI S H R, ZAKARI S A, Zhao Q, KHAN A R, SHAH J M, CHENG F M. Anthocyanin accumulation in black kernel mutant rice and its contribution to ROS detoxification in response to high temperature at filling stage. Antioxidants, 2019, 8(11): 510-524.
[36] FURBANK R T, QUICK W P, SIRAULT X R R. Improving photosynthesis and yield potential in cereal crops by targeted genetic manipulation: Prospects, progress and challenges. Field Crops Research, 2015, 182: 19-29.
The Photosynthesis Characteristics of Colored Rice Leaves and its Relation with Antioxidant Capacity andAnthocyanin Content
CHEN TingTing, FU WeiMeng, YU Jing, FENG BaoHua, LI GuangYan, FU GuanFu*, TAO LongXing*
State Key Laboratory of Rice Biology, China National Rice Research Institute, Hangzhou 310006
【Objective】In recent years, due to colored rice unique appearance and special nutritional value, it has been developed rapidly in the sightseeing agriculture, selection and production of special nutritional rice. The objective of this study was to elucidate the mechanism underlying the photosynthetic response of leaves in colored rice to light.【Method】In this experiment, four rice varieties with different chlorophyll content in leaves were selected, including deep purple (DP), pale green (PG), dark green (DG) and pale purple (PP). The change characteristics of leaf photosynthesis were studied and the response mechanisms were revealed.【Result】The results indicated that the highest chlorophyll content was showed in DP, followed by the DG and PP, while the lowest value was found in PG. Under this case, the PG variety attained the highest value of actual fluorescence quantum efficiency of PSII, photosynthetic rate, ribulose-1,5-bisphosphate carboxylase (Rubisco) activity and total dry matter weight, which were significantly higher than those in the other varieties. The content of hydrogen peroxide and malondialdehyde in PG leaves were significantly lower than those in other rice varieties. Besides, there was no significant difference in leaf chlorophyll content and carotenoid content between DP and DG, while the actual fluorescence quantum efficiency of PSII, net photosynthetic rate, Rubisco activity in leaves of DP were significantly higher than those of DG. Correspondingly, the activities of antioxidant enzymes in leaves of DP were significantly higher than those of DG, while the content of hydrogen peroxide and malondialdehyde in leaves of DP were significantly lower than those of DG. This might be related to the anthocyanin content in the leaves, because the anthocyanin content in the leaves of DP was significantly higher than that of DG. The leaf photosynthetic rate was significantly increased and hydrogen peroxide content was significantly decreased after foliar application of anthocyanin. 【Conclusion】it was inferred that anthocyanin might exert important role in alleviating the inhibition effect caused by excess optical quantum on the photosynthesis of leaves under natural conditions.The results could provide a theoretical basis for rice high light efficiency breeding, and cultivation technology exploitation for collaborative development in grain yield and quality of colored rice.
colored rice; chlorophyll; photosynthesis; antioxidant capacity; anthocyanin
2021-04-06;
2021-06-21
浙江省自然科学基金面上项目(LY20C130011,LY22C130003)、水稻生物学国家重点实验室开放课题(20210402)、国家水稻产业体系(CARS-1)
陈婷婷,E-mail:chentingting@caas.cn。符卫蒙,E-mail:fuwmeng@163.com。陈婷婷和符卫蒙为同等贡献作者。通信作者符冠富,E-mail:fugf1981@sina.com。通信作者陶龙兴,E-mail:taolongxing@caas.cn
(责任编辑 杨鑫浩)
