广西麻鸡m6A甲基转移酶基因表达与肌纤维类型及成肌分化的关系
2022-03-04束婧婷单艳菊姬改革章明屠云洁刘一帆巨晓军盛中伟唐燕飞李华邹剑敏
束婧婷,单艳菊,姬改革,章明,屠云洁,刘一帆,巨晓军,盛中伟,唐燕飞,李华,邹剑敏
广西麻鸡m6A甲基转移酶基因表达与肌纤维类型及成肌分化的关系
束婧婷1,单艳菊1,姬改革1,章明1,屠云洁1,刘一帆1,巨晓军1,盛中伟1,唐燕飞2,李华3,邹剑敏1*
1江苏省家禽科学研究所江苏省家禽遗传育种重点实验室,江苏扬州 225125;2广西富凤农牧集团有限公司,南宁 530024;3佛山科学技术学院,广东佛山 528225
【目的】肌纤维类型及其转化的调节是改善肉质的重要途径,最新研究表明,m6A RNA 甲基化修饰在肌肉的分化中发挥着重要作用。以优良的地方品种——广西麻鸡作为研究对象,研究其性成熟日龄不同部位肌纤维类型的组成差异,探究m6A甲基化转移酶相关基因甲基化转移酶样蛋白 3/14 (methyltransferase like 3/14, METTL3/14)、Wilm 肿瘤 1-相关蛋白(Wilms’ tumor 1-associating protein,WTAP)和病毒样m6A 甲基转化酶(vir like m6A methyltransferase associated,VIRMA,也称 KIAA1429)在不同部位肌肉组织和成肌细胞分化前后的表达差异,为阐明肌纤维类型组成及转换的调控机理提供参考。【方法】采用ATPase染色法比较广西麻鸡胸部、腿部和背部肌肉群7个部位肌纤维类型、直径和密度等肌纤维性状差异,采用比色法检测成肌细胞分化前后不同时间点内源性m6A甲基化水平,采用实时荧光定量PCR方法检测上述4个基因在广西麻鸡7个部位肌肉以及成肌细胞分化前后的表达差异,并将其与肌纤维性状和m6A甲基化水平进行相关性分析。【结果】广西麻鸡性成熟日龄胸部肌肉群的胸大肌和胸小肌全部由白肌纤维组成,腿部肌肉群的耻坐骨肌内侧头、腓肠肌内侧头和缝匠肌均以红肌纤维为主,而髂胫外侧肌以白肌纤维为主,背部肌肉群的背阔肌则以红肌纤维为主;总体上,红肌纤维比例多的肌肉肌纤维密度显著高于白肌纤维比例多的肌肉。METTL3、METTL14、WTAP和KIAA1429基因表达存在显著的组织和时间特异性,总体上,在红肌纤维为主的肌肉中的表达量高于白肌纤维为主的肌肉,在分化期成肌细胞中的表达量要显著高于增殖期成肌细胞。肌肉中METTL3、METTL14和WTAP具有相似的表达模式,均在背阔肌中表达量最高,显著高于其他肌肉组织;在耻坐骨肌内侧头和腓肠肌内侧头的表达量次之,显著高于缝匠肌、胸大肌、胸小肌和髂胫外侧肌。KIAA1429基因在腓肠肌内侧头的表达量最高,显著高于其他组织;在背阔肌中的表达量次之,显著高于耻坐骨肌内侧头、缝匠肌、胸大肌、胸小肌和髂胫外侧肌;在胸大肌中表达量最低,但与在胸小肌和髂胫外侧肌中的表达量差异不显著。在鸡成肌细胞中,METTL3和METTL14基因表达变化趋势较为一致,均表现出先持续升高后下降的趋势,在刚分离0 h细胞中的表达量最低,在诱导分化后2 d(D2)细胞中的表达量最高,显著的高于增殖期和诱导分化当天(D0)细胞中的表达量。WTAP和KIAA1429基因表达变化趋势也较为一致,均呈现持续上升的趋势,在刚分离细胞中的表达量最低,显著低于其他时间点,至19 h显著上升,D0天略有增加,接着显著上升至D5天达到高峰。同时发现,随着成肌细胞的分化,内源性RNA m6A甲基化水平逐步上升,分化期的水平显著高于增殖期,在D2天甲基化水平最高,显著高于其他各时间点,随后在D5天显著下降,但略高于D0天。肌肉和成肌细胞中,METTL3、METTL14、WTAP和KIAA1429基因的表达两两之间均表现出极显著的正相关关系;肌肉中4个基因的表达与红肌纤维比例存在显著的正相关关系,与白肌纤维比例则呈显著的负相关关系;成肌细胞中4个基因的表达与m6A甲基化水平之间也存在正相关关系。【结论】广西麻鸡不同部位肌肉肌纤维类型组成存在差异,所研究的m6A甲基化转移酶4个基因之间协同表达,并可能对鸡肌纤维类型组成、维持及成肌细胞分化具有一定的调控作用。
广西麻鸡;基因表达;m6A甲基化转移酶基因;肌纤维类型; 成肌分化
0 引言
【研究意义】骨骼肌肌纤维类型直接影响肉品质,肌纤维类型及其转化的调节是改善肉质的重要途径[1]。研究表明,RNA甲基化修饰,尤其是N6-甲基腺嘌呤(N6-methyladenosine, m6A)是真核生物体内广泛存在的RNA水平表观遗传修饰,在细胞分化、发育和压力应答等多种生理功能中均有重要作用[2-4]。哺乳动物中研究发现,m6A 甲基化修饰在肌肉的分化中发挥着重要调控作用。然而迄今为止,尚无m6A甲基化修饰在鸡骨骼肌发育和分化中的研究报道。因此,研究m6A甲基化修饰酶相关基因在鸡成肌细胞发育、分化及不同类型肌肉中的表达规律及其相关性,将有助于找寻出参与肌纤维发育及类型组成的调控因子,对于阐明鸡肉品质差异的分子机理具有重要意义。【前人研究进展】禽类骨骼肌肌纤维根据外观、收缩特性和代谢特征可将鸡骨骼肌肌纤维分成慢肌纤维(slow-twitch myofibres, SM)(Ⅰ型,色红,收缩慢,进行有氧代谢)、快红肌纤维(red fast-twitch myofibres, FRM)(2a型,色泽较红,收缩快,进行有氧和酵解代谢)和快白肌纤维(white fast-twitch, FWM)(2b型,色白,收缩快,进行酵解代谢)[5]。其中I型和IIa型纤维可归为红肌纤维[6],所有骨骼肌均是由这3类肌纤维混合构成的,但各块肌肉中各种肌纤维的比例不同。肌纤维类型的发生与转化受到许多信号通路、基因与转录因子的调控,是一个非常复杂的调控过程[7]。研究发现,m6A 修饰在基因表达调控中发挥着重要的作用,主要通过mRNA分子的表达水平来影响mRNA稳定性、出核运动及翻译起始等,介导了超过80%的RNA碱基甲基化[8-9]。参与m6A甲基化修饰的酶有甲基化转移酶、去甲基化酶和甲基化阅读蛋白,其中甲基化转移酶上保守的motif能催化RNA上的腺苷酸发生m6A甲基化修饰,而去甲基化酶主要作用是对已经发生m6A修饰的碱基进行去甲基化修饰,阅读蛋白主要功能是识别发生m6A修饰的碱基,从而激活下游的调控通路如RNA降解、miRNA加工等[10-11]。m6A修饰是一种动态可逆的修饰,这种可逆的动态修饰代表了一种全新的遗传信息调控方式。甲基化转移酶是多种酶的复合物,其核心组分包括甲基化转移酶样蛋白 3/14(methyltransferase like 3/14, METTL3/14)、Wilm 肿瘤 1-相关蛋白(Wilms’ tumor 1-associating protein,WTAP)和病毒样m6A甲基转化酶(vir like m6A methyltransferase associated,VIRMA,也称 KIAA1429)等[12]。在METTL3 /METTL14 /WTAP 复合物中,METTL3与 METTL14形成异二聚体复合物,与WTAP 相互作用。METTL3 被证明是多腺苷酸化 m6A 形成的主要催化活性酶[10];METTL14不具有酶促活性,而是作为 m6A 甲基化过程的支架和衔接子来结合RNA 底物并促进 METTL3 的活性[13];WTAP则起招募METTL3和METTL14 至核斑点促进m6A 水平的作用[14]。KIAA1429可能起招募催化METTL3 /METTL14的核心组分指导区域选择性甲基化的作用[15]。m6A 甲基化修饰对肌肉的分化具有重要调控作用。Chen等研究发现m6A 甲基化修饰能正向调控大鼠成肌细胞的分化[16]。在增殖期成肌细胞中,METTL3通过介导 MyoD 等肌源性转录因子 mRNA 的 5’UTR的 m6A 修饰维持增殖性骨骼肌祖细胞的肌源性潜能,提示METTL3 参与肌源性祖细胞的骨骼肌分化潜能,同时也是骨骼肌分化的关键调节因子[17]。【本研究切入点】目前,关于m6A甲基化转移酶相关基因在鸡成肌细胞增殖、分化过程中以及不同部位肌肉中的表达规律及其表达对m6A甲基化水平、成肌细胞分化及肌纤维类型的影响研究还处于空白。【拟解决的关键问题】肌纤维类型并不是出生前就确定下来的,在生长过程中,它受到品种、年龄、营养、内分泌及机体各级调控因子的影响。广西麻鸡是我国重要的慢速型地方品种,其肉质鲜美,深受广大消费者欢迎。本研究即以广西麻鸡作为研究对象,首次研究其性成熟时不同部位肌肉肌纤维类型组成差异,以及m6A甲基化转移酶相关基因METTL3、METTL14、WTAP和KIAA1429在成肌细胞增殖和分化过程中的发育性表达规律以及在不同部位肌肉中的组织分布,并结合m6A甲基化水平以及肌纤维性状进行相关性分析,以进一步揭示m6A甲基化转移酶相关基因的生物学功能,为鸡肉品质的遗传改良奠定基础。
1 材料与方法
1.1 试验时间、地点
试验于2019年10月至2020年6月在扬州江苏省家禽科学研究所养殖基地和家禽遗传育种重点实验室进行。
1.2 试验材料
广西麻鸡种蛋来源于广西富凤农牧有限公司广西麻鸡保种群。种蛋孵化前,进行称重、消毒和编号,品种内蛋重变异系数在5%以内。在温度为37.5—37.8℃、相对湿度为65%—75%条件下孵化。出雏后,饲养至性成熟(120日龄),随机选择体重相近的母鸡10只屠宰,参考罗克[18]方法采集两侧胸大肌、胸小肌、缝匠肌、耻坐骨肌内侧头、髂胫外侧肌、腓肠肌内侧头肌和背阔肌等7个部位肌肉,在每种肌肉一侧中间部位采集1×1 cm2大小肌肉块,并采集另一侧同一部位组织样品,置于液氮速冻,然后转入-80℃冰箱保存备用。
1.3 组织学测定
在恒温冷冻切片机内进行冰冻切片的制作,每个样品在垂直于肌纤维延展方向做10张连续横切切片,切片厚度10 μm,ATPase染色法染色,封片,显微镜观察测量,根据染色结果确定肌纤维类型。在10倍或者20倍镜下选取视野进行观察,每组切片选取1—2个完整肌束,每只鸡取7个完整肌束,用Image-Pro Plus 6.0软件分析不同类型肌纤维的比例。
1.4 成肌细胞分离及诱导分化
鸡成肌细胞的分离培养参考Luo等[19]方法并稍作调整。用胰酶消化法分离提取11胚龄广西麻鸡腿肌成肌细胞,并用差速贴壁法对提取的成肌细胞进行纯化。将纯化的鸡成肌细胞以1×106个/孔密度接种于6孔培养板,用DMEM +20%胎牛血清培养基培养细胞。待细胞汇合至80%时,换用DMEM +5%马血清培养基进行诱导分化。收集培养0、19 h以及诱导分化后0、2、5 d的成肌细胞。
1.5 引物设计
根据定量PCR引物设计原则,利用Primer Premier 5.0软件,分别设计GenBank中鸡的METTL3、METTL14、WTAP和KIAA1429(GenBank登录号:XM_418337)等4个候选基因以及分化标志基因(MyoD、MyoG)的定量PCR引物,选择鸡肌肉特异性内参基因HSP70作为本研究的内参基因。由上海英俊生物工程有限公司合成,引物信息见表1。
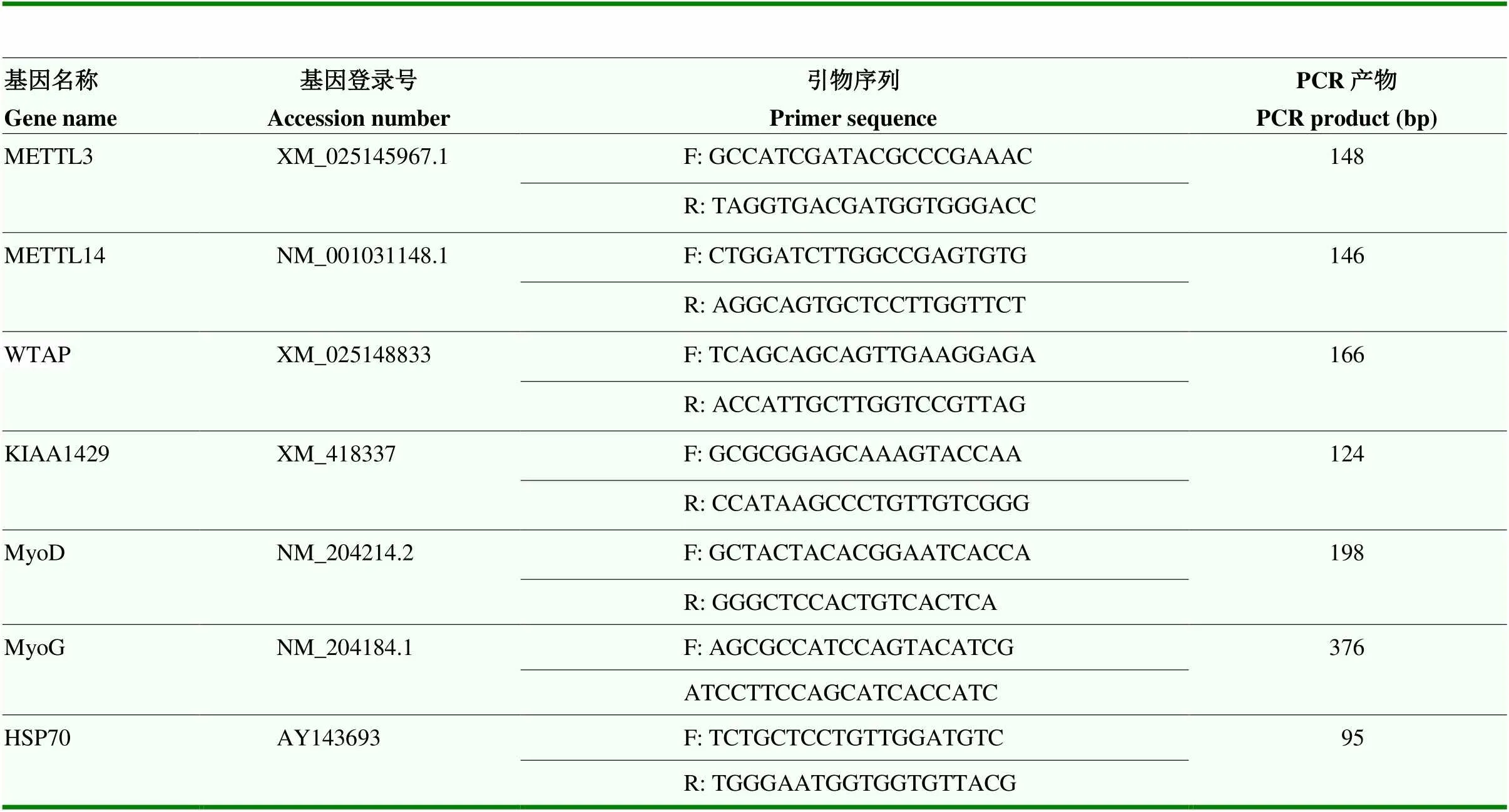
表1 相关基因荧光定量引物序列
1.6 总RNA提取、cDNA合成和实时荧光定量PCR
肌肉和细胞总RNA提取按TRNzol Universal 总RNA提取试剂(DP424)(天根,北京)的说明书进行。RNA样品经琼脂糖凝胶电泳鉴定总RNA完整性后,采用核酸定量仪NanoDrop2000(Thermo Scientific,美国)测定浓度及根据A260nm/A280nm值确定RNA纯度。
cDNA反转录按照HiScript III RT SuperMix for qPCR(+gDNA wiper)合成试剂盒(诺唯赞,南京)的使用说明书进行,RT产物保存在-20℃备用。荧光定量PCR采用SYBR Green Ι法,参照ChamQ SYBR Color qPCR Master Mix(Q411-02)(诺唯赞,南京)试剂盒说明书进行。每次反应均设空白样品为阴性对照,每个样品设置3个平行。
1.7 整体m6A甲基化水平测定
采用比色法检测成肌细胞分化前后不同时间点内源性m6A甲基化水平,具体步骤参考m6A RNA Methylation Quantification Kit(Colorimetric,ab185912)说明书进行,反应结束后使用多功能酶标仪测量450 nm处的吸光度值,计算各样品的RNA m6A含量,计算公式如下:
m6A(%)=((Sample OD-NC OD)/S)/((PC OD- NC OD)/P)×100
式中:S为RNA的量,P为阳性对照RNA的量。
1.8 细胞蛋白质的提取和Western blot检测
细胞总蛋白的提取采用RIPA裂解液和蛋白酶抑制混合物(碧云天,中国)进行,按照细胞板培养面积比例加入蛋白裂解液,把细胞培养板放置在冰上5 min,期间反复水平摇摆培养板让细胞充分裂解,把细胞蛋白裂解液转移到1.5 mL离心管,4℃ 12 000×离心10 min,取上清液。细胞蛋白质浓度测定方法,参考BCA蛋白浓度测定试剂盒(增强型)说明书。按照标准流程进行Western blot检测,抗体信息如下:anti-MyoG(Biorbyt,英国),anti-MyoD(Thermo Fisher Scientific,美国),anti-GAPDH(Bioworld,美国),goat anti-rabbit IgG(H & L)-HRP(Bioworld,美国)。
1.9 统计分析
定量的结果采用2-ΔΔCt法进行处理,分析基因的相对表达量。细胞分化前后表达分析将诱导分化0日龄设为对照组,ΔΔCt=ΔCt(其他时间点)-ΔCt(D0),广西麻鸡性成熟不同部位表达分析将胸大肌设为对照组,ΔΔCt=ΔCt(其他肌肉部位)-ΔCt(胸大肌)。采用 SPSS 20.0统计分析软件进行分析,组间差异显著性用独立样本T检验,One-way ANOVA进行统计分析。Bivariate Correlation用来分析基因表达之间以及基因表达与肌纤维类型和RNA m6A含量的相关性。所有数据以Mean ± SE表示,<0.05,表示差异显著;<0.01,表示差异极显著。
2 结果
2.1 广西麻鸡不同部位肌肉肌纤维类型组成差异
对性成熟日龄的广西麻鸡胸大肌、胸小肌、髂胫外侧肌、腓肠肌内侧头、耻坐骨肌内侧头、缝匠肌和背阔肌等7个部位肌肉进行ATPase染色和肌纤维类型统计,结果见图1和表2。由图1-A可以较直观地看出,性成熟日龄的广西麻鸡胸大肌、胸小肌和髂胫外侧肌肉色较白,而腓肠肌内侧头、耻坐骨肌内侧头、缝匠肌和背阔肌肉色较红。在碱性(pH10.4)条件下,ATPase染色图中,染色深的是ATPase活性较强的快白肌纤维,染色浅的是ATPase活性较弱的慢肌纤维,染色效果居中的是ATPase活性居中的快红肌纤维。由图1-B的不同部位肌肉ATPase染色形态学图片可以看出,胸大肌和胸小肌全部为深染的IIb型纤维,其他的几种肌肉则是由I型、IIa型和IIb型肌纤维组成的混合型肌肉。7个部位肌肉的肌纤维类型组成及平均肌纤维直径、平均肌纤维横截面积、密度等指标统计结果见表2。从肌纤维类型组成来看,胸部肌肉胸大肌和胸小肌仅由快白肌纤维(IIb型)组成;髂胫外侧肌中,快白肌纤维(IIb型)比例最高,中间型纤维(IIa型)比例次之,慢肌纤维(I型)比例最低;腓肠肌内侧头肌中,中间型纤维(IIa型)比例最高,慢肌纤维(I型)比例次之,快白肌纤维(IIb型)比例最低;而在耻坐骨肌内侧头、缝匠肌和背阔肌中,均为中间型纤维(IIa型)比例最高,快白肌纤维(IIb型)比例次之,慢肌纤维(I型)比例最低。将I型和IIa型合并到一起统计为红肌纤维,则可以看出胸大肌、胸小肌和髂胫外侧肌主要由白肌纤维组成,而腓肠肌内侧头、耻坐骨肌内侧头、缝匠肌和背阔肌则主要是由红肌纤维组成。比较了不同部位肌肉的肌纤维直径、横截面积和密度差异,发现白肌纤维比例高的胸大肌、胸小肌和髂胫外侧肌的平均肌纤维直径和横截面积差异不显著(>0.05),但显著高于红肌纤维比例高的腓肠肌内侧头、耻坐骨肌内侧头、缝匠肌和背阔肌(<0.05)。红肌纤维比例高的4种肌肉中,腓肠肌内侧头和背阔肌的平均肌纤维直径和横截面积显著低于耻坐骨肌内侧头和缝匠肌(<0.05),而腓肠肌内侧头和背阔肌、耻坐骨肌内侧头和缝匠肌两两之间差异均不显著(>0.05)。肌纤维密度则与平均肌纤维直径和横截面积结果相反,红肌纤维比例高的肌肉肌纤维密度要显著高于白肌纤维比例高的肌肉(<0.05)。

(A)不同部位肌肉形态图;(B)不同部位肌肉ATPase染色形态学图,І:慢肌纤维;Пa:快红肌纤维;Пb:快白肌纤维;XD:胸大肌;XX:胸小肌;QW:髂胫外侧肌;FN:腓肠肌内侧头;CN:耻坐骨肌内侧头;FJ:缝匠肌;BK:背阔肌。下同

表2 广西麻鸡不同部位肌肉肌纤维类型组成
同一列不同字母表示差异显著(<0.05) Least-squares means with different letters in the same column differed significantly (<0.05)
2.2 m6A甲基化转移酶相关基因组织表达分析
从图2可以看出,m6A甲基化转移酶相关基因METTL3、METTL14、WTAP和KIAA1429在所研究的广西麻鸡7个部位肌肉组织中均有表达,总体来说,4个基因在红肌纤维比例高的肌肉中的表达量要高于白肌纤维比例高的肌肉。
METTL3、METTL14 和WATP基因表达模式较为一致,均在背阔肌中表达量最高,显著高于其他组织(<0.05);3个基因在耻坐骨肌内侧头和腓肠肌内侧头的表达量显著高于缝匠肌、胸大肌、胸小肌和髂胫外侧肌(<0.05)。METTL3 和WTAP基因在缝匠肌中的表达量要高于胸大肌、胸小肌和髂胫外侧肌,但两两之间差异不显著(>0.05)。METTL14基因在缝匠肌和髂胫外侧肌中的表达量显著高于胸大肌和胸小肌(<0.05),而在缝匠肌和髂胫外侧肌中,胸大肌和胸小肌中的表达量差异不显著(>0.05)。
KIAA1429基因在腓肠肌内侧头的表达量最高,显著高于其他组织(<0.05),在背阔肌中的表达量次之,显著高于耻坐骨肌内侧头、缝匠肌、胸大肌、胸小肌和髂胫外侧肌(<0.05);该基因在耻坐骨肌内侧头和缝匠肌中的表达量也显著高于胸大肌、胸小肌和髂胫外侧肌(<0.05),而在耻坐骨肌内侧头和缝匠肌中,胸大肌、胸小肌和髂胫外侧肌中两两之间的表达量差异不显著(>0.05)。
2.3 m6A甲基化转移酶相关基因在成肌细胞分化前后表达分析
为了进一步在细胞水平研究m6A甲基化转移酶相关基因的表达水平与成肌细胞分化的关系,检测成肌分化标志基因MyoG、MyoD以及甲基化转移酶METTL3、METTL14、WTAP和KIAA1429基因在成肌细胞分化前后的相对表达量,将新分离的鸡胚成肌细胞(0 h)中上述基因的表达量平均值设为对照。成肌分化标志基因的mRNA和蛋白表达结果如图3所示,总体来说,MyoG和MyoD基因在分化期的相对表达量高于增殖期。MyoG基因mRNA和蛋白表达水平均随着成肌细胞的分化而逐渐升高,至分化后5 d相对表达量最高,显著高于其他时间点(<0.05)。MyoD基因mRNA和蛋白表达水平则呈现先升高后下降的趋势,mRNA相对表达量在诱导分化当天表达量最高,而蛋白相对表达量则是诱导分化后2 d达到最高,无论是mRNA水平还是蛋白水平D0和D2天表达量差异不显著,但均显著高于其他时间点(<0.05)。
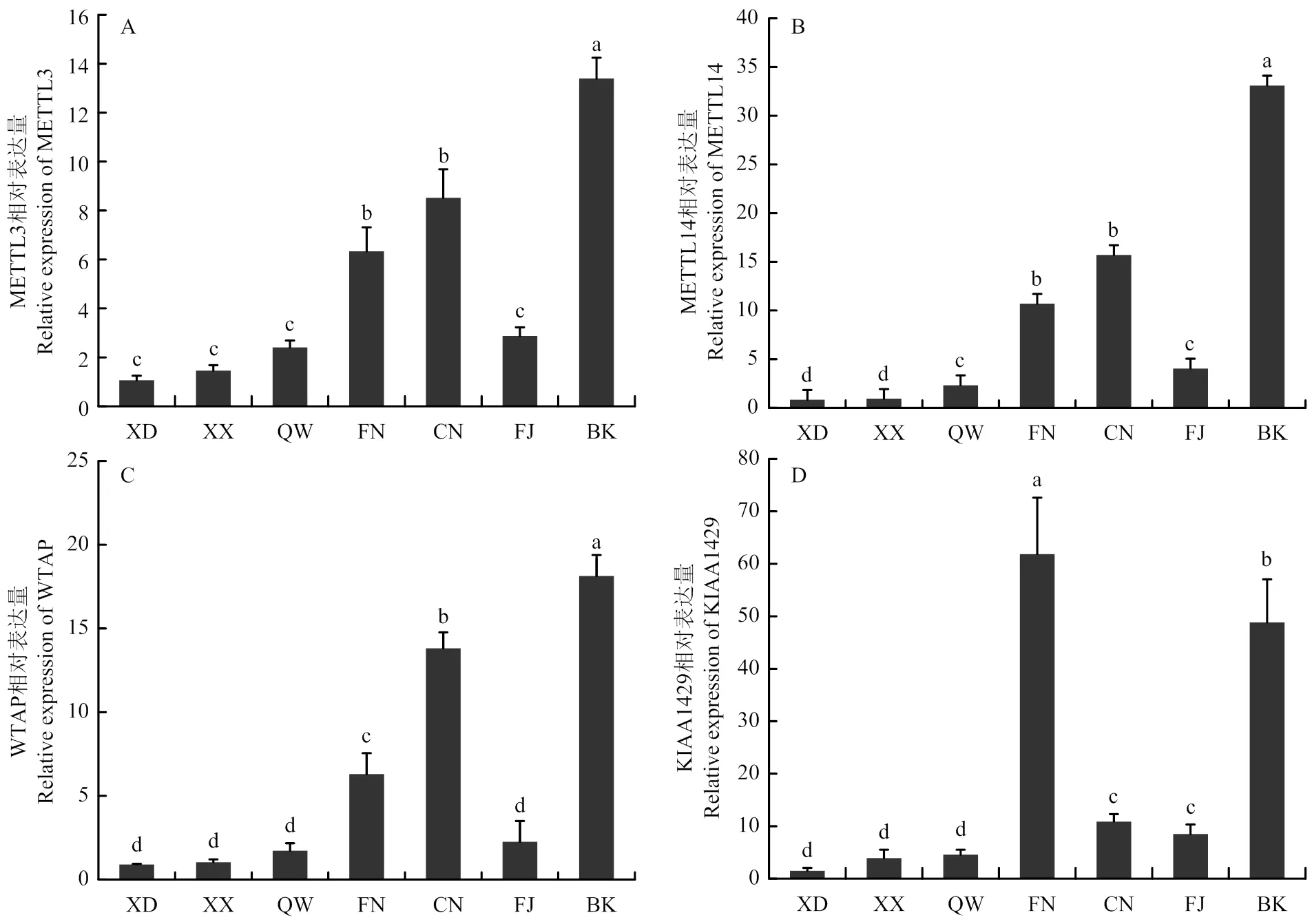
(A)METTL3基因;(B)METTL14基因;(C)WTAP基因;(D)KIAA1429基因。柱形图上字母相同者表示差异不显著(P>0.05),字母不同者表示差异显著(P<0.05)
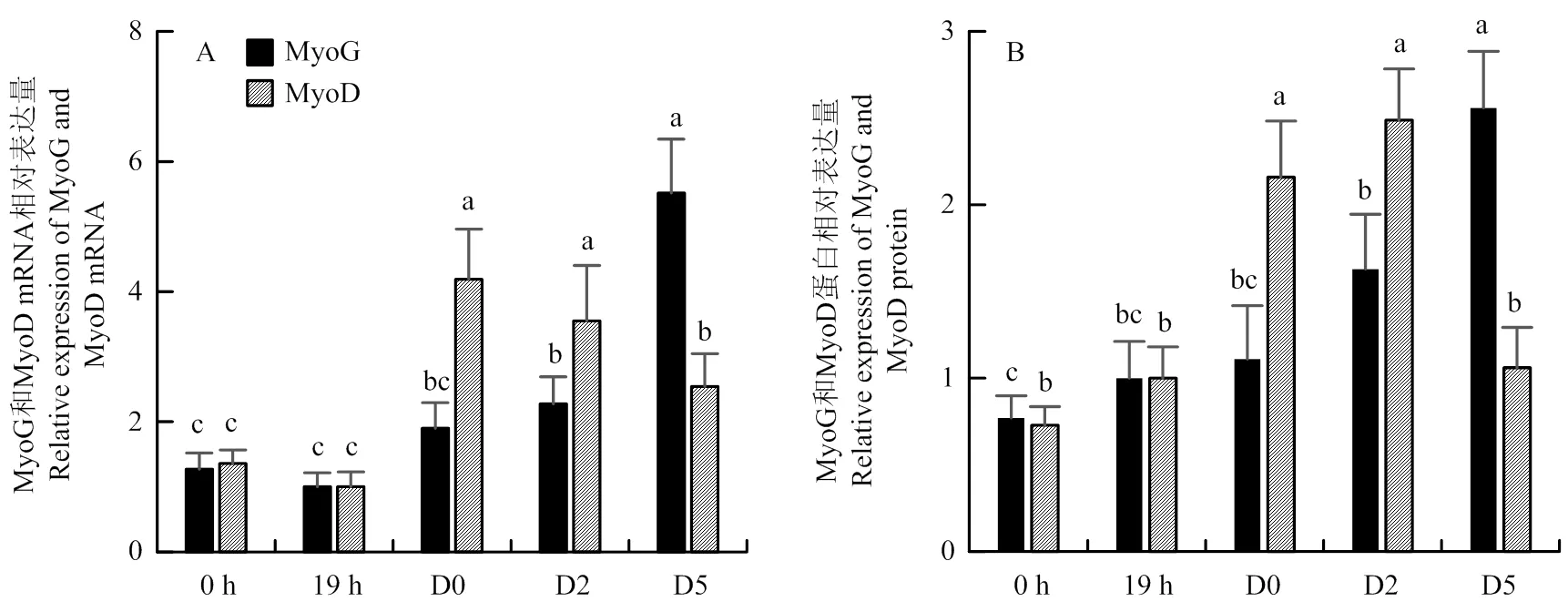
A:mRNA表达;(B)蛋白表达。0 h:新分离的鸡成肌细胞;19 h:增殖19 h的成肌细胞;D0:诱导分化当天的成肌细胞;D2:诱导分化2天的成肌细胞;D5:诱导分化5天的成肌细胞。柱形图上字母相同者表示差异不显著(P>0.05),字母不同者表示差异显著(P<0.05)
甲基化转移酶4个基因mRNA表达结果如图4所示,总体来说,4个基因在鸡原代成肌细胞分化前后均有表达,且在分化后细胞中的表达量要高于增殖期细胞中的表达量。
METTL3和METTL14基因表达变化趋势较为一致,均表现出先持续升高后下降的趋势,在诱导分化后2 d细胞中的表达量最高,显著高于增殖期和诱导分化当天(D0)细胞中的表达量(<0.05)。METTL3基因在刚分离0 h细胞中的表达量最低,显著低于其他时间点细胞中的表达量(<0.05);在诱导分化后5 d(D5)细胞中的表达量相较于诱导分化后2 d(D2)细胞中的表达量有所下降,差异不显著(>0.05),但显著高于其他时间点细胞中的表达量(<0.05)。METTL14基因在刚分离0 h细胞中的表达量最低,除19 h外,显著低于其他时间点细胞中的表达量(<0.05);在D5细胞中的表达量显著低于在D2细胞中的表达量(<0.05),略高于D0细胞中的表达量,但均显著高于诱导分化前细胞中的表达量(<0.05)。
WTAP和KIAA1429基因表达变化趋势也较为一致,均呈现持续上升的趋势,0 h细胞中的表达量最低,显著低于其他时间点(<0.05),至19 h显著上升,D0天略有增加,接着显著上升至D5达到高峰,WTAP基因在D5细胞中的表达量显著高于其他时间点(<0.05),而KIAA1429基因在D5细胞中的表达量略高于D2细胞中,显著高于其他时间点(<0.05)。
2.4 鸡成肌细胞分化前后内源性mRNA m6A甲基化水平分析
为了了解分化前后鸡成肌细胞中内源性RNA m6A甲基化水平,采用比色法检测成肌细胞分化前后不同时间点m6A甲基化水平,结果见图5。可见,成肌细胞分化期的m6A甲基化水平显著高于增殖期(<0.05),诱导分化第2天(D2)m6A甲基化水平达到最高,显著高于其他各时间点(<0.05),随后在诱导分化第5天(D5)显著下降(<0.05),略高于诱导分化当天(D0),但两者差异不显著(>0.05),说明m6A可能在鸡成肌细胞分化过程中具有重要的调控作用。

(A) METTL3 ; (B) METTL14; (C) WTAP; (D) KIAA1429
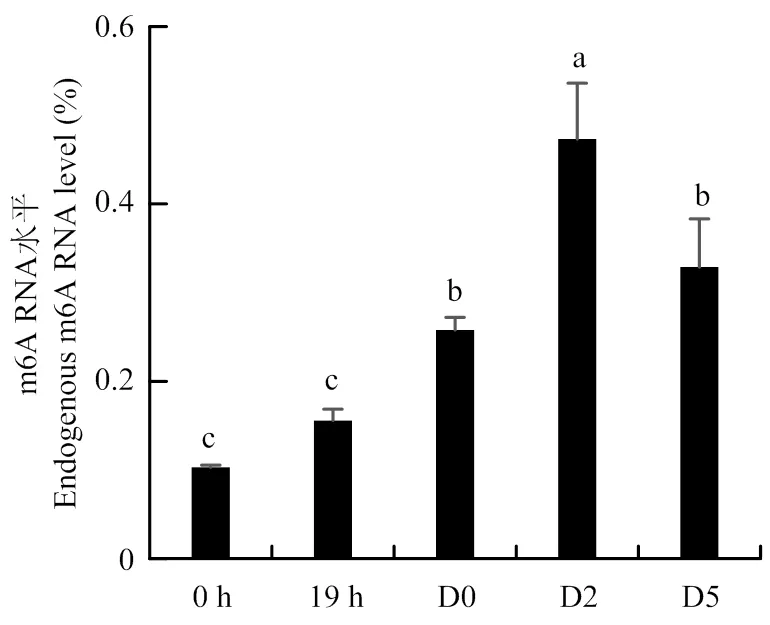
图5 鸡成肌细胞分化前后的m6A RNA 甲基化水平
2.5 肌肉中m6A甲基化转移酶相关基因之间及其表达量与肌纤维性状的相关性
研究表明,m6A调控动物肌肉生长发育[20-21]。故本研究分析了肌肉中m6A甲基化转移酶相关基因表达之间的关系及其对肌肉肌纤维性状的影响,结果见表3。m6A甲基化转移酶相关基因METTL3、METTL14、WTAP和KIAA1429表达水平之间均存在极显著的正相关(<0.01)。4个基因表达水平与红肌纤维比例(I+IIa (%))和肌纤维密度均呈显著或极显著正相关(<0.05 or<0.01),而与白肌纤维比例(IIb (%))和肌纤维直径则呈极显著的负相关(<0.01)。这些结果说明肌肉中m6A甲基化转移酶相关基因协同表达并对肌纤维类型的形成及转换具有一定调控作用。
2.6 成肌细胞中m6A甲基化转移酶相关基因之间及其表达量与m6A甲基化水平的相关性
成肌细胞中m6A甲基化转移酶相关基因表达之间的关系及其对细胞中m6A甲基化水平的影响,结果见表4。m6A甲基化转移酶相关基因METTL3、METTL14、WTAP和KIAA1429表达水平之间均存在极显著的正相关(<0.01);甲基化转移酶4个基因与成肌分化标志基因表达水平存在正相关关系,其中,与MyoG基因mRNA表达水平之间达到极显著(<0.01)。成肌细胞中m6A甲基化水平与6个基因表达水平之间均表现出正相关关系,除与WTAP基因表达差异不显著外(>0.05),与其他5个基因表达水平之间均达到呈显著或极显著正相关(<0.05 or<0.01)。

表3 肌肉中m6A甲基化转移酶相关基因之间及其表达量与肌纤维性状的相关性
*表示显著相关(0.01<<0.05=;**表示极显著相关(<0.01)。下同
* shows that there are significant relationship between two different index (0.01<<0.05);** shows that there are extreme significant relationship between two different index (<0.01). The same as below
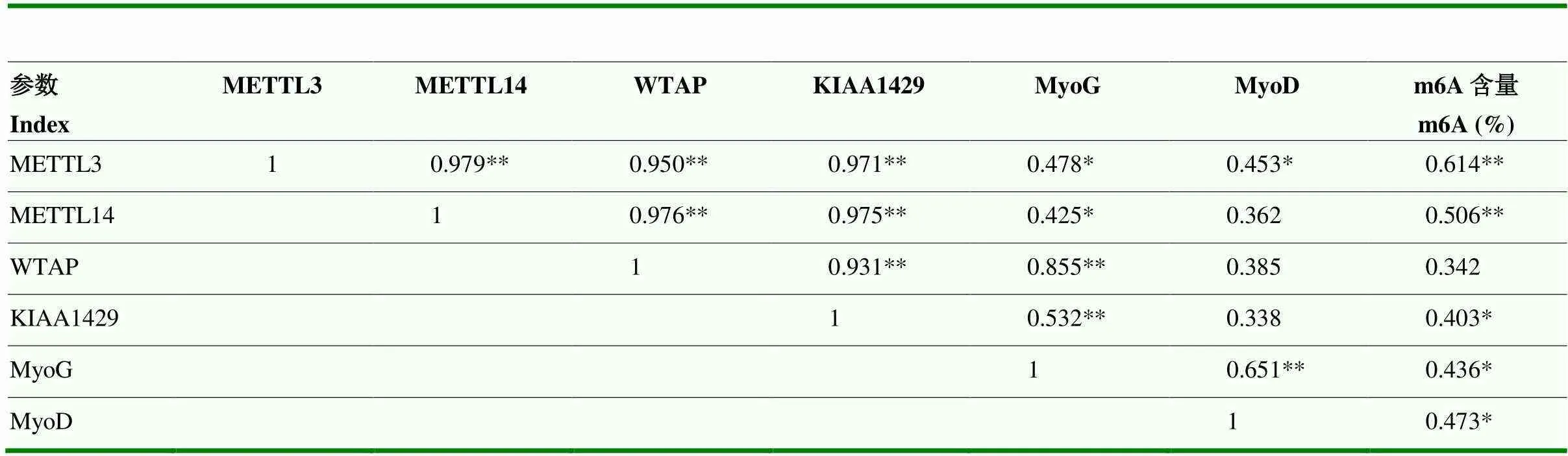
表4 成肌细胞中m6A甲基化转移酶相关基因之间及其表达量与m6A甲基化水平的相关性
3 讨论
3.1 广西麻鸡不同部位肌肉肌纤维类型组成
肌纤维作为构成肌肉的基本单位,不仅决定鸡骨骼肌的生长发育,还影响鸡肉的生理生化特性、屠宰后肌肉的代谢活动及感官品质。鸡肌肉中肌纤维肥大、肌纤维类型的决定与转化和肌内脂肪沉积是影响优良肉质性状形成的主要因素,因此,肌纤维类型及其转化的调节是改善肉质的重要途径[1]。禽类所有骨骼肌均是由不同类型肌纤维混合构成的,而各块肌肉中各种肌纤维的比例不同,鸡的胸肌以白肌纤维为主,腿部肌肉以红肌纤维为主[18]。Suzuki等[22]以罗斯1品系为研究对象,发现腿部肌肉群的耻坐骨肌内侧头、腓肠肌内侧头和缝匠肌均以红肌纤维为主,而髂胫外侧肌以白肌纤维为主,背部肌肉群的背阔肌则以红肌纤维为主。本研究首次采用ATPase染色法(pH10.4),成功对性成熟日龄的广西麻鸡胸大肌、胸小肌、髂胫外侧肌、腓肠肌内侧头、耻坐骨肌内侧头、缝匠肌和背阔肌等7个部位肌肉进行肌纤维分型及统计,结果验证了前人的研究结果[18, 22],广西麻鸡性成熟日龄胸部肌肉群的胸大肌和胸小肌全部由白肌纤维组成,腿部肌肉群的耻坐骨肌内侧头、腓肠肌内侧头和缝匠肌均以红肌纤维为主,而髂胫外侧肌以白肌纤维为主,背部肌肉群的背阔肌则以红肌纤维为主,其中腓肠肌内侧头和背阔肌中红肌纤维比例达到了80%左右。同时发现,红肌纤维比例多的肌肉肌纤维平均直径显著低于白肌纤维比例多的肌肉,而肌纤维密度则表现相反的结果,这也与课题组在前期对清远麻鸡不同类型肌肉的研究结果一致[23]。不同部位肌肉肌纤维类型组成的不同也为研究肌纤维类型形成和转换的分子机理提供了参考,胸肌和腓肠肌内侧头、背阔肌可以作为肌纤维类型形成和转换机理研究的理想模型。
3.2 广西麻鸡肌肉中m6A甲基化转移酶相关基因对肌纤维性状的调控
越来越多的研究表明,m6A RNA甲基化修饰在细胞分化、生长发育和压力应答等多种生理功能中均有重要作用[2-4]。mRNA的m6A修饰是由甲基转移酶复合体催化形成的,甲基化转移酶3(METTL3)发挥功能亚基作用;甲基化转移酶14(METTL14)主要负责识别RNA并与METTL3形成异二聚体[24],KIAA1429同样对甲基转移酶复合物的其他组分起到协同作用,也是m6A修饰的关键[25]。然而,目前尚无m6A RNA甲基化修饰在鸡骨骼肌发育和分化中的相关研究报道。鉴于METTL3、METTL14、WTAP和KIAA1429在m6A甲基化修饰中的重要功能,本研究初步探讨了上述基因在广西麻鸡肌肉肌纤维类型组成及成肌细胞分化中可能发挥的调控作用。
检测了m6A甲基化转移酶相关基因在肌纤维类型组成不同的肌肉中的表达差异及其表达对肌纤维性状的影响。结果发现,所研究的甲基化转移酶相关基因METTL3、METTL14、WTAP和KIAA1429在广西麻鸡不同部位肌肉中均有表达,与Tao等[21]在猪上研究结果一致,他们对野猪、长白猪和荣昌猪3个不同品种的肌肉组织进行转录组测定,绘制了m6A全转录组图谱,结果发现m6A在肌肉组织中广泛分布。本研究中,4个基因表达之间存在极显著的正相关关系,且METTL3、METTL14和WTAP具有相似的表达模式,说明这些基因存在协同表达,这也可能与这些基因在甲基化转移酶复合物中的作用有关[24, 26],在人类疾病研究中也发现,METTL3/METTL14/WTAP复合物同向调控乳腺癌的发生并产生不良预后[27]。研究表明,甲基化转移酶相关基因表达水平发生变化会影响体内mRNA的稳定性从而影响基因的表达,在小鼠胚胎干细胞(ESCs)中特异性敲除METTL3或METTL14会导致ESCs分化相关基因表达显著降低[28],而敲除KIAA1429基因则会导致小鼠胚胎发育阻滞,胚胎在出生前出现死亡的现象[29]。本研究发现,所研究的4个甲基化转移酶基因在红肌纤维比例高的肌肉中的表达量显著高于白肌纤维比例高的肌肉,这提示甲基化转移酶相关基因可能在鸡肌纤维类型组成及转换中发挥了一定的调控作用,关联结果也表明,所研究的甲基化转移酶相关基因的表达与红肌纤维比例呈显著的正相关,与白肌纤维比例则呈显著的负相关,说明这些基因的高表达有利于红肌纤维的生成和维持。
3.3 鸡m6A甲基化转移酶相关基因对成肌细胞分化的调控
研究发现,m6A甲基化修饰对成肌细胞分化具有重要的调控作用[16]。课题组前期研究了鸡成肌细胞的增殖分化规律,发现在培养1 d时,已有部分细胞分化发生融合,形成多核肌管[30],故选择在分离后19h即使用分化培养基诱导分化。本研究发现,随着成肌细胞的分化,成肌分化标志基因MyoG的表达水平逐步上升,在诱导分化第5天最高;而MyoD基因则呈现先升高后降低的趋势,这也与Sabourin[31]报道MyoD是成肌分化早期的标志基因、MyoG是分化后期的标志基因的结论相吻合。随着成肌细胞的分化,内源性RNA m6A甲基化水平逐步上升,分化期的水平显著高于增殖期,且在诱导分化第2天达到最高水平,且与成肌分化标志基因的表达存在显著的正相关关系,说明m6A甲基化修饰在成肌细胞分化中发挥着正向调控作用,与Chen等[16]在小鼠中的研究结果一致。所研究的m6A甲基化转移酶4个基因在鸡成肌细胞分化前后均有表达,且随着成肌细胞的分化,表达量显著上升,说明这些基因的表达对成肌细胞的分化具有正向的调控作用,这与Kudou 等[17]在小鼠增殖期成肌细胞中的研究结果一致,他们研究发现,METTL3通过介导 MyoD 等肌源性转录因子 mRNA 的 5’UTR的 m6A 修饰维持增殖性骨骼肌祖细胞的肌源性潜能,提示 METTL3 参与肌源性祖细胞的骨骼肌分化潜能,同时也是骨骼肌分化的关键调节因子。本研究中,成肌细胞中甲基化转移酶相关基因表达之间均存在极显著的正相关关系,进一步在细胞水平证明了这些基因存在协同表达。在小鼠胚胎干细胞中敲低METTL3或METTL14的研究显示:其数千个位点上的mRNA甲基化减少高达99%[32];Wilms瘤相关蛋白(WTAP)则发挥调节亚基的作用,并在RNA代谢调节中发挥关键作用[26],METTL3、METTL14和WTAP的表达降低都会导致m6A水平的下降[24, 32];本研究基因表达与细胞中内源性RNA m6A甲基化水平关联分析结果也发现,所研究的甲基化转移酶相关基因表达与m6A甲基化水平之间存在正相关关系,这一结果说明在鸡上这些甲基化转移酶基因的表达水平对m6A甲基化修饰水平具有促进作用。
4 结论
4.1 首次采用ATPase染色法了解了广西麻鸡胸大肌、胸小肌、髂胫外侧肌、腓肠肌内侧头、耻坐骨肌内侧头、缝匠肌和背阔肌等7个部位肌肉的肌纤维类型组成,为鸡肌肉肌纤维类型组成及转换的分子机理研究提供了模型参考。
4.2 利用实时荧光定量PCR探究了m6A甲基化转移酶相关基因METTL3,METTL14,WTAP和KIAA1429在广西麻鸡不同部位肌肉中和成肌细胞分化前后的表达量差异,研究结果表明上述4个基因协同表达,在红肌纤维为主的肌肉中的表达量高于白肌纤维为主的肌肉,在分化期成肌细胞中的表达量要显著高于增殖期,4个基因的表达与成肌细胞中m6A甲基化修饰水平之间也存在正向调控机制,提示这4个甲基化转移酶基因可能对鸡肌纤维类型的组成、维持以及成肌细胞的分化具有重要的调控作用,为进一步研究鸡肌纤维类型的形成和转换机理提供了新的思路。
[1] Lefaucheur L. A second look into fiber typing--relation to meat quality. Meat Science, 2010, 84(2): 257-270.
[2] Dominissini D, Moshitch-Moshkovitz S, Schwartz S, Salmon-Divon M, Ungar L, Osenberg S, Cesarks K, Jacob-Hirsch J, Amariglio N, Kupiec M, et al. Topology of the human and mouse m6A RNA methylomes revealed by m6A-seq. Nature, 2012, 485(7397): 201-206.
[3] Lin Z, Hsu P J, Xing X D, Fang J H, Lu Z K, Zou Q, Zhang K J, Zhang X, Zhou Y C, Zhang T, et al. Mettl3-/Mettl14-mediated mRNA N(6)-methyladenosine modulates murine spermatogenesis. Cell Research, 2017, 27: 1216-1230.
[4] Zhao B X S, Roundtree I A, He C. Post-transcriptional gene regulation by mRNA modifications. Nature Reviews Molecular Cell Biology,2017, 18: 31-42.
[5] Ashmore C R, Doerr L. Comparative aspects of muscle fiber types in different species. Experimental Neurology, 1971, 31: 408-418.
[6] Zierath J R, Hawley J A. Skeletal muscle fiber type: influence on contractile and metabolic properties. PLoS Biology, 2004, 2(10): e348.
[7] Schiaffino S, Sandri M, Murgia M. Activity-dependent signaling pathways controlling muscle diversity and plasticity. Physiology, 2007, 22: 269-278.
[8] Bokar J A, Shambaugh M E, Polayes D, Matera A G, Rottman F M. Purification and cDNA cloning of the AdoMet- binding subunit of the human mRNA (N6-adenosine)-methyltransferase. RNA, 1997, 3(11): 1233-1247.
[9] Bokar J A, Rath-Shambaugh M E, Ludwiczak R, Narayan P, Rottman F. Characterization and partial purification of mrna n6-adenosine methyltransferase from hela cell nuclei. internal mrna methylation requires a multisubunit complex. Journal of Biological Chemistry, 1994, 269(26), 17697-17704.
[10] Fu Y, Dominissini D, Rechavi G, He C. Gene expression regulation mediated through reversible m6A RNA methylation. Nature Reviews Genetics, 2014, 15(5):293-306.
[11] Roundtree I A, Evans M E, Pan T, He C. Dynamic RNA modifications in gene expression regulation. Cell, 2017, 169(7): 1187-1200.
[12] Bi Z, Liu Y H, Zhao Y L, Yao Y X, Wu R F, Liu Q, Wang Y Z, Wang X X. A dynamic reversible RNA N(6)-methyladenosine modification: current status and perspectives. Journal of Cellular Physiology, 2019, 234(6): 1-9.
[13] Wang X, Feng J, Xue Y, Guan Z Y, Zhang D L, Liu Z, Gong Z, Wang Q, Huang J B, Tang C, et al. Structural basis of N(6)-adenosine methylation by the METTL3-METTL14 complex. Nature, 2016, 534: 575-578.
[14] Ping X L, SUN B F, WANG L, XIAO W, YANG X, WANG W J, ADHIKARI S, SHI Y, LV Y, CHEN Y S, ZHAO X, LI A, YANG Y, DAHAL U, LOU X M, LIU X, HUANG J, YUAN W P, ZHU X F, CHENG T, ZHAO Y L, WANG X Q, DANIELSEN J M R, LIU F, YANG Y G. Mammalian WTAP is a regulatory subunit of the RNA N6-methyladenosine methyltransferase. Cell Research, 2014, 24(2): 177-189.
[15] Yue Y, Liu J, Cui X, Cao J, Luo G, Zhang Z, Cheng T, Gao M, Shu X, Ma H, et al. VIRMA mediates preferential m(6)a mRNA methylation in 3'UTR and near stop codon and associates with alternative polyadenylation. Cell Discovery, 2018, 4: 10.
[16] Chen J N, Chen Y, Wei Y Y, Raza M A, Zou Q, Xi X Y, Zhu L, Tang G Q, Jiang Y Z, Li X W.Regulation of m6A RNA methylation and its effect on myogenic differentiation in murine myoblasts. Molecular Biology, 2019, 53(3): 384-392.
[17] Kudou K, Komatsu T, Nogami J, Maehara K, Harada A, Saeki H, Oki E, Maehara Y, Ohkawa Y. The requirement of Mettl3-promoted MyoD mRNA maintenance in proliferative myoblasts for skeletal muscle differentiation. Open Biology, 2017, 7(9): 170119.
[18] 罗克. 家禽解剖学与组织学. 福州:福建科学技术出版社. 1983: 27-44.
Luo K. Anatomy and Histology of Poultry. Fuzhou: Fujian Science and Technology Press. 1983: 27-44. (in Chinese)
[19] Luo W, Wu H, Ye Y, Li Z, Hao S, Kong L, Zheng X, Lin S, Nie Q, Zhang X. The transient expression of miR-203 and its inhibiting effects on skeletal muscle cell proliferation and differentiation. Cell Death & Disease, 2014, 5: e1347.
[20] XU T S, XU Z J, LU L Z, ZENG T, GU L H, HUANG Y Z, ZHANG S J, YANG P, WEN Y F, LIN D J, XING M P, HUANG L L, LIU G J, CHAO Z, SUN W P. Transcriptome-wide study revealed m6A regulation of embryonic muscle development in Dingan goose (Anser cygnoides orientalis). BMC Genomics, 2021, 22: 270.
[21] Tao X, Chen J, Jiang Y, Wei Y Y, Chen Y, Xu H M, Zhu L, Tang G Q, Li M Z, Jiang A A, et al. Transcriptome-wide N ( 6) -methyladenosine methylome profiling of porcine muscle and adipose tissues reveals a potential mechanism for transcriptional regulation and differential methylation pattern. BMC Genomics, 2017, 18(1): 336.
[22] Suzuki A, Tsuchiya T, Ohwada S, Tamate H. Distribution of myofiber types in thigh muscles of chickens. Journal of Morphology, 1985, 185: 145-154.
[23] Shu J T, Xiao Q, Shan Y J, Zhang M, Tu Y J, Ji G G, Sheng Z W, Zou J M. Oxidative and glycolytic skeletal muscles show marked differences in gene expression profile in Chinese Qingyuan partridge chickens. PLoS ONE, 2017, 12(8): e0183118.
[24] Liu J Z, Yue Y N, Han D L, Wang X, Fu Y, Zhang L, Jia G F, Yu M, Lu Z K, Deng X. A METTL3-METTL14 complex mediates mammalian nuclear RNA N6-adenosine methylation. Nature Chemical Biology, 2014, 10(2): 93-95.
[25] Schwartz S, Mumbach M R, Jovanovic M, Wang T, Maciag K, Bushkin G G, Mertins P, Ter-Ovanesyan D, Habib N, Cacchiarelli D, et al. Perturbation of m6A writers reveals two distinct classes of mRNA methylation at internaland 5' Sites. Cell Reports, 2014, 8(1): 284-296.
[26] Ping X L, Sun B F, Wang L, Xiao W, Yang X, Wang W J, Yang Y C. Mammalian WTAP is a regulatory subunit of the RNA N6-methyladenosine methyltransferase. Cell Research, 2014, 24(2): 177-189.
[27] Wu L, Wu D, Ning J, Liu W, Zhang D. Changes of N6- methyladenosine modulators promote breast cancer progression. BMC Cancer, 2019, 19: 326.
[28] Pedro J B, Benoit M, Jinkai W, Qu K, Zhang J J, Li L J, Donna M B, Chang H Y. m6A RNA modification controls cell fate transition in mammalian embryonic stem cells. Cell Stem Cell, 2014, 15(6): 707-719.
[29] 魏巍. KIAA1429 在小鼠胚胎发育过程中的功能研究[D]. 南宁: 广西大学, 2017.
Wei W. Study on the function of KIAA1429 in mouse embryo development [D]. Nanning: Guangxi University, 2017. (in Chinese)
[30] Shan Y J, Ji G G, Zou J M, Zhang M, Tu Y J, Liu Y F, Ju X J, Shu J T. PGC-1α differentially regulates the mRNA expression profiles of genes related to myofiber type specificity in chicken. Journal of Integrative Agriculture, 2020, 19(8): 2083-2094.
[31] Sabourin L A, Rudnicki M A. The molecular regulation of myogenesis. Clinical Genetics, 2010, 57: 16-25.
[32] Geula S, Moshitch-Moshkovitz S, Dominissini D, Mansour A A, Kol Nitzan, Salman-Divon M, Hershkovitz V, Peer E, Mor N, Manor Y S, et al. Stem cells. m6A mRNA methylation facilitates resolution of naive pluripotency toward differentiation. Science, 2015, 347(6225): 1002-1006.
Relationship Between Expression Levels of Guangxi Partridge Chicken m6A Methyltransferase Genes, Myofiber Types and Myogenic Differentiation
SHU JingTing1, SHAN YanJu1, JI GaiGe1, ZHANG Ming1, TU YunJie1, LIU YiFan1, JU XiaoJun1, SHENG ZhongWei1, TANG YanFei2, LI Hua3, ZOU JianMin1*
1Key Laboratory for Poultry Genetics and Breeding of Jiangsu Province, Jiangsu Institute of Poultry Science, Yangzhou 225125, Jiangsu;2Guangxi Fufeng Farm Group Co., Ltd. Nanning 530024;3Foshan University, Foshan 528225, Guangdong
【Objective】It is widely accepted that the regulation of myofiber type composition and transition is an important source of variation to improve meat quality. Recently, several studies revealed that N6-methyladenosine (m6A) RNA methylation played a important biological role in the regulation of muscle differentiation. In the present study, the myofiber types of different location of skeletal muscles were identified in the native chicken breed-Guangxi partridge chicken, and the expression levels of the m6A methyltransferase genes (METTL3, METTL14, WTAP and KIAA1429) were first studied in different location of skeletal muscle and myogenic differentiation, which would provide a reference for clarifying the regulation mechanism of chicken myofiber type composition and transition.【Method】Myosin ATPase staining was used to identify the myofiber types and to measure the myofiber size and density of seven location of Guangxi partridge chicken muscles, including the(XD),(XX),(FJ),(CN),(FN),(QW) and(BK). Colorimetric method was used to detect the endogenous m6A methylation levels at different time points before and after myogenic differentiation. Expression of METTL3, METTL14, WTAP and KIAA1429 was quantified by RT-PCR in these seven muscles, as well as at the myoblasts separated on 0 h, 19 h, and cultured in differentiation medium on D0, D2, and D5, and the correlations between the gene expression levels and myofiber characteristics as well as m6A methylation levels were also analyzed by SPSS20.0 software.【Result】The XD and XX muscles of the breast muscle group were all composed of white myofibers, CN, FN and FJ muscles of the leg muscle group were mainly composed of red myofibers, and QW muscles were mainly composed of white myofibers, while the BK muscles of the back muscle group were mainly composed of red myofibers. The average fiber densities of muscles mainly composed of red myofibers were significantly higher than those mainly composed of white myofibers. The expression patterns of METTL3, METTL14, WTAP and KIAA1429 showed significant differences in tissue and time-specific fashion. Overall, the expression levels of the four genes in muscles mainly composed of red myofibers were higher than those mainly composed of white myofibers, and in differentiated myoblasts were significantly higher than those in proliferative myoblasts. The muscle METTL3, METTL14 and WTAP gene showed similar expression patterns, the highest expression level was appeared in BK muscles, which were significantly higher than that in all the other studied muscles; the expression levels in CN and FN muscles were also significantly higher than those in FJ, XD, XX and QW muscles. The highest expression level of KIAA1429 was appeared in FN muscles, which were significantly higher than that in all the other studied muscles; the expression levels in BK muscles were also significantly higher than those in CN, FJ, XD, XX and QW muscles; the lowest expression level was appeared in XD muscles, but the differences were not significantly when compared to XX and QW. In chicken myoblasts, both METTL3 and METTL14 gene showed continuous increasing and then decreasing expression pattern, the lowest expression level was appeared at 0h newly separated myoblasts, and the highest level was appeared at D2 induced differentiation myoblasts, which were significantly higher than those in proliferative myoblasts and D0 induced differentiation myoblasts. The consistent expression pattern was also found in WTAP and KIAA1429 gene, showed continuous increasing expression pattern; the lowest expression level was appeared at 0h newly separated myoblasts, significantly lower than that in other studied time points, then significantly increased at 19 h, and then slightly increased at D0, then significantly increased from D0 to D5. The endogenous m6A RNA methylation levels increased along with myogenic differentiation, and the levels in differentiation myoblasts also showed significantly higher than those in proliferative myoblasts, the highest methylation level was appeared at D2 induced differentiation myoblasts, then significantly increased from D2 to D5; however, the methylation level at D5 was higher than that at D0. Significant positive relationships were observed for the expression of studied genes in different muscle tissues as well as in myoblasts. Meanwhile, the skeletal muscle expression of these four genes was all showed significant positive relationships with red myofiber ratio, and significant negative relationships with red myofiber ratio. Positive relationships were also observed between the expression of studied genes in myoblasts and m6A methylation levels.【Conclusion】There were differences in muscle fiber type composition in different parts of the muscle of Guangxi partridge chicken. Differential expression and coordinated developmental regulation of the selected m6A methyltransferase genes in the chicken skeletal muscles and myoblasts, and these genes might play a role in the regulation of the myofiber type composition, maintain, and myogenic differentiation.
Guangxi partridge chicken; gene expression; m6A methyltransferase genes; myofiber type; myogenic differentiation
2020-12-16;
2021-03-30
江苏省农业自主创新资金(CX(20)3003)、现代农业产业技术体系专项资金(CARS-41)、江苏省种业创新揭榜挂帅项目(JBGS[2021]107)、江苏省农业重大新品种创制项目(PZCZ201728)、江苏现代农业(肉鸡)产业技术体系集成创新中心(JATS[2021]396)、江苏省自然科学基金(BK20211121,BK20210955)
束婧婷,E-mail:shujingting@163.com。通信作者邹剑敏,E-mail:jqszjm@163.com
(责任编辑 林鉴非)
