动物源金黄色葡萄球菌生物被膜形成能力与分子分型关系研究
2022-03-04唐子云胡健欣陈进陆毅兴孔伶俐刁露张发福熊文广曾振灵
唐子云,胡健欣,陈进,陆毅兴,孔伶俐,刁露,张发福,熊文广,曾振灵
动物源金黄色葡萄球菌生物被膜形成能力与分子分型关系研究
唐子云,胡健欣,陈进,陆毅兴,孔伶俐,刁露,张发福,熊文广,曾振灵*
华南农业大学兽医学院/广东省兽药研制与安全评价重点实验室/岭南现代农业科学与技术广东省实验室/国家兽医微生物耐药性风险评估实验室,广州 510642
【目的】调查产生生物被膜的金黄色葡萄球菌流行病学特征,探究生物被膜形成能力与分子型之间的相关性,为治疗动物金黄色葡萄球菌感染提供理论依据。【方法】以广东省兽药研制与安全评价重点实验室保存的98株金黄色葡萄球菌为研究对象,用结晶紫半定量法测定所有菌株生物被膜形成能力,将产膜菌株进行22种常见抗菌药的最小抑菌浓度测定,通过金黄色葡萄球菌常见3种(、MLST和PFGE)分型方式进行分子分型,并分析产膜能力与分子型之间的相关性,最后通过全基因组测序技术分析生物被膜产生菌株中耐药基因和毒力基因携带状况。【结果】结晶紫半定量结果显示,98株金黄色葡萄球菌中能产生生物被膜的菌株共计23株,占23.47%。包括牛乳源22株(占比25.29%,22/87),其中14株(占比60.87%,14/22)来自浙江奶牛养殖场,8株(占比39.13%,8/22)来自福建奶牛养殖场,以及猪源1株(占比9.10%,1/11),来自广东屠宰场,说明牛乳源金黄色葡萄球菌产膜潜力高于猪源;将产膜能力划分为强、中、弱3个等级,23株产膜菌株中,其中强产膜菌株2株(占比8.70%,2/23),中产膜菌株9株(占比39.13%,9/23),以及弱产膜菌株12株(占比52.17%,12/23)。药敏试验显示,牛乳源产膜菌株对所有受试抗菌药物敏感,而猪源产膜菌株对青霉素、阿莫西林、头孢噻呋、头孢西丁、恩诺沙星、环丙沙星、克林霉素、多西环素、红霉素、氟苯尼考、复方新诺明、泰妙菌素、替米考星13种抗菌药均表现出耐药;分型结果显示,98株金黄色葡萄球菌共获得8种型,产膜的23株金黄色葡萄球菌占其中3种:1株t2922型来自广东猪源,14株t2119来自浙江牛乳源,8株t189来自福建牛乳源;MLST分型结果显示,98株菌共分为9种ST型,其中6种ST型不具有产生生物被膜的能力,分别为ST398、ST522、ST705、ST1651、ST479和ST151,仅3种ST型的菌株具有生物被膜产生能力,分别为ST9、ST7和ST188。结果表明,强产膜菌株分子型主要为ST7-t2119,中产膜菌株主要为ST7-t2119和ST188-t189,弱产膜菌株为ST9-t2922、ST7-t2119和ST188-t189;同时结合PCA分析不同ST型组间差异性发现,弱产膜菌株的ST型能与中强产膜菌株很好的区分开来,只有特定ST型的金黄色葡萄球菌才具有产生生物被膜的能力。23株产膜菌株PFGE分型全部成功,结果显示,广东、福建、浙江三省产膜菌株共分为3种PFGE型,且PFGE型存在地域分布特征,同一地区的分离株可能存在克隆传播,但克隆株之间生物被膜产生能力有明显差异;全基因组测序结果显示,产膜菌株中耐药基因和毒力基因根据分子型不同携带情况呈现多样性。【结论】不同来源的金黄色葡萄球菌有不同程度产生生物被膜的潜力,且均携带多种不同的产膜基因,牛乳源金黄色葡萄球菌产膜潜力远远高于猪源;菌株能否产膜与ST型存在强相关性,特定的ST型如ST9、ST7和ST188更容易产生生物被膜。
金黄色葡萄球菌;生物被膜;耐药性;分子分型;毒力基因
0 引言
【研究意义】金黄色葡萄球菌()作为一种自然界广泛存在的革兰氏阳性菌,是导致条件致病的人畜共患病原菌,通常定植在动物表皮和黏膜上,能引起多种组织炎症和伤口恶化[1-2]。同时,金黄色葡萄球菌往往携带大量的毒力基因,如各类肠毒素基因,定植在熟肉制品、水产品、粮食制品中,误食后对人体肠道产生破坏,导致恶心、呕吐等中毒症状[3-5]。在人医临床上,金黄色葡萄球菌在引起血液感染的病原菌中常居首位[6]。在畜牧养殖业上,金黄色葡萄球菌不仅是引起奶牛乳房炎的主要病原菌之一,且能导致猪的渗出性皮炎,犬脓皮病等,该病给畜牧养殖业带来巨大威胁[7-9]。【前人研究进展】细菌生物被膜或称细菌生物膜(bacterial biofilm,BF),是细菌黏附于特定载体表面,分泌大量多糖蛋白[10],在多糖黏附素的作用下逐渐堆积并产生完整的保护性外膜,成熟的外膜产生一段时间后,可将被包裹的菌体释放并寻找新的黏附载体继续形成新的包裹。定植于奶牛乳房表面的金黄色葡萄球菌一旦形成生物被膜,将成为一个巨大且源源不断的细菌聚集输出体,生物被膜的屏障作用导致药物无法到达靶作用位点从而失去药效,而生物被膜处于动态的溶解释放与再生状态[11-14],导致细菌源源不断地被释放到组织中,形成隐性感染和持续感染。而盲目改变抗菌药种类和提高用药剂量,只会导致细菌耐药现状的加剧,同时给养殖业造成极大威胁。【本研究切入点】本研究通过对实验室分离保存的98株金黄色葡萄球菌进行生物被膜形成能力检测,对产膜菌株进行最小抑菌浓度测定、分子分型以及全基因组测序,探讨生物被膜形成与分子型之间的关系。【拟解决的关键问题】了解产膜的金黄色葡萄球菌耐药情况和分子特点,分析生物被膜形成与分子型之间的相关性,为兽医临床使用抗菌药治疗动物金黄色葡萄球菌感染提供有效指导。
1 材料与方法
1.1 试验材料
1.1.1 主要试剂及培养基 TaKaRa TaqTM、dNTP Mixture以及DL2000均购自宝生物工程(大连)有限公司;乙二胺四乙酸、Tris 碱、硼酸、氢氧化钠、浓盐酸、冰醋酸、甲醇、丙酮、无水乙醇、结晶紫等购自广州化学试剂厂。葡萄糖、10×PBS、聚苯乙烯96孔板购于广东凯阁生物技术有限公司。溶菌酶、溶葡萄球菌素、I酶、I酶均购自生工生物工程(上海)股份有限公司;细菌全基因组提取试剂盒购于广州碧尧德生物科技有限公司。
金黄色葡萄球菌显色培养基,高盐甘露醇琼脂培养基,7.5% NaCl 肉汤,水解酪蛋白琼脂培养基(Mueller-HintonAgar),水解酪蛋白肉汤(MH Broth)购自广东环凯微生物科技有限公司。LB 琼脂培养基(Luria-Bertani Agar),LB 肉汤(Luria-Bertani Broth)购于青岛海博生物有限公司。
1.1.2主要仪器 恒温震荡箱,电热恒温干燥箱,电子分析天平,-20℃冰箱,-80℃超低温冰箱高压灭菌锅,微量移液器,Milli-Q 超纯水仪,恒温金属浴电动移液枪,超净工作台,电热恒温培养箱,台式高速离心机,紫外分光光度计、PCR扩增仪、脉冲场凝胶电泳仪、电泳凝胶成像系统、DNA浓度测定仪等。
1.1.3 抗菌药物 阿莫西林、苯唑西林、青霉素、头孢噻呋、头孢西丁、庆大霉素、阿米卡星、多西环素、替加环素、氟苯尼考、红霉素、替米考星、利福平、万古霉素、克林霉素、泰妙菌素、环丙沙星、恩诺沙星、磷霉素、利奈唑胺、泰利唑胺、复方新诺明共22种,参照美国临床和实验室标准化委员会(CLSI)标准进行抗菌药物的配制[15]。
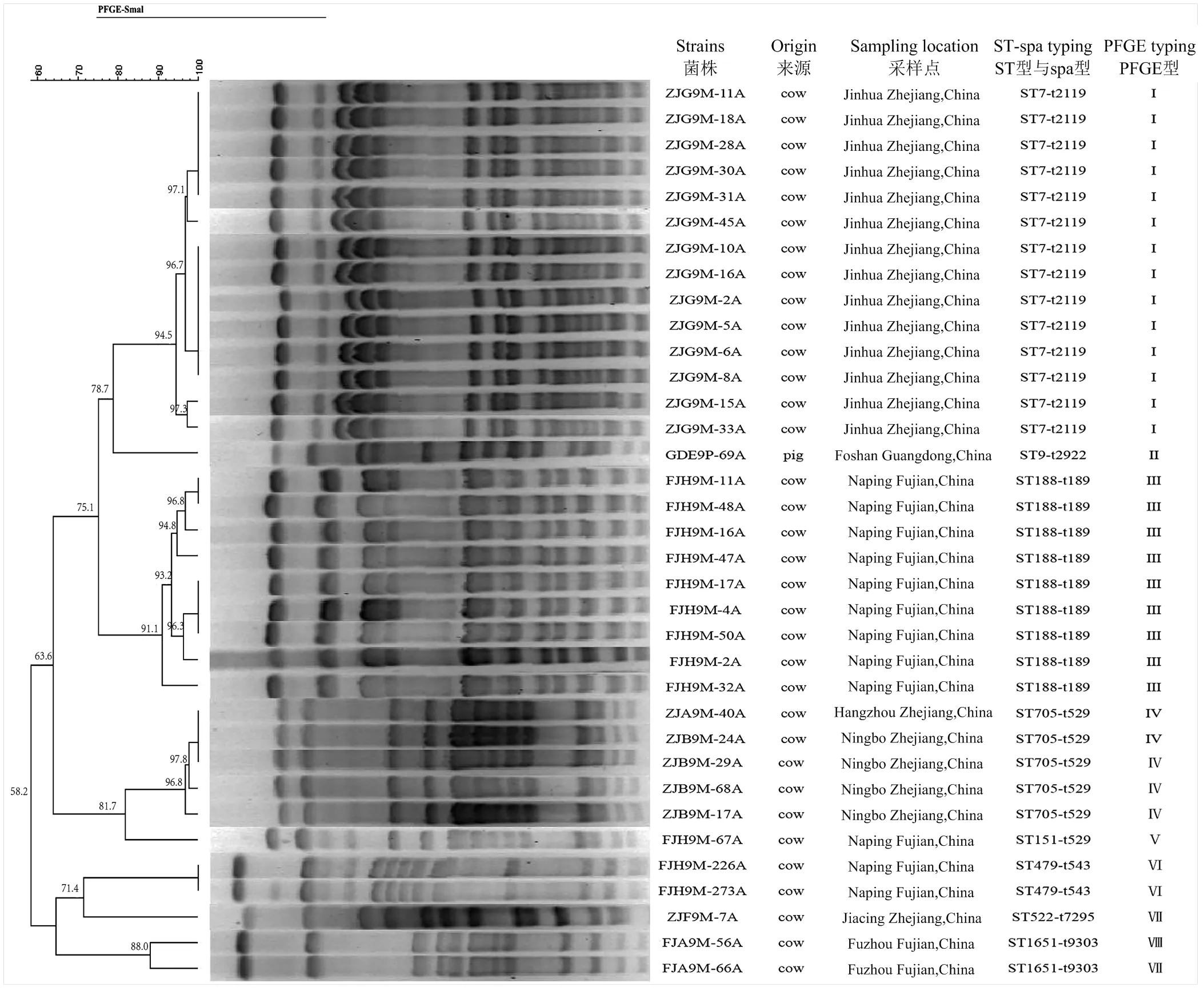
1.1.4 菌株来源 以广东省兽药研制与安全评价重点实验室2019年间分离保存的98株动物源金黄色葡萄球菌为研究对象,菌株信息见表1,金黄色葡萄球菌标准菌株ATCC29213和耐甲氧西林金黄色葡萄球菌(MRSA)ATCC43300来自于该实验室保存。

表1 本研究菌株信息
1.2 试验方法
所有试验于2019—2020年在华南农业大学广东省兽药研制与安全评价重点实验室,以及国家兽医微生物耐药性风险评估实验室开展。
1.2.1 结晶紫半定量 将受试菌株和ATCC43300划线于高盐甘露醇平板,37℃培养48 h。挑单菌落于高压灭菌过的BHI肉汤试管(含0.25%葡萄糖)中,于37℃、180 r/min摇床振荡过夜;在96孔板第1—11列加入199 μL BHI肉汤后,1—10每列加1 μL菌液小心混匀,第11列加入等量ATCC43300菌液作阳性对照,第12列加入200 μL BHI肉汤作为阴性对照;每株菌设8个平行,静置培养24 h以便膜在底部形成;小心移除培养基后每列用200 μL 1×PBS吹洗,每列吹洗3次以除去浮游细菌,丢弃最后一次洗涤液并在超净台中吹风晾干20 min,每列加入150 μL甲醇固定5 min,倒弃液体并加入100 μL结晶紫染色20 min;用缓水冲洗至阴性对照孔水流呈无色,加入洗脱液洗脱20 min后酶标仪测OD595,重复3次,并计算平均值。根据所测OD值大小将生物被膜产生能力划分为强中弱三个等级,规定强OD595>3,中2<OD595≤3,弱1<OD595≤2,统计分析结果并筛选得到产膜菌株。
1.2.2 最小抑菌浓度测定 依照美国临床和实验室标准化委员会(CLSI)标准推荐,采用琼脂稀释法对23株产膜金黄色葡萄球菌进行最小抑菌浓度的测定,并将ATCC29213作为每组质控菌株。根据CLSI-2019 和欧洲共同体药敏试验委员会(the European committee on antimicrobial susceptibility testing,EUCAST)标准进行结果判断[15]。
1.2.3 分子分型 采用水煮法粗提细菌基因组,挑取甘露醇平板划线的单菌落于LB平板上培养生长12 h后刮取少量细菌于装有灭菌1×TE的1.5 mL EP管中,充分混匀。于103.5℃金属浴中加热10 min后迅速转移至-20℃冰箱中急冻30 min以上,再转移至金属浴加热10 min后13 000×离心3 min迅速转移至新的EP管中,并做好编号,长期保存于-20℃冰箱备用。
分型。委托北京擎科生物科技有限公司进行引物合成,引物序列见表2。PCR扩增步骤:配制25 μL反应体系:10×rTaq buffer 2.5 μL,dNTP mixture 2.0 μL,上、下游引物各0.5 μL,rTaq酶0.125 μL,模板1 μL,加超纯水至25 μL充分混匀;反应程序按照{94℃×5min+[94℃×30s+Tm×30s+72℃×50s]×30+72℃×10 min}进行扩增后用凝胶电泳成像系统拍照保存。将阳性条带的扩增产物送至北京擎科生物科技有限公司进行一代测序,测序结果剪切后提交至金黄色葡萄球菌分型网站(http://spa.ridom.de/ submission.shtml)比对得到结果。

表2 spa分型引物合成表
MLST分型。参考金黄色葡萄球菌MLST分型网站(http://saureus.mlst.net)提供的7对管家基因引物序列进行引物合成(表3),PCR扩增参数:{94℃×5min+[94℃×60s+55×60s+72℃×60s]×30+72℃×10min}将扩增产物送至北京擎科生物科技有限公司进行一代测序,测序结果提交至MLST数据库(http://saureus.mlst.net)比对结果。

表3 MLST分型引物合成表
PFGE分型。参照刘保光等[18]的方法将产膜菌株进行PFGE分型,并将分型结果输入到BioNumerics 6.6 软件进行亲缘关系分析。
1.2.4 全基因组测序 按照全基因组试剂盒提供的方法改良提取金黄色葡萄球菌细菌基因组:用一次性接种环刮取一平环在LB平板上培养12 h的菌苔,在1 mL的1×TE中充分涡旋,加入220 μL Buffer STE、30 μL Lysozyme、5 μL RNAase A,再加入1.5 μL Lysostaphin(20 mg·mL-1),涡旋混匀后37℃水浴消化50 min;加入250 μL Buffer DL和10 μL Proteinse K轻轻颠倒混匀,70℃金属浴50 min;加入250 μL无水乙醇充分涡旋后13 000×离心3 min,吸取上清液至装有HiPure gDNA Micro Column的收集管中,13 000×离心3 min倒弃流出液,把柱子装回收集管后加入500 μL GW1,10 000×离心1 min倒弃流出液,再把柱子装回收集管后加入650 μL GW2,10 000×离心1 min倒弃流出液,把柱子装回收集管10 000×离心3 min;把柱子装在新的1.5 mL EP管中,在膜中央加入40 μL预热至65℃的ddH2O放置3 min,10 000×离心1 min;丢弃结合柱,保存于-20℃。将提取的细菌基因组委托北京诺禾致源科技股份有限公司进行建库,并在Illumina HiSeq 2000平台上以测序策略PE 150 bp测序。将测序结果clean reads导入CLC Genomics Workbench 10.1,用De Novo Assembly 进行序列拼接,k-mer为默认值63,将大于500 bp的contigs保留,进行后续分析。在网络数据库https://cge.cbs.dtu.dk/services/中上传组装后的全基因组序列,对测序菌株中的耐药基因和毒力基因进行查找分析。
1.2.5 统计学分析 利用主成分分析法(principal component analysis,PCA)分析不同ST型组间差异性。使用Graphpad Prism 8和R 包中pheatmap对统计结果进行可视化。
2 结果
2.1 生物被膜产生能力
根据结晶紫半定量结果,98株金黄色葡萄球菌中筛选出能产生生物被膜的菌株共计23株,包括牛乳源22株(产膜率22/87=25.29%),14株(14/22=60.87%)来自浙江奶牛养殖场,8株(8/22=39.13%)来自福建奶牛养殖场,和猪源1株(产膜率1/11=9.10%),来自广东屠宰场,说明牛乳源金黄色葡萄球菌产膜潜力高于猪源;23株产膜菌株中,强产膜菌株2株(占比2/23=8.70%),中产膜菌株9株(占比9/23=39.13%),弱产膜菌株12株(占比12/23=52.17%)。
2.2 最小抑菌浓度测定
23株产生物被膜的菌株中,来源不同的金黄色葡萄球菌对22种抗菌药物的敏感程度出现明显差异,猪源较牛乳源耐药情况极严重。牛乳源中分离得到的金黄色葡萄球菌对所有药物均表现敏感,耐药值较低;但值得注意的是,1株猪源金黄色葡萄球菌对青霉素、阿莫西林、头孢噻呋、头孢西丁、恩诺沙星、环丙沙星、克林霉素、多西环素、红霉素、氟苯尼考、复方新诺明、泰妙菌素、替米考星均表现出耐药(表4),耐药值远高于其折点,为耐药严重的多重耐药菌株。
2.3 产膜菌株的分子特征
分型结果显示,所有菌株共分为8种型,其中产膜的23株金黄色葡萄球菌共3种型(表5):1株t2922型来自广东猪源,14株t2119来自浙江牛乳源,8株t189来自福建牛乳源。
MLST分型结果显示(图1),98株菌共分为9种ST型,其中6种ST型的菌株不具有产生生物被膜的能力,分别为:ST398、ST522、ST705、ST1651、ST479和ST151,而3种ST型的菌株具有生物被膜产生能力,分别为ST9、ST7和ST188;通过PCA进行聚类分析:以PCA1和PCA2分别为横纵坐标展示散点图的分类状况。如图2所示,主成分PCA1 和PCA2 分别占据所有成分中63.62%和17.74%,表明在这两个主要成分可以很好的对菌株进行组间聚类,弱产膜菌株ST7型能聚在一起,且与中强产膜菌株很好的区分开来,推测只有特定ST型的金黄色葡萄球菌才具有产生生物被膜的能力。

图1 BF产生能力与ST型之间的关系

表4 产膜菌株分子分型和耐药表型
PFGE分型结果显示(图3),产膜菌株共出现3种PFGE型,其中,广东、福建、浙江各分为1种,显示PFGE型可能存在地域分布特征。
综上,分子分型结果显示,广东产膜菌株分子型为ST9-t2922-PFGEII(n=1),浙江产膜菌株分子型为ST7-t2119-PFGEI(n=14),福建产膜菌株分子型为ST188-t189-PFGEIII(n=8)。
2.4 全基因组测序
对23株生物被膜产生菌株进行WGS测序,将数据提交到网络数据库进行耐药基因和毒力基因的查找,如图4显示,8株福建牛乳源的ST188-t189均携带包括、、、、、、及杀白细胞介素相关毒力因子、在内的9种不同的毒力基因,14株浙江牛乳源的ST7-t2119还携带金黄色葡萄球菌激酶毒素因子、补体抑制剂毒素因子和肠毒素在内的12种不同类型的毒力基因;值得注意的是,1株广东猪源ST9-t2922主要携带氨基糖苷类、-内酰胺类、大环类脂类、酰胺醇类、四环素等耐药基因和包括、、、及6种肠毒素因子在内的共10种毒力基因,该菌还同时携带甲氧西林类耐药基因,分型显示其携带XII型基因盒,即该菌株为能产生物被膜的耐甲氧西林金黄色葡萄球菌(MRSA)。所有菌株均携带调控多糖黏附素(PIA)合成的功能基因和调控表面蛋白合成的黏附基因、、等。

图2 生物被膜产生菌株中ST型的分布
cow:奶牛;pig:猪。Jinhua Zhejiang,China:中国浙江省金华市;Hangzhou Zhejiang,China:中国浙江省杭州市;Ningbo Zhejiang,China:中国浙江省宁波市;Jiaxing Zhejiang, China:中国浙江省嘉兴市;Nanping Fujian,China:中国福建省南平市;Fuzhou Fujian,China:中国福建省福州市;Foshan Guangzhou,China:中国广东省佛山市

表5 金黄色葡萄球菌spa分型特征
3 讨论
3.1 牛乳源金黄色葡萄球菌耐药特点和分子特点
金黄色葡萄球菌不仅能引起多种动物疾病,且具有产生物被膜的生物学特性。生物被膜的存在更容易造成患病动物持续感染和治疗失败,其复杂的动态调控机制使得生物被膜的消除成为临床重大难题[18-20],为解决这一问题而盲目更换抗菌药种类和加大用药剂量只会导致耐药现状加剧[21]。本研究发现,98株金黄色葡萄球菌中牛乳源的产膜率明显高于猪源,而生物被膜的存在更有利于细菌不断繁殖释放从而造成持续感染,这可能是牛更容易患乳房炎的原因;对产膜菌株的药物敏感性检测结果显示,14株浙江牛乳源和8株福建牛乳源金黄色葡萄球菌对22种抗菌药物敏感,与吴帆等[22]2017年从宁夏牛乳源中分离得到的金黄色葡萄球菌耐药率相似,较郭慧琴等[23]2019年在杭州奶牛养殖厂分离得到的金黄色葡萄球菌耐药率低,而1株广东猪源MRSA则表现为多重耐药。推测造成耐药表型差异的主要原因是地域差异和各厂区养殖管理模式不同,一般规模化养殖场中消洗严格并存在相对成熟的饲养管理模式,能大大降低疾病发生几率,且奶牛养殖场中使用抗菌药频率较低,用药种类单一,治疗多针对患病奶牛[24],这可能是牛乳源金黄色葡萄球菌耐药普遍较低的原因。
3.2 生物被膜产生与分子型之间的相关性
分子分型结果表明,产膜优势ST型为ST9、ST7和ST188,推测只有特定ST型的金黄色葡萄球菌才具有产生生物被膜的能力。PCA相关性分析证明菌株生物被膜产生强弱很可能与ST型有关,与CHEN[25]等已报道宠物源金黄色葡萄球菌产膜强弱可能与ST型有关相似。但值得注意的是,来源相同的同种ST型的菌株中,生物被膜产生强弱却是各不相同的,其中原因值得深入探究。金黄色葡萄球菌是造成奶牛感染临床型乳房炎的最主要病原菌,而特定ST型的菌株,因生物被膜的产生更容易聚集粘附于宿主,逐渐发展成为优势菌株并长期定植,造成无临床症状的隐形乳房炎,其病理特征往往无法通过肉眼观察,进而发展成为慢性乳房炎导致乳房萎缩和硬结[26-27],极大降低产奶效率[28-29];全基因组测序结果表明,8株福建牛乳源的ST188-t189-PFGEIII均携带9种不同的毒力基因,14株浙江牛乳源的ST7-t2119-PFGEI分别同时携带12种不同类型的毒力基因,值得注意的是,1株广东猪源ST9-t2922-PFGEII的中产膜菌株,携带10种耐药基因,其中包括介导苯唑西林耐药的甲氧西林类耐药基因,但前人研究表明,我国动物源ST9-MRSA主要型为t899[29-31],而本试验中分离得到的ST9-MRSA-SCCXII-t2922型在我国报道极少,同时该菌株还携带有10种不同的毒力因子,为携带多重耐药基因和毒力基因且能产生生物被膜的MRSA。多种耐药基因和毒力基因共存于MRSA菌株使得临床治疗极为棘手,且其产膜能力更是为该菌株发展为优势菌株并造成克隆传播提供了条件,该类菌株的存在和传播将给公共卫生安全带来极大威胁。
本研究以兽医临床分离得到的金黄色葡萄球菌为研究对象,对菌株生物被膜产生能力进行检测,并分析产膜阳性菌株的耐药特点和分子特点,探究了生物被膜产生与分子型之间的相关性,为研究生物被膜的消除和治疗动物金黄色葡萄球菌感染提供参考。
4 结论
对生物被膜产生能力进行探究发现,牛乳源和猪源金黄色葡萄球菌都有产生生物被膜的潜力,且牛乳源分离株较猪源分离株生物被膜产生能力更强,这将导致患病动物的隐性感染和持续感染;产膜菌株的药物敏感性结果显示,牛乳源分离株对受试22种常见抗菌药物敏感,而猪源产膜株表现为多重耐药;WGS分析耐药基因与毒力基因发现,所有菌株均携带产膜相关的功能基因和黏附类毒力基因,此外,广东猪源MRSA产膜株还携带10种耐药基因和介导苯唑西林耐药的甲氧西林类耐药基因,该类具有产膜能力的多重耐药菌株给临床治疗带来更大困难;菌株能否产膜与ST型存在强相关性,产膜优势ST型仅为ST9、ST7和ST188型;金黄色葡萄球菌生物被膜的产生存在着复杂的调控机制,找寻其关键原因和解决办法仍值得我们不断思考和探究。
[1] NEAMAH A J, AYYEZ H N, KLAIF S F, KHUDHAIR Y I, HUSSAIN M H. Molecular and phylogenetic study ofisolated from human and cattle of Al-Qadisiyah Governorate, Iraq. Veterinary World, 2019, 12(9): 1378-1382. doi:10.14202/ vetworld.2019.1378-1382
[2] 苏洋, 蒲万霞, 陈智华, 邓海平. 牛源金黄色葡萄球菌的耐药性及耐甲氧西林金黄色葡萄球菌的检测. 中国农业科学, 2012, 45(17): 3602-3607.
SU Y, PU W X, CHEN Z H, DENG H P. Antimicrobial resistance analysis and detection of methicillin-resistant(MRSA) amongstrains isolated from bovine mastitis. Scientia Agricultura Sinica, 2012, 45(17): 3602-3607. (in Chinese)
[3] LI H, ANDERSEN P S, STEGGER M, SIEBER R N, INGMER H, STAUBRAND N, DALSGAARD A, LEISNER J J. Antimicrobial resistance and virulence gene profiles of methicillin-resistant and- susceptiblefrom food products in Denmark. Frontiers in Microbiology, 2019, 10: 2681. doi:10.3389/fmicb.2019. 02681.
[4] 王璇, 王娉, 葛毅强, 陈颖. 食品中金黄色葡萄球菌致病性研究进展. 中国人兽共患病学报, 2017, 33(6): 553-558. doi:10.3969/j.issn. 1002-2694. 2017.06.016.
WANG X, WANG P, GE Y Q, CHEN Y. Review on pathogenicity ofin food. Chinese Journal of Zoonoses, 2017, 33(6): 553-558. doi:10.3969/j.issn.1002-2694.2017.06.016. (in Chinese)
[5] FANG R D, CUI J C, CUI T T, GUO H Y, ONO H K, PARK C H, OKAMURA M, NAKANE A, HU D L. Staphylococcal enterotoxin C is an important virulence factor for mastitis. Toxins, 2019, 11(3): 141. doi:10.3390/toxins11030141.
[6] JAVDAN S, NARIMANI T, ABADI M S S, GHOLIPOUR A. Agr typing ofspecies isolated from clinical samples in training hospitals of Isfahan and Shahrekord. BMC Research Notes, 2019, 12(1): 363. doi:10.1186/s13104-019-4396-8.
[7] SONESSON A, PRZYBYSZEWSKA K, ERIKSSON S, MÖRGELIN M, KJELLSTRÖM S, DAVIES J, POTEMPA J, SCHMIDTCHEN A. Identification of bacterial biofilm and thederived protease, staphopain, on the skin surface of patients with atopic dermatitis. Scientific Reports, 2017, 7: 8689. doi:10.1038/ s41598-017-08046-2.
[8] OTTO M.biofilms. Microbiology Spectrum, 2018, 6(4). doi:10.1128/microbiolspec. GPP3-0023-2018.
[9] BASANISI M G, BELLA G L, NOBILI G, FRANCONIERI I, SALANDRA G L. Genotyping of methicillin-resistant(MRSA) isolated from milk and dairy products in South Italy. Food Microbiology, 2017, 62: 141-146. doi:10.1016/j.fm.2016.10.020.
[10] LI X L, ZHOU Y, ZHAN X L, HUANG W C, WANG X. Breast milk is a potential reservoir for livestock-associatedand community-associatedin Shanghai, China. Frontiers in Microbiology, 2018, 8: 2639. doi:10.3389/fmicb.2017. 02639.
[11] MA D Z, MANDELL J B, DONEGAN N P, CHEUNG A L, MA W Y, ROTHENBERGER S, SHANKS R M Q, RICHARDSON A R, URISH K L. The toxin-antitoxin MazEF drivesbiofilm formation, antibiotic tolerance, and chronic infection. mBio, 2019, 10(6): e01658-19. doi:10.1128/mBio.01658-19.
[12] OTTO M. Staphylococcal biofilms. Microbiology Spectrum, 2018, 6(4): 207-228. doi:10.1128/microbiolspec.gpp3-0023-2018.
[13] KIM M K, ZHAO A S, WANG A, BROWN Z Z, MUIR T W, STONE H A, BASSLER B L. Surface-attached molecules controlquorum sensing and biofilm development. Nature Microbiology, 2017, 2: 17080. doi:10.1038/nmicrobiol.2017. 80.
[14] MOORMEIER D E, BAYLES K W.biofilm: a complex developmental organism. Molecular Microbiology, 2017, 104(3): 365-376. doi:10.1111/mmi.13634.
[15] 房诗薇, 黄玲利, 谢书宇, 王玉莲, 瞿玮, 程古月, 刘振利, 袁宗辉, 郝海红. 兽用抗菌药耐药判定标准的研究进展. 中国抗生素杂志, 2019, 44(6): 667-673. doi:10.13461/j.cnki.cja.006669.
FANG S W, HUANG L L, XIE S Y, WANG Y L, QU W,CHENG G Y, LIU Z L, YUAN Z H, HAO H H. Study progress on breakpoints of veterinary antibiotics. Chinese Journal of Antibiotics, 2019, 44(6): 667-673. doi:10.13461/j.cnki.cja.006669. (in Chinese)
[16] 张林吉, 张小荣, 曹永忠, 巢国祥, 任士飞, 吴艳涛. 金黄色葡萄球菌肠毒素基因与MLST及spa分子克隆相关性研究. 中国病原生物学杂志, 2018, 13(5): 449-456. doi:10.13350/j.cjpb.180501.
ZHANG L J, ZHANG X R, CAO Y Z, CHAO G X, REN S F, WU Y T. Diversity of enterotoxin genes ofand characterization ofclones. Journal of Pathogen Biology, 2018, 13(5): 449-456. doi:10.13350/j.cjpb.180501. (in Chinese)
[17] ENRIGHT M C, DAY N P, DAVIES C E, PEACOCK S J, SPRATT B G. Multilocus sequence typing for characterization of methicillin- resistant and methicillin-susceptible clones of. Journal of Clinical Microbiology, 2000, 38(3): 1008-1015. doi:10. 1128/JCM.38.3.1008-1015.2000.
[18] 刘保光, 蔡田, 李小申, 刘营营, 贺丹丹, 匡秀华, 高延玲, 胡功政. 牛奶源金黄色葡萄球菌血清型、毒力基因及PFGE分型. 食品科学, 2019, 40(2): 281-286. doi:10.7506/spkx1002-6630-20180110-124.
LIU B G, CAI T, LI X S, LIU Y Y, HE D D, KUANG X H, GAO Y L, HU G Z. Serotyping, virulence genes and pulsed field gel electrophoresis (PFGE) typing ofisolated from fresh milk. Food Science, 2019, 40(2): 281-286. doi:10.7506/spkx1002-6630- 20180110-124. (in Chinese)
[19] LUTHER M K, PARENTE D M, CAFFREY A R, DAFFINEE K E, LOPES V V, MARTIN E T, LAPLANTE K L. Clinical and genetic risk factors for biofilm-forming. Antimicrobial Agents and Chemotherapy, 2018, 62(5): e02252-17. doi:10.1128/ AAC.02252-17.
[20] PAHARIK A E, HORSWILL A R. The staphylococcal biofilm: adhesins, regulation, and host response. Microbiology Spectrum, 2016, 4(2): 10.1128/microbiolspec.VMBF-22. doi:10.1128/microbiolspec. VMBF-0022-2015.
[21] LAKSHMI S A, BHASKAR J P, KRISHNAN V, SETHUPATHY S, PANDIPRIYA S, ARUNI W, PANDIAN S K. Inhibition of biofilm and biofilm-associated virulence factor production in methicillin- resistantby docosanol. Journal of Biotechnology, 2020, 317: 59-69. doi:10.1016/j.jbiotec.2020.04.014.
[22] 吴帆. 宁夏地区牛源金黄色葡萄球菌生物被膜相关基因检测及耐药性研究[D]. 银川: 宁夏大学, 2017.
WU F. Study on detection of bofilm genes and antimicrobial resistance ofisolated from cow in ningxia[D]. Yinchuan: Ningxia University, 2017. (in Chinese)
[23] 郭慧琴, 李田, 肖鹏, 余茂林, 姜中其. 牛源金黄色葡萄球菌的分离鉴定、耐药性分析及木糖醇对生物被膜形成的干预. 中国兽医学报, 2019, 39(5): 889-893. doi:10.16303/j.cnki.1005-4545.2019.05.14.
GUO H Q, LI T, XIAO P, YU M L, JIANG Z Q. Isolation, identification and bacterial resistance of dairy cows'and intervention of biofilm formation by xylitol. Chinese Journal of Veterinary Science, 2019, 39(5): 889-893. doi:10.16303/ j.cnki.1005-4545.2019.05.14. (in Chinese)
[24] 李宝明, 戴命子, 李学钊. 奶牛乳房炎的诊治. 中国牛业科学, 2019, 45(6): 92-93. doi:10.3969/j.issn.1001-9111.2019.06.030.
LI B M, DAI M Z, LI X Z. Diagnosis and treatment of mastitis in dairy cows. China Cattle Science, 2019, 45(6): 92-93. doi:10.3969/ j.issn.1001-9111.2019.06.030. (in Chinese)
[25] CHEN L, TANG Z Y, CUI S Y, MA Z B, DENG H, KONG W L, YANG L W, LIN C, XIONG W G, ZENG Z L. Biofilm production ability, virulence and antimicrobial resistance genes infrom various veterinary hospitals. Pathogens (Basel, Switzerland), 2020, 9(4): 264. doi:10.3390/pathogens9040264.
[26] ANTÓK F I, MAYRHOFER R, MARBACH H, MASENGESHO J C, KEINPRECHT H, NYIRIMBUGA V, FISCHER O, LEPUSCHITZ S, RUPPITSCH W, EHLING-SCHULZ M, FEßLER A T, SCHWARZ S, MONECKE S, EHRICHT R, GRUNERT T, SPERGSER J, LONCARIC I. Characterization of antibiotic and biocide resistance genes and virulence factors ofspecies associated with bovine mastitis in Rwanda. Antibiotics (Basel, Switzerland), 2019, 9(1): 1. doi:10.3390/antibiotics9010001.
[27] 吴文学, 李秀波, 王瑞, 王朋朋, 田欣睿, 张海燕, 焦晓宇, 李金祥. 奶牛乳房炎的发病机制. 中国兽医杂志, 2019, 55(10): 113-116.
WU W X, LI X B, WANG R, WANG P P, TIAN X R, ZHANG H Y, JIAO X Y, LI J X. Pathogenesis of mastitis in dairy cows. Chinese Journal of Veterinary Medicine, 2019, 55(10): 113-116. (in Chinese)
[28] LIMA M G B, BLAGITZ M G, SOUZA F N, SANCHEZ E M R, BATISTA C F, BERTAGNON H G, DINIZ S A, SILVA M X, LIBERA A M, DELLA M P. Profile of immunoglobulins, clinical and bacteriological cure after different treatment routes of clinical bovine mastitis.Arquivo Brasileiro de Medicina Veterinaria e Zootecnia2018,70(4):1141-1149.doi: 10.1590/1678-4162-9695.
[29] Prevalence of bovine mastitis in the Anaime Canyon, a Colombian dairy region, including etiology and antimicrobial resistance. Revista de Investigaciones Veterinarias del Perú, 2018, 29(1):226-293.doi.org/10.15381/rivep.v29i1.14084.
[30] CUI S H, LI J Y, HU C Q, JIN S H, LI F Q, GUO Y C, RAN L, MA Y. Isolation and characterization of methicillin-resistantfrom swine and workers in China. Journal of Antimicrobial Chemotherapy, 2009, 64(4): 680-683. doi:10.1093/jac/dkp275.
[31] 李德喜. 恶唑烷酮类耐药基因cfr和optrA在猪源MRSA和CoNS中流行及传播机制的研究[D]. 北京: 中国农业大学, 2016.
LI D X. The epidemiological study on the oxazolidinones resistance genescfr and OptrA and theirs transmission mechanism among MRSA and CoNS isolates from swine[D]. Beijing: China Agricultural University, 2016. (in Chinese)
Relationship Between Biofilm Formation and Molecular Typing offrom Animal Origin
TANG ZiYun, HU JianXin, CHEN Jin, LU YiXing, KONG LingLi, DIAO Lu, ZHANG FaFu, XIONG WenGuang, ZENG ZhenLing*
College of Veterinary Medicine, South China Agricultural University/Guangdong Provincial Key Laboratory of Veterinary Pharmaceutics Development and Safety Evaluation/Guangdong Laboratory for Lingnan Modern Agriculture/National Risk Assessment Laboratory for Antimicrobial Resistance of Animal Original Bacteria, Guangzhou 510642
【Objective】The aim of this study was to investigate the epidemiological characteristics of()in the biofilm producing strains and to explore the correlation between biofilm forming ability and molecular typing, so as to provide the theoretical basis for the treatment ofinfection.【Method】The biofilm producing ability of all strains ofwas determined by crystal violet semi-quantitative method. The minimum inhibitory concentrations of 22 common antibiotics were determined by the membrane producing strains. Molecular typing was conducted by three common typing methods of, includingtyping, MLST typing and PFGE typing, and the correlation between membrane production capacity and molecular typing was analyzed. Finally, whole genome sequencing technology was used to analyze the antibiotics resistance gene and virulence genes in the biofilm producing strains. 【Result】The semi-quantitative results of crystalline violet showed that a total of 23 strains (23.47%) of 98strains were able to produce biofilm, including 22 strains (25.29%, 22/87) from cow milk source, 14 strains (60.87%, 14/22) from Zhejiang dairy farms, 8 strains (39.13%, 8/22) from Fujian dairy farms, and 1 strain from pig source (9.10%, 1/11) from Guangdong slaughterhouse, indicating that the film-producing potential offrom cow's milk source was higher than that of pig source, 22 strains (95.65%) of which were from cow's milk source and 1 strain (4.35%) was from pig source. The film-producing ability was classified into strong, medium and weak, and among the 23 film-producing strains, 2 strains (8.70%, 2/23) were strong film-producing strains, 9 strains (39.13%, 9/23) were medium, and 12 strains (52.17%, 12/23) were weak. The results of the drug sensitivity test showed that the bovine milk-derived membrane- producing strains were sensitive to all the tested antibacterial drugs, while the pig-derived membrane-producing strains showed resistance to 13 antibacterial drugs, including penicillin, amoxicillin, ceftiofur, cefoxitin, enrofloxacin, ciprofloxacin, clindamycin, doxycycline, erythromycin, flupenthixol, cotrimoxazole, tiamulin, and tilmicosin. Thetyping results showed that 98 strains ofobtained 8types, and 23 strains of film-producingaccounted for 3 of them: 1 strain t2922 from porcine origin in Guangdong, 14 strains t2119 from Zhejiang cow milk source, and 8 strains t189 from Fujian cow milk source. MLST typing results showed that 98 strains were classified into 9 ST types, of which 6 ST types did not have the ability to produce biofilm, namely ST398, ST522, ST705, ST1651, ST479 and ST151, and only 3 strains of ST type had biofilm production ability, namely ST9, ST7 and ST188. It was found that the molecular types of strong film-producing strains were mainly ST7-t2119, the medium film-producing strains were mainly ST7-t2119 and ST188-t189, and the weak film-producing strains were ST9-t2922, ST7-t2119 and ST188-t189. The ST type of weak film-producing strains could be well distinguished from the medium and strong film-producing strains, and only the specific ST type ofhad the ability to produce biofilm. 23 film-producing strains PFGE typing all successful PFGE typing results showed that the results show that each strain of film-producing bacteria in Guangdong, Fujian and Zhejiang provinces were divided into 3 PFGE types, and there were geographical distribution characteristics of PFGE types; the strains isolating from the same region had clonal transmission, and the strains in the province were clonal to each other, but there were significant differences in biofilm production ability between clones.; the whole genome sequencing results showed that the drug resistance genes and virulence genes in the film-producing strains were diverse according to the molecular type. 【Conclusion】from different sources had different potential to produce biofilm and all carried different film-producing genes. The film-producing potential offrom bovine milk source was much higher than that of porcine source, and all carrid different film-producing genes. Whether strains could produce film or not may be strongly correlated with ST type, and the specific ST types, such as ST9, ST7 and ST188, were more likely to produce biofilm; however, at the same time, the strains with the same molecular type had different abilities to produce biofilm.
; biofilm; antibiotics resistance gene; molecular typing; virulence genes
2020-12-10;
2021-07-08
“十三五”国家重点研发计划(2018YFD0500300)
唐子云,Tel:15827491246;E-mail:1598387644@qq.com。通信作者曾振灵,Tel:13609768425;E-mail:zlzeng@scau.edu.cn
(责任编辑 林鉴非)
