miR-195-5p通过靶向ROCK1抑制肾癌细胞迁移、侵袭和上皮-间质转化
2022-03-03陈少军钱苏波曹奇峰虞永江顾正勤沈海波
陈少军,钱苏波,曹奇峰,邵 宁,虞永江,顾正勤,沈海波
(上海交通大学医学院附属新华医院泌尿外科,上海 200092)
肾细胞癌(renal cell carcinoma,RCC)是起源于肾实质小管上皮细胞的恶性肿瘤,简称肾癌,是成人最常见的肾脏恶性肿瘤,约占所有肾脏肿瘤的90%[1]。由于缺乏早期的临床表现和诊断标志物,超过50%的肾癌患者为偶然发现,并且约20%~30%的患者在首次诊断为肾癌时已经伴随远处转移[2]。最新的统计数据表明未发生转移的肾癌患者5年生存率超过70%,而发生转移的肾癌患者5年生存率不足12%[3]。因此,进一步研究肾癌发生及转移的分子机制,寻找肾癌相关的肿瘤标志物,有助于提高肾癌的早期诊断及改善肾癌患者的预后。
微小RNAs (miRNAs)是一类内源性非编码小分子RNA,主要通过结合其下游靶基因mRNA的3’UTR(3’ untranslated regions)引起的mRNA降解或抑制蛋白质翻译过程,从而影响靶基因的表达水平[4]。大量的研究结果表明,miR-195-5p作为抑癌基因在多种癌症中低表达并可影响肿瘤细胞的增殖、迁移、侵袭等生物学行为,如前列腺癌、胰腺癌和宫颈癌等[5-7]。然而,miR-195-5p在肾癌发生发展中的作用研究尚少。我们在前期的研究中发现miR-195-5p在肾癌组织和细胞中均表现出明显的低表达,过表达miR-195-5p可抑制肾癌细胞的增殖、促进凋亡[8]。本研究旨在进一步探讨miR-195-5p对肾癌细胞迁移、侵袭及上皮-间质转化(epithelial to mesenchymal transition,EMT)的影响及机制,从而进一步阐明其在肾癌发生发展中的作用及机制。
1 材料与方法
1.1 细胞与试剂肾癌细胞株786-O购自中国科学院上海生命研究院细胞中心。RPMI-1640培养基、胎牛血清(FBS)及青霉素链霉素双抗(100×)购自Gibco公司,EDTA-0.25%胰酶购自Amersco公司,RNA提取试剂Trizol和细胞转染试剂Lipofectamine 2000购自invitrogen 公司;cDNA逆转录试剂盒购自北京康为世纪公司,荧光定量RT-PCR检测试剂盒购自TaKaRa公司,Matrigel基质胶和Transwell小室购自美国BD公司;miR-195-5p mimics、miR-195-5p inhibitors、ROCK1 si-RNA及其空白对照(miR-NC,inhibitor-NC,siNC)购自广州市锐博生物科技有限公司。ROCK1及β-actin的一抗购自Abcam公司,E-cadherin、N-cadherin和Vimentin的一抗购自Cell Signaling Technology公司,Western blot二抗购自Abcam公司。
1.2 细胞培养与转染人肾癌细胞株786-O利用RPMI-1640培养基培养。培养基含有10%胎牛血清(fetal bovine serum,FBS)、50 U/mL的青霉素和50 μg/mL的链霉素。培养箱条件为37 ℃、5%的CO2和95%的湿度。细胞转染时,取对数期生长的细胞,将miR-195-5p mimics、miR-NC、miR-195-5p inhi-bitors、inhibitor-NC、ROCK1 si-RNA或siNC利用Lipofectamine 2000按照说明书的方法进行转染。在转染后48 h,收集细胞检测相关RNA或蛋白的表达水平及进行细胞功能实验。
1.3 实时荧光定量PCR在细胞转染48 h后,收集细胞,利用Trizol法提取细胞的总RNA,按照cDNA逆转录试剂盒的说明书将RNA逆转录为cDNA。按照荧光定量RT-PCR试剂盒的说明书配置PCR反应体系,在ABI荧光定量PCR仪上进行反应40个循环,利用2-ΔΔCt的方法计算miR-195-5p的相对表达量。U6作为miR-195-5p的内参对照。miR-195-5p正向引物序列为5′-GGGGTAGCAGCACAGAAAT-3′,反向引物序列为5′-TCCAGTGCGTGTCGTGGA-3′;U6的正向引物序列为5′-TGCGGGTGCTCGCTTCGCAGC-3′,反向引物序列为5′-CCAGTGCAGGGTCCGAGGT-3′;该实验独立重复3次。
1.4 细胞划痕实验取对数期生长且状态良好的各组细胞,将细胞以大约20%的浓度接种于6孔板中,置于培养箱中进行培养。待细胞浓度长至70%~80%时,用200 μL的移液器枪头在6孔板的底面划出均匀的线条,加入PBS漂洗3次,去除脱落细胞。每孔加入无血清培养基2 mL,在倒置显微镜下拍照,记录0 h的划痕宽度。置于培养箱中培养24 h后,取出6孔板,在倒置显微镜下拍照并测量划痕宽度,从而检测细胞的迁移能力。每组实验重复3次,划痕愈合率(%)=(0 h划痕宽度-48 h划痕宽度)/0 h划痕跨度×100%。
1.5 Transwell小室实验取对数期生长且状态良好的各组细胞,去除培养基、消化、离心、加入无血清培养基重悬制备单细胞悬液并计数。在Transwell小室的上室内加入含1.0×105个细胞的无血清培养基单细胞悬液200 μL,在下室内加入600 μL含10%胎牛血清的完全培养基,置于37 ℃的培养箱中培养24 h。培养结束后取出Transwell小室,用PBS清洗3次,4%的多聚甲醛室温下固定30 min。用棉签将上室内未穿透的细胞轻轻擦去,再用1%的结晶紫染色10 min,PBS清洗3次。将Transwell小室于倒置显微镜下随机选择三个视野观察并计数细胞,进行统计。每组实验重复3次。
1.6 双荧光素酶报告基因检测通过TargetScan生物信息学分析网站预测得知ROCK1为miR-195-5p的靶基因,我们利用双荧光素酶报告基因检测的方法进行了验证。根据miR-195-5p与基因相互作用的序列,设计野生型3′UTR及无法与miR-195-5p结合的突变型3′UTR,并构建荧光素酶报告质粒pmirGLO-ROCK1-Wt 3’UTR (Wt 3′UTR)和pmirGLO-ROCK1-Mut 3′UTR(Mut 3′UTR)。将miR-195-5p mimics或miR-195-5p NC与ROCK1的Wt 3′UTR或Mut 3′UTR质粒共转染至786-O细胞中,转染48 h后利用双荧光素酶检测系统检测细胞中的荧光素酶活性,相对荧光值=萤火虫荧光素酶的荧光值/海肾荧光素酶的荧光值。
1.7 免疫印迹试验(Western blot)取转染48 h且生长状态良好的细胞,用冷PBS清洗后提取细胞蛋白,100 ℃煮样后上样于SDS-PAGE胶中进行电泳分离。电泳完成后,将蛋白转至NC膜、5%的脱脂牛奶室温下封闭1 h。PBS-T将膜清洗3次后,按照说明书的浓度加入一抗溶液在4 ℃避光条件下孵育过夜。次日,用PBS-T洗膜后加入二抗溶液于4 ℃孵育1 h。二抗孵育完成后,用PBS-T洗膜3遍,于Oddesey扫膜仪上进行扫膜。每组实验重复3次。

2 结 果
2.1 miR-195-5p对肾癌细胞迁移、侵袭及EMT的影响在前期研究中,我们发现miR-195-5p在肾癌组织和细胞中低表达,提示其在肾癌中可能是一个抑癌基因[8]。为了研究miR-195-5p对肾癌细胞迁移、侵袭等生物学行为的影响,我们将miR-195-5p mimics转入肾癌细胞786-O过表达miR-195-5p,并在转染48 h后利用qRT-PCR进行了验证(图1A)。其次,分别通过细胞划痕实验、Transwell小室实验及Western blot检测了过表达miR-195-5p的786-O细胞迁移、侵袭能力及EMT相关蛋白的表达水平。实验结果表明过表达miR-195-5p后肾癌细胞的迁移及侵袭能力均明显降低(图1B、C),EMT相关的蛋白E-cadherin表达增高而N-cadherin和Vimentin表达降低(图1D)。该研究结果提示miR-195-5p可抑制肾癌细胞的迁移、侵袭及EMT。
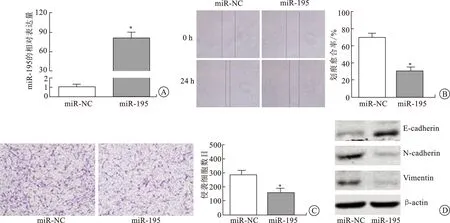
A:转染miR-195-5p mimics(miR-195)后miR-195-5p的表达水平;B:786-O细胞的迁移图(×10)及其柱状图;C:786-O细胞侵袭的结晶紫染色图(×20)及其柱状图;D:EMT(上皮-间质转化)相关蛋白的表达量的免疫印迹图;*P<0.05。
2.2 ROCK1是miR-195-5p的靶基因为了研究miR-195-5p影响肾癌细胞迁移、侵袭及EMT的相关机制,我们通过生物信息学网站Targetscan预测得知ROCK1是miR-195-5p的一个靶基因,其结合序列如下(图2A)。有文献报道ROCK1在肾癌中高表达并且作为促癌基因影响肾癌细胞的生物学行为[9-10]。另外,我们进行了双荧光素酶报告实验进行验证,发现miR-195-5p mimics可明显降低ROCK1-Wt 3’UTR的荧光素酶活性、而不能降低ROCK1-Mut 3’UTR的荧光素酶活性(图2B)。并且,我们还检测了肾癌细胞中过表达miR-195-5p对ROCK1的影响。结果表明过表达miR-195-5p可使ROCK1的表达水平明显降低(图2C)。该研究结果提示ROCK1为miR-195-5p的靶基因。
2.3 转染miR-195-5p inhibitors及si-ROCK1的效果检测为了进一步验证miR-195-5p对肾癌细胞迁移、侵袭和EMT的影响及机制,我们转染了miR-195-5p inhibitors抑制肾癌细胞中miR-195-5p的表达,并利用qRT-PCR进行了验证(图3A)。另外,在抑制miR-195-5p表达的肾癌细胞中,我们利用si-RNA干扰了ROCK1的表达,并通过Western blot进行了验证(图3B)。
2.4 抑制miR-195-5p的表达和干扰ROCK1的表达对肾癌细胞迁移、侵袭及EMT的影响分别检测了抑制miR-195-5p的表达和抑制miR-195-5p的表达后干扰ROCK1的表达,肾癌细胞的迁移、侵袭能力及EMT相关蛋白表达量的变化情况。实验结果表明抑制miR-195-5p可促进肾癌细胞的迁移、侵袭及EMT,而干扰ROCK1后可部分抵消miR-195-5p抑制对肾癌细胞迁移、侵袭及EMT的影响(图4)。该结果提示miR-195-5p可能通过靶向ROCK1抑制肾癌细胞的迁移、侵袭及上皮-间质转化。
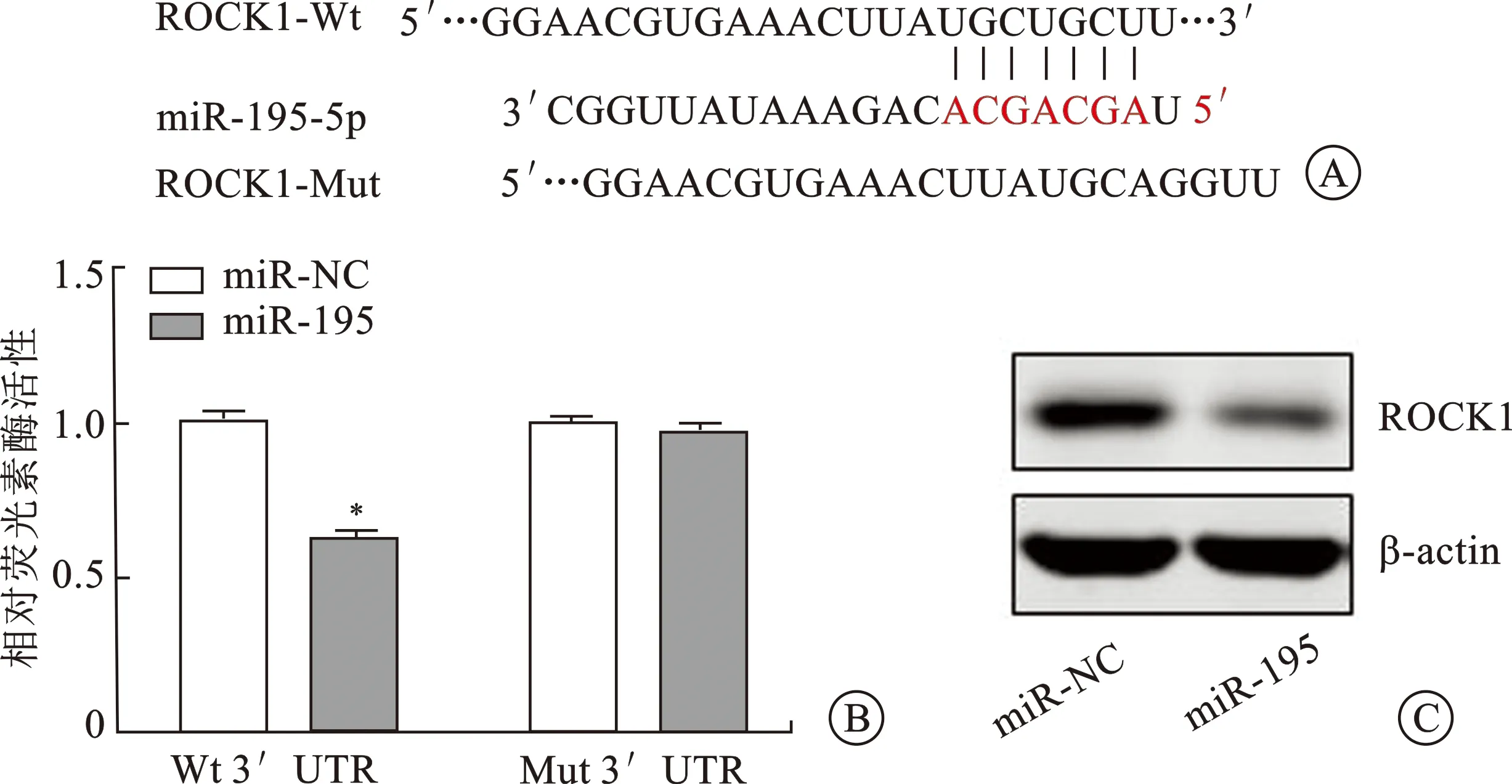
A:生物信息学网站Targetscan预测;B:双荧光素酶报告试验;C:免疫印迹试验。
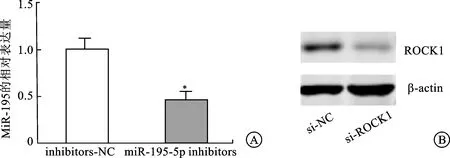
A:转染miR-195-5p inhibitors后miR-195-5p的表达量(*P<0.05);B:转染si-ROCK1后肾癌细胞ROCK1的表达量。
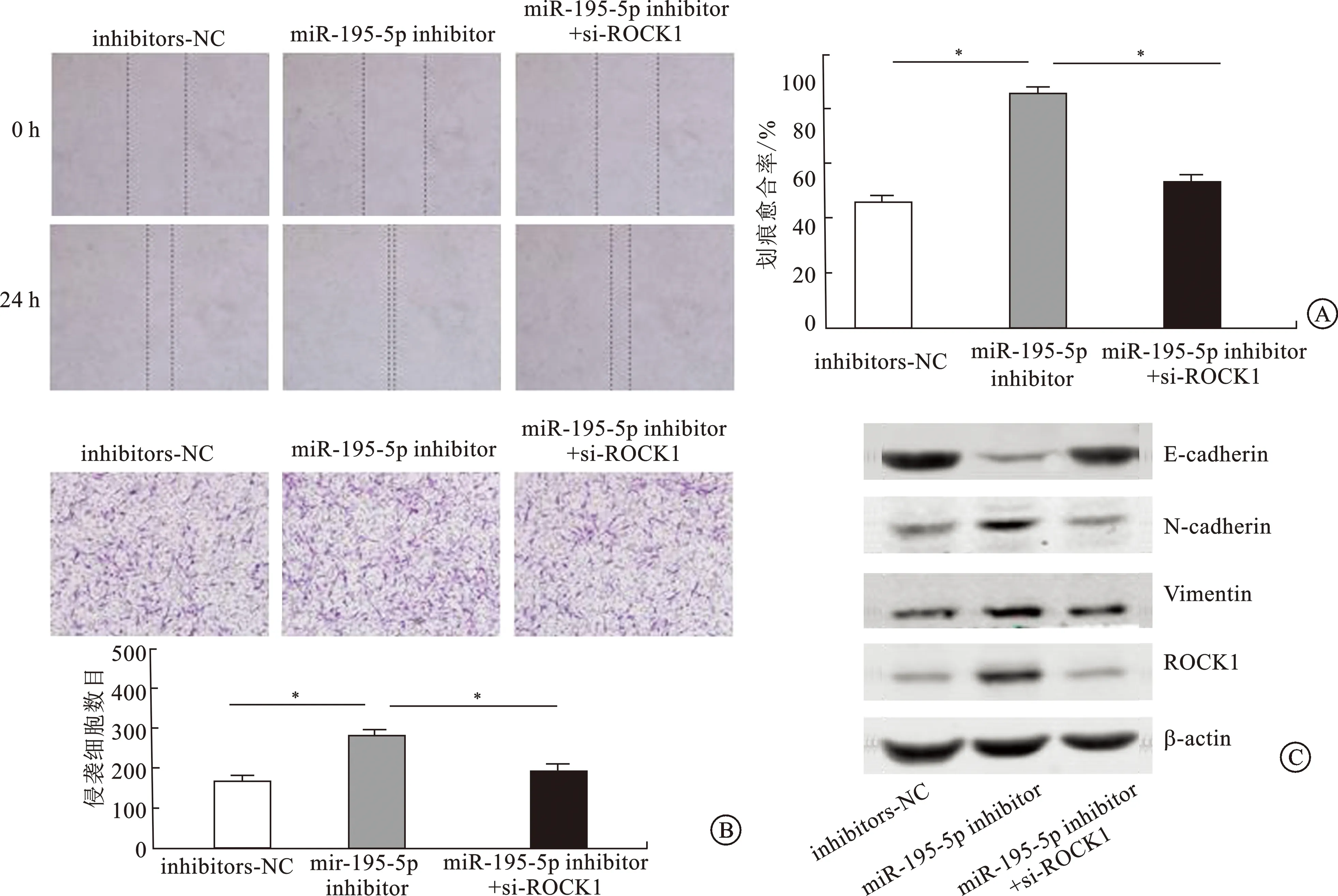
A:肾癌细胞的迁移图(×10)及其柱状图;B:肾癌细胞侵袭的结晶紫染色图(×20)及其柱状图;C:EMT相关蛋白表达量的免疫印迹图;*P<0.05。
3 讨 论
近年来,越来越多的研究表明microRNAs在肿瘤发生发展的过程中发挥了重要的作用,如影响细胞增殖、凋亡、周期转化、迁移、上皮间质转化及免疫应答等过程[11]。在肾癌中,同样有大量的microRNA被证实存在异常表达并作为癌基因或抑癌基因影响肾癌的发生和进展,从而有可能成为肾癌的诊断标志物或治疗靶点[12]。miR-195被证实在多种癌症中低表达,并可通过调控其下游的靶基因影响癌细胞的生物学行为。如LUO等[13]报道miR-195可通过靶向周期蛋白依赖激酶8(cyclin dependent kinase 8,CDK8)抑制结肠癌细胞的增殖、迁移和侵袭等。LIU等[7]研究结果提示miR-195可通过靶向Yes相关蛋白1(Yes-associated protein1,YAP1)抑制宫颈癌细胞的增殖、迁移、侵袭及上皮间质转化。另外,还有研究表明miR-195可通过调控叉头框蛋白K1(Forkhead box K1,FOXK1)抑制肺癌细胞的增殖、迁移和侵袭等[14]。然而,miR-195在肾癌中的表达及功能目前研究尚少。
我们在前期研究中发现miR-195-5p在肾癌中低表达并且可影响肾癌细胞的增殖和凋亡等。这些研究结果表明miR-195-5p可能作为抑癌基因参与了肾癌的发生发展等过程。在本研究中,我们进一步探讨了miR-195-5p对肾癌细胞迁移、侵袭和上皮-间质转化(epithelial to mesenchymal transition,EMT)等的影响。为了过表达或抑制肾癌细胞中miR-195-5p的表达水平,我们向肾癌细胞中转染了miR-195-5p mimics或inhibitors。实验结果表明,过表达miR-195-5p可抑制肾癌细胞的迁移、侵袭和EMT;而抑制miR-195-5p可促进肾癌细胞的迁移、侵袭和EMT等。接着,通过生物信息学分析发现ROCK1是miR-195-5p的一个靶基因。因此,我们进一步研究了miR-195-5p影响肾癌细胞迁移、侵袭和上皮-间质转化的机制。
ROCK1作为癌基因在多种癌症中高表达,主要通过调控细胞迁移、侵袭及血管生成等过程促进肿瘤转移,如黑色素瘤[15]、胶质瘤[16]和非小细胞肺癌[17]等。有研究表明miR-195可通过靶向ROCK1调控喉癌细胞的增殖、迁移和侵袭等生物学行为[18]。然而miR-195-5p能否通过靶向ROCK1调控肾癌细胞的生物学行为尚鲜见研究。我们通过Targetscan等生物信息学分析得知ROCK1是miR-195-5p的靶基因,并通过双荧光素酶报告实验证实miR-195-5p可与ROCK1的3’UTR结合。Western blot实验结果也表明miR-195-5p可抑制ROCK1在肾癌细胞中的表达。另外,我们在抑制肾癌细胞miR-195-5p的表达后利用siRNA干扰ROCK1的表达并检测了肾癌细胞的迁移、侵袭和EMT。研究结果表明干扰ROCK1的表达可部分抵消抑制miR-195-5p对肾癌细胞迁移、侵袭和EMT的影响。这些研究结果表明miR-195-5p可通过靶向ROCK1抑制肾癌细胞的迁移、侵袭和上皮-间质转化。
综上所述,本研究结果表明miR-195-5p在肾癌的发生发展中是一个抑癌基因,可通过靶向ROCK1抑制肾癌细胞的迁移、侵袭和上皮-间质转化等生物学行为。该研究结果提示miR-195-5p可能成为肾癌的分子标志物,为肾癌患者的早期诊断和治疗提供新的可能。