前列腺癌淋巴结转移分子机制的研究进展
2022-03-03蒋璋栋综述吴开杰审校
蒋璋栋 综述,吴开杰 审校
(西安交通大学第一附属医院泌尿外科,陕西西安 710061)
前列腺癌(prostate cancer,PCa)是欧美国家最常见的癌症,但近年来我国的发病率也呈快速上升趋势,年增加率约12.07%[1]。除了骨骼,淋巴结也是常见的转移部位之一,有资料显示新诊断的PCa病例中约10%有淋巴结转移[2]。淋巴结转移患者表现出不良的预后,疾病特异性生存率和无生化复发生存率显著降低[3]。因此,了解淋巴结转移过程和分子机制对于淋巴结转移患者的治疗具有重要作用,特别是在预测疾病进展和确定术后治疗方案方面。通过梳理PCa淋巴结转移相关分子机制,特别是淋巴管生成的作用,以期为PCa淋巴结转移患者临床决策提供帮助。
1 PCa淋巴结转移
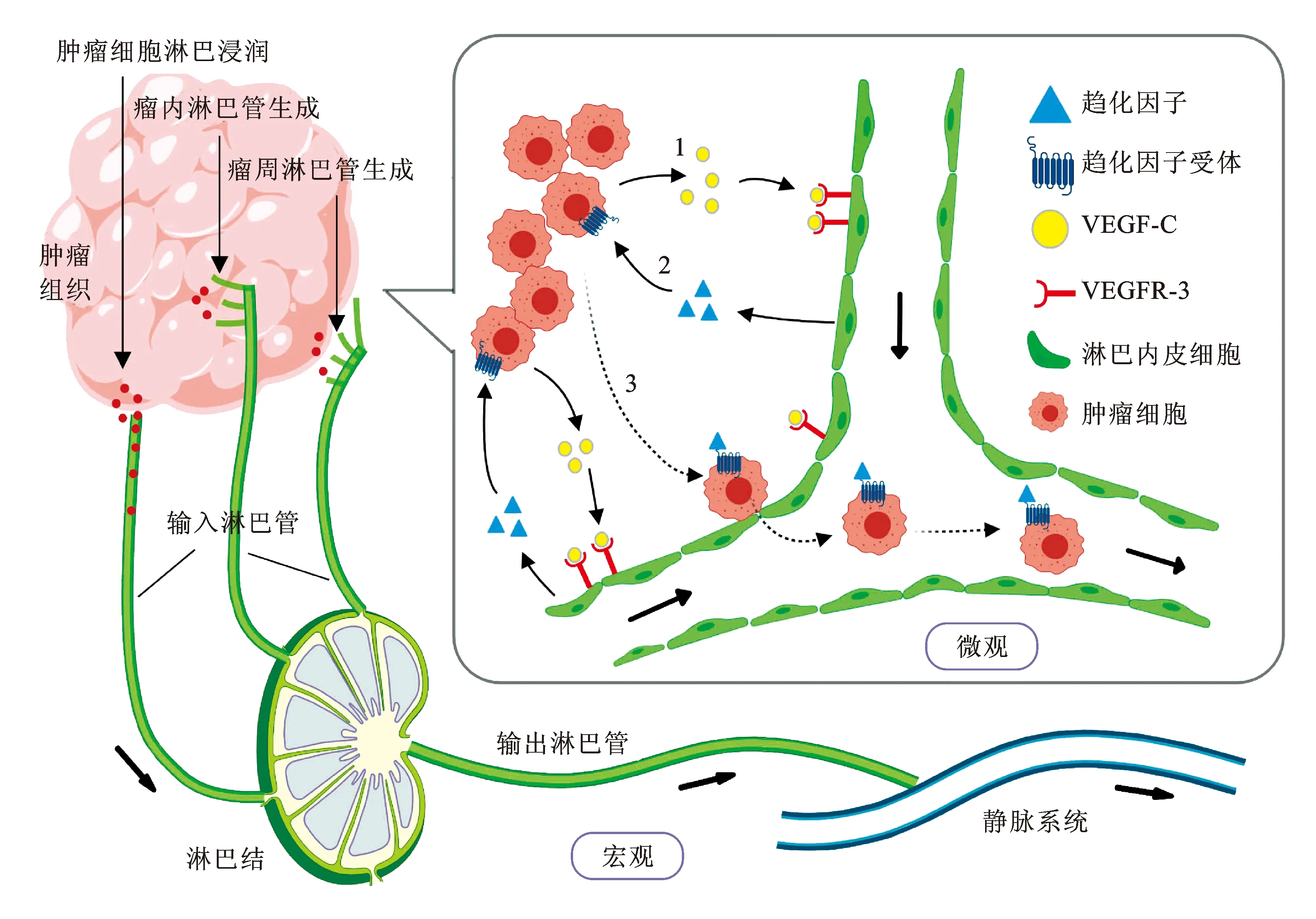
1.1 转移的两种方式一是淋巴管生成:肿瘤分泌淋巴管生成因子在已存在的淋巴管上诱导新淋巴管生成,此时引流肿瘤的淋巴管的管径增大,淋巴流量和搏动增加。淋巴管产生趋化因子可以刺激肿瘤细胞向淋巴管的趋化扩散并引流至淋巴结及其远方。血管内皮生长因子(vascular endothelial growth factor,VEGF)-C/D(VEGF-C/D)是公认的淋巴管生成因子,趋化因子配体21(C-C motif chemokine ligand 21,CCL21)是公认的趋化因子[4]。
二是肿瘤细胞淋巴浸润:肿瘤细胞通过渗透的过程从原发肿瘤局部延伸到周围的淋巴管。淋巴管与血管相比没有紧密的内皮连接,所以淋巴管内皮细胞(lymphatic endothelial cell,LEC)对组织液和细胞更具有渗透性。肿瘤细胞和肿瘤来源的生长因子等分子可以高渗性通过LEC进入淋巴管,促进肿瘤细胞流向区域淋巴结、远处淋巴结,随后进入血液循环,甚至可转移到远处的组织、器官。
这两种方式相互独立又相互联系(图1):肿瘤相关淋巴管的生成一定程度上可作为肿瘤细胞到达淋巴结和远处的容易通道,而肿瘤细胞的浸润加速淋巴转移的发生。
1.2 淋巴管生成与PCa淋巴结转移肿瘤周围和肿瘤内部细胞团中都可以发生淋巴管生成。PCa的瘤周淋巴管生成已被证实与引流淋巴结的转移、远处转移及肿瘤不良预后有关,而肿瘤内淋巴管经常塌陷或可能被肿瘤细胞阻塞,故他们是否或是有多大程度上参与了此过程仍有待证实[5]。KOSTIS等[6]的研究证明了PCa肿瘤标本中瘤周(而非瘤内)淋巴管密度的升高与PCa淋巴结转移有关。
VEGF-C:血管内皮生长因子C; VEGFR:血管内皮生长因子受体。
从原发肿瘤排出的淋巴液由淋巴系统通过一个或几个淋巴结回到血液循环,其中第一个被称为“前哨淋巴结”(sentinel lymph node,SLN)。肿瘤生长期间SLN经常在大小和细胞结构上扩张,这可能是由于肿瘤细胞进入淋巴结并表达淋巴管生成因子所致。肿瘤细胞甚至在转移前就诱导SLN淋巴管生成[7],但目前临床上PCa是否存在SLN及具体淋巴结转移途径尚不明确。
1.3 淋巴管生成因子参与调节肿瘤诱导的淋巴管生成目前只有VEGF家族参与PCa淋巴管生成研究最透彻,被广泛接受。包括肝细胞生长因子(hepatocyte growth factor,HGF)、内皮素1(endothelin-1,ET-1)、胰岛素样生长因子1、2(insulin-like growth factor,IGF-1,-2)、成纤维细胞生长因子2(fibroblast growth factor,FGF-2)、血管生成素1、2(angiogenin-1,-2,Ang-1,-2)、血小板源生长因子BB(platelet derived growth factor-BB,PDGF-BB)等在内的其他淋巴管生成因子均有淋巴管生成的潜能[8],在其他癌种与淋巴结转移的相关性上取得了较多研究进展,但与PCa淋巴结转移过程的相关性目前报道较少,仍有待进一步探索。
VEGF家族是目前广泛公认的淋巴管生成因子,包括VEGF-A、VEGF-B、VEGF-C、VEGF-D、VEGF-E,他们序列高度保守、具有生物活性,是糖蛋白单体以二硫键构成的二聚体。VEGF家族可通过激活血管内皮生长因子受体(vascular endothelial growth factor receptor,VEGFR)促进血管生成以及淋巴管生成。VEGF-C、VEGF-D在体内可诱导正常淋巴管生成或肿瘤相关淋巴管生成,均可激活VEGFR-3和VEGFR-2;VEGF-A与VEGFR-1和VEGFR-2相结合,通过直接诱导LEC增殖来刺激肿瘤淋巴管生成从而促进肿瘤转移扩散[9]。
目前认为VEGF-C/D-VEGFR-3轴是调节肿瘤相关淋巴管生成的主要驱动力。特别是VEGF-C的表达与PCa淋巴结转移相关性极高:在原发肿瘤中,VEGF-C的水平与淋巴结转移水平呈显著正相关。VEGF-C和VEGF-D在肿瘤组织或其周围基质(如免疫细胞、炎性细胞)中表达,VEGFR-3表达于淋巴内皮细胞,VEGF-C和(或)VEGF-D与VEGFR-3结合形成二聚体,该二聚体促进LEC细胞质中酪氨酸残基的磷酸化,同时引起下游Shc和Grb2分子的磷酸化,加速LEC增殖并迁移以形成新的毛细淋巴管。他还增加原始淋巴管的管径,也引起淋巴管之间和淋巴管与血管之间的交错生长,这种微观结构更有利于肿瘤的淋巴转移和血行转移。同时还可以刺激CCL21-CCR7轴,增加肿瘤细胞的趋化性。
1.4 CCL21-CCR7轴CCL21由LEC产生,可固定在细胞表面,与淋巴管距离越远分布越少,形成体内的自体梯度。趋化因子受体7(C-C motif chemokine receptor 7,CCR7)是CCL21的唯一受体,在免疫细胞上表达较多。趋化因子及其受体的主要作用是诱导细胞定向迁移:①正常LEC表达CCL21时可促进表达CCR7的树突状细胞的淋巴结归巢;②在肿瘤细胞迁移和侵袭中也发挥作用,肿瘤细胞分泌VEGF-C可致LEC上VEGFR-3表达增加,进而刺激LEC分泌CCL21,这又促进了表达CCR7的肿瘤细胞向LEC靠拢聚集的趋势(图1)[10]。
2 PCa淋巴结转移的研究新方向
2.1 上皮-间质转化上皮-间质转化(epithelial-mesenchymal transition,EMT)是指上皮细胞转化为具有间质表型细胞的生物学过程。通过EMT,上皮细胞失去了细胞极性,失去与基底膜的连接等上皮表型,获得了较强的迁移与侵袭、抗凋亡和降解细胞外基质的能力等间质表型。其特征有细胞黏附分子(如E-钙黏蛋白)表达的减少等。越来越多的证据表明,高表达EMT相关转录因子(如Snail 1/2、Twist1)的肿瘤细胞通常表达高水平的基质金属蛋白酶(matrix metalloproteinase,MMP)并形成侵袭伪足以促进细胞外基质的降解,这些细胞表现出更强的淋巴结转移的能力。EMT还影响淋巴结转移过程中的趋化性:转化生长因子-β(transforming growth factor-β,TGF-β)诱导的EMT可上调癌细胞上的趋化因子受体,同时也可上调LEC中的趋化因子,激活CCL21-CCR7轴,促进癌细胞的运动和侵袭(图2)[11]。
2.2 LIMK1和LIMA1等重要分子LIMK1即LIM结构域激酶1,是一种丝氨酸蛋白激酶,主要在细胞质中表达,也可在正常细胞核和细胞质间自由穿梭,在多种高侵袭性恶性肿瘤表达升高。活化的LIMK1负责细胞骨架的稳定性和细胞外部刺激的结合。当细胞骨架组装好时,LIMK1通过Ser3位点的磷酸化使下游分子cofilin失活,逆转了肌动蛋白解聚的过程,促进肿瘤的侵袭和转移。HUANG等[12]发现LIMK1在PCa和阳性淋巴结标本中显著上调,是PCa淋巴结转移的独立危险因素,与PCa淋巴结转移和BFS缩短相关。
LIMA1即LIM结构域和肌动蛋白结合蛋白1,已被证明可将钙黏蛋白-连环蛋白复合物连接到肌动蛋白细胞骨架并稳定肌动蛋白束,他的下调导致粘附连接的解体、肌动蛋白细胞骨架的重塑和β-catenin信号传导的激活,这些形态、分子的改变促进EMT过程并增加PCa细胞的侵袭性。ZHANG等[13]在PCa中观察到LIMA1下调促进PCa细胞的EMT过程,并与临床淋巴结转移显著相关(图2)。
2.3 免疫逃逸主要组织相容性复合体(major histocompatibility complex,MHC)分子参与抗原提呈、诱导免疫应答等。转移到淋巴结的肿瘤细胞躲避体内免疫监视的一种策略是抑制MHC表达,从而抑制T细胞识别。携带表达低MHC-I癌细胞的患者往往具有较高的区域淋巴结转移发生率,这与低细胞毒性T细胞裂解有关。
癌细胞会增加程序性死亡受体-配体1(programmed cell death-ligand 1,PD-L1)的表达,它是一种免疫抑制检查点分子。PETITPREZ等[14]发现在PCa淋巴结转移患者中活化的肿瘤浸润T细胞可能通过释放干扰素-γ诱导肿瘤细胞上PD-L1的过表达,最终导致 T 细胞衰竭,达到免疫逃逸的目的(图2)。
2.4 花生四烯酸等脂质代谢异常为了适应淋巴结中富含脂质的环境,淋巴结转移性肿瘤细胞优先使用脂肪酸而不是葡萄糖作为能量来源,癌细胞通过上调人白细胞分化抗原36(cluster differentiation 36,CD36)和脂肪酸结合蛋白5(fatty acid binding protein 5,FABP5)来增强对脂肪酸代谢的依赖。在癌细胞中,花生四烯酸-15-脂加氧酶(arachidonate 15-lipoxygenase,ALOX15)催化花生四烯酸转化为12[S]-HETE和15[S]-HETE,这些代谢物可在淋巴管内皮上产生圆形缺陷,方便肿瘤细胞通过并进入淋巴系统内(图2);另外,环氧化酶-2(cyclooxygenase-2,COX2)催化花生四烯酸转化为前列腺素E2(prostaglandin E2,PGE2),它是一种强大的炎症调节剂,可通过免疫抑制促进淋巴结转移[15]。
2.5 缺氧诱导因子1α缺氧诱导因子1α(hypoxia inducible factor-1α,HIF-1α)是一种DNA结合转录因子,是缺氧组织最重要的标志物。在肿瘤生长、侵袭和转移中起重要作用。缺氧状态可诱导基因改变和血管生成,使肿瘤更具侵略性的细胞表型和恶性进展。HIF-1α可导致VEGF家族的上调,这些因子通过间质液流动转运到肿瘤边缘,促进淋巴结转移过程的发生。HUANG等[16]通过Meta分析发现PCa组织的HIF-1α表达水平显著高于非正常前列腺组织,且在不同的亚组中发现了类似的结果。HIF-1α的表达水平与PCa淋巴结转移以及Gleason评分显著相关(图2)。

HIF-1α:缺氧诱导因子1α;VEGF-C:血管内皮生长因子C;LIMA1:LIM结构域激酶1;LIMK1:LIM结构域和肌动蛋白结合蛋白1;TGF-β:转化生长因子-β;ALOX15:花生四烯酸-15-脂加氧酶;MHC:主要组织相容性复合体;PD-L1:程序性死亡受体-配体1;CD36:人白细胞分化抗原36;FABP5:脂肪酸结合蛋白5。
2.6 LncRNALncRNA是长度大于200 nt的非编码RNA,可在转录及转录后水平影响基因表达和翻译过程,参与肿瘤进展。长链非编码生长停滞特异性蛋白6-反义RNA1 (LncRNA DLX6-AS1)定位于人类染色体7q21.3,LncRNA DLX6-AS1也被证实参与PCa淋巴结转移过程中,他通过将DNA甲基转移酶1(DNMT1)募集到下游基因LARGE的启动子上并诱导其甲基化来下调LARGE的表达,从而加速前列腺癌细胞的恶性表型和淋巴结转移[17]。
2.7 淋巴结转移与远处转移淋巴结中癌细胞是否以及多大程度参与了远处转移是个颇有争议的话题。过去常认为淋巴结转移是远处转移的癌细胞来源,起到“桥头堡”作用;但近来有不同发现:NAXEROVA等[18]用高变DNA区域的体细胞变异,重建了结直肠癌患者的原发性肿瘤、淋巴结转移和远处转移的系统发育分叉图,发现35%的病例淋巴结和远处转移具有共同的起源,而在其余65%的病例中,远处转移似乎源自原发肿瘤中的独立亚克隆。遗憾的是目前还没有PCa相关的发育分叉图的研究成果。
3 基于上述分子机制抑制淋巴结转移潜在的靶点
3.1 靶向淋巴管生成轴阻止淋巴管生成可能是抑制肿瘤淋巴结转移、降低肿瘤死亡率的靶点。如通过使用VEGFR-3的小分子抑制剂或溶解VEGFR-3,使其无法与VEGF-C/D结合,或使用单克隆抗体阻断VEGFR-3与VEGF-C/D的结合,从而阻断VEGF-C/D-VEGFR-3轴,限制肿瘤的淋巴管生成。BURTON等[19]用VEGFR-3拮抗剂治疗PCa荷瘤小鼠,可以成功抑制淋巴管生成和癌症转移,成功抑制晚期PCa进展。此外有研究表明阻断PCa中的VEGF-C/VEGFR-3轴可能优于激素治疗作为晚期PCa的治疗方法[20]。但目前尚无抗淋巴管生成药物得到批准应用于临床。
3.2 靶向脂质代谢轴他汀类药物通过抑制3-羟基-3甲基戊二酰辅酶A还原酶(3-hydroxy-3-methylglutaryl-Coenzyme A reductase,HMGCR)(甲羟戊酸途径限速酶)来降低胆固醇水平。已在包括PCa等多种癌症中作为单一疗法或与其他药物联合进行试验,有抗肿瘤进展的作用[21];塞来昔布是一种环氧化酶-2的抑制剂,其抗肿瘤能力在PCa、乳腺癌和结直肠癌患者已得到证实[22]。但已有的临床试验聚焦在整个PCa人群,仍缺乏此类药物直接对淋巴结转移结局改善的临床试验资料。
4 总结与展望
肿瘤周围淋巴管密度的增加和现有肿瘤周围淋巴管中肿瘤细胞的侵袭是PCa淋巴结转移的主要方式。VEGF-C/D-VEGFR3轴和CCL21-CCR7轴对于PCa淋巴结转移很重要,近年来的发现在对上述两个轴进行补充之余,也提出了EMT、免疫逃逸、脂质代谢及缺氧适应性等新领域,为之后的研究奠定基础。
PCa患者肿瘤具有异质性,所以未来针对单个的前列腺癌患者开发本质上更个性化的疗法是很重要的。阻止淋巴管生成可能是抑制肿瘤淋巴结转移,降低肿瘤死亡率的策略;而肿瘤淋巴管生成相关指标有望作为PCa淋巴结转移的预后指标,如肿瘤内和肿瘤周围淋巴管的密度、血液中循环淋巴管生成因子水平的定量检测等。但是,该领域还有许多未解的问题需要探索,例如需要确定淋巴结转移导致远处器官转移的程度以及机制,阐明抗淋巴管药物效果不佳的主要原因,开展精准淋巴管标记成像等。