槲皮素通过G3BP1调控Wnt/β-catenin信号通路对前列腺癌细胞迁移、侵袭及上皮-间充质转化的影响
2022-03-03邹安庆古丽扎尔伊里阿力木热合曼
贺 毅,杨 鑫,邹安庆,古丽扎尔·伊里,阿力木·热合曼,崔 涛,郜 乐,杜 恒,马 彬
(新疆医科大学第二附属医院泌尿外科,新疆乌鲁木齐 830063)
前列腺癌(prostate cancer,PCa)是发生在男性前列腺腺体的上皮性恶性肿瘤,已成为影响全球男性健康的重大难题之一[1-2]。当前,PCa的治疗方式有手术治疗、内分泌治疗、放化疗及局部治疗等,但肿瘤细胞的持续增殖、迁移和转移导致PCa临床治疗效果不佳,患者生存率下降[3-4]。因此,探寻抑制PCa转移的新方法或者新靶点,对PCa的临床治疗具有重要意义。上皮-间充质转化(Epithelial-mesenchymal transition,EMT)是肿瘤细胞获得侵袭、迁移能力的重要生物学过程,EMT可促进肿瘤进展,增加肿瘤治疗难度[5-6]。GTP酶激活蛋白-Src同源结构域3-结合蛋白1(Ras-GTPase-activating protein SH3 domain binding protein,G3BP1)是一种SH3结构域结合蛋白。已有文献显示 G3BP1 在脑部肿瘤、肺癌、前列腺癌、结肠癌等多种癌症中高表达,其可通过调节多种信号通路促进肿瘤细胞增殖、转移及EMT过程[7-9]。因此,G3BP1可能是防治肿瘤细胞EMT过程、发生转移的潜在靶点。槲皮素(Quercetin)是一种天然黄酮类化合物,具有抗菌、抗炎、抗肿瘤、降血压等多种生物活性。近年来多项研究表明,槲皮素对肝癌、胃癌、乳腺癌等多种肿瘤细胞均有抑制作用,是颇具研究价值和应用前景的抗癌药物之一[10-11]。已有研究证实,槲皮素可增加人前列腺癌细胞-3(human prostate cancer cell,PC-3)对化疗药物的敏感性并逆转其对化疗药的耐药性。但槲皮素对PCa细胞迁移、侵袭及EMT的作用效果及机制尚未完全明确[12]。因此,本研究探讨槲皮素对PCa细胞迁移、侵袭及EMT的影响,并探究其可能的作用机制。
1 材料与方法
1.1 细胞株PC-3细胞株购自上海远慕生物科技有限公司。
1.2 主要试剂与仪器主要试剂:槲皮素购自成都德思特生物技术有限公司,纯度≥98%;胎牛血清(Fetal bovine serum,FBS)购自美国Gibco公司;DMEM培养基购自美国艾德思公司;Transwell小室购自Corning公司;Matrigel基质胶购自美国BD公司;胰蛋白酶、青霉素、链霉素、RIPA裂解液、蛋白质提取试剂盒、二辛可宁酸(Bicinchoninic acid,BCA)试剂盒均购自上海碧云天生物技术公司;LipofectamineTM2000购自美国Invitrogen公司;NC siRNA和G3BP1 siRNA购自美国Origene公司;真核过表达质粒pcDNA3.1-G3BP1及对照质粒pcDNA3.1均购自上海吉玛制药有限公司;G3BP1及内参上下游引物均购自上海生工公司;Trizol试剂盒、TaqMan miRNA反转录试剂盒、2×SYBR Premix Ex Taq试剂盒均购自日本TaKaRa公司;G3BP1、E-钙黏蛋白(E-cadherin)、N-钙黏蛋白(N-cadherin)、波形蛋白(Vimentin)、转录因子Snail、Wnt家族成员3A(Wnt family member 3A,Wnt3α)、β-连环蛋白(β-catenin)、糖原合成酶激酶3β(Glycogen synthase kinase-3β,GSK-3β)、磷酸化GSK-3β(p-GSK-3β)等兔抗人单克隆抗体均购自美国Cell Signaling Technology公司;小鼠抗人β-肌动蛋白(β-actin)单克隆抗体购自美国Abcam公司;辣根过氧化物酶(Horseradish peroxidase,HRP)标记的山羊抗兔 IgG、HRP标记的山羊抗小鼠IgG 购自Sigma公司;电化学发光液购自 Millipore 公司。
主要仪器:Forma370细胞培养箱(美国Thermo公司);Varioskan LUX 多功能酶标仪(美国Thermo公司);DYC-p32型电泳仪(上海巴玖实业有限公司);实时定量PCR仪(美国Bio-Rad公司);低温高速离心机(德国Eppendorf公司);倒置荧光显微镜(日本Olympus公司);FCM凝胶成像仪(美国Protein Simple公司)。
1.3 实验方法
1.3.1细胞培养 解冻、复苏PC-3细胞,置于加有10% FBS、100 U/mL青霉素和100 μg/mL链霉素的DMEM培养基,37 ℃,5% CO2培养箱中培养,待细胞贴壁生长至80%~90%时,以0.25%的胰酶消化传代,收集生长状态良好的对数生长期细胞制备单细胞悬液。
1.3.2细胞分组与处理 取生长状态良好的对数生长期PC-3细胞,分别用20、40、80 μmol/L浓度槲皮素处理48 h的PC-3细胞作为槲皮素低、中、高浓度组,并筛选出槲皮素适宜浓度用于后续研究;正常培养的PC-3细胞设为空白对照组;将稀释的LipofectamineTM2000 和 G3BP1 siRNA干扰序列混合液转染至PC-3细胞,培养6 h,然后用适宜浓度的槲皮素处理48 h,记为槲皮素+G3BP1 siRNA组,同时设置槲皮素+si-NC组;将稀释的pcDNA3.1-G3BP1与LipofectamineTM2000混合液转染至PC-3细胞,培养6 h,然后用适宜浓度的槲皮素处理48 h,记为槲皮素+pcDNA3.1-G3BP1组,同时设置槲皮素+pcDNA3.1组。
1.3.3细胞划痕试验检测细胞迁移能力 取各组PC-3细胞,经胰酶消化后制成单细胞悬液,以5×105个/孔的接种密度均匀接种于6孔板进行培养等待贴壁,每孔设6个复孔,细胞贴壁铺满孔板底部时弃去培养液,用高温灭菌的20 μL移液枪头匀速在6孔板内垂直划痕,用灭菌的磷酸盐缓冲液(phosphate buffered solution,PBS)小心冲洗3次,随后加入无血清的DMEM培养基,将6孔板放于倒置显微镜下观察拍照,标记初始划痕距离,继续培养24 h后显微镜下再次拍照,计算细胞迁移率,实验重复3次。细胞迁移率(%)=(初始划痕距离-24 h划痕距离)/初始划痕距离×100%。
1.3.4Transwell小室法测定细胞侵袭能力 各组PC-3细胞用无血清DMEM培养基处理12 h后,重悬并调整细胞浓度约5×105/mL,取各组细胞悬液200 μL接种于Transwell小室的上室(Transwell小室基底膜预先使用1∶8的matrigel基质胶包被),下室加入含10% FBS的DMEM培养基600 μL,每组设置3个复孔,将Transwell小室置入37 ℃,5% CO2培养箱中常规培养24 h,弃去培养液,无菌棉签轻轻擦去上层未穿膜细胞,PBS洗涤3次,加入4%多聚甲醛固定20 min,室温下用0.1%结晶紫染色30 min,弃去染液,PBS冲洗3次,自然晾干,于400倍倒置显微镜下随机选取5个视野进行细胞计数,结晶紫染色细胞数即为侵袭细胞数。实验重复3次。
1.3.5qRT-PCR检测G3BP1 mRNA表达水平 收集各组细胞,采用Trizol法提取细胞中的总RNA,以酶标仪检测RNA浓度。根据反转录试剂盒将总RNA反转录合成cDNA。G3BP1上游引物5′-GTCGCCCAGTTGCAGTGCTG-3′,下游引物5′-CAGTCGGACCTGCTCAGCTG-3′;β-actin上游引物5′-TGCACCAGCTGCTCTTCAGC-3′,下游引物5′-AGCTGGACCTCGGATCAGCAG-3′。以cDNA为模板进行qRT-PCR实验,反应体系为:10 μmol/L的G3BP1及GAPDH上下游引物各0.5 μL,cDNA模板2 μL,2×SYBR Premix Ex Taq 12.5 μL,加灭菌蒸馏水至总反应体系25 μL。反应条件为:95 ℃预变性30 s,95 ℃预变性15 s,60 ℃退火30 s,72 ℃延伸30 s,共进行40次循环。以β-actin为内参,采用2-△△Ct法计算G3BP1 mRNA相对表达量。
1.3.6Western blot法测定细胞内G3BP1、EMT、Wnt/β-catenin相关蛋白表达水平 收集各组细胞,胰酶消化处理,加入RIPA细胞裂解液,冰上裂解30 min,12 000 r/min离心10 min,提取总蛋白,采用BCA法测定总蛋白浓度。聚丙烯酰氨凝胶电泳(Sodium salt-polyacrylamide gel electrophoresis,SDS-PAGE)分离蛋白后湿转至聚偏氟乙烯(Polyvinylidene Fluoride,PVDF)膜上,在含5% 脱脂奶粉的TBST缓冲液中室温封闭2 h,分别加入G3BP1、E-cadherin、N-cadherin、Vimentin、Snail、Wnt3α、β-catenin、GSK-3β、p-GSK-3β、β-actin单克隆抗体,稀释比均为1∶1 000),4 ℃孵育过夜,TBST洗涤3次,每次10 min,对应加入HRP标记的山羊抗兔IgG和HRP标记的山羊抗小鼠IgG 1∶2 000,室温孵育1 h,TBST洗涤3次,每次10 min,滴加ECL试剂显色,于暗室中曝光,采集图像,分析各条带灰度,计算目的蛋白表达水平。

2 结 果
2.1 槲皮素抑制PC-3细胞迁移、侵袭及EMT细胞划痕实验结果显示,与空白对照组相比,槲皮素低、中、高浓度组PC-3细胞迁移能力均显著下降(P<0.05),且细胞迁移能力降低程度呈浓度依赖性(图1A);Transwell小室法实验结果显示,与空白对照组相比,槲皮素低、中、高浓度组PC-3细胞侵袭能力均显著下降(P<0.05),且细胞侵袭能力降低程度呈浓度依赖性(图1B); Western blot法检测结果显示,与空白对照组相比,槲皮素低、中、高浓度组PC-3细胞E-cadherin表达量均显著上调(P<0.05),N-cadherin、Vimentin、Snail表达量均显著下调(P<0.05),且上述蛋白表达量变化呈浓度依赖性(图1C)。由于槲皮素对PC-3细胞的作用效果呈浓度依赖性,故本研究后续实验选用高浓度槲皮素处理PC-3细胞。
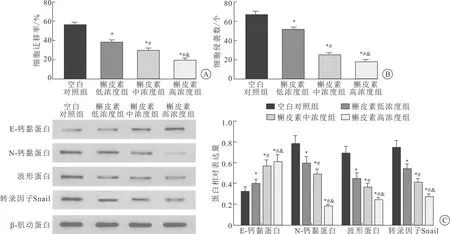
A:细胞划痕试验检测PC-3细胞迁移能力柱状图;B:Transwell小室法检测PC-3细胞侵袭能力柱状图;C:Western blot法检测EMT相关蛋白表达水平及柱状图。*与空白对照组比较,P<0.05;#与槲皮素低浓度组比较,P<0.05;&与槲皮素中浓度组比较,P<0.05。
2.2 槲皮素抑制PC-3细胞G3BP1 mRNA和蛋白表达与空白对照组相比,槲皮素低、中、高浓度组PC-3细胞G3BP1 mRNA和蛋白表达水平均显著下降(P<0.05),且G3BP1 mRNA和蛋白表达水平下降程度呈浓度依赖性(图2)。图2显示Western blot法检测G3BP1、qRT-PCR法检测G3BP1 mRNA表达水平电泳图及柱状图。

* 与空白对照组比较,P<0.05;#与槲皮素低浓度组比较,P<0.05;&与槲皮素中浓度组比较,P<0.05。
2.3 沉默G3BP1联合槲皮素抑制PC-3细胞迁移、侵袭及EMT槲皮素+G3BP1 siRNA组PC-3细胞内G3BP1 mRNA表达水平显著低于槲皮素+si-NC组和空白对照组(P<0.05),槲皮素+si-NC组和空白对照组PC-3细胞内G3BP1 mRNA表达水平无显著性差异(P>0.05),说明G3BP1 siRNA转染成功(图3A)。与空白对照组比较,槲皮素+si-NC组和槲皮素+G3BP1 siRNA组PC-3细胞迁移、侵袭能力均显著下降(P<0.05)(图3B、C);与槲皮素+si-NC组比较,槲皮素+G3BP1 siRNA组PC-3细胞迁移、侵袭能力均显著下降(P<0.05)(图3B、C)。Western blot法检测结果显示,与空白对照组比较,槲皮素+si-NC组和槲皮素+G3BP1 siRNA组PC-3细胞E-cadherin表达量均显著上调(P<0.05),N-cadherin、Vimentin、Snail表达量均显著下调(P<0.05);与槲皮素+si-NC组比较,槲皮素+G3BP1 siRNA组PC-3细胞E-cadherin表达量显著上调(P<0.05),N-cadherin、Vimentin、Snail表达量均显著下调(P<0.05)(图3D)。

A:qRT-PCR法检测G3BP1 mRNA表达水平柱状图;B:细胞划痕试验检测PC-3细胞迁移能力柱状图;C:Transwell小室法检测PC-3细胞侵袭能力柱状图;D:Western blot法检测EMT相关蛋白表达水平及柱状图。*与空白对照组比较,P<0.05;# 与槲皮素+si-NC组比较,P<0.05。
2.4 过表达G3BP1拮抗槲皮素促进PC-3细胞迁移、侵袭及EMT槲皮素+pcDNA3.1-G3BP1组PC-3细胞内G3BP1 mRNA表达水平显著高于槲皮素+pcDNA3.1组和空白对照组(P<0.05),槲皮素+pcDNA3.1组和空白对照组PC-3细胞内G3BP1 mRNA表达无显著性差异(P>0.05),说明pcDNA3.1-G3BP1转染成功(图4A)。与空白对照组比较,槲皮素+pcDNA3.1组和槲皮素+pcDNA3.1-G3BP1组PC-3细胞迁移、侵袭能力均显著下降(P<0.05);与槲皮素+pcDNA3.1组比较,槲皮素+pcDNA3.1-G3BP1组PC-3细胞迁移、侵袭能力均显著升高(P<0.05)(图4B、C)。Western blot法结果显示,与空白对照组比较,槲皮素+pcDNA3.1组和槲皮素+pcDNA3.1-G3BP1组PC-3细胞E-cadherin表达量均显著上调(P<0.05),N-cadherin、Vimentin、Snail表达量均显著下调(P<0.05);与槲皮素+pcDNA3.1组比较,槲皮素+pcDNA3.1-G3BP1组PC-3细胞E-cadherin表达量显著下调(P<0.05),N-cadherin、Vimentin、Snail表达量均显著上调(P<0.05)(图4D)。
2.5 沉默/过表达G3BP1联合槲皮素影响PC-3细胞Wnt/β-catenin信号通路相关蛋白表达Western blot法结果显示,与空白对照组比较,槲皮素组、槲皮素+G3BP1 siRNA组、槲皮素+pcDNA3.1-G3BP1组PC-3细胞Wnt3α、β-catenin、p-GSK-3β表达量均显著下调(P<0.05),GSK-3β表达量显著上调(P<0.05);与槲皮素组比较,槲皮素+G3BP1 siRNA组PC-3细胞Wnt3α、β-catenin、p-GSK-3β表达量均显著下调(P<0.05),GSK-3β表达量显著上调(P<0.05),槲皮素+pcDNA3.1-G3BP1组PC-3细胞Wnt3α、β-catenin、p-GSK-3β表达量均显著上调(P<0.05),GSK-3β表达量显著下调(P<0.05)(图5)。

A:qRT-PCR法检测G3BP1 mRNA表达水平柱状图;B:细胞划痕试验检测PC-3细胞迁移能力柱状图;C:Transwell小室法检测PC-3细胞侵袭能力柱状图;D:Western blot法检测EMT相关蛋白表达水平电脉图及柱状图。*与空白对照组比较,P<0.05;#与槲皮素+si-NC组比较,P<0.05。
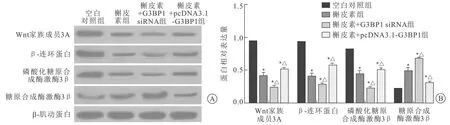
A:Western blot法检测各组相关蛋白表达水平电泳图;B:各组相关蛋白表达水平柱状图。*与空白对照组比较,P<0.05;△与槲皮素组比较,P<0.05。
3 讨 论
PCa是常见且发病率高的男性恶性肿瘤之一,早期症状轻但却易发生转移,临床确诊时许多患者已处于晚期,虽然临床上有手术、化疗、内分泌治疗等手段可改善PCa患者生存率,然而肿瘤细胞远端转移仍然是影响患者存活率和预后的主要不良因素[13],因此,探究PCa发生、转移的分子机制,寻找治疗PCa的分子靶点极为必要。槲皮素是一种具有抗炎、抗氧化、抗肿瘤等多种药理作用的天然多醇羟基黄酮类化合物,大量的临床研究证实槲皮素可抑制多种肿瘤细胞的增殖、侵袭和转移[14-15]。本研究考察槲皮素对PCa细胞侵袭、迁移的影响,结果显示,槲皮素能显著抑制PC-3细胞迁移、侵袭,并呈现浓度依赖性关系。
G3BP1是一种RNA结合蛋白,具有调节压力颗粒形成和mRNA代谢及稳定性等多种生物学功能。近年来,越来越多的研究证据表明G3BP1可以参与肿瘤发生和转移[21]。但G3BP1在PCa中的功能作用尚不清楚。本研究采用qRT-PCR和Western blot实验检测G3BP1 mRNA和蛋白表达水平,结果显示槲皮素处理PC-3细胞后,PC-3细胞中G3BP1 mRNA和蛋白表达水平明显降低,提示G3BP1可能参与了槲皮素抗PCa的过程。为进一步明确G3BP1在槲皮素治疗PCa中的功能作用,本研究通过沉默和过表达G3BP1,分析G3BP1对PC-3细胞迁移、侵袭及EMT的影响,结果发现,沉默G3BP1能够增强槲皮素对PC-3细胞迁移、侵袭及EMT的抑制效果,过表达G3BP1能够逆转槲皮素对PC-3细胞迁移、侵袭及EMT的抑制效果。该结果表明槲皮素可通过靶向G3BP1抑制PC-3细胞迁移、侵袭及EMT进程。
Wnt/β-catenin信号通路是一条高度保守的信号通路,参与正常干细胞的增殖、凋亡与迁移。当Wnt/β-catenin信号通路被异常激活时,Wnt3α作为一种激活Wnt/β-catenin通路的Wnt同源物,可促进一系列蛋白活化,导致GSK3β磷酸化失活和β-catenin蛋白聚积。胞内大量聚积的β-catenin转移进入细胞核中会激活转录因子的转录活性,促进靶基因转录,从而调控肿瘤细胞增殖、侵袭、转移等生理活动[22-23]。大量临床研究证实Wnt/β-catenin信号通路在PCa的发生、发展中起着重要作用[24-25]。WEI等[26]报道汉黄芩苷通过调节 Wnt/β-catenin 通路和EMT抑制PCa细胞生长和转移。WU等[27]研究表明2’-羟基黄酮通过抑制 Wnt/β-catenin信号通路进而抑制PCa细胞EMT过程和细胞迁移、侵袭。LI等[28]研究报道,过表达G3BP1通过激活 β 连环蛋白信号通路促进结肠癌的进展。ZHANG等[29]研究发现G3BP1基因沉默通过抑制 Wnt/β-catenin 和 PI3K/AKT 信号通路抑制食管癌细胞的增殖、迁移和侵袭,而G3BP1基因过表达则对食管癌细胞的生长和转移产生相反作用。本研究探究槲皮素、G3BP1与Wnt/β-catenin通路的关系,结果发现,槲皮素能够显著下调PC-3细胞Wnt3α、β-catenin、p-GSK-3β表达量,上调PC-3细胞GSK-3β表达量;沉默G3BP1能够增强槲皮素对Wnt/β-catenin信号通路相关蛋白的调控作用,过表达G3BP1可逆转槲皮素对Wnt/β-catenin信号通路相关蛋白的调控作用。该结果提示槲皮素通过G3BP1调控Wnt/β-catenin信号通路发挥抗PCa的作用。
综上所述,槲皮素能够抑制PCa细胞EMT进程,进而抑制PCa细胞侵袭、迁移,槲皮素抑制EMT的作用机制可能与靶向G3BP1调控Wnt/β-catenin信号通路相关。本研究为PCa的治疗提供了潜在的靶点和候选药物。