神经影像学技术在帕金森病中的应用进展
2022-03-03林盼盼,张晓磊,吴仁华
林盼盼,张晓磊,吴仁华

摘要:帕金森病作为常见的神经系统退行性疾病,早期诊治依然存在困难。近几年神经影像学飞速发展,神经影像学技术在帕金森病的诊断和治疗方面的研究成果层出不穷。本文通过挖掘帕金森病神经影像学相关领域的研究趋势和热点,对帕金森病神经影像学近几年的研究成果和临床应用进行阐述。
关键词:帕金森病;神经影像学;多学科融合
中图分类号:R741;R81文献标识码:BDOI:10?郾3969/j.issn.1001-0270.2022.01.01
Advances in Neuroimaging Techniques in Parkinson's Disease
LIN Pan-pan1, 2, ZHANG Xiao-lei2, WU Ren-hua(Corresponding author)2
(1. School of Clinical Medicine, Quanzhou Medical College, Fujian 362000, China; 2.Department of Radiology, Second Affiliated Hospital, Shantou University School of Medicine, Fujian 515000, China)
Abstract: Parkinson's disease is a common neurodegenerative disease,while the early diagnosis and treatment of Parkinson's disease remains difficult. In recent years, neuroimaging has developed rapidly, and researches of neuroimaging techniques in Parkinson's disease emerge in an endless stream. In this study, we mine the trends and hotspots in the field of neuroimaging related to Parkinson's disease, and analyze the research findings and clinical applications of neuroimaging in Parkinson's disease in recent years.
Key Words: Parkinson's disease; neuroimaging; multi-subjects amalgamation
帕金森病(PD)的患病率逐年升高,然而对PD的诊断仍基于1997年发表的英国脑库PD诊断标准,即以患者的临床症状为主要诊断依据[1]。PD的辅助检查除了嗅觉识别测试等方法之外[2-3],大量的影像学技术如磁共振成像(MRI)也被应用于PD患者的诊断。目前临床PD影像学检查还包括正电子发射计算机体层成像(PET)[4]、新兴的正电子发射断层扫描-核磁共振成像(PET-MRI)和经颅超声(TCS)等[5]。PET可检测纹状体内多巴胺的含量,通过对多巴胺受体显像以鉴定PD患者脑内黑质-纹状体通路的亚临床损伤[6]。PET-MRI通过结合患者的脑部结构信息和脑功能信息,深入研究脑代谢的改变[7]。截至2021年4月,在PubMed数据库共检索到419篇有关PD神经影像学的文献(检索结果不包括超声相关的文献),其中,刊登在影响因子(IF)>5的期刊122篇,占比29.12%,说明神经影像学技术在PD中的应用是国内外学者持续研究的热点。近年来,多模态成像和多学科融合已成为PD神经影像学的研究趋势和热点,如Knudsen等(2018)[8]采用多模态神经成像对运动前PD进行诊断,Bi等(2021)[9]基于多模态成像设计了聚类随机神经网络(CERNNE),可识别PD患者并预测相关脑区和基因。本研究通过深入剖析与PD影像学相关的研究趋势和热点,为即将开展的PD影像学研究指明方向。
1 1985年以来高IF期刊中PD影像学相关文献研究趋势
1.1 高IF期刊中PD影像学相关文献检索方法和文献分布
在PubMed中以Parkinson Disease和 Neuroimaging等作为检索的主题词(MeSH),采用逻辑检索,共检索出419篇PD影像学相关的文献,将高IF期刊定义为IF>5的期刊,初步筛选出122篇发表于高IF期刊的文献。这122篇文献所在期刊IF最高为33.130,发表在Nature Medicine[10],IF最低为5.074,发表在European Journal of Medicinal Chemistry[11]。经统计,高IF期刊中的文献70%以上发表在Radiology、Neurology、Journal of Nuclear Medicine和Annals of Neurology这4本期刊上。表1汇总了IF>9的期刊分布,共计20篇,在高IF期刊中占比16.26%。
1.2 PD神经影像学领域研究趋势
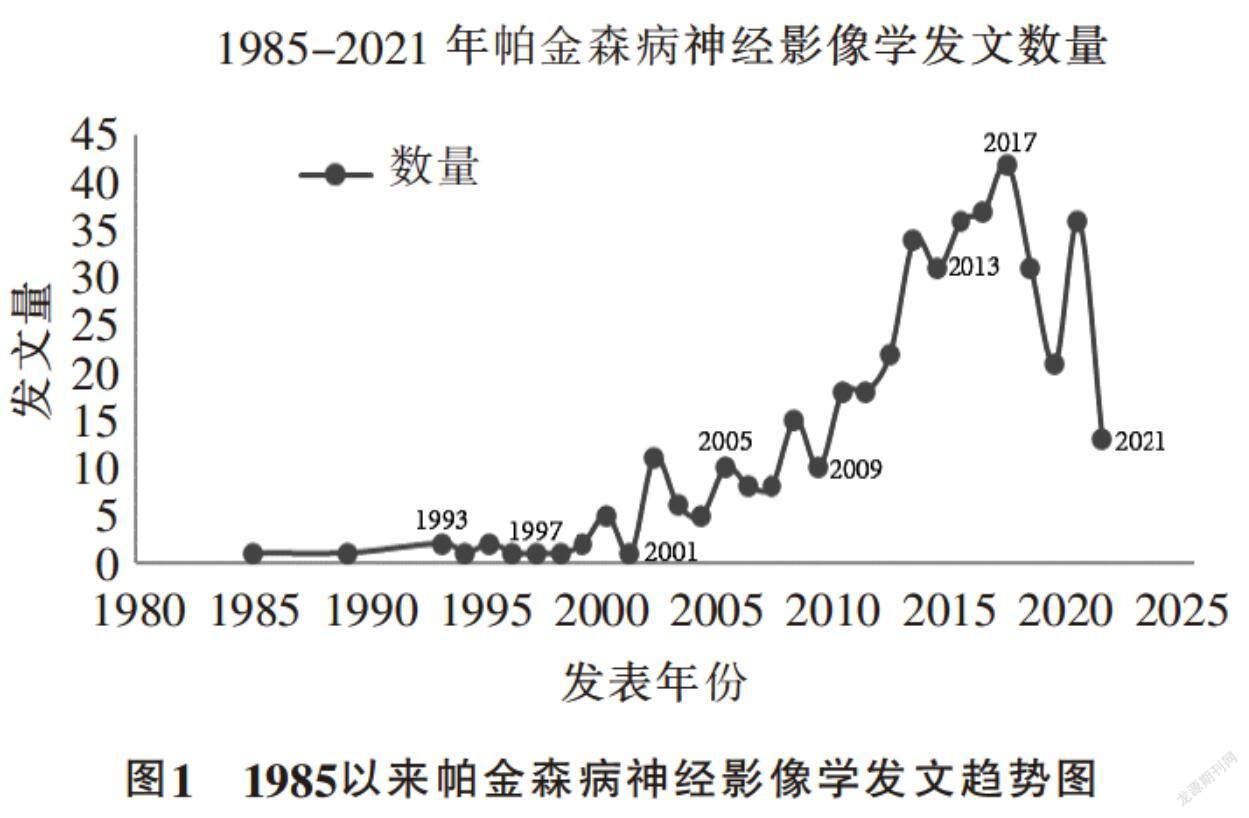
1.2.1 PD神经影像学领域的历年发文量以及高IF期刊中的文献占比
如图1所示,PD影像学领域研究成果的数量平稳上升。其中,2017年度发文量最多,全年文献总量达到41篇,发表在高IF期刊中的文献达到14篇,占比34.15%。
1.2.2 PD神经影像学领域研究趋势初步探析
PD神经影像学研究的高频关键词为脑白质、多巴胺转运体(DAT)、纹状体、中脑直径、黑质、胆碱和丘脑下核(STN)。临床研究中常采用影像学方法对PD和多系统萎缩(MSA)以及进行性核上性麻痹(PSP)进行鉴别诊断或比较研究[12-13]。通过对发表在高IF期刊122篇文献的研究主题和技术归纳后,PD所采用的影像学技术手段可分为两个阶段:第一阶段为1985-2005年(含2005年),2005年之前的前沿影像学技术多体现在SPECT的应用,这个阶段的显像剂多以DAT顯像剂123I-beta-CIT为主[14-15]。第二阶段为2005年至今,2005年之后高IF期刊中研究PD的文献所选用的影像学技术多为MRI,研究方法集中在弥散张量成像(DTI)[16-17]、静息状态功能磁共振成像(rs-fMRI)[18]以及定量磁敏感图(QSM)[19],SPECT的显像剂多选用的是123I-FP-CIT[20]。这个阶段出现许多基于PET技术研究PD发病及疾病诊断的高水平研究成果[21]。与此同时,PD相关的神经影像研究呈现出多学科和跨学科的研究趋势,如来自意大利的学者将影像学技术与机器学习相结合,尝试采用算法来诊断PD或与其他疾病区分[22-23],南加州大学的研究人员利用基于3D卷积神经网络的深度学习技术对MR图像进行校正,极大地改进了PD患者脑皮质表面重建的质量指标[24]。
2 近5年高IF期刊中的文献选定
2.1 文献纳入标准
本研究纳入标准:①研究内容与PD影像学密切相关;②文献所用语言为英语;③发表时间为2017年1月至今;④文献IF>5(发表当年的IF);⑤刊登的期刊为中科院JCR期刊分区2区及以上。
2.2 文献排除标准
本研究排除标准:①文献属于综述、评论、案例报道、声明、社论、快讯和信件等体裁;②文献所用语言为葡萄牙语、法语和德语等;③研究对象还包括糖尿病等其他系统的疾病,或者包括MSA、脑肿瘤和脑梗死等其他神经系统疾病;④属于动物研究;⑤研究方法不是以神经影像学为主要技术手段,而是基于影像学技术引导的立体定向治疗相关研究。
3 近5年高IF期刊中影像学技术在帕金森病诊断中的研究热点和应用
本研究中,122篇发表于高IF期刊的文献有20篇属于综述、评论和案例报道等,17篇是与衰老、精神神经障碍和MSA等疾病做比较研究,2篇属于动物研究,2篇以脑深部刺激术(DBS)为主要研究技术;排除2017年之前发表的53篇文献,最终纳入研究的文献共计28篇。接下来,基于高IF期刊中的28篇文献对PD神经影像学近几年的研究热点和应用做一综述。
3.1 基于体素的形态学测量
近年来,基于体素的形态学测量(VBM)作为MR的结构成像技术之一,越来越多地应用于PD患者局部大脑结构的研究。PD患者在早期阶段可表现为脑容量的减少,许多研究也表明PD患者局部大脑体积的改变与认知功能障碍存在相关性[25]。VBM技术能够计算大脑皮层厚度及体积,尤其在患病的早期,可用于评价PD认知障碍患者脑部灰质结构的变化[26]。由此可见,研究者们有望通过基于VBM技术的形态学研究结果动态评估PD患者的疾病进程[27]。然而目前VBM仅能应用于组间差异的对比,不适用个体疾病进程的评估,且依赖较高的后期图像处理能力,加之研究结果在不同研究团队之间存在差异,因此VBM在临床影像学中的应用受到一定限制。最终纳入研究的高IF期刊的文献中,来自宾夕法尼亚大学医学中心的学者基于体素和感兴趣区域,构建T1W/T2W比率图,研究结果具有极高的灵敏度,可用于PD早期诊断[28]。
3.2 弥散张量成像
DTI是一种用于评估白质完整性的影像学技术,主要用于研究活体脑组织结构的变化[29-30]。DTI技术基于对“流体中水分子的随机运动”的测量,可以在活体组织中测量到脑组织内水分子流动的平均弥散率(MD)和各向异性(FA)。脑组织中的物理屏障如轴突、髓鞘和微管等物质,使得脑内水分子的移动具有一定的方向性。在健康人群的神经系统中,水分子倾向于沿着白质纤维束运动,而一旦轴突及其周围的神经传导束遭到破坏,水分子的运动将变得杂乱无章,进而引起水分子流动的MD增加和FA减少。MD和FA在轻度认知障碍等神经退行性疾病的病理学研究中被用作结构损伤的标记。有研究表明,使用DTI技术可以观察到PD患者比健康人群对照组显著增加的MD和明显减弱的FA,并且DTI对于脑组织连接异常的识别要早于大脑皮层灰质的萎缩。DTI技術已逐渐成为研究PD病理生理学和疾病严重程度的敏感方法[31],因此在高IF期刊文献中常被用于早期PD的影像学诊断研究。比如,基于DTI的参数探索脑白质扩散的剖面,进而评估脑白质变化,以此发现PD患者视觉系统的早期变化[32]。又比如,有学者采用DTI技术识别出PD患者胼胝体的白质异常[33]。
3.3 多巴胺转运体成像
DAT成像技术被认为是评估PD患者多巴胺能神经元受损严重程度的金标准。近几年随着SPECT的普及,DAT成像技术已被广泛使用,在PD的早期诊断和患者运动症状及并发症的预测中具有一定的价值。经统计,纳入最终研究的28篇文献有11篇采用的研究技术与DAT成像技术相关。DAT在多巴胺能神经元之间的信息传递过程中起着关键作用,然而,因DAT受体密度将随着年龄的增长而下降,以及多种药物对多巴胺的摄取会产生影响进而不利于DAT的良好显像,因此在临床上尚未将其作为常规的影像学诊断工具。DAT成像常用于PD的早期诊断,有学者采用纹状体DAT成像技术来研究脑病理学与神经丝轻链蛋白(NfL)浓度的关系[34]。
3.4 神经黑色素成像
神经黑色素(NM)是多巴胺代谢的产物,随着年龄的增长而积累在黑质的多巴胺神经元中。多巴胺数量的减少和功能的缺失会导致黑质中NM不同程度的累积。多项研究表明,NM、铁和多巴胺在PD中的相互作用促进病程进展[35],铁的沉积和NM在脑黑质中的积累与大脑老化和神经退行性疾病尤其是PD密切相关[36]。一个公认的理论是,NM通过绑定铁离子来对芬顿反应进行催化,形成活性氧物质,进而在PD的发病机理中起到关键作用。另一种理论认为,NM通过影响PD患者的钙信号通路,保护多巴胺能神经元细胞免于细胞死亡。神经黑色素敏感的磁共振成像(NM-MRI)是一种较新的MRI技术,可用于研究体内多巴胺在神经退行性疾病中的作用[37]。因黑质和蓝斑等部位富含NM,MRI技术可在活体的这些部位检测到NM的丢失,影像学图像上黑质和蓝斑等部位呈现低信号改变,信号的强度体现NM的丢失或耗竭程度,观察这些部位出现的低信号及其改变情况有助于PD的早期诊断。
3.5 超高场强磁共振成像
韩国仁川大学神经科学研究所的学者们,在2012年使用超高场MRI(7-T)来研究PD 患者脑内黑质的解剖变化[38],同时基于3D形状分析大脑区域,定量比较PD患者和健康人群的脑图像。研究结果表明,3D 7-T MRI可对PD患者脑内黑质的结构改变进行可视化,该研究成果发表在当年的Annals of Neurology。2014年,意大利学者也通过对黑质进行7-T MR成像来区分PD患者和健康受试者,他们认为,7-T的MR成像可以精确地描述黑质并可视化其内部组织,为PD患者的诊断提供了新思路,该重要成果被发表在高IF期刊Radiology上[39]。
随着神经影像学技术的更新迭代,深入研究近几年新兴的影像学技术及其在PD等神经退行性疾病中的应用,必将对PD的早期诊断起到促进作用。
4 帕金森病神经影像学的多学科融合应用
上文总结了基于高IF期刊文献中的神经影像学技术在PD发病和疾病进展过程中的诊断应用。近年来,帕金森病神经影像学的研究逐渐趋于多学科融合研究,如影像科与药理科、眼科和神经外科等科室的紧密结合,推动多学科的融合和发展。
4.1 影像学技术在PD患者视觉障碍诊断中的应用
PD患者的视觉功能障碍涉及视觉敏锐度、瞳孔反应、视觉处理速度和眼球运动感知等。此外,还可能存在视觉空间方向障碍、面部识别问题和慢性视觉幻觉等。视觉体征和症状是PD临床表现的重要组成部分,视觉障碍对患者整体的运动功能有重要影响。越来越多的高IF期刊文献采用影像学技术对PD患者的视觉障碍与结构和患病机制的关联进行探索,比如有学者采用基于18F-FP-CIT的PET/CT顯像技术,证实了未经治疗的PD患者视网膜变薄与黑质多巴胺能丧失相关[40],还有学者采用MRI技术,在获得T1加权成像、视觉任务期间的全脑功能MR成像和DTI数据的基础上,分析出伴有视觉障碍的PD患者枕叶γ-氨基丁酸减少[41]。
4.2 影像学技术在PD患者临床分期中的应用
Hoehn-Yahr分级表常用于评估PD患者的运动障碍级别,采用影响平衡、自行走动和站立等词汇来记录其日常活动,可用来预测PD患者的病情,并进行临床分期的评估,此表于1967年发表于美国Neurology刊物上。来自四川大学华西医院的研究团队应用静息态fMRI和图论方法探讨PD脑功能连接体及其与疾病严重程度的潜在关系,认为PD患者的脑功能连接体表现为整体水平(如聚类系数)异常和节点水平(如运动皮层节点中心)异常,并且运动皮层节点中心随着Hoehn和Yahr分期的增加而降低。基于Hoehn-Yahr分级表的影像学研究为影像学技术在PD患者临床分期的应用提供了拓扑结构新见解[42]。
4.3 影像学技术在PD生物标志物中的应用
在生理条件下,精氨酸循环通过自噬维持细胞的生长,使得生物体的寿命得以延长。因此,来自日本的学者们评估了以精氨酸为首的聚胺代谢物作为PD生物标志物的能力。结果表明,精胺相关的合成物或可作为PD潜在的生物标志物,且和疾病的严重程度相关[43]。另外,有学者对32例LRRK2 G2019S突变的无症状携带者进行DAT的SPECT扫描,并对图像进行视觉和半定量分析,评估影像学在预测无症状LRRK2 G2019S携带者4年后转化为PD的价值[44]。
综上所述,神经影像学技术在PD的早期诊断和临床应用中有着巨大的潜力和价值。
参考文献:
[ 1 ] GRAYSON M. Parkinson's disease[J]. Nature,2016,538(7626):S1.
[ 2 ] ROSS G W,PETROVITCH H,ABBOTT R D,et al. Association of olfactory dysfunction with risk for future Parkinson's disease[J]. Annals of NeurOlogy,2008,63(2):167-173.
[ 3 ] DOUBLE K L,ROWE D B,HAYES M,et al. Identifying the pattern of olfactory deficits in Parkinson disease using the brief smell identification test[J]. Arch Neurol,2003,60(4):545-549.
[ 4 ] GERHARD A,PAVESE N,HOTTON G,et al. In vivo imaging of microglial activation with [11C](R)-PK11195 PET in idiopathic Parkinson's disease[J]. Neurobiology of Disease,2006,21(2):404-412.
[ 5 ] MAREK K L,SEIBYL J P,ZOGHBI S S,et al. [123I] beta-CIT/SPECT imaging demonstrates bilateral loss of dopamine transporters in hemi-Parkinson's disease[J]. Neurology,1996,46(1):231-237.
[ 6 ] DENTRESANGLE C,VEYRE L,LE BARS D,et al. Striatal D2 dopamine receptor status in Parkinson's disease:an [18F]dopa and[11C]raclopride PET study[J]. Movement Disorders,1999,14(6):1025-1030.
[ 7 ] CHOI H,CHEON G J,KIM H J,et al. Gray matter correlates of dopaminergic degeneration in Parkinson's disease:a hybrid PET/MR study using (18) F-FP-CIT[J]. Human Brain Mapping,2016,37(5):1710-1721.
[ 8 ] KNUDSEN K,FEDOROVA T D,HANSEN A K,et al. In-vivo staging of pathology in REM sleep behaviour disorder:a multimodality imaging case-control study[J]. Lancet Neurology,2018,17(7):618-628.
[ 9 ] BI X A,HU X,XIE Y,et al. A novel CERNNE approach for predicting Parkinson's Disease-associated genes and brain regions based on multimodal imaging genetics data[J]. Medical Image Analysis,2021,67:101830.
[10] BROWNELL A L,JENKINS B G,ELMALEH D R,et al. Combined PET/MRS brain studies show dynamic and long-term physiological changes in a primate model of Parkinson disease[J]. Nature Medicine,1998,4(11):1308-1312.
[11] LE DOUARON G,SCHMIDT F,AMAR M,et al. Neuroprotective effects of a brain permeant 6-aminoquinoxaline derivative in cell culture conditions that model the loss of dopaminergic neurons in Parkinson disease[J]. European Journal of Medicinal Chemistry,2015,89:467-479.
[12] PERAN P,BARBAGALLO G,NEMMI F,et al. MRI supervised and unsupervised classification of Parkinson's disease and multiple system atrophy[J]. Movement Disorders,2018, 33(4):600-608.
[13] QUATTRONE A,MORELLI M,NIGRO S,et al. A new MR imaging index for differentiation of progressive supranuclear palsy-parkinsonism from Parkinson's disease[J]. Parkinsonism&Related Disorders,2018,54:3-8.
[14] RAVINA B,EIDELBERG D,AHLSKOG J E,et al. The role of radiotracer imaging in Parkinson disease[J]. Neurology,2005,64(2):208-215.
[15] MARAGANORE D M,O'CONNOR M K,BOWER J H,et al. Detection of preclinical Parkinson disease in at-risk family members with use of [123I]beta-CIT and SPECT:an exploratory study[J]. Mayoclinic Proceedings,1999,74(7):681-685.
[16] VAILLANCOURT D E,SPRAKER M B,PRODOEHL J,et al. High-resolution diffusion tensor imaging in the substantia nigra of de novo Parkinson disease[J]. Neurology,2009, 72(16):1378-1384.
[17] MELZER T R,WATTS R,MAC ASKILL M R,et al. White matter microstructure deteriorates across cognitive stages in Parkinson disease[J]. Neurology,2013,80(20):1841-1849.
[18] SEIBERT T M,MURPHY E A,KAESTNER E J,et al. Interregional correlations in Parkinson disease and Parkinson-related dementia with resting functional MR imaging[J]. Radiology,2012,263(1):226-234.
[19] XIAO B,HE N,WANG Q,et al. Quantitative susceptibility mapping based hybrid feature extraction for diagnosis of Parkinson's disease[J]. Neuroimage Clin,2019,24:102070.
[20] JOUTSA J,JOHANSSON J,SEPPANEN M,et al. Dorsal-to-Ventral shift in midbrain dopaminergic projections and increased thalamic/raphe serotonergic function in early Parkinson disease[J]. Journal of Nuclear Medicine,2015, 56(7):1036-1041.
[21] BOHNEN N I,FREY K A,STUDENSKI S,et al. Gait speed in Parkinson disease correlates with cholinergic degeneration[J]. Neurology,2013,81(18):1611-1616.
[22] CHERUBINI A,MORELLI M,NISTICO R,et al. Magnetic resonance support vector machine discriminates between Parkinson disease and progressive supranuclear palsy[J]. Movement Disorders,2014,29(2):266-269.
[23] CHERUBINI A,NISTICO R,NOVELLINO F,et al. Magnetic resonance support vector machine discriminates essential tremor with rest tremor from tremor-dominant Parkinson disease[J]. Movement Disorders,2014,29(9):1216-1219.
[24] DUFFY B A,ZHAO L,SEPEHRBAND F,et al. Retrospective motion artifact correction of structural MRI images using deep learning improves the quality of cortical surface reconstructions[J]. Neuroimage,2021,230:117756.
[25] WILSON H,NICCOLINI F,PELLICANO C,et al. Cortical thinning across Parkinson's disease stages and clinical correlates[J]. Journal of the Neurological Sciences,2019,398:31-38.
[26] XU Y,YANG J,HU X,et al. Voxel-based meta-analysis of gray matter volume reductions associated with cognitive impairment in Parkinson's disease[J]. Journal of Neurology,2016,263(6):1178-1187.
[27] XUAN M,GUAN X,HUANG P,et al. Different patterns of gray matter density in early-and middle-late-onset Parkinson's disease:a voxel-based morphometry study[J]. Brain Imaging Behav,2019,13(1):172-179.
[28] DU G,LEWIS M M,SICA C,et al. Magnetic resonance T1w/T2w ratio:a parsimonious marker for Parkinson disease[J]. Annals of Neurology,2019,85(1):96-104.
[29] ADLURU N,ZHANG H,TROMP D P,et al. Effects of DTI spatial normalization on white matter tract reconstructions[J]. Proc Spie Int Soc Opt Eng,2013,8669.
[30] TEIPEL S J,BOKDE A L,MEINDL T,et al. White matter microstructure underlying default mode network connectivity in the human brain[J]. Neuroimage,2010,49(3):2021-2032.
[31] TAYLOR K I,SAMBATARO F,BOESS F,et al. Progressive decline in gray and white matter integrity in de novo Parkinson's disease:an analysis of longitudinal Parkinson progression markers initiative diffusion tensor imaging data[J]. Frontiers in Aging Neuroscience,2018,10:318.
[32] ARRIGO A,CALAMUNERI A,MILARDI D,et al. Visual system involvement in patients with newly diagnosed Parkinson disease[J]. Radiology,2017,285(3):885-895.
[33] BLEDSOE I O,STEBBINS G T,MERKITCH D,et al. White matter abnormalities in the corpus callosum with cognitive impairment in Parkinson disease[J]. Neurology,2018,91(24):2244-2255.
[34] BACKSTROM D,LINDER J,JAKOBSON MO S,et al. NfL as a biomarker for neurodegeneration and survival in Parkinson disease[J]. Neurology,2020,95(7):827-838.
[35] YOUDIM M B,BEN-SHACHAR D,RIEDERER P. The enigma of neuromelanin in Parkinson's disease substantia nigra[J]. J Neural Transm Suppl,1994,43:113-122.
[36] ZECCA L,CASELLA L,ALBERTINI A,et al. Neuromelanin can protect against iron-mediated oxidative damage in system modeling iron overload of brain aging and Parkinson's disease[J]. Journal of Neurochemistry,2008, 106(4):1866-1875.
[37] SASAKI M,SHIBATA E,TOHYAMA K,et al. Neuromelanin magnetic resonance imaging of locus ceruleus and substantia nigra in Parkinson's disease[J]. Neuroreport,2006,17(11):1215-1218.
[38] KWON D H,KIM J M,OH S H,et al. Seven-Tesla magnetic resonance images of the substantia nigra in Parkinson disease[J]. Annals of Neurology,2012,71(2):267-277.
[39] COSOTTINI M,FROSINI D,PESARESI I,et al. MR imaging of the substantia nigra at 7 T enables diagnosis of Parkinson disease[J]. Radiology,2014,271(3):831-838.
[40] AHN J,LEE J Y,KIM T W,et al. Retinal thinning associates with nigral dopaminergic loss in de novo Parkinson disease[J]. Neurology,2018,91(11):1003-1012.
[41] FIRBANK M J,PARIKH J,MURPHY N,et al. Reduced occipital GABA in Parkinson disease with visual hallucinations[J]. Neurology,2018,91(7):675-685.
[42] SUO X,LEI D,LI N,et al. Functional Brain Connectome and its relation to hoehn and yahr stage in Parkinson disease[J]. Radiology,2017,285(3):904-913.
[43] SAIKI S,SASAZAWA Y,FUJIMAKI M,et al. A metabolic profile of polyamines in parkinson disease:a promising biomarker[J]. Annals of Neurology,2019,86(2):251-263.
[44] SIERRA M,MARTINEZ-RODRIGUEZ I,SANCHEZ-JUAN P,et al. Prospective clinical and DaT-SPECT imaging in premotor LRRK2 G2019S-associated Parkinson disease[J]. Neurology,2017,89(5):439-444.
