表皮生长因子家族成员调控卵泡发育的分子机制研究进展
2022-02-26贾琼邛方兰兰
贾琼邛,方兰兰
(郑州大学第一附属医院生殖与遗传专科医院,郑州 450052)
卵泡的生长发育过程与卵子及其周围体细胞的相互作用密切相关,卵母细胞和颗粒细胞主要通过缝隙连接进行双向信息交流及新陈代谢物质传递[1]。卵母细胞通过分泌卵源性生长因子作用于卵丘细胞、壁层颗粒细胞和卵泡膜细胞,促进其增生、分化成熟、甾体类激素生成和卵泡的生长发育等过程[2]。此外,卵丘细胞、壁层颗粒细胞和卵泡膜细胞也可通过旁分泌/自分泌途径调控卵母细胞的功能。在调控卵泡发育的因子中,表皮生长因子(epidermal growth factor,EGF)家族成员在卵泡中有所表达,且参与调控卵泡发育过程中多种生物学事件。本文献综述了EGF家族成员在卵泡生长发育各阶段中的作用及其机制。
一、EGF家族与ErbB家族
(一)EGF家族成员
EGF家族成员为包含N末端延伸区、1个或多个EGF结构域、短近膜茎、疏水性跨膜结构域和羧基末端片段的I型跨膜蛋白,是一组在结构和功能上具有高度相似性的有内在酪氨酸激酶活性的蛋白质,可促进体内多种类型组织和细胞分裂增生[3-4]。EGF家族成员包含11种蛋白质:EGF、肝素结合性表皮生长因子(HB-EGF)、转化生长因子-α(TGF-α)、双调蛋白(AREG)、表皮生长素(EREG)、β-纤维素(BTC)、神经调节蛋白(NRG;包含NRG1、NRG2、NRG3、NRG4四个成员)和表皮细胞分裂原(Epigen)等[3]。
(二)ErbB超家族成员
EGF受体(EGFR)是一种分子量为170 kDa的细胞膜糖蛋白,是Ⅰ型跨膜酪氨酸激酶受体,具有配体诱导的酪氨酸蛋白激酶活性,广泛表达于多种细胞表面。EGFR也称为ErbB1,属于受体酪氨酸激酶类蛋白(RTKs),是ErbB超家族中的一员,该家族的其它成员还包括:ErbB2/Neu/HER2、ErbB3/HER3和ErbB4/HER4。ErbB家族成员在结构和功能上具有相似性,这些受体包含1个由四部分组成的富含半胱氨酸的细胞外结构域、单一跨膜区和1个具有酪氨酸激酶功能的细胞内结构域[5]。ErbB家族成员在卵巢中广泛表达,在卵泡发育的整个过程中,它们在卵泡膜细胞、壁颗粒细胞、卵丘细胞及卵母细胞中均有不同程度的表达。
(三)EGF家族配体与受体相互结合及信号通路
1.EGF/ErbB结合:ErbB家族成员可单独存在,也可以以组合形式形成同型二聚体(两个相同类型的ErbB受体结合在一起)或异型二聚体(两个不同的ErbB受体结合在一起)。EGF家族与ErbB家族受体结合的情况可分为3类:EGF、TGF-α、AREG与EGFR结合;BTC、HB-EGF、EREG与EGFR、ErbB4结合;NRG又可分为两种结合情况:NRG1和NRG2主要与ErbB3、ErbB4结合,而NRG3和NRG4则与ErbB4结合[6]。
2.ErbB信号通路:每个ErbB家族成员在其C末端拥有不同位置及数量的磷酸化位点,ErbB家族成员结合的配体种类或受体间形成的二聚体类型决定了后续激活的磷酸化位点及其下游的信号通路,ErbB受体家族可激活包括Ras/Raf/丝裂原激活的蛋白激酶(MEK)/细胞外信号调节激酶(ERK)通路,磷脂酰肌醇-3-激酶(PI3K)/AKT途径和PLCγ级联在内的多种信号网络[6-8]。
二、EGF家族调控卵泡发育
(一)EGF在卵泡发育过程中的作用
1.EGF促进卵母细胞成熟和卵丘扩张:EGF在卵母细胞中的表达始于窦前卵泡,随着卵泡发育其表达量逐渐增加,参与卵母细胞减数分裂的恢复、诱导生发囊泡破裂(GVBD)及卵丘扩张等一系列生殖活动[9]。
卵母细胞中cAMP通过抑制减数分裂促进因子(MPF)的产生使卵母细胞停滞于减数分裂Ⅰ期[10];cGMP在卵丘细胞和颗粒细胞中由C型利钠肽(CNP)通过激活鸟苷酸环化酶利钠肽受体2(NPR2)产生,经缝隙连接传递至卵母细胞,抑制卵母细胞内cAMP水解酶磷酸二酯酶3A(PDE3A)活性,进而抑制cAMP降解[10];EGF通过阻断cGMP和cAMP进入卵母细胞解除其对卵母细胞减数分裂的阻滞,使卵母细胞减数分裂恢复[11]。此外,EGF可激活ERK1/2途径并增加卵丘卵母细胞复合物(COC)中卵丘细胞对Ca2+的吸收,调控卵丘扩张基因透明质酸合酶2(Hyaluronan synthase 2,Has2)的表达,参与卵丘扩张[12]。在体外培养的小鼠COC中添加EGF证实其对卵母细胞成熟具有促进作用,并观察到EGF刺激卵丘扩张的作用强于卵泡刺激素(FSH)[13]。此外,体外培养的羊COC中添加EGF可提高核成熟率[14]。
2.EGF调控甾体激素生成:甾体激素的生成需要将胆固醇运输至线粒体膜内,这一过程由类固醇生成急性调节蛋白(StAR)调控。LH和FSH分别与位于卵泡膜细胞上的LH受体和颗粒细胞上的FSH受体结合,促进胆固醇在3β-羟基类固醇脱氢酶(3β-HSD)及胆固醇侧链裂解酶P450(P450scc)作用下合成孕激素,后者在细胞内经17α-羟化酶作用合成雄激素;通过基底膜进入到颗粒细胞的雄激素在P450芳香化酶(Aromatase)的作用下转化为雌激素。StAR及Aromatase等作为调控甾体激素生成过程中各限速步骤的关键酶,在甾体激素生成中发挥重要作用[15]。
除卵母细胞外,EGF在卵巢颗粒细胞和卵泡膜细胞中的表达量从窦卵泡到排卵前卵泡逐渐增多,直至黄体中期,随着黄体的退化其表达量逐渐减少。EGF一方面抑制FSH介导的人颗粒细胞内Aromatase的活性,且该作用与卵泡大小成正相关;另一方面增加FSH受体的数量并促进FSH与颗粒细胞相结合,故其最终效应为增加雌激素的生成[16]。同时,EGF上调人黄素化颗粒细胞中3β-HSD和P450scc的表达,增加孕激素的产生并调控颗粒细胞的增殖与分化[17]。在小鼠卵母细胞-颗粒细胞体外培养的实验中,EGF可通过与EGFR结合促进颗粒细胞中孕激素、睾酮及雌激素表达,EGFR的特异性抑制剂AG1478可阻断该效应[18]。
(二)AREG、EREG及BTC在卵泡发育中的作用
1.AREG、EREG、BTC促进卵母细胞成熟:前述卵母细胞内高水平cAMP和cGMP可维持卵母细胞减数分裂静止状态。LH诱导排卵前卵泡颗粒细胞分泌AREG、EREG 和BTC等EGF样肽[19],它们与位于颗粒细胞上的受体结合后使EGFR磷酸化,一方面抑制CNP基因的表达使 NPR2活性降低,并激活磷酸二酯酶5(PDE5)促进cGMP水解,使其进入卵母细胞的量减少,进而激活PDE3A使cAMP水平下降,有助于卵母细胞减数分裂恢复[20];另一方面,EGF样肽增强了COC的间隙连接蛋白磷酸化并促使间隙连接关闭,最终导致cGMP和cAMP进入卵母细胞的量减少,缓解了二者对卵母细胞减数分裂的阻滞,使卵母细胞减数分裂恢复[10,19]。
在包括人在内的多种哺乳动物体外实验中证实了添加外源性EGF样肽可加速卵母细胞减数分裂恢复。在LH作用下人卵泡液中AREG、EREG和BTC水平上调,与EGFR结合后抑制CNP/NPR2产生cGMP并关闭间隙连接从而促进卵母细胞减数分裂恢复与成熟,而抑制EGFR活性可减弱LH诱导的cGMP降低[9,11,21]。在小鼠COC中,AREG/EGFR信号传导可减少颗粒细胞内cGMP水平;使用AG1478可阻滞AREG诱导的卵母细胞成熟和COC扩张,但培养前去除卵丘颗粒细胞后,未见AG1478对卵母细胞成熟的阻滞[22-23],进一步揭示了EGF类生长因子不是直接作用于卵母细胞,而是通过作用于卵丘颗粒细胞进而影响卵母细胞成熟。
2.AREG、EREG及BTC促进卵丘扩张:卵丘扩张涉及两个关键步骤,其一Has2调控促进透明质酸基质合成,其二EGFR被活化后激活下游Ca2+通路和ERK1/2通路介导的卵丘细胞脱离和运动。AREG、EREG和BTC水平上调后促进富含透明质酸的基质合成及透明质酸稳定因子五聚蛋白3(Ptx3)、肿瘤坏死因子α诱导蛋白6(Tnfaip6)增加,同时激活ERK1/2和细胞内Ca2+信号通路上调钙蛋白酶活性,抑制钙蛋白酶活性则可阻止COC中卵丘细胞的脱离、突起的形成及卵丘细胞的运动[12,24]。LH激增也可刺激前列腺素-过氧化物合酶2[Ptgs2,又称环氧合酶2(COX2)]快速表达[25],导致前列腺素E2(PGE2)增加,PGE2通过与其受体结合维持EGF样肽在颗粒细胞和卵丘细胞中的表达。EGF样肽和PGE2协同刺激卵丘细胞产生透明质酸和透明质酸稳定因子,促进卵丘扩张[12]。
在恒河猴COC中添加AG1478可降低卵母细胞成熟度及卵丘扩张[12]。Liu等[26]的小鼠实验证实AREG、EREG和BTC通过升高G蛋白偶联受体30(GPR30)水平来增加17β-E2介导的卵丘扩张相关基因(Has2、Ptgs2、Ptx3和Tnfaip6)表达。在小鼠COC中,AREG和EREG可增强氨基己糖通路生物代谢活性,增加透明质酸的合成,同时有增强卵丘细胞糖基化的作用[12,27]。在动物实验中已证实了糖基化与卵母细胞的发育能力相关,但其作用机制与途径尚不清楚[10,28]。
3.AREG、EREG及BTC促进排卵:PGE2不仅是促进卵泡壁破裂的关键因子,亦通过诱导排卵基因(如Areg、Ereg、Has2和Tnfaip6)的表达以及增加细胞内cAMP水平在排卵级联反应中发挥作用[29]。COX2是动物排卵前卵泡中催化PGE2产生的关键酶[29]。在灵长类和其他哺乳动物中,LH激增刺激COX2的表达和颗粒细胞产生PGE2,PGE2在卵泡中的浓度于排卵前达到峰值,以调节排卵过程中卵泡基底膜破裂、卵泡壁黄素化、卵泡破裂和卵母细胞从卵巢中释放[30]。
在人颗粒细胞中添加PGE2可激活G蛋白偶联受体(GPCR)及cAMP/PKA、MAPK信号通路促进AREG、EREG的表达,分别使用cAMP/PKA和MAPK的抑制剂H89和U0126可降低该效应;使用COX2抑制剂尼美舒利可有效阻断LH诱导的AREG、EREG生物合成[31]。此外,AREG、EREG和BTC激活ERK1/2途径上调颗粒细胞中COX2表达及PGE2产生,在排卵过程中发挥作用[32]。动物研究表明使用COX2的特异性抑制剂NS398可阻断大鼠及恒河猴排卵,且这种抑制作用在添加外源性PGE2后发生逆转[33]。
血管内皮生长因子(VEGF)可刺激某些蛋白水解内皮酶和纤溶酶原激活剂使卵泡液迅速增多、卵泡壁变薄破裂,从而促进优势卵泡排卵[24]。AREG可通过激活MAPK信号通路上调人颗粒细胞中VEGF的表达量,使用EGFR特异性抑制剂AG1478或ERK1/2抑制剂U0126可减弱AREG作用下的VEGF产生[34]。
4.AREG参与甾体激素的生成:Noma等[35]发现AREG在人颗粒细胞促进孕激素水平明显增高。我们的前期研究证实AREG在人颗粒细胞中通过激活PI3K/AKT信号通路上调Aromatase及雌激素表达,且卵泡液内AREG与雌激素呈正相关[36];此外,AREG通过激活ERK1/2信号通路上调颗粒细胞中StAR的表达与孕激素生成[37],表明AREG在人黄素化颗粒细胞中参与了雌孕激素的生成。
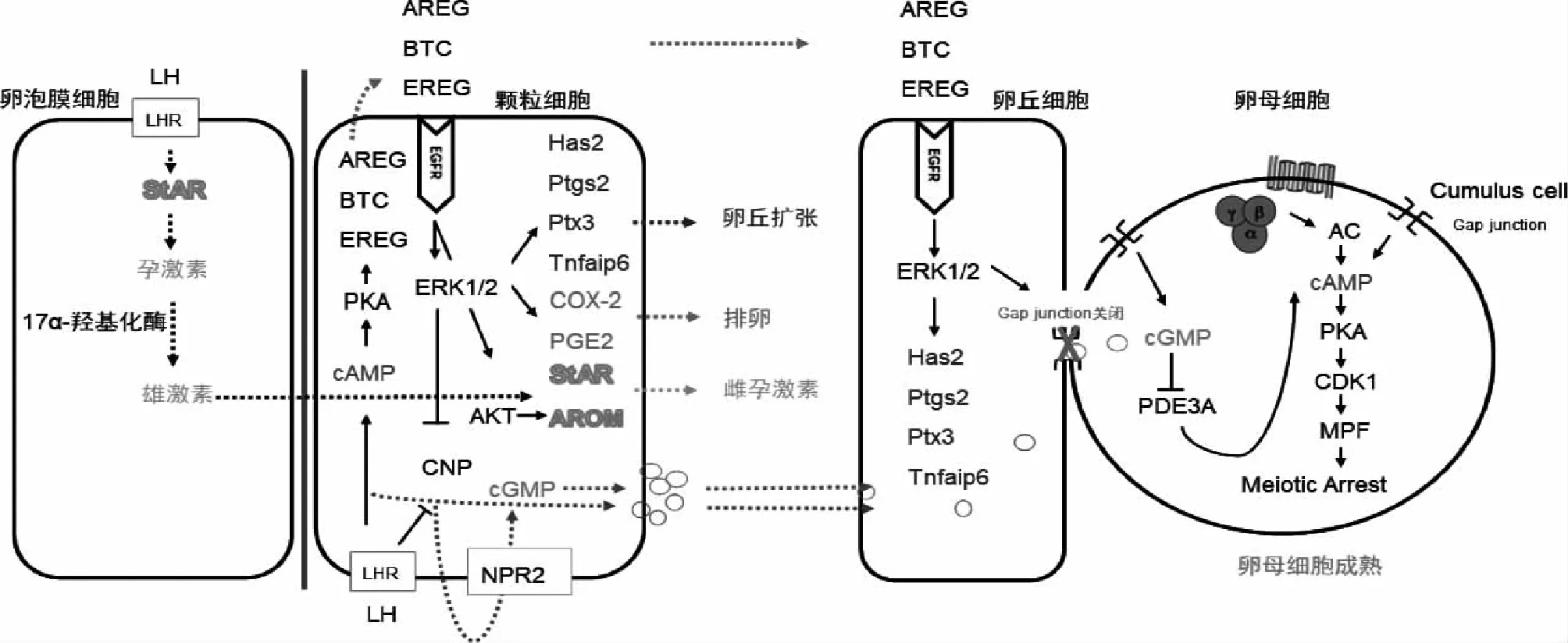
图1 AREG、EREG和BTC调控卵泡发育进程
(三)NRG1在卵泡发育中的作用
NRG1在卵泡发育中的作用研究不多,一方面调控卵母细胞成熟及卵丘扩张,另一方面促进AREG作用下的孕激素生成。小鼠COC中外源性添加NRG1后激活PI3K/AKT途径可延迟卵母细胞减数分裂自发性恢复的进程,但其延迟卵母细胞中GVBD的分子机制尚待明确;NRG1在COC中与AREG共同处理激活Ca2+途径和ERK1/2途径上调卵丘扩张基因Tnfaip6的mRNA水平,参与调控卵丘扩张[12,35]。虽然NRG1单独作用并不促进孕激素生成,但可通过增强AREG激活的ERK1/2活性上调AREG作用下的孕激素生成[10,35]。
(四)HB-EGF在卵泡发育中的作用
HB-EGF在卵巢中以两种形式存在:前体膜锚定形式和成熟分泌形式。使用免疫组化及半定量RT-PCR的方式并未在人卵巢中各阶段卵泡中检测到HB-EGF的表达;而在黄体中,HB-EGF在早期的颗粒细胞中明显表达,中期时逐渐增多,晚期时其表达量开始下降,并于白体时完全消失,HB-EGF在黄体中表达的阶段性变化与月经周期中雌孕激素的变化趋势高度相似[38]。HB-EGF作为一种抗凋亡因子可抑制人黄素化颗粒细胞的凋亡[39];此外,HB-EGF在人颗粒细胞中可激活MAPK并增加VEGF的表达量,对卵泡生长及排卵进程有促进作用[34]。
三、总结及展望
综上所述,EGF家族成员在调控卵泡发育过程中发挥着关键作用。虽然不同EGF家族成员表达方式和功能存在差异,但其协调作用于女性卵巢功能调控,促进卵泡生长和成熟。目前关于EGF家族成员在改善排卵障碍、卵母细胞成熟障碍及治疗不孕症中的应用研究尚较缺乏,因此了解EGF家族在调控卵泡生长发育各阶段的作用机制不仅对全面认知卵巢生理功能具有重要意义,还为寻求卵泡发育异常相关疾病的新型分子诊疗措施提供了思路。
