人卵巢颗粒细胞体外分离培养后连续传代的观察
2022-02-26袁涛刘文杰辛志敏宋蕊王丽李薇王晓杰高秀霞王树玉刘英
袁涛,刘文杰,辛志敏,宋蕊,王丽,李薇,王晓杰,高秀霞,王树玉,刘英
(首都医科大学附属北京妇产医院生殖医学科,北京 100026)
人卵巢颗粒细胞(granulosa cells,GCs)围绕于卵母细胞周围,其在不同阶段产生类固醇激素和生长因子,以旁分泌的方式调节卵泡生长发育[1]。除此之外,卵巢GCs凋亡与卵泡闭锁密切相关[2]。随着不孕患者日益增多,在辅助生殖治疗中,提高获取卵子的质量成为重点和难点。对卵巢GCs进行体外培养,进而对其增殖、凋亡等特点进行分析,可以为临床诊疗中提高卵子质量提供新的思路。目前人们对人卵巢GCs体外培养的研究较少,GCs在体外能否进行连续传代、传代后是否保持其特性等仍不确定,有待进一步的研究探讨。因此,本研究采用密度梯度离心法和红细胞裂解法分离人卵巢GCs,并进行体外培养及连续传代,观察GCs的生长特性。
材料和方法
一、研究对象
人卵巢GCs、人卵泡液来源于首都医科大学附属北京妇产医院生殖医学科行辅助生殖技术治疗的不孕患者(共30例)。
纳入标准:年龄20~40岁;体质量指数(BMI)18~30 kg/m2。排除标准:子宫内膜异位症、子宫肌瘤;多囊卵巢综合征(PCOS);卵巢恶性肿瘤;卵巢功能低下或者卵巢早衰;患有慢性疾病、遗传病;患有梅毒、乙肝、HIV等传染性疾病。
本研究经首都医科大学附属北京妇产医院医学伦理委员会审核批准,同时获得患者的知情同意。
二、主要试剂
DMEM培养液和PBS缓冲液(Gibco,美国);胎牛血清(FBS,Hyclone,美国);0.25% EDTA-胰蛋白酶(Sigma,美国);淋巴细胞分离液(天津灏洋生物);红细胞裂解液(北京索莱宝科技);卵泡刺激素受体(FSHR)抗体(Proteintech,美国)。
三、研究方法
1.卵泡液的收集及GCs原代培养:收集行控制性促排卵患者经阴道穿刺取卵时的卵泡液,1 500 r/min离心5 min,上清液(即卵泡液)收集储存在-20℃备用,沉淀物即为GCs、红细胞和白细胞的混合物。将含有少量卵泡液的沉淀物吹打混匀后,平均分成两组,分别采用以下两种方法从沉淀物中分离GCs:(1)密度梯度离心法:将沉淀物缓慢加于3倍体积淋巴细胞分离液液面上,3 000 r/min离心10 min,离心后吸取上层白色层(即GCs层),PBS洗涤2次。(2)红细胞裂解法:沉淀物上加入3倍体积红细胞裂解液,放于37℃中裂解5 min,1 500 r/min离心5 min,弃上清后加入PBS洗涤2次。
用GCs完全培养液(DMEM+10% FBS)重悬细胞,调整细胞浓度为2×105个/ml,接种于培养皿中。置于37℃、5% CO2的孵箱中培养,隔天更换培养液。
2.GCs的传代和扩增:GCs密度达到80%~90%时,弃上清,PBS洗涤2次,加入0.25% EDTA-胰蛋白酶,37℃消化3 min。用等体积培养液终止消化后,1 500 r/min离心5 min,PBS洗涤两次。弃上清后用培养液重悬细胞,按1∶3比例接种于培养皿,镜下观察细胞密度,隔天更换培养液。连续传代培养至第8代。
3.原代及传代后GCs生长曲线绘制:将两种方法分离得到的GCs以1.5×105/孔的密度均匀接种于24孔板,每3天换液。分别于培养的第1、3、5、7、9、11天(D1、D3、D5、D7、D9、D11)同一时间取3孔细胞,用0.25% EDTA-胰蛋白酶消化后计数,取平均值。以培养天数为横轴,细胞量为纵轴描绘生长曲线。
4.GCs的鉴定:采用免疫荧光染色检测FSHR的表达。GCs均匀接种于爬片,72 h后用PBS缓冲液洗3 min×3次;4%多聚甲醛固定30 min,PBS缓冲液3 min×3次;0.1% Triton处理20 min,PBS缓冲液3 min×3次;3% FBS孵育30 min;FSHR兔多克隆抗体(1∶200)孵育,4℃过夜;PBS缓冲液洗3 min×3次,荧光标记的二抗(1∶200)常温避光孵育1 h;PBS缓冲液洗3 min×3次,用含有DAPI的抗荧光淬灭封片剂封片,荧光显微镜下观察。
用PBS代替一抗作为阴性对照。
三、统计学分析
采用SPSS 21.0统计软件进行分析。组间比较采用独立样本t检验;P<0.05为差异有统计学意义。
结 果
一、两种分离方法所获细胞量比较
密度梯度离心法获得的细胞数为(3.1±1.1)×106/ml,红细胞裂解法为(5.8±1.2)×106/ml。红细胞裂解法可获得较密度梯度离心法更多的GCs(P<0.05)。
二、两种分离方法所获GCs原代培养生长形态比较
1.密度梯度离心法:用密度梯度离心法分离的GCs在接种后24 h显微镜下观察贴壁率约达70%,细胞呈单层贴壁生长,形状为多角形,伸出伪足相互连接,聚集成片;细胞折光性好,核大且圆,细胞质的颗粒均匀且丰富;在培养的第7天,细胞出现短梭形改变。当细胞生长至10 d以后,显微镜下观察并测量发现细胞和细胞核变小,细胞变为椭圆形/圆形,折光性降低,细胞间隙增宽,部分细胞开始脱壁死亡,悬浮于培养液内(图1A)。
2.红细胞裂解法:用红细胞裂解法分离的GCs在接种后24 h显微镜下观察细胞贴壁率约达50%,形状与密度梯度离心法分离的GCs相似,但用此方法分离的细胞多为单个细胞或少量细胞聚集,成片生长的情况较少。与密度梯度离心法相似,细胞在10 d左右发生退化(图1B)。
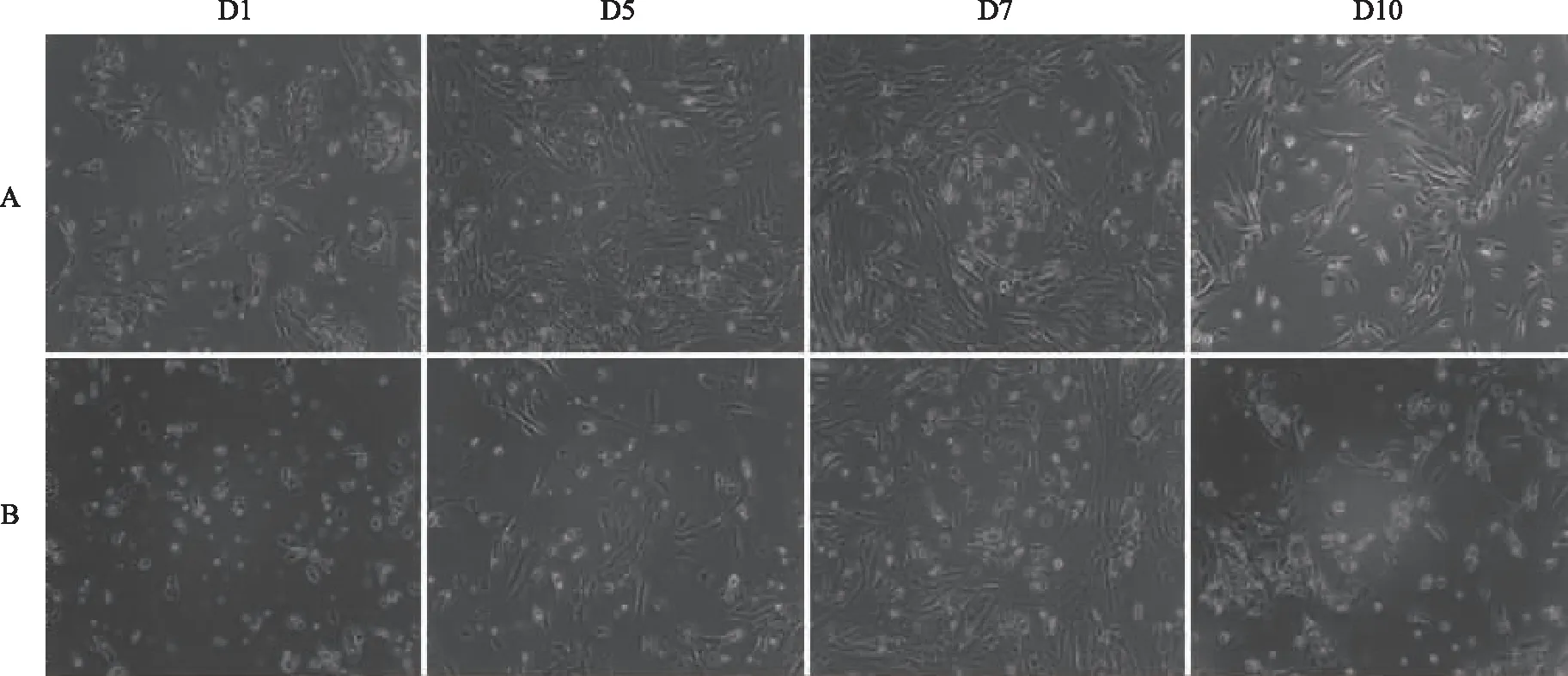
A:密度梯度离心法;B:红细胞裂解法。
三、两种分离方法所获GCs原代及第1代传代(Passage 1,P1)培养增殖情况比较
两种方法分离的原代GCs在第3~5天为快速增殖期,第7天细胞增殖达到顶峰,之后因接触抑制细胞生长进入平台期,第10天左右细胞开始衰老、退化,活细胞量下降。每个时间点密度梯度离心法处理的细胞量均显著高于红细胞裂解法(P<0.05)(图2A)。
两种方法分离的GCs第1代传代培养(P1 GCs)在第1~5天为快速增殖期,第7天细胞增殖达到顶峰,之后进入平台期。与原代细胞相似,P1 GCs也在10 d左右发生衰老和退化,细胞量减少。密度梯度离心法组P1 GCs细胞量在每个时间点均略高于红细胞裂解法组,但差异尚无统计学意义(P>0.05)(图2B)。
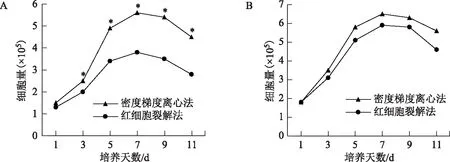
A:原代培养;B:P1培养。与红细胞裂解法组相同时间点比较,*P<0.05。
四、两种分离方法所获GCs连续传代情况比较
两种方法分离的GCs均可进行连续传代,镜下观察两组细胞形态无明显差异,均逐渐由上皮样向成纤维样转变。P1 GCs呈典型的上皮样形态,细胞紧密相连,形态不规则或呈多角形,中间有圆形核;P2 GCs仍以上皮样形态为主,但出现成纤维状的细胞,呈短梭形或三角形,胞质向外伸出凸起;P3 GCs以成纤维状为主,并在之后传代的过程中(P4、P5),细胞保持成纤维状(图3)。

A:密度梯度离心法;B:红细胞裂解法;P0:原代培养;P1~5:传代培养第1~5代。
五、GCs的免疫荧光鉴定结果
免疫荧光检测GCs的FSHR表达情况。结果显示FSHR在P0、P1、P6 GCs胞质内均阳性表达,胞质呈红染;胞核呈蓝染(图4)。

P0:原代GCs;P1、P6:第1、6代传代GCs;FSHR:FSH受体;DAPI:细胞核4,6-二脒基-2-苯基吲哚染色;Merge:合并;Control:阴性对照;比例尺50 μm。
讨 论
GCs紧密排列在卵母细胞的周围,通过间隙连接与卵母细胞相互作用。GCs向卵母细胞提供营养成分,为卵母细胞提供适宜的微生态环境[3]。同时,GCs通过间隙连接向卵母细胞传递信息,在卵母细胞发育及成熟过程中起重要作用[4]。另外,卵母细胞分泌的因子也可通过旁分泌和自分泌作用促进GCs增殖和分化[3]。
有文献报道,干细胞诱导形成的GCs与卵母细胞共培养,会包围在卵母细胞周围,形成一体[5]。GCs表面有FSHR、黄体生成素(LH)受体和雌激素受体等。FSH结合GCs上的受体后,促进卵泡募集、卵母细胞生长、发育及成熟[6]。LH在排卵前达到峰值,结合GCs上的受体后,促进卵丘的膨胀以及与卵泡GCs的分离,从而诱发排卵。胆固醇可转化为孕烯醇酮,孕烯醇酮是雌、孕、雄激素的前身。卵泡期,GCs分泌孕酮的能力非常有限;排卵后,卵泡内血管增生,GCs可获得大量胆固醇,合成大量孕激素。雌激素的生成需要卵泡膜细胞和GCs共同参与[7]。LH可促进膜细胞生成睾酮,然后经基底膜传递至GCs,在FSH的促进下,经芳香化酶催化成雌激素[4]。在体外分离培养的GCs,如果培养液内未添加雄激素,则只能停留在孕酮生成的阶段,而分泌极少量的雌激素。GCs的功能障碍可导致人类卵巢功能紊乱,如PCOS、卵巢早衰或卵巢功能不全等[8]。GCs在女性生殖系统中发挥重要作用,对其进行体外培养扩增可用于潜在功能研究和临床应用。
在取卵过程中获得的卵泡液中除单个的和块状的GCs外还含有红细胞和白细胞,选择合理有效的方法将GCs从细胞混合物中分离出来,可为GCs相关研究提供帮助。本研究中,我们比较了采用密度梯度离心法及红细胞裂解法两种方法分离GCs所得的细胞量、贴壁时间、原代及传代后细胞的生长曲线及连续传代的情况。由于在离心法过程中,部分GCs会与红细胞聚集成团沉在离心管底,因此用密度梯度离心法分离的细胞量小于红细胞裂解法,此结果与之前的研究[9]一致。而在贴壁情况及原代细胞生长情况的比较中,密度梯度离心法均优于红细胞裂解法,可能是由于裂解液对GCs有伤害且裂解后的细胞碎片影响GCs贴壁及生长[9]。传代后在每个时间点红细胞裂解法分离的GCs细胞量均小于密度梯度离心法,但差异尚无统计学意义,考虑是因为在换液和传代的过程中去除了细胞碎片的影响。在细胞的连续传代中,两种方法分离的GCs形态上未表现出明显差异,均在P2出现成纤维状形态的细胞,在后续的传代过程中成纤维状细胞逐渐成为主要的细胞群。提示虽然密度梯度离心法获得的细胞量较少,但细胞的生长情况优于红细胞裂解法,可作为GCs首选的分离方法。
黄素化的GCs被认为是终末分化状态,在排卵几天后就不可避免地发生凋亡[10],无法长时间在体外培养,导致对GCs的研究受阻。在本研究中,原代培养的GCs在2~5 d快速增殖,7 d左右达顶峰,10 d左右发生退化现象,与刘玉霞等[11]的研究结果相似。
有研究表明在培养基中添加白细胞抑制因子可使GCs在体外长时间培养,但其主要特征如FSHR和p450-芳香化酶的表达逐渐消失[12]。目前对人卵巢GCs传代的研究很少,在周小丹等[9]的研究中,传代后的GCs贴壁数目少、细胞状态差,不适合体外细胞实验。而在我们的实验中,连续传代的GCs贴壁率高、增殖快、细胞状态佳,并且我们对传代后的GCs进行了鉴定,发现细胞传至第6代时FSHR仍阳性表达,这可能与我们的处理方法有关系。选择合适的处理方法对建立一个有效而稳定的GCs培养模型非常重要,在分离培养GCs的过程中,本实验室的经验总结如下:(1)取材:穿刺取卵时卵泡注意不要碰到卵泡外膜和卵巢表面血管,避免卵泡液中含有太多红细胞以及相关并发症的发生;取材后要及时培养GCs,如不能及时处理应及时放于4℃冰箱,并且最长不超过24 h。长时间放于4℃冰箱的细胞不贴壁,且时间越久越容易造成污染。(2)分离:与用淋巴细胞分离液梯度离心法相比,红细胞裂解法能更好地去除红细胞,但同时会对GCs造成伤害,裂解后的残渣可能影响GCs贴壁;使用淋巴细胞分离液离心后,许多红细胞与GCs聚集成团一起浮于GCs表面,较大的团则向下沉淀,故应在加入淋巴细胞分离液之前将细胞充分吹打分离;分离时淋巴细胞分离液与细胞悬液至少达到3∶1,否则离心后细胞仍悬浮于卵泡液中,离心效果差;离心时,转速要达到或稍低于3 000 r/min,转速太低则GCs与红细胞无法分离,导致二者一同沉降在离心管底,而转速太高会损害细胞,接种时细胞碎片多,影响贴壁。(3)传代:传代前1日换液可使细胞在传代时保持良好状态;传代时,胰酶消化时间不宜过长,应保持在3 min左右,看到大片细胞飘起则应及时终止消化。
GCs是女性卵巢内唯一可表达FSHR的细胞,在胞膜和胞浆内均表达,所以FSHR是鉴定GCs的主要标志物之一。FSHR对于卵巢中的卵泡生长和排卵至关重要。GCs中的FSHR以卵泡生长阶段依赖性方式表达。FSHR在GCs中的表达随着健康卵泡的增长而增加,而在闭锁卵泡中则下降[10]。FSHR最初在原始或初级卵泡中检测不到,而在后期小窦卵泡中可观察到,且之后持续增加至排卵前阶段。FSHR在GCs中的表达被精确调节以诱导正常卵泡形成[13]。只有少数选定的卵泡获得FSHR表达后呈促性腺激素依赖性生长,而大多数卵泡保持静止。在卵巢中,FSHR的表达受FSH和激活素诱导的转录及转录后机制的直接调控,卵泡抑素则通过其对激活素的影响间接调控FSHR[14]。FSH与GCs上的FSHR特异性结合,进而上调GCs的FSHR mRNA的水平,促进GCs上的FSHR的表达,增加GCs的增殖和各类激素的分泌,最终促进卵泡的生长以及卵母细胞的发育成熟[15]。FSHR的表达决定了FSH作用的靶点和程度,最终决定了GCs对激素的反应情况。FSH信号随时间变化,从而调节卵泡生长和卵母细胞成熟过程中细胞增殖和分化所需的转录及代谢活动。FSHR突变可导致卵巢早衰、卵巢过度刺激综合征和不育症[8]。有研究报道在不育女性中有许多自然发生的FSHR基因失活突变。FSHR的低表达可能是卵巢对促性腺激素刺激反应差的原因,提示FSHR在卵巢反应中起着关键作用[16]。在本研究中,原代和传代的GCs均可表达FSHR,从某种程度上说明传代后其功能特性并未发生较大改变,故本方法培养的GCs可用于其相关的体外研究。
综上,运用合理的分离培养方法,人卵巢GCs不仅可在体外进行培养,还可成功进行连续传代,且传代后仍可保持GCs形态、增殖能力和功能特性。
