传统泡菜中乳酸菌的筛选鉴定及抗氧化特性分析
2022-02-25赵鑫胡蝶张素平祁勇刚吴勇超高冰柳志杰
赵鑫,胡蝶,张素平,祁勇刚,3,吴勇超,高冰,3,柳志杰,3*
(1.湖北工业大学生物工程与食品学院 湖北省食品发酵工程技术研究中心,武汉 430068;2.湖北聚汇农业开发有限公司,湖北 荆门 431821;3.湖北省发酵蔬菜企校联合创新中心,湖北 荆门 431821)
泡菜历史悠久,从古至今在中国人的食谱中扮演了重要的角色。其由大白菜等生鲜蔬菜与中,低浓度盐水浸泡腌制,经乳酸菌为主的益生菌发酵,形成独特风味的腌渍食品[1-2]。因其酸咸适中、清香脆嫩、色泽诱人且富含有机酸、维生素、氨基酸等成分,获得了世界各地人们的喜爱[3-4]。随着食品工业的发展,对泡菜的研究愈发广泛,如筛选应用发酵剂[5-6]、优化发酵工艺[7-8]、分析香味成分等[9]。近几年来,筛选出耐酸且兼具有益属性的乳酸菌作为天然发酵剂已成为研究热点。研究表明,一些乳酸菌具有清除活性氧,缓解氧化损失的作用[10]。罗强等[11]从20份自然发酵泡菜中筛选得到植物乳杆菌NR-11和LR-13、棒状乳杆菌LR-43对人工模拟胃液有较强的耐受性,具有肠胃益生菌的潜力。梁小波等将分离筛选获得的高抗氧化活性发酵乳杆菌ZN011接种发酵泡菜,缩短了2 d左右的发酵周期,改善了风味。
本实验从传统发酵泡菜中分离纯化得到2株疑似乳酸菌,对其进行分子生物学鉴定,分析产酸、耐酸及抗氧化活性等生物学特性,以期为具有耐酸、较高抗氧化能力的乳酸菌制剂及在发酵食品中的应用提供理论参考。
1 材料与方法
1.1 材料
1.1.1 原料
泡菜:采用传统方法制作发酵而成,取自湖北聚汇农业开发有限公司泡菜车间,用无菌袋收集,于4 ℃冰箱保存备用。
1.1.2 培养基
1.1.2.1 MRS液体培养基
蛋白胨10.0 g/L,牛肉膏8.0 g/L,酵母粉4.0 g/L,磷酸氢二钾2.0 g/L,柠檬酸氢二铵2.0 g/L,乙酸钠5.0 g/L,葡萄糖20.0 g/L,吐温80 1.0 g/L,硫酸镁0.2 g/L,硫酸锰0.04 g/L。
1.1.2.2 MRS固体培养基
蛋白胨10.0 g/L,牛肉膏8.0 g/L,酵母粉4.0 g/L,磷酸氢二钾2.0 g/L,柠檬酸氢二铵2.0 g/L,乙酸钠5.0 g/L,葡萄糖20.0 g/L,吐温80 1.0 g/L,硫酸镁0.2 g/L,硫酸锰0.04 g/L,琼脂粉15.0 g/L。
1.1.2.3 MRS鉴定培养基
蛋白胨10.0 g/L,牛肉膏8.0 g/L,酵母粉4.0 g/L,磷酸氢二钾2.0 g/L,柠檬酸氢二铵2.0 g/L,乙酸钠5.0 g/L,葡萄糖20.0 g/L,吐温80 1.0 g/L,硫酸镁0.2 g/L,硫酸锰0.04 g/L,琼脂粉15.0 g/L,碳酸钙0.02 g/L。
1.1.3 主要试剂
2×Taq Master Mix试剂(试剂中含有染料):购于天根生化科技(北京)有限公司;细菌16S rDNA通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)、1492R(5′-ACGGTTACCTTGTTACGACTT-3′):均由苏州金唯智生物科技有限公司合成;1,1-二苯基-2-三硝基苯肼(DPPH)、硫酸亚铁(FeSO4)、水杨酸(C7H6O3)、过氧化氢(H2O2)、二乙三胺五乙酸(C14H23N3O10)、三羟甲基氨基甲烷(Tris-HCl)、联苯三酚(C6H6O3)、磷酸缓冲液(PBS)、铁氰化钾(K3[Fe(CN)6])、三氯乙酸(Cl3CCOOH)、三氯化铁(FeCl3):均为分析纯,购于国药集团化学试剂有限公司。
1.1.4 仪器与设备
AR323CN 电子天平 奥豪斯仪器有限公司;ME54E微量天平、DELTA320 pH计 梅特勒-托利多有限公司;DK-S22恒温水浴锅 上海精宏实验设备有限公司;5424R台式高速冷冻离心机 Eppendorf公司;CR21N落地式高速冷冻离心机 日本Hitachl公司;MS-H-ProT磁力搅拌器(大龙);HCB-1300V垂直层流超净工作台(海尔);MLS-3781L高压蒸汽灭菌锅 日本Panasonic公司;ZXSR-1270恒温培养箱 上海智城分析仪器制造有限公司;DYY7C电泳仪 北京市六一仪器厂;TC-96/G/H(b)C PCR仪 杭州博日科技有限公司;95-0444-01凝胶成像仪 上海苑胜仪器设备有限公司;UV-1601 UV-Vis分光光度计 北京瑞利分析仪器有限公司。
1.2 实验方法
1.2.1 乳酸菌的分离纯化
取泡菜发酵液样品1 mL,无菌生理盐水10倍梯度稀释,取各梯度100 μL均匀涂布于MRS鉴定培养基上,贴封口膜置于37 ℃的恒温箱中培养48 h。观察菌落形态并挑选产生溶钙圈的菌种,在MRS固体平板上纯化直至出现单菌落[12-13]。对筛选的单一菌进行生理生化实验[14],保存备用。
1.2.2 乳酸菌的16S rDNA鉴定
PCR扩增体系(50 μL):25 μL 2×PCR预混液,1 μL菌液作为模板,2.5 μL引物27F,2.5 μL引物1492R,19 μL ddH2O。
PCR扩增条件:94 ℃预变性1 min,94 ℃变性10 s,55 ℃退火30 s,72 ℃延伸1 min,共30次循环,72 ℃终延伸5 min,4 ℃保温备用。
PCR扩增产物送至苏州金唯智生物科技有限公司测序。将测序结果提交至NCBI (https://blast.ncbi.nlm.nih.gov/)进行Blast同源性比对,选取同源性较高的模式菌株16S rDNA序列,采用MEGA 6.0软件中的邻接法(neighbor joining,NJ)构建系统发育树。
1.2.3 乳酸菌产酸能力测定
取分离纯化的200 μL菌液接种至10 mL MRS液体培养基中,37 ℃培养24 h,4000 r/min离心10 min,弃上清液,无菌水重悬调整菌液浓度为1×108CFU/mL(OD595 nm=1.0)。37 ℃培养0,4,8,16,20,24 h,测定发酵液的乳酸量[15]。
1.2.4 乳酸菌耐酸能力测定
用盐酸调节液体培养基至不同的pH(2.0,2.5,3.0,3.5,4.0,4.5,5.0,5.5,6.0)。吸取1 mL菌液接种至上述不同pH的培养基中,37 ℃恒温培养24 h,测定OD600 nm。
1.2.5 乳酸菌抗氧化性测定
1.2.5.1 制备乳酸菌细胞悬浮液和无细胞提取物
细胞悬浮液制备:取活化3代后的菌液,5000 r/min离心10 min,弃上清液,用无菌水洗涤3次,重悬调整菌液浓度为1×108CFU/mL(OD595nm=1.0)。
无细胞提取物制备:对细胞悬浮液进行离心破碎处理,电镜检查无完整细胞,离心收集上清液。
1.2.5.2 DPPH清除能力测定
参考Lin等[16]的方法并略作改进:取样品各2 mL,加入1 mL 0.2 mmol/L DPPH-无水乙醇溶液,充分混合并避光反应30 min,9000 r/min离心10 min,取上清液在OD517 nm处测吸光度。按式(1)计算DPPH自由基清除能力。
DPPH清除能力(%)=[1-(A1-A10)/A0]×100%。
式(1)
式中:A1为样品和DPPH-无水乙醇的吸光度;A10为无水乙醇代替DPPH-无水乙醇的吸光度;A0为同体积纯水代替样品的吸光度。
1.2.5.3 羟基自由基清除能力测定
参考He等[17]的方法并略作改进:取样品2 mL加入5 mmol/L硫酸亚铁溶液、5 mmol/L水杨酸-乙醇溶液、3 mmol/L H2O2各1 mL,37 ℃水浴20 min,测定OD510 nm。按式(2)计算羟基自由基的清除能力。
羟基自由基清除能力(%)=[1-(A1-A10)/A0]×100%。
式(2)
式中:A1为样品组的吸光度;A10为同体积纯水代替H2O2溶液的吸光度;A0为同体积纯水代替样品的吸光度。
1.2.5.4 超氧阴离子清除能力测定
参考张江巍等[18]的方法:取样品0.5 mL加入150 mmol/L Tris-HCl溶液(pH 8.2)、1.2 mmol/L邻苯三酚溶液、3 mmol/L二乙三胺五乙酸溶液各1 mL。25 ℃水浴10 min,测定OD325 nm。按式(3)计算超氧阴离子的清除能力。
超氧阴离子清除能力(%)=[1-(A11-A10)/(A01-A00)]×100%。
式(3)
式中:A11为含样品和邻苯三酚的吸光度;A10为含样品,不含邻苯三酚的吸光度;A01为不含样品,含邻苯三酚的吸光度;A00为不含样品和邻苯三酚的吸光度。
1.2.5.5 还原能力测定
参考刘洋等[19]的方法:取样品0.5 mL加入0.2 mol/L PBS溶液(pH 6.6)、1%铁氰化钾溶液各0.5 mL混匀,50 ℃水浴20 min,迅速冷却后加入10%三氯乙酸0.5 mL,4000 r/min离心5 min,取上清液、蒸馏水、0.1%三氯乙酸各1 mL混匀,静置反应10 min,测定OD700 nm。按式(4)计算还原能力。
还原能力(%)=(A1-A0)/A0×100%。
式(4)
式中:A1为样品组的吸光度;A0为PBS缓冲液代替样品的吸光度。
1.3 数据分析
使用NCBI数据库对比菌株的相似性,MEGA 7.0绘制系统发育树,Origin 2019进行数据分析及作图。
2 结果与分析
2.1 乳酸菌的生理生化实验
从泡菜发酵液中共分离出2株乳酸菌,将其命名为Z2、Z5。生理生化实验见表1,2株菌均为G+,过氧化氢酶、明胶液化、产硫化氢、吲哚实验均为阴性。
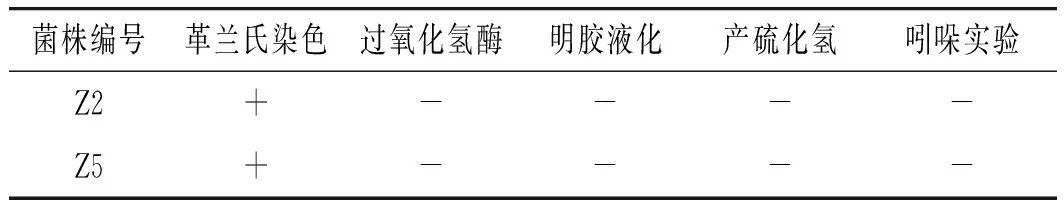
表1 乳酸菌的生理生化实验
2.2 乳酸菌的16S rDNA鉴定
采用试剂盒提取2株菌的DNA,PCR扩增后电泳,结果见图1。

图1 乳酸菌PCR产物电泳图Fig.1 PCR product electrophoretogram of lactic acid bacteria
由图1可知,对菌株DNA采取16S rDNA PCR扩增后,均得到条带大小在1000~2000 bp左右的产物,表明PCR扩增产物无杂质可进行测序,符合预期长度。将测序得到的结果提交到NCBI进行Blast同源性比对搜索,结果见表2。Z2与Limosilactobacillusfermentum的相似度为99.05%,Z5与Lactiplantibacilluspingfangensis的相似度为99.16%。

表2 乳酸菌16S rDNA序列鉴定结果Table 2 The identification results of 16S rDNA sequence of lactic acid bacteria
采用MEGA 6.0软件分析,邻接法构建系统发育树,Bootstrap自展1000次检验进化树拓扑结构置信区间,结果见图2。菌株Z2与发酵乳杆菌聚为一支,菌株Z5与植物乳杆菌聚为一支,亲缘关系较近。

图2 基于16S rDNA序列的乳酸菌系统进化树Fig.2 Phylogenetic tree of lactic acid bacteria based on 16S rDNA sequence
2.3 乳酸菌的产酸能力
产酸力是乳酸菌的重要特性之一。对获得的2株乳酸菌在37 ℃培养24 h进行产酸能力测定,结果见图3。

由图3可知,发酵24 h时,相对于发酵乳杆菌Z2,植物乳杆菌Z5的菌液pH明显较低,酸度高,产酸能力明显较强。在0~20 h内,2株菌的产酸量都在逐渐增加,20~24 h内,产酸量逐渐趋于平缓或下降。其中,菌株Z5的产酸速度最快,产酸量最高,达到1.393 g/L。这与赵山山等[20]从贵州泡菜中分离出的植物乳杆菌产酸量结果相近。
2.4 乳酸菌的耐酸能力
对2株乳酸菌的耐酸能力进行测定,结果见图4。
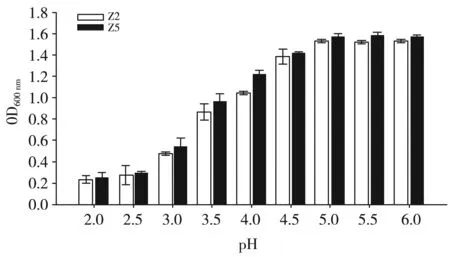
图4 乳酸菌的耐酸性Fig.4 The acid tolerance ability of lactic acid bacteria
由图4可知,随着培养基酸度的增强,2株乳酸菌的生长都受到抑制。在pH值<5.0时,菌体浓度下降幅度大,在pH值为4.0时,2株菌的生长差异最为明显,Z5的耐酸能力最强。
2.5 乳酸菌的抗氧化性

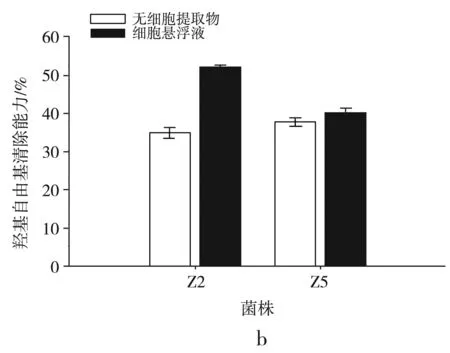
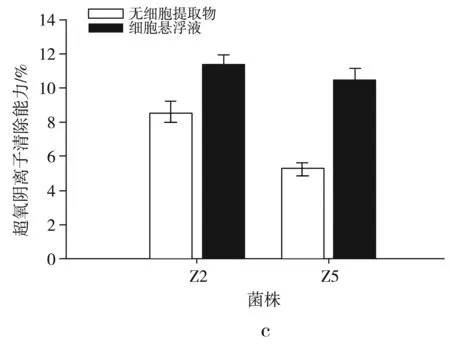
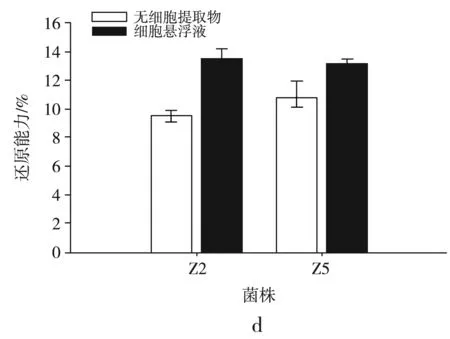
图5 菌株对DPPH自由基的清除能力(a)、羟基自由基的清除能力(b)、超氧阴离子的清除能力(c)、还原能力的测定(d)
2.5.1 清除DPPH自由基能力的测定
由图5中a可知,菌株的完整细胞悬浮液对DPPH自由基的清除率平均在(50.615±0.329)%,最高的为Z2,清除率达到(59.294±0.294)%。菌株的无细胞提取物的清除率平均在(33.180±0.580)%,最高的为Z2,清除率达到(41.990±0.364)%。乳酸菌的细胞悬浮液和无细胞提取物的清除能力也有所差异,细胞悬浮液的清除能力均高于无细胞提取物。Z2对DPPH自由基的清除能力最高,即抗氧化性最高。
2.5.2 清除羟基自由基能力的测定
由图5中b可知,两株乳酸菌的无细胞提取物和细胞悬浮液都表现出一定的羟基自由基清除能力,但清除能力有所差异。Z2的细胞悬浮液清除效果最强,清除率达到(52.244±0.311)%。Z5的无细胞提取物清除能力较强于Z2,清除率达到(37.944±0.794)%。
2.5.3 超氧阴离子清除能力的测定
由图5中c可知,细胞悬浮液对超氧阴离子的平均清除率为(10.912±0.589)%,其中Z2的清除率最高,达到(11.370±0.492)%。无细胞提取物的平均清除率为(6.901±0.507)%,Z2的清除率最高,可达(8.510±0.689)%。总体看来,Z2对超氧阴离子的清除能力较高于Z5,细胞悬浮液的清除能力较高于无细胞提取物,这与郭慧芬等[21]的研究结果一致。
2.5.4 还原能力的测定
由图5中d可知,2株乳酸菌的还原能力均有一定的差异,细胞悬浮液的还原能力均高于无细胞提取物,Z2的细胞悬浮液还原能力较高,达到(13.518±0.660)%, Z5细胞悬浮液的还原能力为(13.181±0.299)%,Z5无细胞提取物的还原能力高于Z2,达到(10.794±1.174)%。
3 结论
实验从泡菜中分离出2株菌,经生理生化实验及16S rDNA序列对比,鉴定Z2为发酵乳杆菌(Limosilactobacillusfermentum),Z5为植物乳杆菌(Lactiplantibacilluspingfangensis)。通过对菌株产乳酸量、盐酸耐受性进行分析,发现2株菌的性质较为优良,其中Z5的乳酸量达到(1.393±0.060) g/L,耐酸能力最强,可在pH 2.0的条件下存活,是可进一步研究与应用的备选菌株。测定2株菌的体外抗氧化能力,比较发现,细胞悬浮液对DPPH自由基、羟基自由基、超氧阴离子的清除率以及还原能力都明显高于无细胞提取物,其中Z2的抗氧化活性强于Z5,还原能力大于13%,为具有耐酸、较高抗氧化能力的乳酸菌制剂及在发酵食品中的应用提供了理论参考。
