干湿交替灌溉改善稻田根际氧环境进而促进氮素转化和水稻氮素吸收
2022-02-23曹小闯刘晓霞朱练峰吴龙龙张均华金千瑜朱春权孔亚丽虞轶俊
曹小闯,刘晓霞,马 超,田 仓,朱练峰,吴龙龙,张均华*,金千瑜,朱春权,孔亚丽,虞轶俊
(1 中国水稻研究所/水稻生物学国家重点实验室,浙江杭州311400;2 浙江省耕地质量与肥料管理总站,浙江杭州310020;3 安徽农业大学资源与环境学院/农田生态保育与污染防控安徽省重点实验室,安徽合肥 230036)
长期淹水易诱导稻田氧化还原电位和硝化作用降低、还原性物质累积,不利于水稻生长发育[1]。通常情况下,稻田土壤中氧含量至少在3%~5%才能满足水稻根系对氧的正常需求[2]。为了缓解淹水胁迫,水稻根系可通过形成通气组织[3]、降低径向泌氧量[4]等途径将地上部氧气输送至地下部,在根际形成微域“氧环境”。这一主动适应机制在缓解低氧胁迫下稻田还原性物质对水稻根系毒害作用、促进硝化作用和土壤氮循环过程等方面具有重要的意义。生产实践中,通过适宜的栽培措施协调稻田水、肥、气平衡是构建水稻理想根系、培育健康土壤环境和提高氮素利用率的关键[5]。当前,国内外学者已发现不同栽培模式,如好氧栽培、强化栽培、覆膜栽培和干湿交替等,可通过调控叶片光合作用、根际环境(如溶氧量、氧化还原电位和pH等)、氮形态转化和微生物活性和群落结构协调氮吸收转化,提高水稻产量和氮素利用率[6-8]。然而,由于选取的土壤类型、干湿交替频率和培养环境等的不同,上述结论并不一致[9-10]。另一方面,研究发现增加根系溶氧量对水稻良好根系形态构建、水稻氮吸收、同化物转运和产量形成等均具有显著的“积极效应”[11-12];且增氧条件下铵态氮吸收后受谷氨酸脱氢酶调控的氨基酸代谢增强,可能是水稻生长和氮利用效率提高的主要原因[13]。因此,水稻“氧营养”及其配套栽培模式研究逐渐引起人们的重视。
水稻根系溶氧量直接或间接影响土壤有机氮矿化,是否能最终促进水稻对氮素的吸收和生长发育,这是农业生产所关注的热点,也是本研究的目的所在。根系作为水稻与土壤物质交换的通道,其根际溶氧量受土壤结构、孔隙度、含水量和氧化还原电位等理化性质影响,在水稻根系附近营造根际氧环境这一特殊生境,进而直接或间接对稻田氮吸收转化进程产生影响[3,11,14]。但是,当前研究较少从稻田“氧环境”对水稻生长和氮转化过程的影响及其微生物学机制进行深入研究。基于Unisense微电极系统可实现土壤剖面氧环境的无损、原位检测,本研究拟通过研究不同水氮耦合模式下水稻根际内外氧环境变化特征及其对土壤微生物量碳氮和酶活性、氮转化、水稻生长和氮素利用率的影响,以期从稻田“氧环境”调控角度揭示适宜水氮耦合管理提高水稻生长和氮高效利用的内在机制。这对进一步理解水稻抗(耐)干旱适应机理、增氧灌溉技术创建等均具有重要的理论和实践指导意义。
1 材料与方法
1.1 试验设计
供试土壤来自于中国水稻研究所富阳水氮耦合长期定位试验 (2016—2020),试验设有常规淹灌(conventional flood irrigation,CF)、干湿交替(alternate wet and dry irrigation,AWD) 2种灌溉模式,以及无氮 (0 g/kg,N0)、中氮 (0.8 g/kg,180 kg/hm2,N0.8)和高氮(1.2 g/kg,270 kg/hm2,N1.2) 3个施氮水平,具体水肥和田间管理如Cao等[15]所述。采集上述各处理稻田0—20 cm耕层土壤,风干、粉碎后过0.85 mm筛备用。试验Ⅰ采用根箱模拟培养,根箱为硬质塑料制成,规格为 25 cm×10 cm×5.5 cm (长×高×宽),由2块孔径为20 μm的网状隔板将根箱分为1个根室(宽度1.5 cm)和2个边室(宽度2.0 cm),水稻种植于根室中,根系被限制于根室中生长,水分和养分可以在根室与2个边室之间自由通过。每个根箱装550 g上述风干土壤,其中根室150 g,边室200 g,灌溉和施氮水平处理同大田,在培养箱内干湿交替循环预培养30天以活化土壤。随后N0、N0.8和N1.2处理中每个根箱分别添加0、47.9和71.8 mg尿素(N 46%)作基肥;所有处理将24.4 mg氯化钾(K2O 60%)、122.2 mg过磷酸钙(P2O512%)溶解于10 ml水中,随后用1 mL Eppendorf 移液器均匀添加至土壤中。以日本晴(粳稻)、扬稻6号(籼稻)为供试材料,幼苗2叶1心期移栽至根箱,人工气候室培养环境如下:白天/晚上温度控制28℃/23℃,光量子通量密度600 μmol/(m2·s),光照周期 12 h (7:00—19:00),每 3 天更换一次根箱位置以消除边际效应的影响。试验设2个水稻品种、2种水分、3个氮水平,每个处理3次重复,共36个根箱,幼苗培养21天后测定根际内外溶氧量和氧化还原电位;随后,破坏性采集根际内外土壤样品和水稻植株样品。
1.2 15NH+和15N O-短期标记培养试验43
试验Ⅱ中,采用单一15N标记培养方法(15NH4+或15NO3-)研究水稻根系对不同形态氮的选择性吸收[16]。采用试验Ⅰ根箱模拟培养21天后各氮水平分别设15NH4++NO3-(1∶1)、NH4++15NO3-(1∶1) 2种处理,根据田间分蘖肥施氮水平向各处理土壤均匀注射5 mL不同施氮量的15N标记NH4+或NO3-(atom 99%),N0、N0.8和N1.2处理分别施用0、68.3和102.6 mg15NH4NO3或NH415NO3。故试验设2个水稻品种、2种水分、3个氮水平、2个15N标记氮形态,共24个处理,每处理3次重复,共72个根箱。15N标记培养2 h后收获。
1.3 测定项目与方法
1.3.1 水稻干物重和氮素利用效率 根箱模拟培养21天后 (试验Ⅰ),随机选取4株长势一致的水稻幼苗,分成地下部和地上部,105℃杀青30 min,随后75℃烘干至恒重后粉碎。水稻营养生长期氮素利用率以氮利用指数表征(nitrogen use index,NUI)[17],NUI值越高,说明单位氮量所能生产的干物质越多。
1.3.2 根际溶氧量和氧化还原电位 根箱模拟培养21天后,采用丹麦Unisense微电极系统 (MM-METER,Unisense) 测定水稻根际内外溶解氧含量和氧化还原电位,电极校正、测定步骤参考潘延鑫等[18]所述方法。根据Lorenzen等[19]所述的溶氧量模型,采用Fick第二扩散定律计算各处理水-土界面溶解氧净通量。
1.3.3 土壤微生物量碳氮和硝化速率 根箱试验水稻幼苗收获后,将附着于根表5 mm以内的土壤定义为根际土壤,用无菌镊子小心剥离;两边室距离尼龙网 4 mm以外的土壤定义为非根际土壤。土壤微生物量碳氮采用氯仿熏蒸提取方法测定[20],以氯仿未熏蒸处理作为对照,微生物量碳、氮转换系数分别为0.38、0.54。土壤可溶性有机碳采用史登林等[21]所述方法测定,短期硝化速率测定采用Jones等[20]所述方法。
1.3.4 土壤理化性质、各形态氮含量和胞外酶活性 采用0.5 mol/L K2SO4(土水比1∶5)提取土壤各形态氮,浸提液中NH4+、NO3-采用流动分析仪测定,游离氨基酸采用茚三酮比色法测定,提取态总氮(extracted total N,ETN) 采用过硫酸钾氧化—紫外分光光度法测定[22],可溶性有机氮 (extracted organic N,EON) = ETN−NH4+−NO3-。土壤pH采用电位法(土水比1∶2.5)测定;有机质采用重铬酸钾氧化外加热法测定;全氮采用开氏法测定;碱解氮采用扩散吸收法测定;有效磷采用盐酸-氟化铵浸提比色法测定;速效钾用乙酸铵浸提—火焰光度计法测定。
土壤碳、氮、磷代谢相关酶活性测定,脲酶(urease,UR)采用苯酚钠-次氯酸钠比色法测定;蔗糖酶 (invertase,Inv)用3,5二硝基水杨酸比色法测定;酸性磷酸酶 (acid phosphatase,AP) 采用磷酸苯二钠比色法测定;过氧化氢酶 (catalase,CAT) 采用高锰酸钾比色法测定;β-1,4-葡萄糖苷酶 (β-1,4-glucosidase,BG) 和 N-乙酰-β-D-葡萄糖苷酶 (N-acetylβ-D-glucosaminidase,NAG) 采用对硝基苯酚比色法测定[7,23]。
1.3.5 水稻根系15NH4+/15NO3-吸收速率 水稻根系15N丰度和氮含量采用连续流动同位素比值质谱仪偶联碳氮元素分析仪(ANCA-MS; PDZ Europa)测定,根据外源添加的15NH4+/15NO3-丰度计算根系吸收的15N,15NH4+/15NO3-吸收速率以单位时间内单位干物质重根系的15N含量来计算[16]。
1.4 数据处理
所有数据均采用Microsoft Excel 2010和SPSS数据分析软件包进行数据整理和方差分析,不同处理间差异显著性检验采用LSD0.05(least significant difference test)进行比较,采用Origin 8.0 进行绘图。各指标间的相关性分析采用Pearson相关系数法。
2 结果与分析
2.1 长期不同水氮管理对稻田基本理化性质的影响
表1表明,与稻田基础土壤理化性质相比,连续5年不施氮肥 (N0) 处理土壤有机质、全氮、碱解氮均显著降低,常规淹灌 (CF) 处理pH显著增加。稻田pH随施氮水平增加显著降低,且中氮 (N0.8) 和高氮 (N1.2) 处理pH、有效磷和速效钾含量均低于不施氮肥 (N0) 处理;稻田有机质、全氮和碱解氮含量在N0.8和N1.2处理均高于N0处理。但是,N0.8和N1.2处理稻田有机质、全氮、碱解氮和速效钾含量等肥力指标并未随施氮水平、水分管理方式发生显著变化。

表1 不同水氮管理模式对稻田土壤理化性质的影响Table 1 Effects of different irrigation and N regimes on soil physical and chemical properties
2.2 不同水氮管理模式下水稻根际内外氧环境变化特征
如图1所示,水稻根际内外溶氧量受灌溉模式、水稻品种和剖面深度影响差异明显,但受氮水平影响较小。与CF处理相比,干湿交替 (AWD) 提高了日本晴和扬稻6号根际内外溶氧量,且根际溶氧量在5000~40000 μm剖面深度高于非根际。CF处理下,扬稻6号非根际水-土界面(3000~−2000 μm) 溶氧量高于日本晴,2个品种根际水-土界面溶氧量呈现相反趋势。AWD处理下,日本晴非根际溶氧量在0~−1000 μm 剖面深度高于扬稻6号,随剖面深度增加扬稻6号高于日本晴;而扬稻6号根际不同剖面深度溶氧量均高于日本晴,尤其在−5000~−40000 μm。

图1 水稻根际和非根际土壤溶氧量的剖面分布Fig. 1 Profiles of soil dissolved oxygen in root rhizospheric and non-rhizospheric soils of two rice cultivars
与CF处理相比,AWD增加了2个水稻品种根际内外氧化还原电位。CF处理下,扬稻6号非根际水-土界面氧化还原电位在3000~−2000 μm水土界面明显高于日本晴;N0.8、N1.2水平下扬稻6号根际水-土界面氧化还原电位高于日本晴 (图2)。AWD处理下,扬稻6号和日本晴根际内外氧化还原电位均随氮水平增加而逐渐增加。其中,各氮水平下日本晴非根际氧化还原电位高于扬稻6号,但其根际氧化还原电位低于扬稻6号。
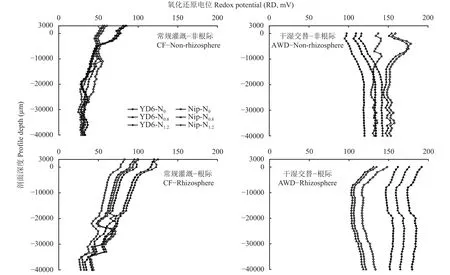
图2 水稻根际和非根际土壤氧化还原电位的剖面分布Fig. 2 Profiles of soil redox potential in root rhizospheric and non-rhizospheric soils of two rice cultivars
2.3 不同水氮管理模式对水稻根际内外微生物量碳氮和硝化速率的影响
CF和AWD处理下,日本晴和扬稻6号非根际微生物量碳氮均随氮水平升高而显著增加(表2)。与CF处理相比,AWD显著提高了N0.8、N1.2水平2个水稻品种非根际和根际微生物量碳氮含量,但降低了其N0水平根际微生物量氮。不同的是,日本晴根际微生物量碳在N1.2水平均高于N0和N0.8水平,扬稻6号在N0.8和N1.2水平均高于N0水平;日本晴根际微生物量氮随氮水平增加而增加,扬稻6号在N0.8水平均高于N0和N1.2水平。
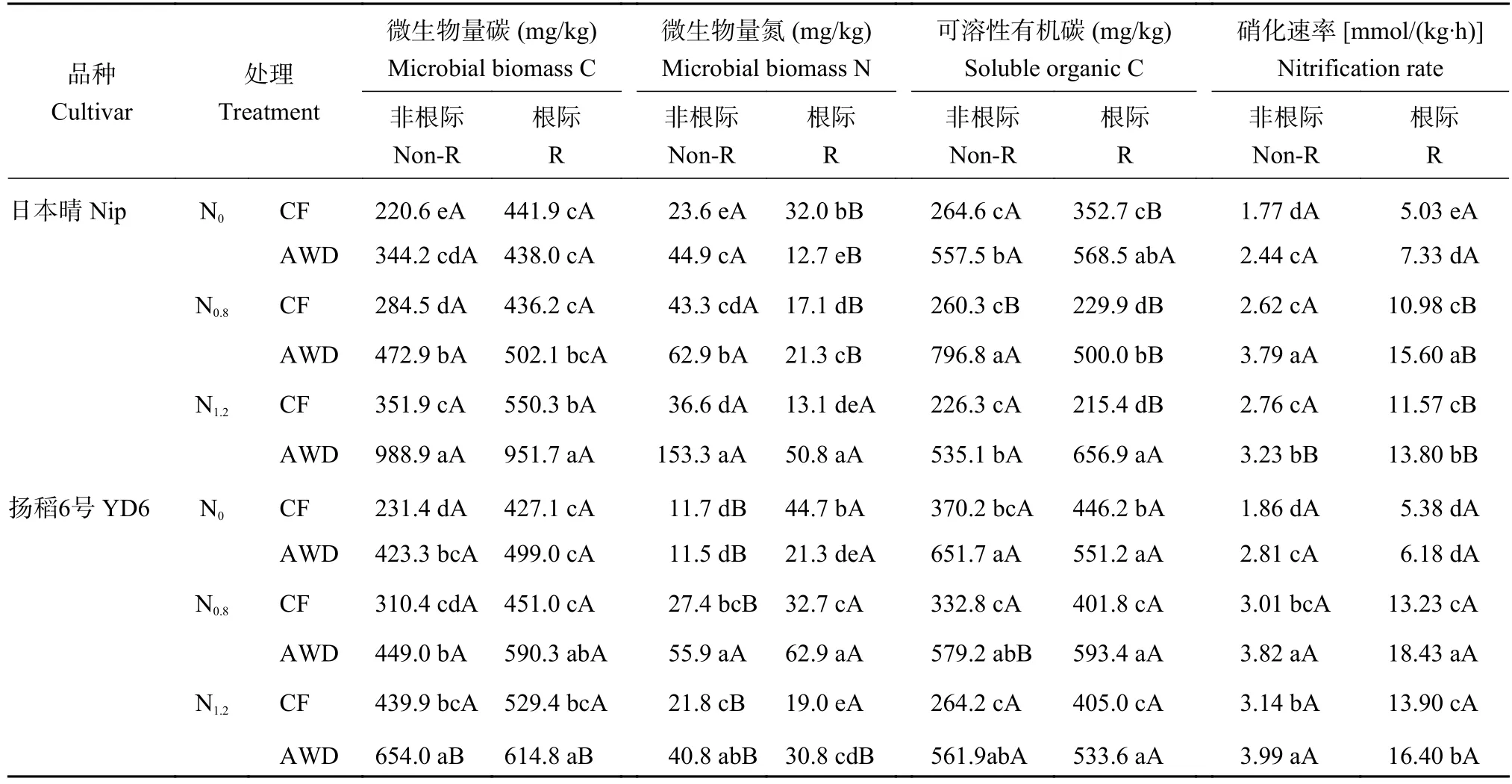
表2 不同水氮管理模式下水稻根际和非根际微生物量碳氮和硝化速率Table 2 Microbial biomass C and N,and nitrification rate in rhizospheric and non-rhizospheric soils under different irrigation and N regimes
与CF相比,AWD显著增加了日本晴和扬稻6号根际、非根际可溶性有机碳和硝化速率,且其根际硝化速率高于非根际。CF处理下日本晴和扬稻6号根际可溶性有机碳在N0水平显著高于N0.8和N1.2。AWD下日本晴根际可溶性有机碳在N1.2水平均高于N0.8水平,其非根际可溶性有机碳在N0.8水平均高于N0和N1.2水平。无论CF、AWD处理,根际、非根际硝化速率均随氮水平升高先增加后降低。值得注意的是,AWD处理下N0.8和N1.2水平扬稻6号根际可溶性有机碳和硝化速率均高于日本晴;无论CF、AWD处理,扬稻6号根际可溶性有机碳高于日本晴。
2.4 不同水氮管理模式对水稻根际内外胞外酶活性和各形态氮含量的影响
表3表明,除扬稻6号根际N-乙酰-β-D-葡萄糖苷酶外,日本晴和扬稻6号非根际和根际脲酶、N-乙酰-β-D-葡萄糖苷酶活性均随氮水平升高而增加。与CF相比,AWD增加了N0.8和N1.2水平2水稻品种非根际脲酶、蔗糖酶、酸性磷酸酶、过氧化氢酶、β-1,4-葡萄糖苷酶 (除 N1.2水平)和 N-乙酰-β-D-葡萄糖苷酶等碳氮磷代谢相关酶活性,且各酶活性在N0.8和N1.2水平均高于N0水平。在N0水平,AWD降低了2水稻品种根际脲酶和N-乙酰-β-D-葡萄糖苷酶,但增加了扬稻6号根际蔗糖酶、酸性磷酸酶和过氧化氢酶以及日本晴过氧化氢酶活性。AWD也增加了N0.8和N1.2水平日本晴以及N0.8水平扬稻6号根际蔗糖酶、酸性磷酸酶和过氧化氢酶活性,其含量在N0.8水平高于N1.2水平。N0.8和N1.2水平下扬稻6号根际脲酶活性高于日本晴,但N0.8水平下扬稻6号根际β-1,4-葡萄糖苷酶和N-乙酰-β-D-葡萄糖苷酶活性高于日本晴。
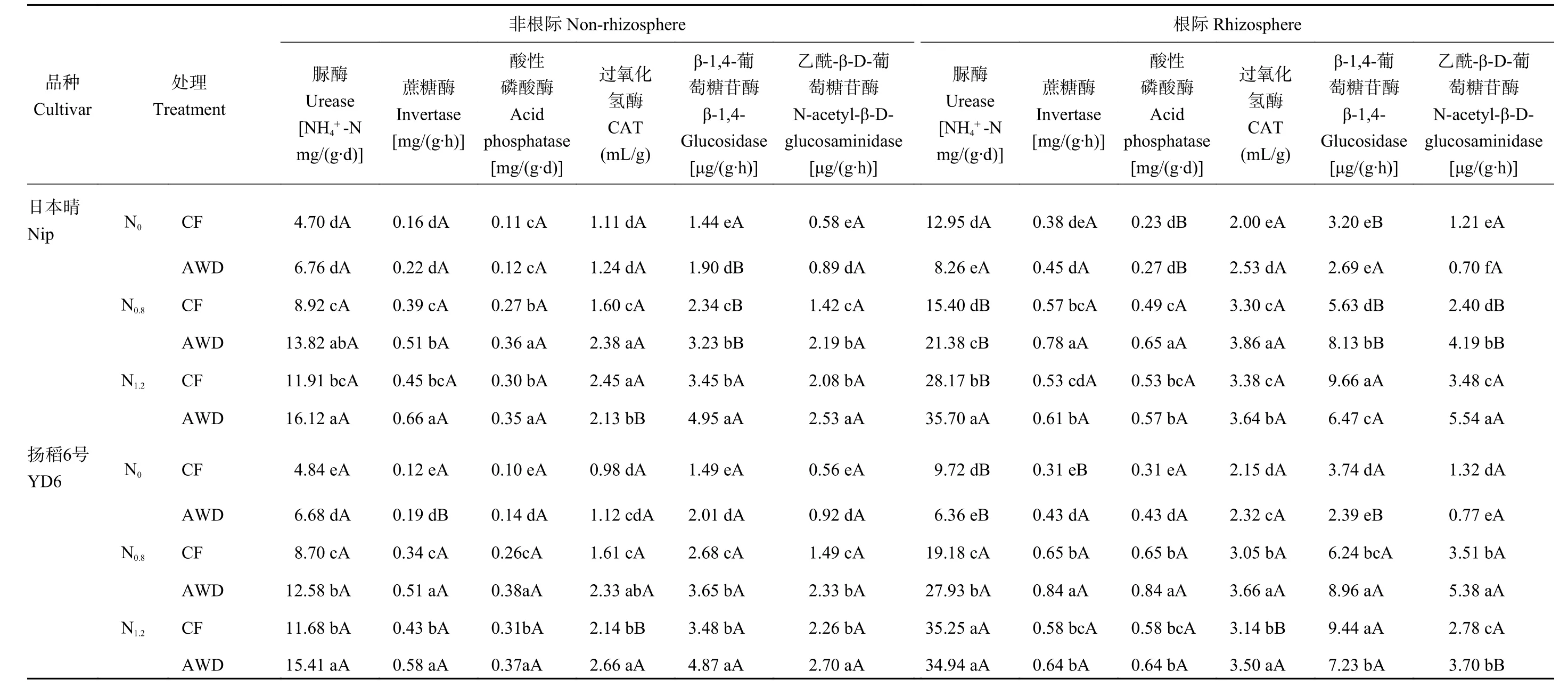
表3 不同水氮管理模式下水稻根际和非根际胞外酶活性Table 3 The activities of extracellular enzymes in the rhizosphere andnon-rhizosphere soils under different irrigation andN regimes
表4表明,日本晴和扬稻6号根际、非根际提取态总氮、硝态氮、铵态氮和游离氨基酸含量均随氮水平升高而显著增加(P<0.05)。与CF相比,AWD增加了N0.8、N1.2水平下2个水稻品种非根际和根际提取态总氮、硝态氮、游离氨基酸和可溶性有机氮含量,但降低了N0.8、N1.2水平日本晴和扬稻6号根际、非根际铵态氮含量。不论CF、AWD处理,N0.8、N1.2水平下日本晴和扬稻6号根际硝态氮和铵态氮均较非根际明显降低;而AWD处理扬稻6号根际铵态氮含量低于日本晴。

表4 不同水氮管理模式下水稻根际和非根际各形态氮含量Table 4 Nitrogencontents in the rhizosphere andnon-rhizosphere soils under different irrigation andN regimes
2.5 不同水氮管理模式对水稻幼苗干物重和氮吸收利用的影响
表5表明,与CF相比,AWD提高了N0、N0.8处理日本晴和扬稻6号地上部和整株干物重以及氮素利用指数(P< 0.05);AWD提高了N0、N1.2水平下日本晴根系和整株氮累积量,且各器官氮累积量在N0.8、N1.2水平高于N0水平。相反,AWD降低了N0水平扬稻6号根系氮累积量,增加了N0.8、N1.2水平根系、地上部和整株氮累积量,且其地上部和整株氮累积量在N1.2水平高于N0.8水平。无论CF、AWD,日本晴氮素利用指数均在N0.8水平最高,均高于N0和N1.2水平;扬稻6号氮素利用指数均在N0.8和N1.2水平最高,均高于N0水平。从两个水稻品种来看,AWD处理下N0.8和N1.2水平扬稻6号地上部和整株干物重、整株氮累积量以及氮素利用指数均高于日本晴。

表5 不同水氮管理模式下水稻干物重、氮累积和氮素利用指数Table 5 Accumulation of N,dry matter,and N utilization index of rice under different irrigation and N regimes
15N短期标记培养试验结果(图3)表明,水稻对根际NH4+的吸收速率远高于NO3-,且其吸收速率受水稻品种、氮水平和水分管理模式影响。与CF相比,AWD提高了N0.8和N1.2水平下日本晴和扬稻6号根系NH4+和NO3-吸收速率。CF、AWD条件下N0.8和N1.2,氮水平对日本晴NH4+和NO3-吸收速率无显著影响,但扬稻6号根系NH4+和NO3-吸收速率随氮水平增加而增加;且扬稻6号根系NH4+吸收速率在N0.8和N1.2水平显著高于日本晴。
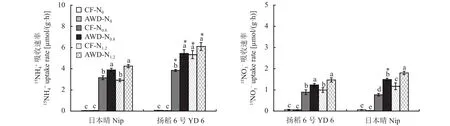
图3 不同水氮管理模式下水稻根系15NH4+和15NO3−吸收速率Fig. 3 15NH4+ and 15NO3− uptake rates of rice under different irrigation and N regimes
2.6 各指标间相关性分析
水稻营养生长期干物质累积和氮利用指数与根际微生物量碳、可溶性有机碳氮、硝化速率、有机质、各形态氮以及15NH4+和15NO3-吸收速率显著正相关(图4,P< 0.05),但与土壤pH和有效磷显著负相关。值得注意的是,水稻干物质累积和氮利用指数与根际土壤微生物量氮、铵态氮、全氮和速效钾均无显著相关关系;根际微生物量氮与可溶性有机碳、可溶性有机氮显著正相关,但与土壤其他理化性质无显著相关性。
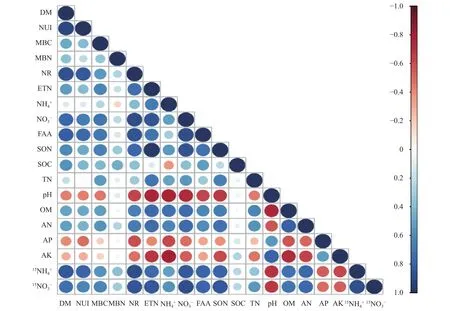
图4 各指标间相关性矩阵分析Fig. 4 Correlation matrix analysis among the different indicators
3 讨论
3.1 不同水氮管理下水稻根际内外氧环境变化特征
基于Unisense微电极原位测定技术,本研究发现水稻根室和边室溶氧量受灌溉模式、水稻品种和剖面深度影响差异明显,但受氮水平影响较小。与CF处理相比,AWD处理明显提高了水稻根室和边室溶氧量,其根室溶氧量在−5000~−40000 μm剖面深度明显高于边室,且扬稻6号高于日本晴。采用Fick第二扩散定律对各处理水-土界面溶解氧净通量进行计算,发现AWD处理扬稻6号根际内外溶解氧净通量均高于日本晴。以中氮水平(N0.8)为例,扬稻6号和日本晴边室、根室溶解氧净通量分别为−0.280和−0.041 nmol/(cm3∙s)、−0.104 和−0.031 nmol/(cm3∙s)(负值代表净消耗)。扬稻6号根际水-土界面较高的溶氧量消耗速率表明,AWD不仅明显增加其稻田溶解氧含量,也有利于维持较强的微生物呼吸或者氧化还原作用,其较高的氧化还原电位也间接证明了这一观点。
除水分外,稻田溶氧量还与水稻品种、根系泌氧能力和氧气消耗速率密切相关。与低产水稻品种相比,高产水稻品种可通过维持较强的根系径向泌氧屏障作用[24]和根系通气组织发育[25],进而为根系生长提供更充足的氧气。本研究中,扬稻6号较日本晴具有更高的生物量和根际溶氧量水平,而后者有利于增强根际硝化速率。相关性分析表明水稻生物量与根际溶氧量诱导的硝化速率显著正相关,也进一步验证了前人的研究。这可能由于硝化速率促进了根际土壤氮转化和氮吸收,且适当增加环境中NO3-含量有利于促进水稻生长和氮素利用率[8]。作为形成水稻干物质的主要途径,叶片光合作用释放的氧气可经由叶鞘和茎秆通气组织输送到根系[26]。与CF相比,AWD灌溉能通过减小叶基角和增加叶长改善水稻冠层结构,提高群体透光率和光合速率,促进水稻生长[8,27]。因此,我们推测扬稻6号较高的干物质量也可能与其根系泌氧能力和叶片光合产氧能力紧密相关。
3.2 不同水氮管理对稻田可溶性有机碳、微生物量碳氮及其相关酶活性的影响
可溶性有机碳是土壤中易氧化碳源,可作为衡量微生物量、有机碳矿化和土壤呼吸作用的重要指标[28-29]。本研究中,CF处理日本晴根际可溶性有机碳含量与非根际无明显差异,但其微生物量碳明显高于非根际土壤;AWD处理下2个水稻品种土壤微生物量碳、可溶性有机碳在根际与非根际无显著差异。除了受根系分泌物的影响外,这可能与不同灌溉模式下土壤微生物活性和可溶性有机碳的有效性有关。CF处理高含水量条件有利于可溶性有机碳的扩散和根际微生物量碳增加;AWD处理则不利于可溶性有机碳扩散,可显著降低土壤有机质矿化作用和微生物活性[30]。不同的是,中高氮水平下日本晴根际微生物量氮低于非根际,但扬稻6号根际和非根际土壤无明显差异。与粳稻相比,有研究指出籼稻可通过招募根际特异性微生物类群将有机氮转化为无机氮供水稻根系吸收,提高水稻氮利用效率[31]。我们分析这可能与不同品种水稻和微生物对根际有机氮的竞争吸收有关,但其调控机制仍有待进一步研究。与CF处理相比,频繁干湿交替可通过调控有机质矿化速率和微生物活性[32]提高土壤可溶性有机碳水平,本研究也得出类似的结论。此外,AWD较CF处理有利于水稻地上部光合产物向土壤传输、累积[33],还可通过提高可溶性有机碳并抵制微生物进入半休眠状态[34],进而提升中氮和高氮水平2个水稻品种土壤微生物量碳氮。相应地,中高氮水平日本晴和扬稻6号非根际碳氮代谢相关酶活性在AWD处理中也明显增加,且其微生物量碳氮和相关酶活性在中高氮水平均明显高于低氮水平。本研究中由于根袋的限制作用,根系分泌物对中高氮水平非根际可溶性有机碳和微生物量碳氮的影响有限。我们分析其可溶性有机碳增加主要受AWD刺激调控,且增施氮肥能改善土壤环境和提高土壤肥力[35],二者均为微生物提供了可直接利用的碳/氮源。不同的是,AWD虽然明显增加了中高氮水平日本晴和中氮水平扬稻6号根际碳氮代谢相关酶活性,但其相关酶活性在中氮水平明显高于高氮水平。蔡晓红等[36]则指出与CF相比,轻度AWD能显著提高土壤微生物量碳和酶活性,但重度AWD降低了土壤酶活性及微生物数量。这也表明氮肥和灌溉模式对微生物量和酶活性的影响具有交互效应,合理施氮和灌溉模式耦合有利于提高根际微生物数量及酶活性。
与CF相比,AWD不仅明显提高了日本晴和扬稻6号根际内外土壤硝化速率和NO3-浓度,还提高了调节有机氮向无机氮转化的关键酶活性[25,37],如β-1,4-葡萄糖苷酶和N-乙酰-β-D-葡萄糖苷酶,进而提高有机氮矿化效率和无机氮水平。不论CF、AWD,中高氮水平下日本晴和扬稻6号根际NH4+和NO3-含量均较非根际土壤明显降低,这可能与水稻根系对NH4-的吸收有关。15N同位素示踪试验表明扬稻6号根系对NH4+的吸收速率明显高于日本晴,这也造成前者根际NH4+浓度明显低于后者。值得注意的是,虽然日本晴和扬稻6号非根际土壤NH4+含量大于根际,但AWD模式下二者根际硝化速率分别是非根际的3.78和3.82倍,表明该环境下NH4+浓度不是影响硝化速率的关键限制因子。相关性分析表明水稻根际硝化速率与干物质重和氮利用指数显著正相关,但与微生物量氮和全氮无显著相关性(P> 0.05)。表明在当前施氮水平下灌溉模式及其诱导的根际溶氧量可能是影响硝化作用和水稻生长的主要因子。
3.3 不同水氮管理对水稻生长、氮吸收利用的影响及其调控机制
适宜的水氮耦合可通过“以水调氮、以水控氧”调控稻田根际溶氧量,促进良好根系形态构建、氮形态转化以及光合产物“源-库”分配平衡,提高水稻产量形成和氮素利用效率[38]。与CF相比,AWD明显提高了日本晴地下部生物量,这与陆大克等[39]的研究结果一致,但对扬稻6号则无明显影响。董桂春等[40]发现,影响水稻生物量的主要根系性状在不同穗型品种间具有显著差异,日本晴为每株不定根数,扬稻6号为每株不定根数、每株根干重、每株不定根长。表明水稻根系生长可能受到品种遗传背景和环境条件的共同影响。但是,AWD明显提高了各施氮水平日本晴和扬稻6号地上部、整株生物量、整株氮累积量及氮利用指数(P< 0.05)。这可能与AWD调控的稻田根际氧环境变化特征紧密相关,增加根际溶氧量可增加根系可溶性糖、蛋白质含量和呼吸强度,为根部生理活动提供能量[41],进而促进养分吸收。同时,AWD模式下稻田硝化作用增强,速效氮由淹水时的NH4+为主变成干湿交替时的NH4++NO3-为主。张亚丽等[42]指出增加根系溶氧量导致水稻根系对NH4+的亲和力显著高于NO3-。我们前期研究也发现增加根系溶氧量可显著增加水稻NH4+吸收,且NH4+吸收后受谷氨酸脱氢酶调控的氨基酸代谢增强,可能是水稻生长和氮利用效率提高的主要原因[13]。虽然日本晴和扬稻6号水稻根系形态构建对AWD响应不同,但AWD诱导的良好根际氧环境有利于养分的吸收。本研究中日本晴和扬稻6号较高的15NH4+吸收速率也证明了这一观点。
值得注意的是,水稻地上部和整株生物量、氮累积量以及水稻氮素利用指数在不同水稻品种间呈现明显的基因型差异,扬稻6号水稻品种上述各参数在中氮和高氮水平显著高于日本晴。相关性分析表明水稻生物量和氮素利用指数与根际硝化强度、微生物生物量碳和可溶性有机碳等理化指标显著正相关。李奕林等[43]发现籼稻根际硝化强度在中高氮水平下显著高于粳稻。这表明水稻根际硝化作用增强可能在水稻生长和氮素利用方面发挥重要作用,下一阶段应加强其作用机制研究。
4 结论
干湿交替灌溉明显增加了水稻根际内、外溶氧量和氧化还原电位,良好的稻田氧环境增强了根际硝化作用,促进了氮形态转化,进而增加了土壤碳、氮的有效性,提高水稻对NH4+和NO3-(尤其是NH4+)的吸收,进而提高水稻干物质累积和氮素利用效率。
