沼泽红假单胞菌与枯草芽孢杆菌混施对水稻根域细菌多样性与功能的影响
2022-02-23张娜,朱艳,肖娴*,赵远
张 娜,朱 艳,肖 娴*,赵 远
(1 常州大学环境与安全工程学院,江苏常州 213000;2 中国科学院南京土壤研究所,江苏南京 210008)
利用微生物菌肥促进作物增产增效、维持土壤肥力是一个备受关注的绿色生产方式[1]。微生物菌肥是将一种或多种有益微生物菌经工业化发酵后制成的活性微生物菌群,利用微生物的生命活动和代谢产物改善土壤性质,产生对作物生长有益的活性物质,以及作物生长所需的养分,提高作物抗逆和抗病能力,促进作物生长[2]。研究表明,施用微生物菌肥可以使作物根系增粗增重,作物的优势生长性状表现较为明显,果实品质改善,果实产量增加,以及病虫害得以抑制[3]。微生物菌肥的投入可以减少农业生产中化肥和农药的使用,减轻环境污染,改善土壤质量,在现代农业可持续发展中具有良好的开发潜力和应用前景。
沼泽红假单胞菌(Rhodopseudomonas palustris)是微生物肥料中应用最广泛的一种光合细菌,对生存环境具有较强的适应性,可产生多种生物活性物质,具有调节土壤微生态、提高土壤酶活力、促进作物生长、诱导植物宿主产生系统抗性等功能[4]。已知的沼泽红假单胞菌基因组中均有与固氮酶相关的基因[5],大部分菌株具有生物固氮能力,可提供作物生长所需的氮素。沼泽红假单胞菌利用吲哚-3-丙酮酸和色胺途径合成植物生长激素吲哚-3-乙酸(indole-3-acetic acid,IAA)[6],其促生功能在水稻、番茄等农作物上取得了显著的效果[7-8]。枯草芽孢杆菌(Bacillus subtilis)肥料是目前农业生产中应用较为广泛的一种微生物功能菌肥[9]。芽孢杆菌能产生长寿且耐胁迫的孢子,生长速度快、营养需求少、环境适应性强。芽孢杆菌通过合成IAA、赤霉酸和1-氨基环丙烷-1-羧酸(1-aminocyclopropane-1-carboxylate,ACC)脱氨酶调节细胞内植物激素代谢,刺激作物生长。芽孢杆菌通过分泌抗菌代谢物及其细胞壁降解物质可增强作物抗病性。在逆境条件下,芽孢杆菌会产生胞外多糖和铁载体,通过改变应激反应基因、蛋白质、植物激素和相关代谢物等提高作物的抗逆能力[10]。有些枯草芽孢杆菌具有解磷功能,可通过分泌有机酸等方式将土壤中的无机磷或有机磷转化为作物可吸收利用的有效态磷[11]。
早期微生物肥料大多选择高效的单一微生物种类菌剂,由于单一微生物菌剂在不同土壤环境中或者针对不同宿主植物的活性差异很大,导致功效不稳定,限制了其在实际生产中的应用[12]。具有不同功能的有益微生物之间可能互补或协作,在一定程度上提高了微生物肥料改善土壤性质、促进作物生长功效的稳定性[13]。近年来,使用两种或多种有益微生物的混合菌剂逐渐成为发展趋势。沼泽红假单胞菌和枯草芽孢杆菌作为微生物菌肥常用的单一菌剂,对其提高作物抗病性和产量及品质的效果关注较多,而对两者混合的协同效果及其影响机理关注较少。研究沼泽红假单胞菌和枯草芽孢杆菌混合施用对水稻产量及其根域土壤微生物多样性和功能的影响,为其在田间试验和农业生产中的应用和可能产生的影响提供参考。
1 材料与方法
1.1 供试土壤
试验于2019年5月至2019年11月在常州大学进行,常州属于亚热带季风气候,年平均降水量1064 mm,年平均温度16.0℃,全年日照时间1943 h。供试水稻品种为南粳5055号,供试水稻土采于江苏省常州市水稻田,初始土壤基本理化指标为:pH 6.51、有机质38.32 g/kg、NO3--N 3.19 mg/kg、NH4+-N 31.64 mg/kg、碱解氮128 mg/kg、速效磷148 mg/kg。
1.2 供试菌株
供试沼泽红假单胞菌(R. palustris)和枯草芽孢杆菌(B. subtilis)菌株购自新疆光合元生物科技有限公司(http://www.xjguangheyuan.com/index.php),其保藏号分别为BNCC134292和BNCC188062。两株菌之间没有明显相互抑制作用(图1)。
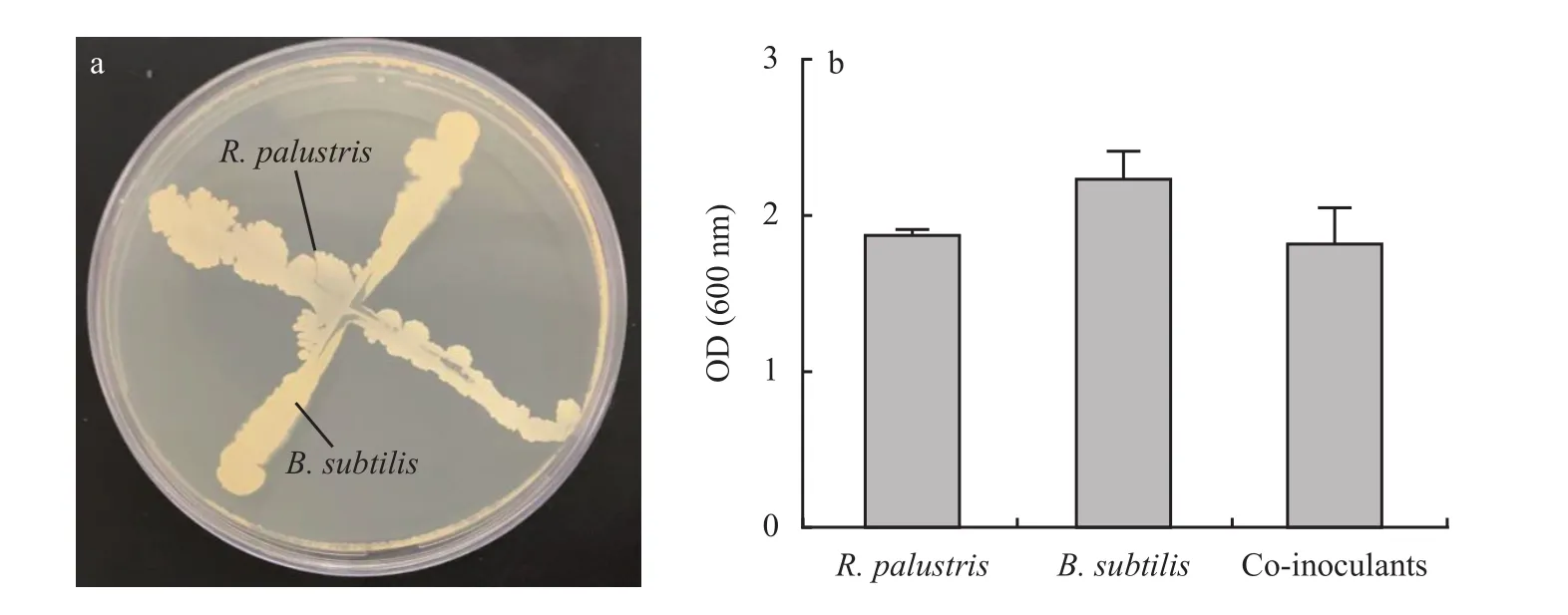
图1 沼泽红假单胞菌和枯草芽孢杆菌在固体(a)和液体(b)培养基中的相容性(P > 0.05)Fig. 1 The compatibility between R. palustris and B. subtilis conducted on solid (a) and liquid (b) medium
将存于−20℃的沼泽红假单胞菌(R. palustris)和枯草芽孢杆菌(B. subtilis)保藏菌种活化,接种到灭菌的LB固体培养基上,28℃培养2天,然后挑选培养基上茁壮的单菌落接种到新的LB固体培养基上,28℃培养2天。再挑取新培养的生长良好的单菌落接种到灭菌的50 mL LB液体培养基中28℃下180 r/min振荡富集培养24 h,然后将富集菌液以12000 r/min离心10 min,将离心后的菌体沉淀重悬于无菌蒸馏水中,其最终浓度约为2×108cfu/mL,以备盆栽施用。
1.3 试验设计
试验采用盆栽方法,盆钵容积为0.02 m3(直径26 cm ×高30 cm),底部密封,防止漏水漏肥。试验设4个处理:清水为对照(CK)、单施沼泽红假单胞菌(R. palustris)、单施枯草芽孢杆菌(B. subtilis)、1∶1 (v∶v)沼泽红假单胞菌和枯草芽孢杆菌混施(Mix),每个处理设置3个重复。具体方法如下:将取自田间的水稻土风干破碎后过2.36 mm筛,每盆装6 kg风干土,均匀施入1.71 g磷酸二氢钾、0.50 g氯化钾和0.66 g尿素作为基肥。将水稻种子用70%乙醇浸泡3 min,20%次氯酸钠浸泡3 min,70%乙醇浸泡30 s,无菌水冲洗6~8遍进行灭菌处理,灭菌处理后的种子播种在育苗盘上育苗,5天后移植到盆钵中,每盆种植3穴,每穴两株。在水稻分蘖期和抽穗期每盆追施0.66 g尿素。菌肥处理分别在水稻分蘖期于水稻根围注施菌液1.68 mL,在抽穗期喷施菌液1.68 mL。所有处理作物在自然光照下生长,水稻生长前期保持覆水2 cm,到抽穗期之后进行晒田,统一管理。
1.4 样品收集
在水稻成熟期,每盆各选取3株长势相近的水稻植株,采集水稻秸秆和籽粒、根域土壤样品。根域土壤样品包括采集根区、根际、根表土壤,根区土壤样品用于理化指标分析,根际和根表土壤样品用于微生物分析。用铲子在水稻植株四周挖出10 cm × 10 cm× 10 cm的土块,抖落根周松散的土壤收集为根区土。抖落根周松散土壤后,使用无菌镊子和剪刀挑取约5 g根,放入含有25 mL无菌0.85% NaCl溶液的50 mL离心管中,180 r/min摇动1 h,以最大转速涡旋15 s,然后将混浊溶液用100 μm尼龙网孔过滤器过滤,以除去破碎的植物部分和大量沉积物。将混浊滤液在8000 g下离心10 min收集沉淀土壤即为根际土。将上述根再次放入无菌磷酸缓冲盐溶液(phosphate buffer saline,PBS)中超声震荡3次(30 s,50~60 Hz),玻珠击打均质后,用于提取根表微生物脱氧核糖核酸(deoxyribonucleic acid,DNA)。
1.5 测定方法
将水稻籽粒自然风干后称重测产。测定根区土壤理化性质,方法如下[14]:土壤pH采用玻璃电极测定,水土比2.5∶1;土壤有机质含量采用重铬酸钾容量法测定;硝态氮含量采用氯化钙浸提—紫外可见分光光度法测定;铵态氮含量采用靛酚蓝比色法测定;碱解氮含量测定采用碱解扩散法;速效磷含量测定采用Olsen-P法—钼锑抗比色测定。
土壤微生物总DNA的提取和检测:取振荡离心收集的根际土壤样品2.0 g用于提取根际土壤DNA,将根表超声后的溶液离心收集菌体提取根表土壤微生物DNA。采用土壤微生物DNA强力提取试剂盒(PowerSoil® DNA Isolation Kit)并结合液氮冷冻研磨的方法提取土壤样品中微生物总DNA[15],具体的操作步骤详见试剂盒说明书。提取的DNA进行1%(w/v)琼脂糖凝胶电泳检测DNA片段大小,采用NanoDropND-2000 (Thermo Fisher Scientific,USA)测定提取液中双链DNA的浓度和提取液在230、260和280 nm波长的吸光值,进行DNA质量分析,质量合格标准:浓度≥20 ng/μL,总量≥500 ng,OD260/280 = 1.8~2.0。
细菌16S rDNA测序:采用对大多数细菌的16S rDNA基因V4~V5高变区具有特异性的引物对515F (5′-GTGCCAGCMGCCGCGG-3′)和 907R (5′-CCGTCAATTCMTTTRAGTTT-3′)扩增其 V4~V5区片段[16-17],利用Illumina MiSeq测序平台进行高通量测序。对于DNA质量合格的样本进行目的区域高保真PCR扩增,设置3个重复试验,同时以标准的细菌基因组DNA Mix作为阳性对照。琼脂糖凝胶电泳检测扩增产物是否单一和特异。将同一个样本的3个平行扩增产物混合,每个样本加入等体积的AgencourtAMpure XP核酸纯化磁珠对产物进行纯化,获得样本的原始文库。对文库定量并按比例混合样本,向文库末端引入read1、read2和特异性Index标签序列。通过Agilent 2100 Bioanalyzer检测测序文库插入片段的大小,确认在120~200 bp无非特异性扩增,并准确定量测序文库浓度。建库后采用Miseq平台,2×250 bp的双端测序策略对文库进行测序,原始下机数据经过质量控制和过滤后,利用UPARSE软件对97%相似水平的OTU (Operational Taxonomic Unit)代表序列进行分类学统计,分类比对参照RDP (Ribosomal Database Project)数据库,后续进行生物信息学分析,测序工作委托上海天昊生物科技有限公司完成。
1.6 数据分析
本研究中水稻产量和结实率、土壤理化性质、土壤细菌群落alpha多样性指数等数据,在各菌肥处理间及根际与根表土壤之间的差异显著性分析采用方差分析法(analysis of variance,ANOVA)和Tukey法 (P<0.05和P<0.01),在 SPSS 22.0 (IBM SPSS Statistics 22)中完成。土壤细菌群落的alpha多样性(Chao1和Shannon指数)和beta多样性(Bray-Curtis差异性)、群落结构的主成分分析(principal component Analysis,PCA)在 R_3.5.1 (https://www.r-project.org/)中使用“vegan”包(https://CRAN.R-project.org/package=vegan)完成。土壤细菌群落beta多样性指数的整体差异显著性分析使用Kruskal-Wallis test在R_3.5.1中完成。基于16S rDNA高通量测序的细菌功能预测利用PICRUSt软件完成。土壤理化和细菌多样性及功能与水稻产量的Pearson相关性分析在R_3.5.1中使用“corrplot”包(https://CRAN.R-project.org/package=corrplot)完成。
2 结果与分析
2.1 沼泽红假单胞菌与枯草芽孢杆菌混施对水稻产量和土壤理化性质的影响
与化肥对照相比,沼泽红假单胞菌(R. palustris)和枯草芽孢杆菌(B. subtilis)单施和混施3个处理均显著提高了水稻的结实率(P< 0.05,图2),结实率依次分别提高了13.3%、14.6%、17.2%;单施沼泽红假单胞菌及其与枯草芽孢杆菌混施处理显著增加了水稻产量,增产率分别为9.8%、13.7%,而单施枯草芽孢杆菌处理增产不显著(图2)。
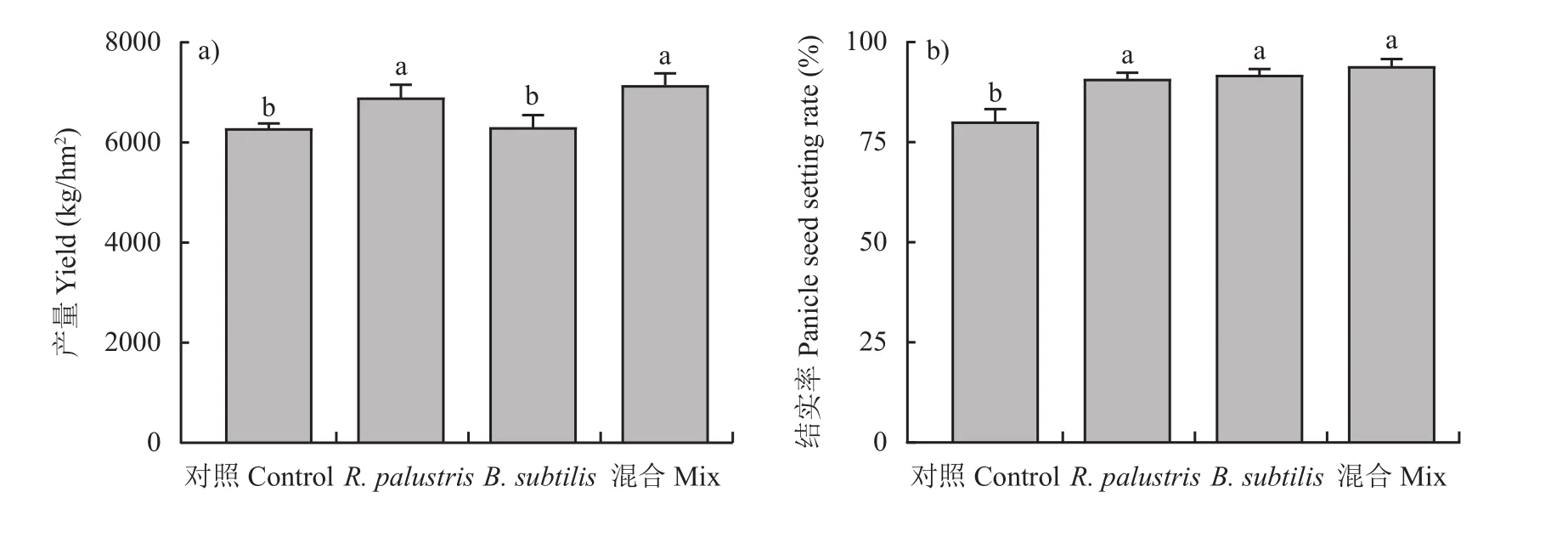
图2 功能菌施用对水稻产量(a)和结实率(b)的影响Fig. 2 Effects of microbial inoculations on the rice yields (a) and panicle seed setting rates (b)
在水稻成熟期,两种功能菌的单施和混施处理对测定的6个土壤理化性状指标均没有显著影响(P> 0.05,表1)。

表1 施用微生物菌肥对土壤化学性质的影响Table 1 Effects of microbial inoculation on soil chemical properties
2.2 沼泽红假单胞菌与枯草芽孢杆菌混施对土壤细菌群落多样性的影响
采用16S rDNA高通量测序分析土壤细菌群落,每个样本有效序列分别≥5万条。按照序列相似度97%的划分标准,划分了9287个OTU。在门、纲、目、科、属、种水平分别对OTU进行聚类,共得到44门、75纲、99目、217科、566属、911种。利用物种丰富度(Chao1)和Shannon-Wiener多样性指数(H’)来表征细菌群落alpha多样性(图3)。结果发现,整体而言各处理下根表土壤细菌群落alpha多样性均显著低于根际土壤细菌群落alpha多样性(P<0.05)。两种功能菌的单施和混施对根际土壤细菌群落alpha多样性影响较小,而对根表土壤细菌群落的alpha多样性影响较大。相比常规施化肥处理(Control,Chao1 = 4390 ± 252),单施沼泽红假单胞菌(R. palustris)提高了根表土壤细菌群落的物种丰富度(Chao1 = 4705 ± 172),而单施枯草芽孢杆菌(B.subtilis) (Chao1 = 3986 ± 202)、1∶1 (v∶v)沼泽红假单胞菌和枯草芽孢杆菌混施(Mix) (3924 ± 37)降低了根表土壤细菌群落的物种丰富度。另外,两种功能菌的单施和混施处理下根表土壤细菌群落的Shannon-Wiener多样性指数均低于常规施化肥(Control)处理,其中单施枯草芽孢杆菌(B. subtilis)处理下的多样性指数减幅最大。
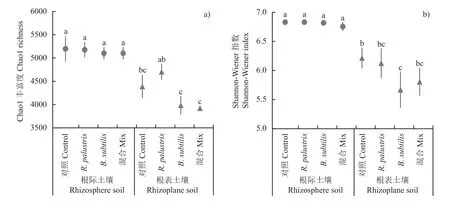
图3 土壤细菌群落物种丰富度(a)和多样性指数(b)Fig. 3 Alpha diversity of bacterial community with Chao1 richness (a) and Shannon-Wiener index (b)
从门水平上观察细菌的群落组成,根际土壤细菌群落组成和根表土壤细菌群落组成差异明显(图4)。根际土壤细菌群落以变形菌门(Proteobacteria)、绿弯菌门(Chloroflexi)、酸杆菌门(Acidobacteria)和厚壁菌门(Firmicutes)占主导,其相对丰度分别占21.5%~28.1%、22.2%~26.6%、8.6%~9.8%和5.9%~12.8%。单施枯草芽孢杆菌(B. subtilis)显著增加了根际土壤中厚壁菌门(Firmicutes,P= 0.004)而减少了绿弯菌门(Chloroflexi,P= 0.024)的相对丰度。根表土壤细菌群落以变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、绿弯菌门(Chloroflexi)和放线菌门(Actinobacteria)占主导,其相对丰度分别占39.4%~61.3%、6.5%~22.5%、4.4%~14.4%和4.7%~12.7%。相比根际土壤细菌群落组成,两种功能菌的单施和混施更明显地改变了根表土壤细菌群落的组成。单施沼泽红假单胞菌(R. palustris)、单施枯草芽孢杆菌(B. subtilis)、1∶1 (v∶v)沼泽红假单胞菌和枯草芽孢杆菌混施(Mix)处理下优势菌变形菌门(Proteobacteria)在群落中所占丰度比例分别为46.4%~48.9%、52.0%~58.8%、51.7%~61.3%,显著高于其在常规施化肥(Control)处理中所占的比例39.4%~51.1% (P= 0.024)。单施沼泽红假单孢菌、单施枯草芽孢杆菌以及两种功能菌的混施处理下,变形菌门相对丰度分别平均增加3%、10%和13%。
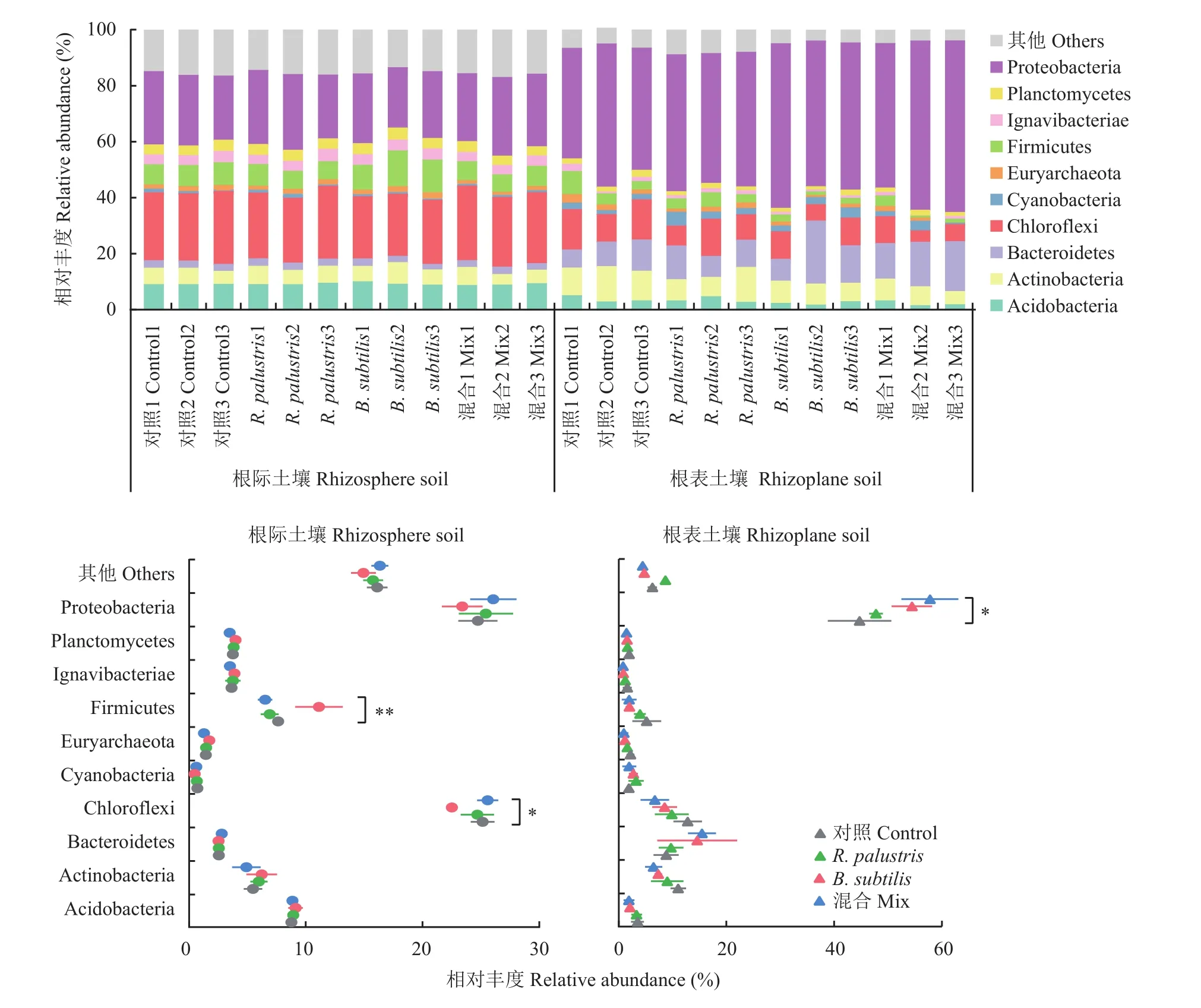
图4 土壤细菌群落组成(门水平)Fig. 4 Bacterial community composition at phylum level
进一步从属水平上比较各处理下的土壤细菌群落组成差异(图5a),根表土壤细菌群落中注释到属水平的细菌相对丰度(平均约为69%)要显著高于根际土壤细菌的相对丰度(平均约为41%)。在此,我们具体展示在根际和根表土壤中相对丰度占前15名的属别。结果显示,根际土壤细菌群落中相对丰度最高的属依次为Anaeromyxobacter、Clostridium_sensu_stricto、Geobacter、Gp6、Melioribacter、Gp7、Longilinea、Gp3、Syntrophobacter、Gaiella、Ornatilinea、Bacillus、Pseudolabrys、Gp1和Bradyrhizobium,其平均相对丰度均在0.5%以上(图5b)。相比于其他处理(0.4%~0.8%),单施枯草芽孢杆菌(B. subtilis,1.0%~1.5%)显著增加了根际土壤细菌群落中Bacillus的相对丰度(P= 0.009),这可能与枯草芽孢杆菌的快速生长和环境适应性强等特点有关,单独施用该菌肥能够有一定的定殖并促进芽孢杆菌的繁殖。根表土壤细菌群落中则以Novosphingobium、Caulobacter、Cloacibacterium、Flavobacterium、Rhizobium、Anaeromyxobacter、Pleomorphomonas、Bradyrhizobium、Nocardioides、Thermomonas、Propionicimonas、Chryseobacterium、Desulfovibrio、Methanobacterium和Pseudoxanthomonas占优势,其平均相对丰度均在1.1%以上(图5c)。与门水平组成相似,相比根际土壤细菌群落组成,两种功能菌的单施和混施更明显地改变了根表土壤细菌群落属水平的组成。单施枯草芽孢杆菌(B. subtilis)和两种功能菌混施(Mix)显著降低了根表土壤中Anaeromyxobacter的相对丰度(P= 0.026)。与两种功能菌单施(R. palustris、B. subtilis)的影响相比,混施(Mix)处理更大幅度地增加了根表土壤细菌优势菌Novosphingobium、Flavobacterium和Rhizobium的相对丰度,而减少了Pleomorphomonas、Nocardioides、Propionicimonas和Methanobacterium的相对丰度。两种功能菌的单施和混施均减少了Bradyrhizobium的相对丰度。另外,单施枯草芽孢杆菌(B. subtilis)处理下Caulobacter、Cloacibacterium、Thermomonas、Chryseobacterium和Desulfovibrio的相对丰度明显增加。
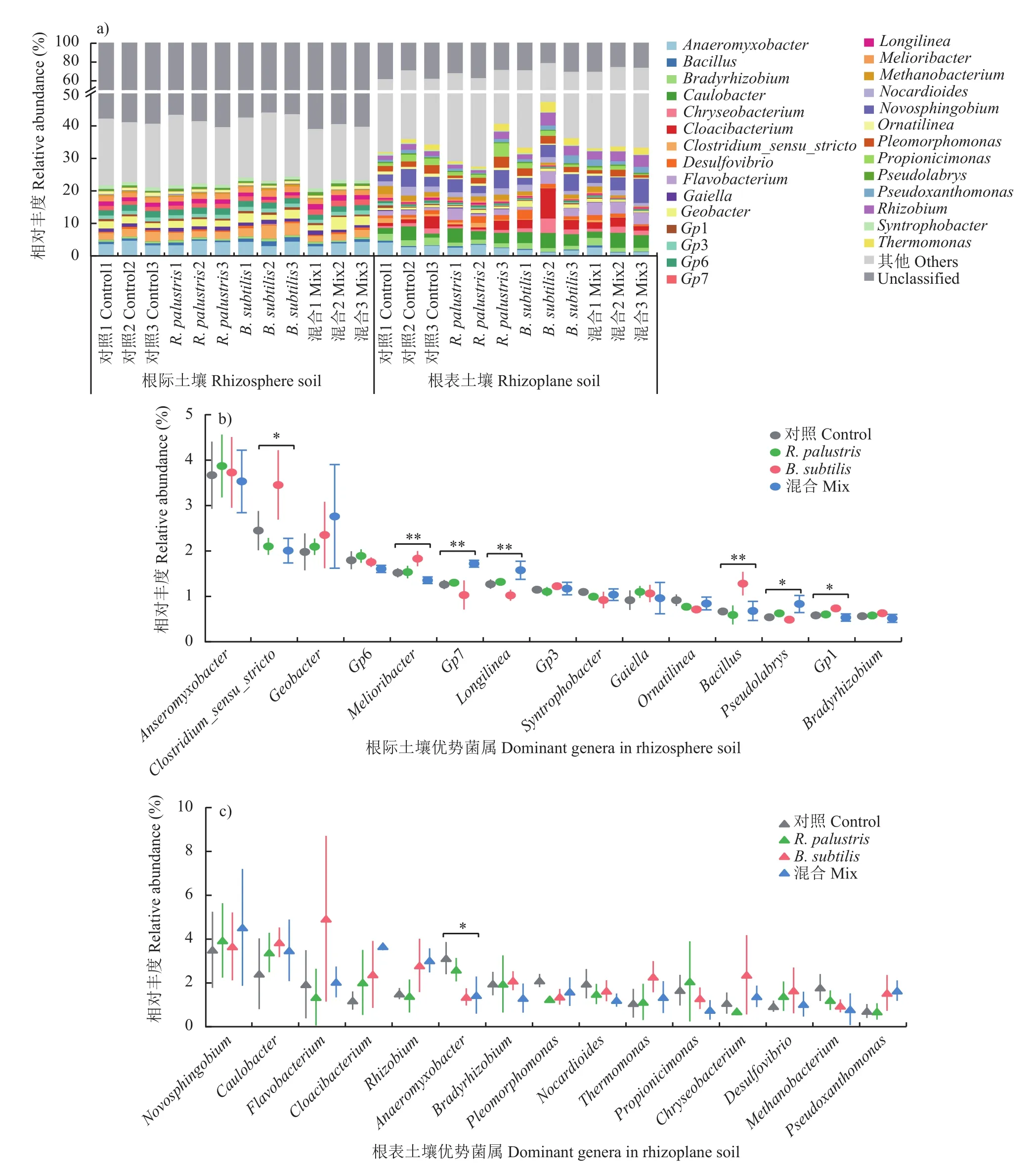
图5 土壤细菌群落组成(属水平) (a)及根际(b)和根表(c)土壤中优势菌属的相对丰度Fig. 5 Bacterial community composition (a) at genus level and relative abundance of dominant genera in rhizosphere (b) and rhizoplane (c) soil
利用主成分分析研究土壤细菌群落结构,对于所有根域土壤的细菌群落而言,PCA分析第一、二轴解释量分别为24.6%和5.0%,根际土壤细菌群落和根表土壤细菌群落在第一轴上明显地分散开来,说明根际土壤细菌群落和根表土壤细菌群落结构差异显著,根域微环境是影响土壤细菌群落的首要因素(图6a)。对于根际土壤细菌群落,混施(Mix)处理下的细菌群落结构与其他处理下的细菌群落结构差异最大(图6b)。而对于根表土壤细菌群落,两种功能菌的单施(R. palustris、B. subtilis)和混施(Mix)处理下的细菌群落结构均与常规施化肥(Control)处理下的细菌群落结构有一定差异(图6c)。相比根际土壤细菌群落组成,微生物菌肥施用在更大程度上改变了根表土壤细菌群落结构。
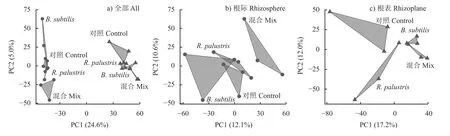
图6 所有根域土壤细菌(a)、根际土壤细菌(b)、根表土壤细菌(c)群落结构的主成分分析Fig. 6 Principal component analysis of all root zone (a),rhizosphere (b),rhizoplane (c) bacterial community structure
基于Bray-Curtis相异指数分析细菌群落的beta多样性,结果发现根表土壤细菌群落的Bray-Curtis相异指数显著高于根际土壤细菌群落的Bray-Curtis相异指数(P< 0.001,图7a),这说明根表土壤细菌群落的beta多样性比根际土壤细菌群落的beta多样性高,根表土壤细菌群落之间物种组成的相似性较低。进一步比较不同处理下根际土壤细菌群落和根表土壤细菌群落的beta多样性,两种功能菌的单施和混施均未显著改变根际土壤细菌群落的beta多样性(P= 0.218,图7b),但可能潜在改变了根表土壤细菌群落的beta多样性(P= 0.099,图7c)。

图7 所有根域土壤细菌(a)、根际土壤细菌(b)、根表土壤细菌群落(c)的Bray-Curtis相异指数Fig. 7 Bray-Curtis dissimilarity of all root zone (a),rhizosphere (b),rhizoplane bacterial community (c)
2.3 沼泽红假单胞菌与枯草芽孢杆菌混施对土壤细菌群落功能的影响
基于16S rDNA高通量测序的OTU丰度特征,利用PICRUSt软件可预测出未进行全基因组测序OTU的基因组信息,再通过KEGG (Kyoto Encyclopedia of Genes and Genomes,京都基因和基因组百科全书,http://www.genome.jp/kegg/)数据库对基因家族进行分类,获得土壤细菌的功能预测结果。根据预测结果,统计各类功能的基因丰度,在KEGG level2代谢通路中,所有样品中均以碳水化合物代谢通路(carbohydrate metabolism)、氨基酸代谢通路(amino acid metabolism)和能量代谢通路(energy metabolism)涉及的基因丰度最高(图8)。比较不同样品,单施枯草芽孢杆菌(B. subtilis)、1∶1 (v∶v)沼泽红假单胞菌和枯草芽孢杆菌混施(Mix)、单施沼泽红假单胞菌(R. palustris)处理下的根表土壤细菌的各类功能涉及的基因丰度最高,且均明显高于常规施化肥对照组(Control)根表土壤细菌的各类功能基因丰度。为了比较不同样品的相似性,进一步构建了基于Bray-Curtis距离的聚类树对样品进行聚类分析。基于KEGG功能丰度表,以Bray-Curtis方法计算距离矩阵,进行样品间聚类分析,并将聚类结果与各样品在KEGG数据库第二层级上的功能基因相对丰度整合展示如图8。可以看出根际土壤细菌和根表土壤细菌的功能差异较大,与细菌群落组成结构一致,根域微环境是影响土壤细菌群落功能的首要因素。对于根表土壤细菌群落而言,同一处理下的样品聚类距离越近,功能越相似,不同处理的样品位于不同聚类分支;而对于根际土壤细菌群落,不同处理的样品没有明显的聚类区分。同样说明两种功能菌的单施和混施可能改变了根表土壤细菌群落功能,而对根际土壤细菌群落功能没有显著影响。
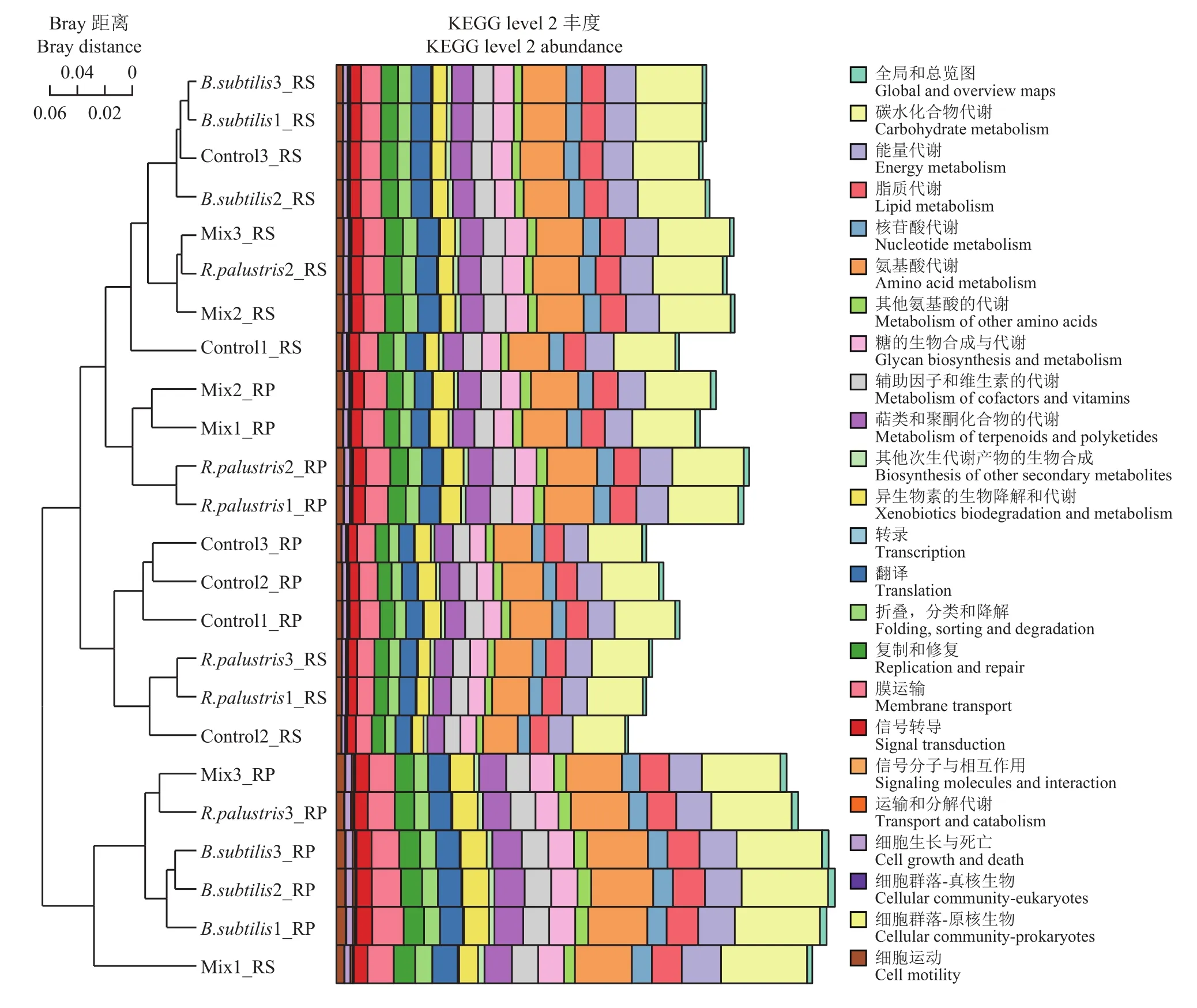
图8 PICRUSt预测KEGG通路的功能聚类Fig. 8 Functional clustering of KEGG pathways with PICRUSt prediction
2.4 细菌多样性与功能对水稻产量的潜在影响
将细菌多样性与功能及水稻产量和结实率进行Pearson相关性分析(图9a),结果发现根表土壤细菌Shannon-Wiener多样性指数与根表土壤细菌群落涉及新陈代谢(r= −0.60,P= 0.04)、环境信息处理(r=−0.62,P= 0.03)和细胞过程 (r= −0.64,P= 0.03)等功能的基因丰度均呈显著负相关关系。根际土壤细菌和根表土壤细菌的涉及新陈代谢、遗传信息处理、环境信息处理、细胞过程等功能基因丰度均与水稻结实率显著正相关(r= 0.60~0.68,P< 0.05),根域土壤微生物的潜在功能可能对水稻结实产生重要影响。具体分析根际(图9b)和根表(图9c)土壤细菌群落中优势菌属的相对丰度与其功能基因丰度及水稻产量和结实率的关系,结果发现,相比于根际土壤细菌,根表土壤细菌中优势菌属的变化对整体群落功能的基因丰度影响更大,其中Thermomonas的相对丰度与各类功能的基因丰度均显著正相关(r=0.59~0.66,P< 0.05),Anaeromyxobacter(r=−0.69~−0.54,P< 0.05)和Bradyrhizobium(r=−0.71~−0.60,P< 0.05)的相对丰度与各类功能的基因丰度显著负相关,而根际土壤细菌的优势菌属中则主要以Pseudolabrys的相对丰度与各类功能的基因丰度呈显著正相关关系(r= 0.59~0.61,P< 0.05)。这可能与功能菌肥施用更明显地改变了根表细菌群落组成有关,两种功能菌的单施和混施均减少了Anaeromyxobacter和Bradyrhizobium的相对丰度。另外,根际土壤中Gp7(r= 0.59,P= 0.04)和根表土壤中Flavobacterium(r= 0.60,P= 0.04)的相对丰度与水稻产量均呈显著正相关。如前所述,相比于常规施化肥处理,两种功能菌的单施和混施均增加了根表土壤中Flavobacterium的相对丰度,且混施处理下增幅更大。由此可知,施用功能菌肥可能通过改变根域细菌,尤其是根表细菌的群落组成及其功能而促进作物生长、提高水稻产量。
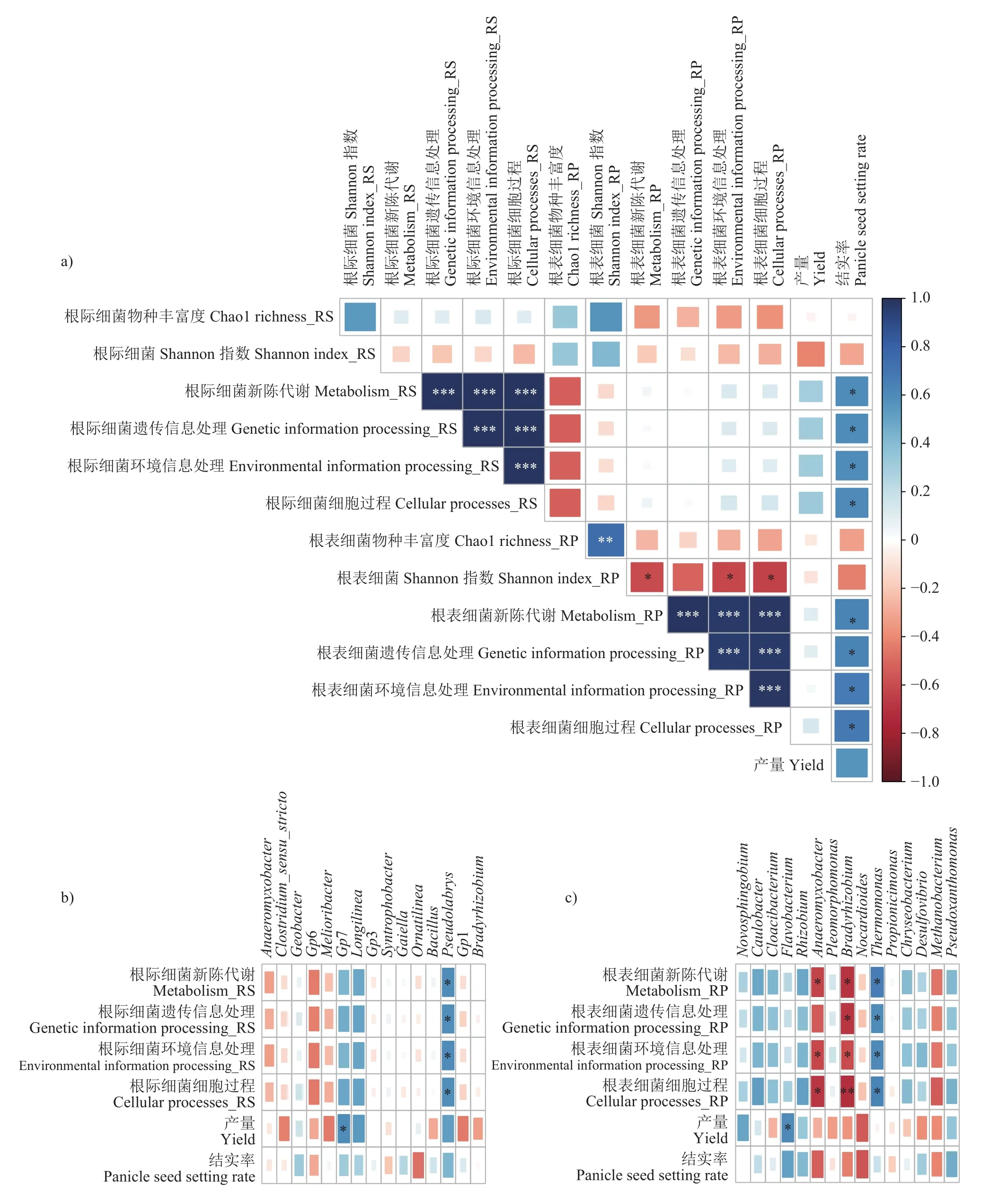
图9 细菌多样性和功能(a)及根际(b)和根表(c)土壤细菌优势属的相对丰度与水稻产量和结实率的相关性Fig. 9 Pearson correlations between microbial diversity and function (a),relative abundance of dominant bacterial genera in rhizosphere (b) and rhizoplane (c) soil and rice yield and panicle seed setting rate
3 讨论
微生物菌肥作为一种绿色环保的新型肥料,近年来在农业生产中备受关注。本研究通过盆栽试验探讨两种常见的微生物菌肥对水稻生产的影响,结果发现,单独施用和混合施用沼泽红假单胞菌(R.palustris)和枯草芽孢杆菌(B. subtilis)均显著提高了水稻的结实率,单施沼泽红假单胞菌及其与枯草芽孢杆菌混施处理显著增加了水稻产量且两种功能菌混施的增产效果最明显。沼泽红假单胞菌是光合细菌类生物肥料,可通过光能自养等代谢方式将大气中的CO2转化为生物质,促进植物的光合作用,增加作物产量,另一方面,其生物固氮功能可将大气中的N2转化为植物可利用的铵,为作物生长提供养分[18]。有研究报道,沼泽红假单胞菌生物肥料可使水稻增产高达48%[19]。枯草芽孢杆菌作为植物促生菌,在改善土壤环境、提高作物抗逆抗病性、促进作物生长等方面都有良好成效[20-21]。施用枯草芽孢杆菌菌剂可有效抑制尖孢炭疽菌(Colletotrichum acutatum),控制炭疽病引起的落果,显著提高作物结实率[22-23]。孙玥等[24]研究发现水稻结实率和产量均与枯草芽孢杆菌菌肥用量呈显著正相关。两种有益微生物的混合施用可能产生协同作用[25-26]。例如,当枯草芽孢杆菌与沼泽红假单胞菌一起接种时,能消耗溶解氧,促进沼泽红假单胞菌形成生物膜并提高固氮酶活性[27]。但也有研究发现当枯草芽孢杆菌与巴西固氮菌混合施用时,引起了作物根系结构的改变,抑制了作物的生长[28]。对于微生物复合菌肥的研制和使用,还需要加强对不同功能菌组合及其与不同农作物的效益关系展开研究。
微生物菌肥的施用,不仅影响作物生长,还会改变地下部土壤微生物群落。本研究中利用高通量测序技术研究了沼泽红假单胞菌和枯草芽孢杆菌单施和混施对水稻根际和根表土壤细菌多样性和功能的影响,结果发现,微生物菌肥的施用主要影响了水稻根表土壤细菌群落的alpha和beta多样性及其代谢功能,而对根际土壤细菌群落多样性和功能影响较小。一方面,微生物菌肥施入土壤后,主要作用于作物根系表面、根系内部及通过作物导管传输到作物茎、叶等部位实现定殖和繁殖,因此可能优先对根表土壤细菌群落产生影响[3,29]。外源物种可能在定殖过程中与根表土壤细菌之间发生对生态位和养分的竞争,导致根表土壤细菌群落的丰富度和多样性指数下降,群落组成结构发生变化[30]。另一方面,微生物菌肥处理下,刺激了植物根系分泌活动,受根系分泌物调节,根表土壤细菌群落比根际土壤细菌群落的变化更大。研究表明,在植物-微生物相互作用过程中,根表土壤微生物与植物的相互作用要比根际土壤微生物与植物的相互作用更强烈,相比根际土壤微生物,宿主植物对根表土壤微生物的选择压力更强[31-33]。本研究中沼泽红假单胞菌和枯草芽孢杆菌单施和混施不同程度地增加了根表土壤细菌优势菌Novosphingobium、Flavobacterium和Rhizobium的相对丰度,而减少了Anaeromyxobacter、Bradyrhizobium、Pleomorphomonas、Nocardioides、Propionicimonas和Methanobacterium的相对丰度。相关研究发现接种沼泽红假单胞菌Rhodopseudomonas palustris增加了土壤中Chloroflexia和Bacilli等微生物占比,而减少了一些具有光合能力的细菌,如Cyanobacteria、Rhodobacter、Sphingomonadales和Burkholderiales的相对丰度,沼泽红假单胞菌可能和这些光合细菌存在竞争[34]。Gadhave等[35]研究表明接种的芽孢杆菌Bacillusspp.本身不能作为内生菌繁殖,但会对根系内生菌群落的组成结构造成影响,Lysobacter和Acidovorax的相对丰度减少而Acinetobacter相对丰度增加,这些变化也可能与不同微生物之间对养分和生态位的竞争或相互之间的拮抗作用有关。
微生物菌肥对作物生长的影响不仅通过其代谢活动直接产生,还可能通过影响土壤微生物群落组成及其功能而间接产生。本研究基于16S rDNA高通量测序的OTU丰度特征预测土壤细菌功能结果表明,沼泽红假单胞菌与枯草芽孢杆菌的单施和混施虽然减少了水稻根表土壤细菌群落的多样性,但均富集了根表土壤中优势菌变形菌门的丰度,改变了优势菌属组成比例,显著提高了根表土壤细菌群落涉及新陈代谢、遗传信息处理、环境信息处理、细胞过程等功能的基因丰度,且根际土壤细菌和根表土壤细菌的功能基因丰度均与水稻结实率显著正相关,说明施用微生物菌肥可能通过影响根域土壤微生物组成及其功能而促进作物增产增效。两种功能菌的单施和混施均增加了根表土壤细菌中优势菌黄杆菌属Flavobacterium的相对丰度,且混施处理下增幅更大,而Flavobacterium的相对丰度则与水稻产量呈正相关关系。黄杆菌Flavobacterium是土壤中常见的植物促生菌之一,具有一定的溶磷能力,能够产生生长素[36],功能菌肥的施用可能通过提高土壤中这些植物益生菌的占比来促进作物生长。相关研究发现,施用假单胞菌提高了根际相关微生物的代谢活性,刺激了黄酮类和酚类物质的分泌和积累,从而调节了土壤微生物和植物的相互作用,促进了作物生长[37]。Li等[38]通过田间试验证明,接种固氮菌Paenibacillustriticisoli BJ-18增加了土壤微生物群落中固氮菌和植物促生菌(芽孢杆菌属Bacillus,克雷伯氏菌属Klebsiella和柄孢壳属Podospora)的相对丰度,降低了致病菌(链格孢属Alternaria)的相对丰度,提高了固氮酶基因丰度,微生物菌肥通过优化土壤和植物微生物的组成和功能促进了作物生长,提高了作物生产力。
4 结论
施用沼泽红假单胞菌和枯草芽孢杆菌可提高水稻产量和结实率,且两种功能菌混施比单施的增产效果更好。菌肥施用对根际土壤细菌群落多样性及潜在功能都没有显著影响,但显著改变了根表土壤细菌群落多样性,提高了优势菌变形菌门的相对丰度,改变了根表土壤细菌群落组成和结构,增加了根表土壤细菌的功能丰度。混施对土壤细菌群落的影响与单施枯草芽孢杆菌相似,而与单施沼泽红假单胞菌的影响有一定差异。水稻结实率与根际和根表土壤细菌涉及新陈代谢、遗传信息处理、环境信息处理、细胞过程等功能基因丰度均显著正相关。微生物菌肥对水稻生长的促进作用不仅通过其代谢活动直接产生,还可能通过影响根域微生物,尤其是根表土壤细菌的多样性及其功能而间接产生。
