丛枝菌根真菌提高植物非生物胁迫耐受性研究进展
2022-02-20李晓芸伊力塔李彦刘美华
李晓芸,伊力塔,李彦,刘美华,2
(1.浙江农林大学 林业与生物技术学院,浙江 杭州 311300;2.宁海县浙工大科学技术研究院,浙江 宁海 315600)
逆境胁迫会对植物的生长发育造成有害的影响,非生物胁迫主要是指盐、重金属污染、干旱、极端温度等对植物生长发育产生有害影响的环境胁迫。研究植物对非生物胁迫的响应机制,并用于指导农林业生产、提高植物生产力是当前热点研究领域之一。丛枝菌根真菌(Arbuscular mycorrhizal fungi,AMF或AM真菌),能与地球上近80%陆生植物的根系形成互惠共生体[1]。AM真菌通过与宿主根系形成菌丝网络,扩大宿主植物根系对水分、营养物质以及其他矿物质元素的吸收面积[2-3],是植物抗逆的重要手段之一。近年来,越来越多的研究探索了AM真菌与宿主植物的共生机制。研究发现,AM真菌能通过与宿主植物交换碳源,促进宿主植物对氮(N)和磷(P)的吸收,增加植物叶绿素、可溶性糖、脯氨酸的含量,提高植株生产力和抵抗非生物胁迫的能力[2-9]。国内外学者在AM真菌提高植物非生物胁迫方面开展了大量的研究,近年来的相关研究类和综述类文献数量不断增加,但对于最新研究文献的总结归类仍需不断完善[4-9]。鉴于AM真菌的重要性及其在农林业的应用前景,本文从共生机理的国内外最新研究入手,分类阐述在盐、重金属、干旱和极端温度等非生物胁迫条件下AM真菌如何提高宿主植物的耐受性,探讨不同胁迫下AM真菌与宿主植物的共生机制,为逆境胁迫下提高植物生产力提供理论参考。
1 AM 真菌与宿主植物的共生机制
AM真菌作为一种古老的土壤真菌,与植物根系的共生关系可以追溯到约4亿年前[10-11]。菌根共生是一系列复杂的生物过程,真菌通过发达的根外菌丝形成菌丝网络,增加根系与土壤的接触面积,通过介导植物和真菌的养分运输调节植物的生长发育,对自然生态系统和农业作物生产均具有有益影响[2]。在热带森林中,某些根外菌丝(Extraradical mycelium,ERM)的长度可达植物自身根长的13倍,吸收范围超过自身根系的700倍[3,12]。AM真菌菌丝穿过根系皮层进入细胞内形成丛枝和泡囊,部分形成丛枝结构。庞大的菌丝网络能够扩大植物对土壤中N、P等无机养分的吸收,提高宿主植物的水分利用效率,增强植物对非生物胁迫的耐受性,保护宿主免受病原体侵害[13]。同时,AM真菌缺少棕榈酸合成基因,需要宿主植物合成脂肪酸并作为主要碳源直接传递给菌根真菌[14],获取宿主植物固定的近20%含碳化合物[15](图1)。Tedersoo[16]等认为真菌与宿主之间的“C-P营养交易”中,菌丝体能把来源于宿主植物的碳源以糖、氨基酸、多元醇的形式运输到土壤中,维持真菌根际微生物群落的生存繁殖。目前,国内外关于AM真菌促进植物营养元素吸收方面已经开展了大量的研究,为探究AM真菌与宿主植物的共生机制、提高植物非生物胁迫的耐受力提供了重要的理论支撑[17-25]。
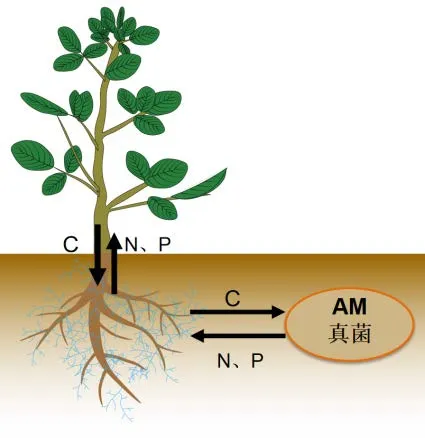
图1 AM真菌与宿主植物共生养分交换机制Figure 1 Mechanism of symbiotic nutrient exchange between AM fungi and host plants
1.1 AM真菌促进宿主植物P吸收
P元素是植物生长必需的元素之一,也是植物细胞核酸、磷脂及ATP的重要组成部分;P元素参与植物光合和呼吸作用,在细胞分裂、基因表达调控、物质循环、能量流动和信息传递的过程中同样发挥重要作用[18-19]。土壤中的P元素易被固定,导致P元素利用的空间有效性降低[12]。AM真菌定植宿主后改变土壤根际微环境,这种改变促进了有机P和难溶解P元素的解离,将无效P转化为有效P,有利于根系直接吸收和菌根间接吸收土壤中的P元素。AM真菌还可以编码高亲和力的P转运蛋白,使宿主植物通过发达的菌丝吸收土壤中的P元素[12,20-21]。此外,菌根无隔膜结构也有利于P元素的吸收[22-24],促进宿主植物生长发育。研究表明,接种AM真菌能提高甜叶菊Stevia rebaudiana[25]、玉蜀黍Zea mays[26]、榉树Zelkova serrata[27]、澳洲坚果Macadamia integrifolia[28]和紫苜蓿Medicago sativa[29]等植物根系对P元素的吸收,真菌菌丝可能促进了土壤酸性磷酸酶的分泌,促使土壤中的P素分解,有利于植物对P元素的吸收利用[12,30]。AM促进植物吸收P元素是宿主植物获得营养元素最大的驱动力,这种互惠关系是二者良好共生的坚实基础[31]。
1.2 AM真菌促进宿主植物N吸收
N元素是植物生长的关键营养物质,是细胞的核心组分DNA、RNA和蛋白质的重要组成部分。近年的研究结果发现,AM真菌能够促进宿主吸收铵态N、硝态N、氨基酸等简单形态的N[32-33]。土壤中含有较多的有机N,必须经分解者分解后才能被植物利用。研究表明,AM真菌可以从分解的有机物质中获得大量的N元素。但AM真菌的相关酶基因表达缺陷,不能直接单独降解土壤有机质(Soil organic matter,SOM)中的矿质养分[34],必须通过菌丝分泌物刺激土壤中微生物群落的生长,依赖微生物之间的共同作用释放有机质中的养分[12]。研究表明,AM真菌菌丝具有吸收、转移N元素至宿主植物或附近植物的能力,N分解吸收速率的增加是AM真菌菌丝扩张的直接结果[35]。Hodge等用15N同位素标记发现,接种菌根真菌的宿主植物N元素的吸收量大约是空白对照的3倍,接种后真菌菌丝而非宿主植物先生长到富含有机质斑块区域,并在斑块中旺盛繁殖,约31%的真菌15N来自有机质斑块,仅小部分被传递至宿主植物[36-37]。AM真菌能与大多数植物根系土壤共生,具有较高的N需求,能够降低土壤温室气体N2O的释放,对全球土壤N循环也具有重要意义[38]。
2 AM 真菌在植物抵抗非生物胁迫中的作用
非生物胁迫(Abiotic stress)是指干旱、盐碱、极端温度、极端pH、重金属污染等不良环境对植物的生长、生物量积累和适应性产生的不利影响,也是全球农林作物生产力下降的主要原因[39]。其中,高盐胁迫是世界上最严重的非生物胁迫之一,损害了全球20%以上的作物,预计在2050年会上升至50%左右,可导致农林产品生产力损失高达70%[40]。非生物胁迫对植物产生严重的负面影响,深入探究如何增强植物对非生物胁迫耐受性迫在眉睫。AM真菌作为一种环境友好型真菌,不仅能提高植物生产力,其推广与使用也是全球气候不断变化情况下提高植物生产力的一种可持续发展策略。近年的研究结果表明,AM真菌能够改善土壤环境,帮助植物缓解非生物胁迫,促进植物生长[41]。因此,AM真菌可作为农业领域非常重要的一种生物肥料菌剂,用于改善植物的生长发育。在盐、重金属、干旱和极端温度等非生物胁迫条件下,研究接种AM真菌的宿主植物在生长形态、营养吸收、生理生化效应、渗透性等多方面产生的变化,探究AM真菌增强宿主植物非生物胁迫耐受性的方式具有重要的意义。
2.1 AM真菌提高宿主植物的盐胁迫耐受性
盐碱化是影响植物生长的主要非生物胁迫之一,威胁了世界上近8.31亿hm2的农业用地[42]。中国的盐渍化土地面积约有3 460万hm2,主要分布在北方干旱、半干旱地区及长江流域[43]。近年来,由于人为的不合理灌溉导致土壤盐渍化情况日益严重[44]。在盐胁迫下,植物的渗透调节作用、细胞膜系统、光合作用及抗氧化酶体系等会受到相应损伤,植物净同化率与营养生长降低,植物生长受限[45]。AM真菌植物调节土壤水分是宿主植物抵抗土壤盐渍化的主要策略之一,可以通过外源菌丝体扩大宿主的水分吸收面积,提高盐渍化土壤中植物对水分和营养的吸收能力。研究表明,盐胁迫下接种AM真菌能提高金叶女贞Ligustrum×vicaryi、柑橘Citrus tangerine等植物对土壤中P、K、Ca、Mg、Zn等元素的吸收,增加可溶性蛋白质含量,降低根组织中的Na+、Cl-的积累量,有利于维持植物体内的离子平衡,减轻盐胁迫产生的毒害作用[43,46]。
AM真菌对宿主植物叶片和根系的水孔蛋白基因表达均具有调节作用,使根系水分调节相关的基因LeAQP2过量表达,促进接种植株根系吸收更多的水分[47-48]。当植物细胞水分充裕时,保卫细胞膨胀打开,对CO2的吸收速率加快,这有利于提高植株光合作用积累有机物,缓解盐胁迫对植物的影响[49]。此外,盐胁迫会促进植物活性氧(Relative oxygen species,ROS)的产生,造成植物氧化损伤,干扰植物的正常代谢活动[50]。AM真菌通过诱导植物产生并积累脯氨酸、甜菜碱、可溶性糖等渗透调节物质,提高宿主的抗氧化能力,降低H2O2含量,抑制脂质过氧化,提高宿主抗氧化能力,增强植物的盐胁迫耐受性[49-51]。在稻Oryza sativa[52]、羊草Leymus chinensi[53]、黄瓜Cucumis sativus[17]等植物的研究中均得到类似结果(表1)。目前,在盐胁迫下接种AM真菌的宿主植物主要是农林作物、模式植物等,对滨海耐盐碱植物的研究较少,可加强对这类植物的研究。
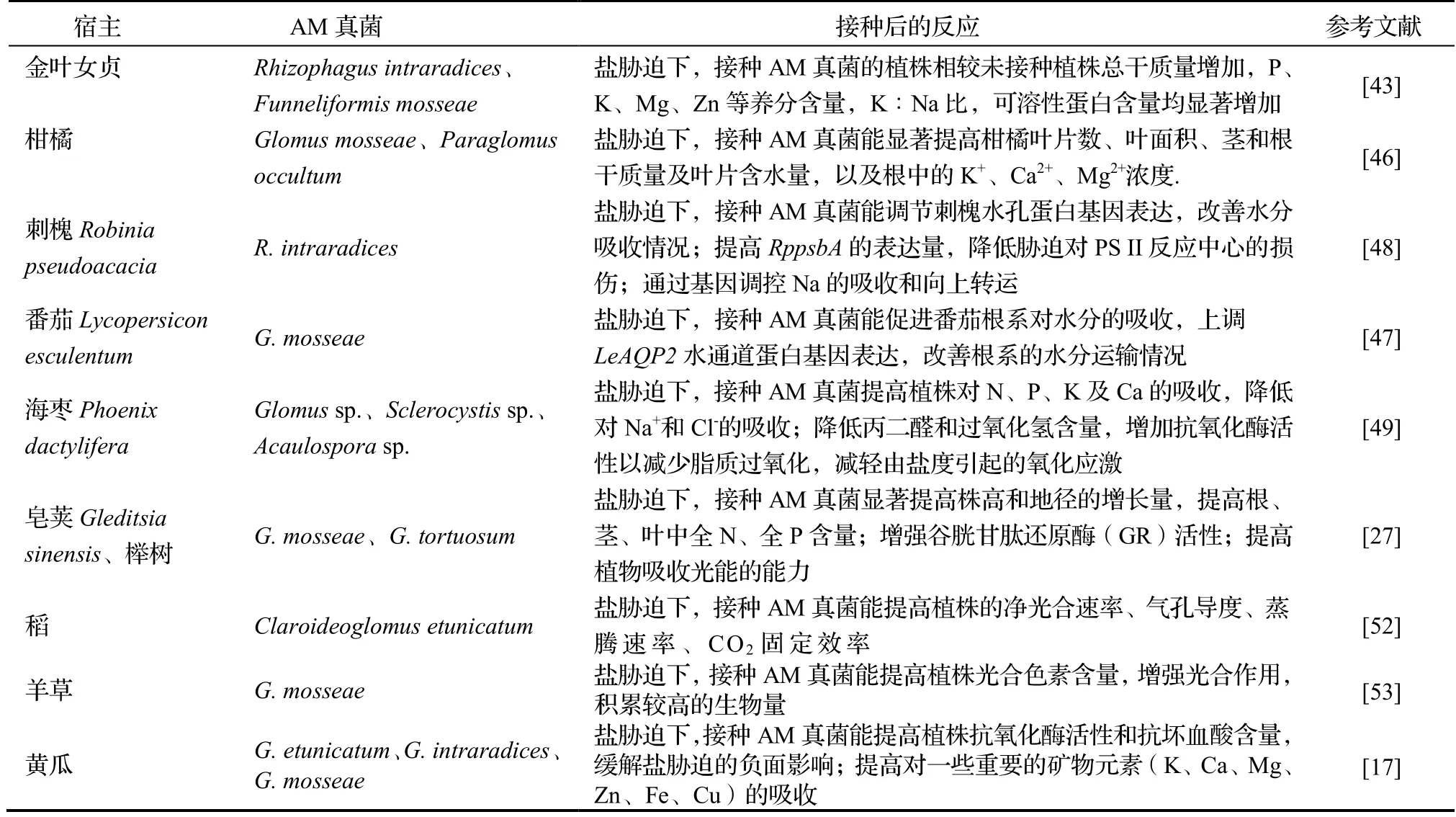
表1 AM真菌提高宿主植物盐胁迫耐受性研究结果Table 1 Improvement of tolerance of host plants to salt stress by AM fungi
2.2 AM真菌提高宿主植物的重金属胁迫耐受性
土壤是重金属(Cr、Cd、Pb、Hg、Cu、As等)汇集的主要场所。城市化、工业化、采矿业、肥料、农药过量使用等人为活动加剧了重金属在土壤中的扩散蔓延,重金属污染成为一个全球性环境问题[54]。针对中国70%以上土壤调查表明,16.1%的土壤中重金属含量超过生态环境部规定的质量标准,高达82.4%的农业土壤受不同程度的重金属污染[55]。重金属在生物体内不能被降解吸收,经食物链富集进入人体后严重影响人类健康。在重金属污染环境中,植物细胞代谢产生大量活性氧,导致DNA损伤和脂质过氧化,线粒体、叶绿体中的电子传递链受到破坏,影响细胞的正常代谢[56]。重金属离子积累会导致植物地上部分和地下部分脱落酸含量增加,气孔关闭,气体交换受限,植物蒸腾速率降低[57]。高浓度重金属甚至通过与光合色素相关酶的官能团结合扰乱植物光合作用,破坏植物正常的生理生化特征,影响植物的形态[58]。因此,重金属离子对植物的毒害问题亟待解决。
菌根共生可增强宿主植物的逆境胁迫耐受性,提高植物修复重金属损伤的效率。AM真菌的丛枝、泡囊和发达的菌丝网络等结构可以缓解重金属导致的植物养分缺失、光合速率降低等问题[59-61]。一般来说,植物主要通过土壤沉淀、吸附在根表面或积累在根内等方法吸收、固定重金属离子[62]。AM真菌采取了与宿主相似的策略固定重金属离子,真菌分泌的螯合剂对重金属有固定作用,利用土壤中的磷酸盐将重金属沉淀在土壤中,真菌菌丝不断向宿主细胞的皮层渗透,菌丝通过与金属结合降低其损伤。共生菌根较大的表面积对菌丝与重金属的结合体具有较强的截留作用,菌丝细胞壁中的果胶成分对重金属离子具有吸附滞留作用,阻止真菌质膜吸收。囊泡与细胞中的液泡作用类似,可通过区室化储存重金属螯合物,限制重金属离子向地上部分的运输,对植物组织中的重金属离子起到稀释的作用,缓解重金属对宿主植物地上部分的毒害[62-63]。Bago等[64]认为,AM真菌还能介导一系列复杂的信号传递,使宿主植物在重金属胁迫中更好地生存下去。研究表明,AM真菌对重金属的修复作用还体现在能够诱导宿主植物产生抗氧化酶,上调相关过氧化酶基因表达,降低重金属胁迫下活性氧对植株的危害作用[65]。Zhang等[61]发现,在Pb胁迫条件下,接种AM真菌能减轻Pb对蒺藜苜蓿Medicago truncatula光合作用的危害,促进蔗糖从地上部分向根部运输裂解,增加微量氨基酸的积累,降低Pb胁迫带来的危害。接种AM真菌也能显著提高美洲黑杨Populus deltoides对Pb和Cd的富集系数,削弱其向地上部分迁移的能力[66]。在稻[67]、女贞Ligustrun lucidum[22]、普通小麦Triticum aestivum[68]等植物中也得到了类似结果(表2)。

表2 AM真菌提高宿主植物重金属胁迫耐受性研究结果Table 2 Improvement of tolerance of host plants to heavy metal stress by AM fungi
2.3 AM真菌提高宿主植物的干旱胁迫耐受性
水分是制约干旱和半干旱地区植物生长的主要因素。全球变暖、低降雨量以及高温导致植物蒸腾速率增加,植物根系对土壤水分吸收增加,进一步加剧了土壤的干旱程度,引起植物氧化应激反应,给植物生长带来不良影响[72]。
研究表明,AM真菌能够提高宿主对水分亏缺的耐受性。AM真菌通过菌丝网络提高宿主植物的抗旱能力。菌丝直径为2~ 7 μm时,能够穿透土壤中有机物的颗粒间隙[73],延伸至根系无法到达的地方,从养分耗竭之外的区域广泛吸收水分和养分。AM真菌广泛的菌丝网络与土壤颗粒缠结,与植物根系协作生成长链多糖和蛋白质等胞外化合物影响土壤聚集的物理过程,形成土壤团聚体改善土壤结构,提高宿主根系吸收水分的效率[74-75]。球囊霉素(Glomalin)是AM真菌大量产生的一种糖蛋白,其在土壤中的浓度与土壤团聚体的水稳定性呈正相关,能将水分固定在土壤聚集体中,便于宿主植物吸收水分[76]。另外,与非菌根共生植物相比,AM真菌定植宿主后,宿主植物的叶片水势、相对含水量(RWC)、气孔导度、CO2的同化速度等均有所改善。Zarik等[77]研究表明,AM真菌能够提高大西洋柏木Cupressus atlantica的水分胁迫耐受性,对幼苗地上部高度、生物量和生长率都产生了积极影响。AM真菌提高植株抗旱性与植物体内的抗氧化水平有关,AM真菌共生能增强植株的SOD、POD、愈创木酚等抗氧化酶的活性,抵抗干旱诱导的氧化应激,帮助植物缓解干旱胁迫产生的不利影响[78]。与干旱胁迫下的非真菌化的植物相比,菌根植物中脯氨酸、多胺和可溶性糖等渗透调节物质的生物合成增加,有助于降低渗透势,维持细胞的整体生理活动,促进光合作用[79]。也有观点认为,仅代谢物的积累不能满足干旱胁迫下对渗透的调节,渗透调节物质可能具有替代活性氧清除剂的作用[80]。接种AM真菌后的玉蜀黍[81]、青冈Cyclobalanopsis glauca[82]、任豆Zenia insigni[79]、大豆Glycine max[83]等对干旱胁迫的适应性均得到了提高(表3)。
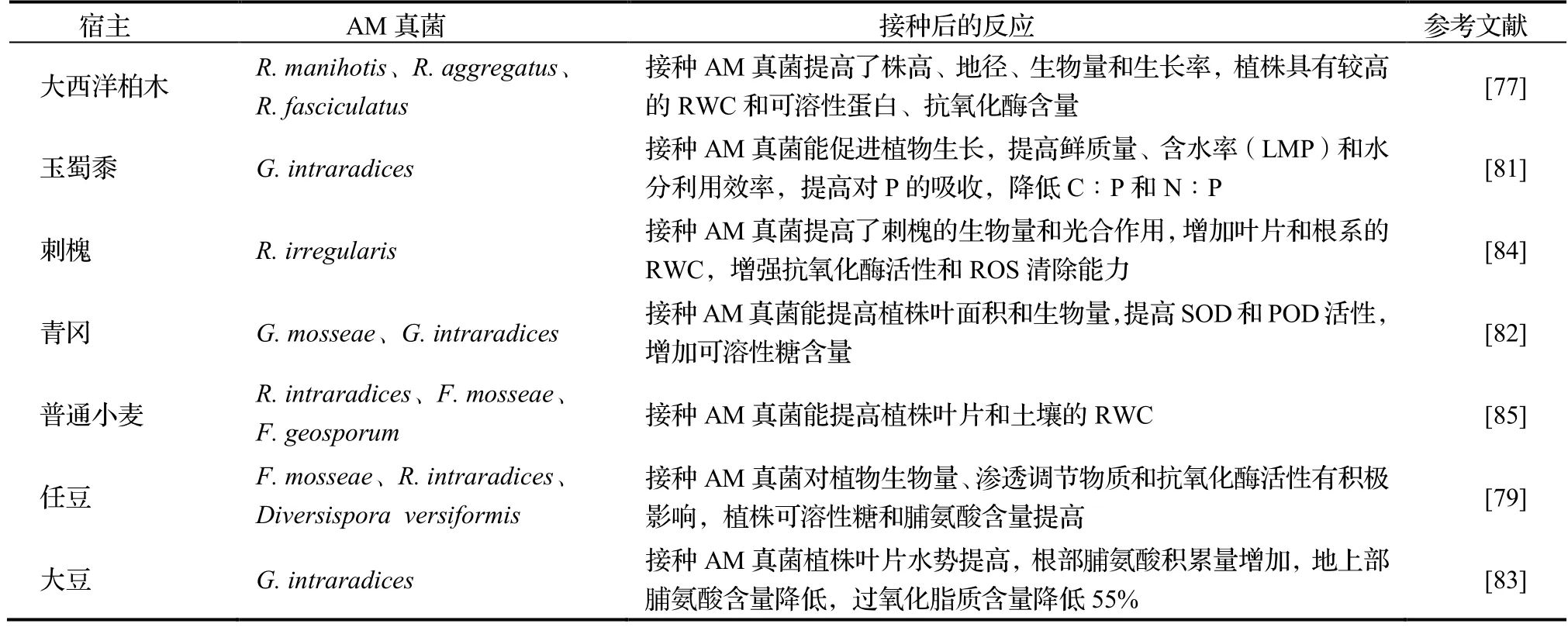
表3 AM真菌提高宿主植物干旱胁迫耐受性研究结果Table 3 Improvement of tolerance of host plants to drought stress by AM fungi
2.4 AM真菌提高宿主植物的温度胁迫耐受性
温度是决定全球植物生产力的重要环境因素之一。植物体内大部分生理生化过程都直接或间接受到温度的制约。随着全球变暖,极端温度愈加频繁。植物受到高温或低温胁迫后,会导致细胞膜结构损伤、电解质和氨基酸渗漏、膜脂质过氧化、蛋白质变性和聚集、细胞内钙离子重新分布、叶绿体中酶失活、有毒化合物及ROS的产生等问题[86]。
在高温胁迫下,接种AM真菌能增加番茄叶和根的数量,提高冠幅、叶面积、叶片相对含水量,缓解高温胁迫产生的不利影响[87-88]。在低温胁迫下,接种AM真菌能提高玉蜀黍植株的净光合速率、蒸腾速率和气孔导度,增加地下部分的比例,通过改善水分状况和光合能力使宿主植物免受温度胁迫的影响[89-90]。研究表明,在低温和高温条件下,接种AM真菌植物具有更高的叶绿素和类胡萝卜素浓度,从而增强光合作用[89]。根系水分吸收和传导受水孔蛋白控制,正常温度和低温胁迫下AM真菌不仅调节自身的水孔通道蛋白活性向宿主转运更多的水分,而且还通过调节植物水通道蛋白基因表达改善宿主的水分转运[91]。在低温胁迫下,接种AM真菌还可以降低宿主植物的膜电解质通透性[90];减轻脂膜过氧化,维持膜的流动性。此外,植物受到低温或者高温胁迫时,也会诱发过量ROS产生,引起氧化应激反应损伤植物,通常AM真菌定植宿主植物后能有效促进SOD、过氧化氢酶(CAT)、POD和GR等产生,缓解活性氧带来的危害,并通过降低膜脂过氧化和膜通透性,增加渗透调节物质的积累,减轻温度胁迫产生的不利影响[92-93](表4)。

表4 AM真菌提高宿主植物温度胁迫耐受性研究结果Table 4 Improvement of tolerance of host plants to temperature stress by AM fungi
3 结论与展望
AM真菌与植物根系共生,形成广泛的菌丝网络,宿主将光合作用固定的碳源输送给真菌,同时,菌根共生促进了植物对N、P等营养元素及其他元素的吸收。在盐、重金属、干旱、极端温度等非生物胁迫中,接种AM真菌的宿主植物光合作用增强、营养元素吸收量增加、水分利用率提高,缓解了植物受到的不利影响[98-99]。
然而,对AM真菌的研究还存在许多不足之处,需要在后续研究中继续加强。AM真菌种类及数量丰富,形态结构不一;对某种特定真菌的研究,需要对真菌进行纯化培养;现阶段对菌种使用主要集中在实验研究领域,使用量较小,仍需要努力探索这一“天然肥料”的大规模纯化培养技术并加以推广。不同宿主植物的共生菌种不同,因此,真菌的筛选与鉴定也是AM真菌研究过程中需要深入研究的课题。对于菌根共生机制还需深入探究,特别是AM真菌对植物在抗逆过程中代谢产物、转录因子、相关蛋白及通路、基因表达变化等的影响[100]。国内外关于AM真菌提高植物非生物胁迫耐受性的研究已经取得重大成果,但目前研究主要针对少数几种AM真菌,不同的AM真菌具有不同的作用机制,因此,还不能完全阐述其作用机制。此外,自然界中的真菌类群不是单一存在,各种群之间的关联尚不明确,需进一步进行研究。需要从土壤-AM真菌-植物这一整体出发,系统地研究菌根共生体,深入探究共生体的作用机理,为农林业系统的可持续发展提供理论依据。综上所述,需在各个层面深入研究AM真菌,以进一步研究其作为生物肥料的可能性,推动农林业的可持续发展。
