土壤盐胁迫对日本荚蒾生理生化特性的影响
2022-02-20徐千瑞周星怡李贺鹏岳春雷
徐千瑞,周星怡,李贺鹏,岳春雷
(1.浙江农林大学 林业与生物技术学院,浙江 杭州 318020;2.南京农业大学 生命科学学院,江苏 南京 210095;3.浙江省林业科学研究院,浙江 杭州 310023)
盐胁迫指植物的生长环境中存在过量钠离子和氯离子[1],影响植物的生长及分布[2]。全世界受盐胁迫影响的土壤非常多,已有超过20%的农林耕地受到盐分的危害,并且数量仍在不断增加[3],预计到21世纪中叶,将有半数耕地出现土壤盐渍化现象[4],这会对土地利用、植株生存及作物生产造成严重威胁[5]。土壤盐渍化以及盐渍化土地资源该如何利用,成为了一个世界性难题[6]。首先,土壤盐胁迫会通过渗透胁迫提高植物细胞的渗透势,使植物体无法正常吸收水分,这种危害会长期存在;其次,由离子胁迫造成的离子失调使植物缺少生长发育所必需的营养元素;最后,产生氧化胁迫,即加深膜脂过氧化程度,破坏细胞结构以及紊乱代谢[7-10]。为了抵抗土壤盐胁迫造成的伤害,植物自身会表现出一系列的生理及生态适应性变化,以调节叶片内离子和水分的平衡,维持正常的生理活动[2]。因此,研究植物在盐胁迫环境中生理生化指标的变化,对于了解植物的耐盐机理,评价植物的耐盐性以及筛选耐盐植物进行盐渍化土地造林具有重要意义。
日本荚蒾Viburnum japonicum为常绿乔灌木,主要分布在环太平洋西部海岛,在我国仅生长于台湾省的北部海岸、浙江省台州市以及舟山市的部分海岛,分布范围狭窄,数量稀少,需要重点保护[11-14]。日本荚蒾叶片革质深绿,白花簇状,熟果鲜红,观赏性好,园林价值高[15]。近年来,对日本荚蒾的研究主要集中在抗旱性[16]、耐荫性[17]、扦插繁殖[18]、遗传多样性[19]等方面。李瑞姣等[20]发现日本荚蒾幼苗对轻中度干旱胁迫具有一定的抵抗能力,并且在遮阴条件下能正常生长,具有耐荫性;王宝党等[18]认为混合基质更适宜日本荚蒾插穗生根。与其它植物相比,对日本荚蒾的研究进展较为缓慢[21],且目前并没有关于此濒危海岛植物耐盐性的相关研究。本试验选用3年生日本荚蒾实生苗,研究日本荚蒾生理生化指标对土壤盐胁迫的响应,分析该植物的耐盐机理,探讨其对土壤盐胁迫的抵抗能力,有利于更加充分地了解日本荚蒾的濒危原因,同时为该植物的种群恢复、迁地引种以及推广应用提供科学依据。
1 材料与方法
1.1 试验材料
试验选用浙江省临海市林业技术推广总站提供的日本荚蒾3年生实生苗,苗高约为50 cm,冠幅约为40 cm。植株生长旺盛、长势基本一致。试验所用苗木的栽培方法为盆栽法,选择下口直径为16 cm、上口直径为21.3 cm、高为20 cm的塑料盆钵,每盆内装入挖取于苗圃的混匀熟土(有机质含量为27.43 g·kg-1,有效氮含量为0.175 g·kg-1,有效磷含量为70.50 g·kg-1,速效钾含量为20.57 g·kg-1)5 kg,每盆栽入1株日本荚蒾幼苗。
1.2 试验设计
2020年6月,将日本荚蒾容器苗移入浙江省林业科学研究院大棚内缓苗,期间进行正常养护。日本荚蒾适应生长1个月后,挑选长势基本一致的植株进行土壤盐胁迫处理。为防止盐分渗漏,每盆植物的下方垫有托盘。试验共设置6个土壤盐分梯度,于2020年7月13日一次性浇入不同浓度的NaCl溶液,使土壤含盐量分别为0(CK)、0.15%、0.30%、0.45%、0.60%、0.75%。每个处理重复4株容器苗。植株经过土壤盐胁迫处理之后,于2020年7月23日、8月2日、8月12日及8月22日分别进行一次采样及各项指标的测定。
1.3 测定指标与方法
1.3.1 生理生化指标的测定 每个处理随机选择3株日本荚蒾容器苗,每株选取正常枝条的中上部成熟叶片2~3片,将采得的叶片立即编号并用液氮进行冷冻处理,带回实验室后保存于-80℃的冰箱中备用。
丙二醛(MDA)含量测定采用硫代巴比妥酸(TBA)法;可溶性蛋白含量测定采用考马斯亮蓝染色法;可溶性糖含量测定采用蒽酮比色法;超氧化物歧化酶(SOD)活性测定采用氮蓝四唑(NBT)法;过氧化物酶(POD)活性测定采用愈创木酚法。
1.3.2 数据分析 采用SPSS 23.0软件对试验数据进行统计分析,运用LSD法进行显著性分析和多重比较,使用Origin 2018绘制图形。
2 结果与分析
2.1 土壤盐胁迫对日本荚蒾叶片MDA含量的影响
由图1可知,在土壤盐胁迫下,日本荚蒾叶片的MDA含量均高于CK的,且在胁迫的同一阶段,叶片的MDA含量随着土壤含盐量的升高持续上升。盐胁迫初期(10 d),在0.60%和0.75%土壤含盐量环境中的植株叶片的MDA含量显著高于前4组处理的(P<0.05);盐胁迫20 d时,0.30%和0.45%土壤含盐量处理组植株叶片的MDA含量显著增加(P<0.05),与同浓度盐胁迫10 d时相比分别增加了54.8%和41.2%,0.60%和0.75%土壤含盐量处理组的植株死亡;盐胁迫30 d后,0.30%和0.45%土壤含盐量处理组植株叶片的MDA含量继续增大,较同浓度盐胁迫20 d时分别增加了31.3%与45.4%;盐胁迫40 d时,0.15%土壤含盐量处理组植株叶片的MDA含量增量较大,与CK产生显著性差异(P<0.05),而0.30%和0.45%土壤含盐量处理组的植株死亡。
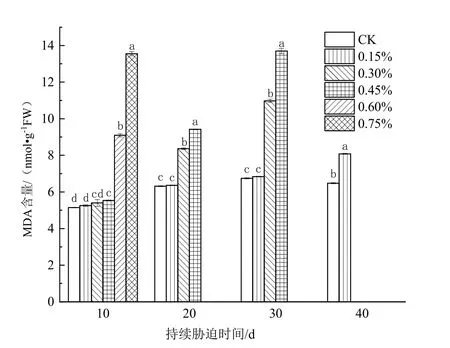
图1 不同浓度土壤盐分处理下日本荚蒾叶片MDA含量的变化Figure 1 MDA content in leaves of V.japonicum under different salt treatments
2.2 土壤盐胁迫对日本荚蒾叶片渗透调节物质含量的影响
由图2可知,在土壤盐胁迫处理下,各处理组日本荚蒾叶片的可溶性蛋白含量均高于CK的,且在胁迫的同一阶段,植物叶片细胞内的可溶性蛋白含量与土壤含盐量成正比。0.15%土壤含盐量处理组植株叶片的可溶性蛋白含量从盐胁迫30 d开始与CK产生较大差异(P<0.05),而其他处理组植株叶片的可溶性蛋白含量在盐胁迫初期(10 d)就显著高于CK的(P<0.05)。

图2 不同浓度土壤盐分处理下日本荚蒾叶片可溶性蛋白含量的变化Figure 2 Soluble protein content in leaves of V.japonicum under different salt treatments
由图3可知,日本荚蒾叶片可溶性糖含量的变化情况与可溶性蛋白含量的变化类似,随着土壤含盐量的升高持续上升,但在盐胁迫10 d时,0.30%土壤含盐量处理组植株叶片的可溶性糖含量略低于0.15%土壤含盐量处理组的。
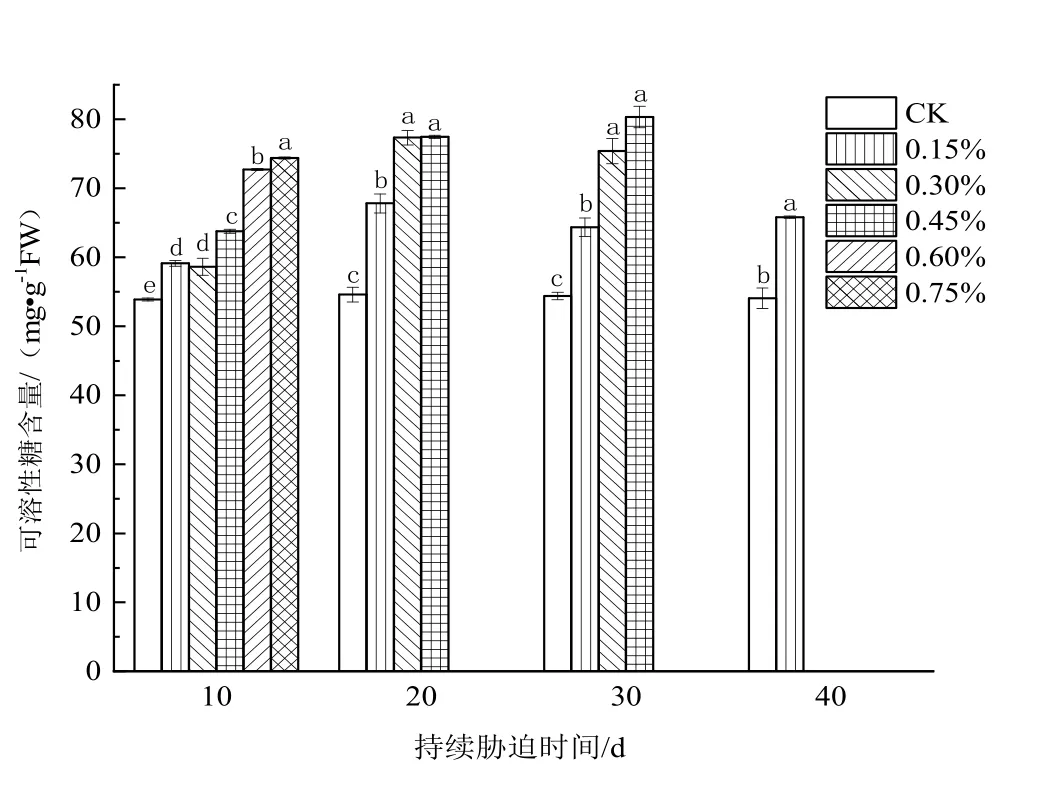
图3 不同浓度土壤盐分处理下日本荚蒾叶片可溶性糖含量的变化Figure 3 Soluble sugar content in leaves of V.japonicum under different salt treatments
2.3 土壤盐胁迫对日本荚蒾叶片抗氧化酶活性的影响
SOD和POD是植物叶片细胞内重要的抗氧化酶,可反映出植物对胁迫环境的响应。由图4可以得知,在盐胁迫的10 d和20 d时,日本荚蒾叶片的SOD活性与土壤含盐量及胁迫持续时间成正比;在盐胁迫30 d时,0.30%和0.45%土壤含盐量处理组植株叶片的SOD活性较盐胁迫20 d时下降,其中,0.45%土壤含盐量处理组植株叶片的SOD活性降至CK之下,比CK的低7.9%;盐胁迫40 d时,0.15%土壤含盐量处理组植株叶片的SOD活性大幅上升,与CK差异显著(P<0.05)。

图4 不同浓度土壤盐分处理下日本荚蒾叶片SOD活性的变化Figure 4 SOD activity in leaves of V.japonicum under different salt treatments
由图5可知,盐胁迫10 d时,除0.60%及0.75%土壤含盐量处理组外,植株叶片的POD活性随土壤含盐量的升高而上升,而0.60%及0.75%土壤含盐量处理组植株叶片的POD活性均低于CK的,且两组中土壤含盐量越高的处理组植株叶片的POD活性越低;盐胁迫持续20 d时,0.15%及0.30%土壤含盐量处理组植株叶片的POD活性继续上升,0.30%土壤含盐量处理组植株叶片的POD活性达到了最大值,而0.45%土壤含盐量处理组植株叶片的POD活性较盐胁迫10 d时下降,0.60%及0.75%土壤含盐量处理组植株死亡;盐胁迫30 d时,0.15%土壤含盐量处理组植株叶片的POD活性达到了最大值,0.30%及0.45%土壤含盐量处理组植株叶片的POD活性较盐胁迫20 d时下降,0.45%土壤含盐量处理组植株叶片的POD活性降至CK之下;当盐胁迫持续40 d时,0.15%土壤含盐量处理组植株叶片的POD活性下降,但仍高于CK的,其余处理组植株死亡。
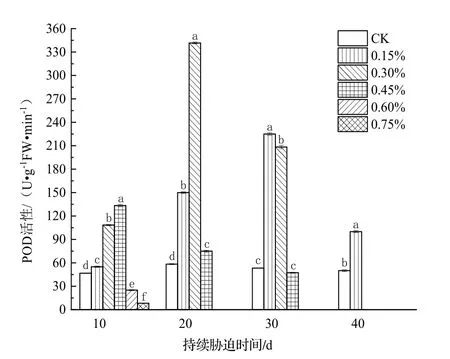
图5 不同浓度土壤盐分处理下日本荚蒾叶片POD活性的变化Figure 5 POD activity in leaves of V.japonicum under different salt treatments
综上所述,随着土壤盐胁迫的持续进行,日本荚蒾叶片的SOD活性在轻度胁迫(0.15%土壤含盐量)下持续上升,在中度胁迫(0.30%土壤含盐量)下先上升后下降;0.45%土壤含盐量处理组植株叶片的POD活性持续下降,CK、0.15%及0.30%土壤含盐量处理组植株叶片的POD活性呈先上升后下降的趋势。
2.4 土壤盐胁迫下日本荚蒾叶片各生理指标相关性分析
由表1可以得知,日本荚蒾在土壤盐胁迫下,叶片中的MDA含量与可溶性蛋白及可溶性糖含量具有极显著正相关关系(P<0.01),与POD活性具有负相关关系,但相关性不显著。可溶性蛋白含量与可溶性糖含量呈极显著正相关(P<0.01),与POD活性呈负相关,但相关性不显著。

表1 盐胁迫下日本荚蒾叶片各生理生化指标的相关系数Table 1 Correlation coefficients of physiological and biochemical index in V.japonicum leaves under salt stress
3 讨论与结论
3.1 讨论
土壤盐胁迫会对植物造成许多不利影响,使植物的生长状况、形态特征、生理指标等发生较大变化[22]。在本试验中,没有盐胁迫的日本荚蒾植株生长旺盛,长势较好,0.15%土壤含盐量处理组的植株在胁迫期间几乎没有盐害症状,而在0.30%及以上土壤含盐量环境中,随着胁迫时间的增加植株陆续死亡。以上结果说明日本荚蒾植株在0.15%及以下含盐量土壤环境中能够正常生长,而在0.30%及以上含盐量土壤环境中无法长期存活。
植物在胁迫环境中由于膜脂过氧化作用产生MDA,MDA的形成代表着植物细胞膜遭到了破坏[23]。研究表明,植物叶片中MDA含量的变化规律与该植物的耐盐能力有关:在土壤盐胁迫过程中,植物叶片细胞内的MDA含量越高,说明该植物抵抗盐胁迫的能力越弱[24]。本试验中,在不同程度的土壤盐胁迫下,各处理组日本荚蒾叶片的MDA含量均高于CK的。盐胁迫10 d时,0.15%~ 0.45%土壤含盐量环境中植株叶片的MDA含量虽高于CK的但二者间的差距不显著(P>0.05),可以认为试验初期该盐胁迫浓度范围中日本荚蒾叶片的细胞膜几乎没有遭到破坏,而0.60%及0.75%土壤含盐量处理组植株叶片的MDA含量明显高于CK的,说明这两组处理的植株叶片在试验初期膜脂过氧化程度就很高,细胞膜遭到了严重破坏;0.30%及0.45%土壤含盐量处理组在盐胁迫10 d以后植株叶片的MDA含量持续大幅度上升,说明这两组植株在土壤盐胁迫的过程中细胞膜的破坏程度不断加深,直至死亡;0.15%土壤含盐量处理组植株叶片的MDA含量与CK在盐胁迫40 d之前均无显著性差异(P>0.05),直至盐胁迫40 d时大幅增加,出现胁迫症状。而佘建炜等[25]在研究沼泽小叶桦Betula microphyllavar.paludosa时发现,该植物在土壤盐胁迫处理下叶片的MDA含量总体上低于CK的,这与本试验结果有差异。王斌等[26]发现,沼泽小叶桦的野生种主要生长于盐碱沼泽地中,耐盐能力较强,而日本荚蒾在0.30%及以上土壤含盐量环境中胁迫反应明显,这进一步体现出日本荚蒾的耐盐性不强。
土壤盐胁迫会提高植物的渗透势,植物通过合成渗透调节物质使植物能够从外界汲取水分[27]。在土壤盐胁迫环境中,可溶性蛋白和可溶性糖作为渗透调节物质会提高植物的耐盐能力[28],同时,可促进植物体内有机物的合成,增强细胞膜的稳定性,也可对酶类产生保护作用[29]。在本试验中,植株叶片的可溶性糖及可溶性蛋白含量与MDA含量均具有极显著正相关性(P<0.01)。随着土壤盐浓度的升高和胁迫的持续进行,植株叶片的MDA含量攀升,细胞膜遭到严重破坏。为了提高植物叶片的渗透调节能力以降低胁迫对细胞膜的破坏程度,日本荚蒾细胞中的可溶性蛋白含量及可溶性糖含量随着MDA含量的升高不断上升,这说明日本荚蒾通过提高体内渗透调节物质的含量降低细胞的渗透势,缓解细胞膜的膜脂过氧化程度,进而减轻土壤盐胁迫对植物造成的危害。本试验对日本荚蒾渗透调节物质的研究结果与盐胁迫下白刺Nitraria tangutorum[30]的研究结果一致,可溶性蛋白与可溶性糖的含量都与土壤含盐量成正比,说明植物在受到盐胁迫时会通过合成渗透调节物质降低胁迫对自身造成的伤害。
在受到土壤盐胁迫时,植物会通过提高细胞内抗氧化酶活性清除多余活性氧,减少活性氧积累对植物造成的伤害[24]。SOD和POD可通过协同作用降低细胞内的活性氧数量。SOD将活性氧转化为O2和H2O2,POD清除由SOD产生的H2O2[31]。在正常环境中,植物体内的活性氧数量会保持相对平衡,而当植物处于胁迫环境中其活性氧的清除数量要低于所产生数量,随着活性氧积累数量的增加会促使植物启动自我保护机制,即通过提高抗氧化酶活性清除体内多余的活性氧[32]。在本试验中,随着土壤盐胁迫的持续进行,日本荚蒾叶片的SOD活性与POD活性总体上呈现出先上升后下降的趋势,但不同浓度盐分处理下的植株抗氧化酶活性的变化情况存在较大差异。本研究中,日本荚蒾在受到土壤盐胁迫处理后,0.15%土壤含盐量处理组植株叶片的SOD活性持续上升,POD活性上升至盐胁迫40 d时开始下降,体现出日本荚蒾在土壤含盐量为0.15%的胁迫环境中,会通过提高抗氧化酶活性抵抗由胁迫造成的伤害,说明日本荚蒾在轻度土壤盐胁迫(0.15%及以下土壤含盐量)中耐盐性较高。彭立新等[33]发现,在盐胁迫环境中沙枣Elaeagnus angustifolia幼苗的抗氧化酶活性先上升后下降,由此提出了植物细胞只能承受一定范围内的活性氧积累,一旦超出这个范围会造成膜脂过氧化程度加深,细胞结构被破坏,进而降低植物耐盐能力的结论。在本试验中,随着胁迫的持续进行,0.30%土壤含盐量处理组植株叶片的SOD、POD活性及0.45%土壤含盐量处理组植株叶片的SOD活性也表现出先上升后下降的趋势,说明随着胁迫的持续进行,日本荚蒾在中度土壤盐胁迫中受到的盐害会不断增强。0.60%及0.75%土壤含盐量处理组植株叶片的SOD活性高于CK的,而POD活性显著低于CK的,说明在重度土壤盐胁迫下植物体内SOD的作用高于POD的,但细胞内部积累的活性氧数量超出了细胞可承受范围,多余活性氧破坏了抗氧化酶系统,导致植物对重度土壤盐胁迫的抵抗能力弱。
3.2 结论
综上所述,日本荚蒾耐盐性弱,在0.15%及以下土壤含盐量环境中,会通过提高渗透调节物质含量及抗氧化酶活性降低细胞渗透势,抵抗膜脂过氧化作用,维持植物生理活动的正常进行。但当土壤含盐量达到0.30%及以上时,日本荚蒾的生理调节系统遭到破坏,活性氧不断积累,膜脂过氧化程度持续加深,最终导致植株死亡。因此,在日本荚蒾的迁地保护和栽培过程中应选择土壤含盐量低的立地以保证植物正常生长。日本荚蒾喜温和多雨的海洋性气候,自然分布仅限于海岛[21],而海岛土壤盐渍程度相对较高[34],因此,推测日本荚蒾耐盐性低是致使该种群扩散困难的原因之一。
