土壤真菌Aspergillus fumigatus固体发酵产物的化学成分及抗氧化活性研究
2022-02-19赵江源范箫艺邹雪峰杨佩文唐蜀昆李铭刚刘世巍丁建海
赵江源,范箫艺,邹雪峰,杨佩文,唐蜀昆,李铭刚*,刘世巍,丁建海*
1云南大学生命科学学院,昆明650091;2宁夏师范学院化学化工学院,固原756000;3云南农业大学植物保护学院,昆明650201;4云南省农业科学院农业环境资源研究所,昆明 650205
近年来,土壤真菌多样性的研究受到了广泛关注,土壤中含有丰富的微生物资源,是地球上最复杂的微生态系统之一[1]。由于真菌和土壤、植物的根系联系紧密,共同参与营养物质的吸收、保存和循环,具有独特的代谢途径,因此产生结构新颖、生物活性显著的代谢产物。土壤真菌烟曲霉(Aspergillusfumigatus)化学成分及活性已有报道,Mohamed等[2]从土壤真菌Aspergillusfumigatus3T-EGY次生代谢产物中分离鉴定得到8个化合物,其中化合物juglanthraquinone A-5-O-D-rhodosamine (4′→1′′) -2-deoxy-D-glucose (4′′→1′′′) -cinerulose B 对金黄色葡萄球菌、铜绿假单胞菌和白色念珠菌具有中等体外抗菌活性。Liu等[3]从沿海盐渍土壤真菌烟曲霉中分离出一种新的倍半萜类衍生物,命名为aspergiketone,该化合物对HL-60和A549具有细胞毒性,IC50值分别为12.4和22.1 μM。Liang等[4]发现土壤真菌烟曲霉是个高活性铁载体菌株,该菌株无抑制植物病原菌活性,但其发酵提取物可明显促进土壤生物活性。本研究前期对来源于哀牢山国家级自然保护区河谷的土壤真菌烟曲霉进行固体发酵培养,发现其粗体物对DPPH(IC50= 3.3 mg/mL)、ABTS+(IC50= 0.094 mg/mL)、OH自由基(IC50= 1.8 mg/mL)具有清除效果,因此本研究对土壤真菌的乙酸乙酯层的发酵提取物进行化学成分研究和抗氧化活性测试,为后续该菌种的活性成分的开发与利用奠定基础。
1 材料与方法
1.1 仪器与材料
Bruker DRX-500 MHz核磁共振仪测定(TMS为内标,Bruker公司);AutoSpec Premier P776三扇型双聚焦磁质谱仪(美国Waters公司);ZF-20D暗箱式紫外分析仪(上海光豪分析仪器有限公司);柱层析硅胶和GF254TLC预制板(青岛海洋化工厂);Sephadex LH-20(瑞典 Amersham Biosciences公司);反相硅胶(德国Merck公司);DPPH(C11753365)、ABTS(C12193480)、抗坏血酸(C12455241)、过硫酸钾(C11974937)、硫酸亚铁(C12175404)、水杨酸(C12173991)、磷酸氢二钠(C12113745)和磷酸二氢钠(C10095240)(分析纯,麦克林生化试剂有限公司)。
1.2 菌株来源
菌株来源于云南省哀牢山国家级自然保护区河谷土壤样本,并通过DNA提取、ITS序列扩增以及序列比对,供试菌种被鉴定为Aspergillusfumigatus[4]。
1.3 菌株培养基及发酵条件
1.3.1 培养基
菌株斜面培养基(PDA):马铃薯200 g(煮20 min后过滤);葡萄糖20 g;琼脂20 g;pH自然;蒸馏水1 000 mL。121 ℃灭菌15 min后,摆斜面备用。
液体种子培养基:硝酸钠3 g,磷酸氢二钾1 g,硫酸镁0.5 g,氯化钾0.5 g,蔗糖30 g,蒸馏水1 000 mL。500 mL三角瓶分装(100 mL/500 mL),121 ℃灭菌15 min后备用。
固体发酵培养基:10 g珍珠岩,30 g大米(提前用液体种子培养液浸泡20 min),50 mL液体种子培养液。混匀后分装到罐头瓶中(瓶口用12层纱布包口)。121 ℃灭菌15 min后备用。
1.3.2 培养条件
斜面培养:将菌株转移到斜面培养基上,30 ℃,7天进行培养。待有明显孢子生成即可用于液体种子培养。
液体种子培养:将1支斜面孢子转接到1瓶液体培养三角瓶内。将三角瓶置于恒温摇床上,120 rpm,30 ℃培养5天。待有明显颗粒状菌丝球出现即可用于固体发酵接种。
固体发酵:将液体种子接入固体培养基内(1瓶液体种子可以接种5瓶固体培养基。接种量为20 mL液体种子/固体培养瓶)。搅拌均匀后,置于30 ℃恒温恒湿培养箱内培养20天。待培养基被孢子完全覆盖,培养基颜色及质地发生明显变化后即可停止发酵。
1.4 提取与分离
发酵物用二氯甲烷和甲醇等体积混合作为提取溶剂,连续提取5次,减压浓缩,得到提取物浸膏,将提取物浸膏与水混悬后,用乙酸乙酯萃取5次,萃取液合并减压浓缩得浸膏50.0 g。浸膏用80~100目的硅胶拌样,经正相硅胶柱层析(二氯甲烷/甲醇,1∶0→0∶1)梯度洗脱得到7个极性依次增大的片段。由二氯甲烷/甲醇(80∶1)洗脱得到片段3,在80∶1段析出白色粉末,通过Sephadex LH-20凝胶色谱柱(二氯甲烷/甲醇,1∶1)纯化,得到化合物1、2的混合物,继续正相硅胶柱层析纯化得到化合物1(15 mg)、2(2 mg)。由二氯甲烷/甲醇(60∶1)洗脱得到片段4,在该段析出白色晶体,通过Sephadex LH-20凝胶色谱柱纯化,得到化合物3(7.4 mg)。由二氯甲烷/甲醇(40∶1)洗脱得到片段5,通过Sephadex LH-20凝胶色谱柱分离纯化,得到化合物4(20.7 mg)。由二氯甲烷/甲醇(20∶1)洗脱得到片段6,通过Sephadex LH-20凝胶色谱柱和反相硅胶柱层析(甲醇/水 3∶2)分离纯化,得到化合物的5(10.7 mg)。由二氯甲烷/甲醇(20∶1)洗脱得到片段6,通过Sephadex LH-20凝胶色谱柱分离纯化,得到化合物6、7(共4.5 mg)的混合物,继续正相硅胶柱层析纯化得到化合物6(3 mg)。在片段4通过Sephadex LH-20凝胶色谱柱纯化得到化合物8(1.8 mg)、11(3.5 mg)、12(2.9 mg)、13(2.3 mg)。由二氯甲烷/甲醇(80∶1)洗脱得到片段3,在80∶1段析出白色粉末,得到化合物通过Sephadex LH-20凝胶色谱柱,在经过反相硅胶柱层析(甲醇/水,7∶3)分离纯化,得到化合物9(2.3 mg)、10(2.3 mg)。
1.5 DPPH自由基清除实验
将化合物分别配置成一定浓度梯度的乙醇溶液,作为实验组,同时配制一定浓度的抗坏血酸作为阳性对照组。将不同浓度的样品溶液和DPPH(0.5 mmol/L)同体积混合,避光保存30 min,在517 nm最大吸收波长下测定其吸光度(A1);同时测定不加DPPH的样品空白吸光度(A2)和加DPPH不加样品的吸光度(A0),实验重复3次,阳性对照与待测样品一致,根据公式计算DPPH自由基清除率。
DPPH自由基清除率=[1-(A1-A2)/A0]×100%
1.6 ABTS+自由基清除实验
将化合物分别配置成一定浓度梯度的乙醇溶液,作为实验组,同时配制一定浓度的抗坏血酸作为阳性对照组。将过硫酸钾(2.6 mmol/L)和ABTS(7.4 mmol/L)混合反应12 h,用无水乙醇稀释30倍,在734 nm波长下测定吸光度。将不同浓度的样品溶液和ABTS溶液按照体积比1∶10混合,避光保存6 min,在734 nm最大吸收波长下测定其吸光度(A1);同时测定不加ABTS的样品空白吸光度(A2)和加ABTS不加样品的吸光度(A0),实验重复3次,阳性对照与待测样品一致,根据公式计算ABTS+自由基清除率。
ABTS+自由基清除率=[1-(A1-A2)/A0]×100%
1.7 OH自由基清除实验
将化合物分别配置成一定浓度梯度的乙醇溶液,作为实验组,同时配制一定浓度的抗坏血酸作为阳性对照组。首先加入样品,依次加入硫酸亚铁(5 mmol/L)、水杨酸(2.5 mmol/L)各1 mL,最后加入过氧化氢(1%)1 mL启动反应,40 ℃水浴30 min,在510 nm最大吸收波长下测定其吸光度(A1);同时测定不加过氧化氢的样品空白吸光度(A2)和不加样品的吸光度(A0),实验重复3次,阳性对照与待测样品一致,根据公式计算OH自由基清除率。
OH自由基清除率=[1-(A1-A2)/A0]×100%
2 实验结果与讨论
2.1 化合物结构鉴定
化合物1白色粉末;分子式:C16H14O5;HR-ESI-MS:m/z287.092 6[M+H]+;1H NMR(500 MHz,CDCl3)δ:14.96(1H,s,5-OH),6.97(1H,s,H-10),6.58(1H,d,J= 2.2 Hz,H-9),6.39(1H,d,J= 2.2 Hz,H-7),6.00(1H,s,H-3),4.00(3H,s,6-OCH3),3.92(3H,s,8-OCH3),2.36(3H,s,2-CH3);13C NMR(125 MHz,CDCl3)δ:167.4(C-2),107.2(C-3),184.2(C-4),153.4(C-5),160.7(C-6),97.2(C-7),161.4(C-8),97.7(C-9),101.1(C-10),110.1(C-11),108.3(C-12),141.1(C-13),162.7(C-14),20.7(C-15),55.5(6-OCH3),56.1(8-OCH3)。以上数据与文献[5]报道基本一致,故鉴定化合物1为rubrofusarin B。
化合物2白色粉末;分子式:C15H12O5;1H NMR(500 MHz,CDCl3)δ:14.96(1H,s,5-OH),12.79(1H,s,6-OH),6.96(1H,s,H-10),6.60(1H,d,J= 2.2 Hz,H-9),6.40(1H,d,J= 2.2 Hz,H-7),5.98(1H,s,H-3),3.96(3H,s,8-OCH3),2.49(3H,s,2-CH3)。以上数据与文献[5]报道基本一致,故鉴定化合物2为rubrofusarin A。
化合物3针状晶体;分子式:C13H11NO3;HR-ESI-MS:m/z229.096 6[M]+;1H NMR(500 MHz,CD3OD)δ:8.40(1H,s,H-2),7.24(1H,d,J= 7.0 Hz,H-9),7.32(1H,t,J= 7.1 Hz,H-11),7.23(1H,d,J= 7.0 Hz,H-13),7.30(1H,d,J= 7.0 Hz,H-11),7.33(1H,t,J= 7.0 Hz,H-12),6.32(1H,s,H-5),3.94(2H,s,H-6);13C NMR(125 MHz,CD3OD)δ:178.4(C-4),168.7(C-6),168.7(C-14),164.7(C-2),137.4(C-8),130.5(C-9),130.5(C-10),128.3(C-11),130.5(C-12),130.5(C-13),118.3(C-5),119.5(C-3),39.6(C-7)。以上数据与文献[6]报道基本一致,故鉴定化合物3为carbonarone A。
化合物4针状晶体;分子式:C13H12N2O2;HR-ESI-MS:m/z229.097 3[M+H]+;1H NMR(500 MHz,DMSO-d6)δ:12.14(1H,br s,1-NH),9.51(1H,br s,14-NH2),8.31(1H,s,H-2),7.33(1H,s,H-10),7.33(1H,s,H-12),7.29(1H,s,H-9),7.29(1H,s,H-13),7.28(1H,s,H-11),6.21(1H,s,H-5),3.89(2H,s,H-7);13C NMR(125 MHz,DMSO-d6)δ:141.9(C-2),117.4(C-3),177.3(C-4),118.3(C-5),150.8(C-6),37.6(C-7),137.1(C-8),128.7(C-9),128.9(C-10),126.9(C-11),128.9(C-12),128.7(C-13),165.5(C-14)。以上数据与文献[7]报道基本一致,故鉴定化合物4为aspernigrin A。
化合物5针状晶体;分子式:C16H14O5;HR-ESI-MS:m/z287.090 7[M+H]+;1H NMR(500 MHz,CDCl3)δ:12.78(1H,s,5-OH),6.87(1H,s,H-6),6.59(1H,d,J= 2.2 Hz,H-7),6.40(1H,d,J= 2.2 Hz,H-9),6.28(1H,s,H-3),3.97(3H,s,10-OCH3),3.92(3H,s,8-OCH3),2.50(3H,s,2-CH3);13C NMR(125 MHz,CDCl3)δ:166.5(C-2),110.3(C-3),182.8(C-4),156.8(C-5),105.8(C-6),97.9(C-7),161.4(C-8),96.9(C-9),159.1(C-10),155.7(C-11),104.9(C-12),141.1(C-13),108.7(C-14),20.5(C-2),55.4(10-OCH3),55.9(8-OCH3)。以上数据与文献[8]报道基本一致,故鉴定化合物5为flavasperone。
化合物6白色粉末;分子式:C28H44O3;1H NMR(500 MHz,CD3OD)δ:6.54(1H,d,J= 8.5 Hz,H-7),6.27(1H,d,J= 8.5 Hz,H-6),5.30(1H,dd,J= 15.3,7.5 Hz,H-23),5.15(1H,dd,J= 15.3,7.5 Hz,H-22),3.78(1H,m,H-3),1.03(3H,d,J= 6.6 Hz,H-21),0.95(3H,d,J= 6.3 Hz,H-28),0.92(3H,s,H-19),0.87(3H,d,J= 6.5 Hz,H-27),0.85(3H,s,H-18),0.82(3H,d,J= 6.5 Hz,H-26);13C NMR(125 MHz,CD3OD)δ:137.0(C-6),133.7(C-22),132.0(C-23),131.9(C-7),83.7(C-5),80.9(C-8),67.2(C-3),57.8(C-17),53.3(C-14),53.0(C-9),44.5(C-13),41.3(C-24),40.9(C-20),40.6(C-12),38.0(C-10),36.1(C-4),34.6(C-1),32.9(C-25),30.0(C-2),29.4(C-16),24.6(C-15),20.7(C-11),20.3(C-21),19.5(C-27),18.8(C-26),18.2(C-19),16.10(C-28),13.2(C-18)。以上数据与文献[9]报道基本一致,故鉴定化合物6为(22E,24R)-5α,8α-过氧麦角甾-6,22-二烯-3β-醇。
化合物7白色晶体;分子式:C28H42O3;1H NMR(500 MHz,CD3OD)δ:6.66(1H,d,J= 7.3 Hz,H-7),6.31(1H,d,J= 8.4 Hz,H-6),5.49(1H,dd,J= 7.0,1.5 Hz,H-11),5.43(1H,dd,J=6.0,1.9 Hz,H-23),5.24(1H,m,H-22),3.94(1H,m,H-3),1.07(3H,s,H-19),1.02(3H,d,J= 6.6 Hz,H-21),0.91(3H,d,J= 6.8 Hz,H-28),0.86(3H,d,J= 3.5 Hz,H-27),0.84(3H,d,J= 3.5 Hz,H-26),0.82(3H,s,H-18)。以上数据与文献[9]报道基本一致,故鉴定化合物7为(22E,24R)-5α,8α-过氧麦角甾-6,9(11),22-三烯-3β-醇。
化合物8黄色粉末;分子式:C32H26O10;HR-ESI-MS:m/z571.160 7[M+H]+;1H NMR(500 MHz,CDCl3)δ:15.25(1H,s,5′-OH),14.84(1H,s,5-OH),7.15(1H,s,H-10),6.97(1H,s,H-9),6.41(1H,d,J= 2.2 Hz,H-7′),6.20(1H,d,J= 2.2 Hz,H-9′),6.05(1H,s,H-3),5.95(1H,s,H-3′),4.02(3H,s,6′-OCH3),3.79(3H,s,8-OCH3),3.60(3H,s,8′-OCH3),3.46(3H,s,6-OCH3),2.41(3H,s,2-CH3),2.12(3H,s,2′-CH3);13C NMR(125 MHz,CDCl3)δ:167.6(C-2),20.8(2-CH3),107.4(C-3),184.5(C-4),104.6(C-4a),161.9(C-5),111.4(C-5a),158.4(C-6),61.9(6-OCH3),117.6(C-7),160.1(C-8),55.8(8-OCH3),101.3(C-9),140.8(C-9a),101.2(C-10),153.3(C-10a),167.5(C-2′),20.6(2′-CH3),107.2(C-3′),184.6(C-4′),104.2(C-4a′),162.6(5′-OH),108.5(C-5′a),160.9(C-6′),56.2(6′-OCH3),96.8(C-7′),161.4(C-8′),55.1(8′-OCH3),96.4(C-9′),140.5(C-9′a),105.1(C-10′),150.7(C-10′a)。以上数据与文献[5]报道基本一致,故鉴定化合物8为ourosperone A。
化合物9白色粉末;分子式:C28H44O;HR-ESI-MS:m/z395.329 5[M-H]-;1H NMR(500 MHz,CDCl3)δ:5.57(1H,m,H-6),5.34(1H,m,H-7),5.14-5.24(2H,m,H-22,H-23),3.64(1H,m,H-3),1.03(3H,d,J= 6.7 Hz,H-21),0.94(3H,s,H-19),0.91(3H,d,J= 6.8 Hz,H-28),0.83(3H,d,J= 7.2 Hz,H-27),0.82(3H,d,J= 7.2 Hz,H-26),0.63(3H,s,H-18);13C NMR(125 MHz,CDCl3)δ:38.4(C-1),32.0(C-2),70.5(C-3),40.8(C-4),139.9(C-5),119.6(C-6),116.3(C-7),141.4(C-8),46.2(C-9),37.3(C-10),21.1(C-11),39.1(C-12),42.8(C-13),54.6(C-14),23.0(C-15),28.3(C-16),56.0(C-17),12.0(C-18),16.3(C-19),40.4(C-20),21.1(C-21),135.6(C-22),132.0(C-23),42.8(C-24),33.1(C-25),19.9(C-26),19.7(C-27),17.6(C-28)。以上数据与文献[9]报道基本一致,故鉴定化合物9为(22E,24R)-麦角甾-5,7,22-三烯-3β-醇。
化合物10白色粉末;分子式:C29H48O;1H NMR(500 MHz,CDCl3)δ:5.35(1H,d,J= 5.1 Hz,H-6),5.14(1H,d,J= 7.7 Hz,H-1),5.02(1H,dd,J= 8.6,8.6 Hz,H-2),3.53(1H,m,H-3),1.00(3H,brs,H-19),0.97(3H,d,J= 6.8 Hz,H-21),0.84(3H,d,J= 7.0 Hz,H-26),0.82(3H,d,J= 5.3 Hz,H-27),0.68(3H,br s,H-18);13C NMR(125 MHz,CDCl3)δ:139.7(C-1),129.5(C-2),71.8(C-3),42.4(C-4),140.8(C-5),121.7(C-6),29.8(C-7),31.7(C-8),50.1(C-9),36.2(C-10),21.1(C-11),37.2(C-12),39.8(C-13),56.8(C-14),24.3(C-15),28.3(C-16),56.1(C-17),11.9(C-18),19.4(C-19),34.0(C-20),18.8(C-21),31.9(C-22),26.1(C-23),45.9(C-24),29.2(C-25),19.0(C-26),19.8(C-27),23.1(C-28),12.0(C-29)。以上数据与文献[10]报道基本一致,故鉴定化合物10为stigmast-1,5-dien-3β-ol。
化合物11黄色粉末;分子式:C32H26O10;1H NMR(500 MHz,CDCl3)δ:15.24(1H,s,-OH),12.82(1H,s,5-OH),7.05(1H,s,H-6),6.97(1H,s,H-7),6.42(1H,d,J= 2.2 Hz,H-7′),6.33(1H,s,H-3),6.19(1H,d,J= 2.2 Hz,H-9′),6.00(1H,s,H-3′),4.03(3H,s,6′-OCH3),3.78(3H,s,8-OCH3),3.61(3H,s,8′-OCH3),3.48(3H,s,10-OCH3),2.42(3H,s,2-CH3),2.12(3H,s,2′-CH3);13C NMR(125 MHz,CDCl3)δ:167.5(C-2),20.6(2-CH3),110.6(C-3),183.0(C-4),109.4(C-4a),156.7(C-5),106.1(C-6),140.8(C-6a),101.6(C-7),160.0(C-8),56.0(8-OCH3),117.3(C-9),156.9(C-10),61.3(10-OCH3),108.0(C-10a),155.1(C-10b),166.9(C-2′),20.7(2′-CH3),107.4(C-3′),184.6(C-4′),104.3(C-4a′),162.8(5′-OH),108.6(C-5′a),161.1(C-6′),56.3(6′-OCH3),161.1(C-6′),56.3(6′-OCH3),97.0(C-7′),161.1(C-8′),55.2(8′-OCH3),96.3(C-9′),140.6(C-9′a),105.0(C-10′),150.8(C-10′a)。以上数据与文献[11]报道基本一致,故鉴定化合物11为fonsecinones A。
化合物12黄色粉末;分子式:C32H26O10;1H NMR(500 MHz,CDCl3)δ:14.75(1H,s,5-OH),13.11(1H,s,5′-OH),7.13(1H,s,H-10),6.98(1H,s,H-9),6.42(1H,d,J= 2.2 Hz,H-9′),6.32(1H,s,H-3′),6.25(1H,d,J= 2.2 Hz,H-7′),6.03(1H,s,H-3),3.99(3H,s,10′-OCH3),3.81(3H,s,10-OCH3),3.63(3H,s,6-OCH3),3.61(3H,s,8′-OCH3),2.54(3H,s,2′-CH3),2.40(3H,s,2-CH3)。以上数据与文献[11]报道基本一致,故鉴定化合物12为asperpyrone C。
化合物13黄色粉末;分子式:C32H26O10;1H NMR(500 MHz,CDCl3)δ:13.18(1H,s,5-OH),12.80(1H,s,5′-OH),7.03(1H,s,H-10),6.98(1H,s,H-9),6.41(1H,d,J= 2.2 Hz,H-9′),6.33(1H,s,H-3′),6.31(1H,s,H-3),6.20(1H,d,J= 2.2 Hz,H-7′),4.00(3H,s,10′-OCH3),3.80(3H,s,10-OCH3),3.63(3H,s,6-OCH3),3.61(3H,s,8′-OCH3),2.54(3H,s,2′-CH3),2.47(3H,s,2-CH3)。以上数据与文献[8]报道基本一致,故鉴定化合物13为asperpyrones B。
2.2 抗氧化活性测试结果
土壤真菌Aspergillusfumigatus固体发酵产物分离得到化合物1~13,对其中10个化合物和阳性对照Vc进行了DPPH、ABTS+和OH自由基抗氧化活性测试。实验结果(见表1)显示,聚酮类化合物8对DPPH、ABTS+和OH自由基都有一定的清除自由基效果,而甾体化合物6、9和10对DPPH没有清除效果,但是对OH自由基有很强的清除自由基活性,优于阳性对照。
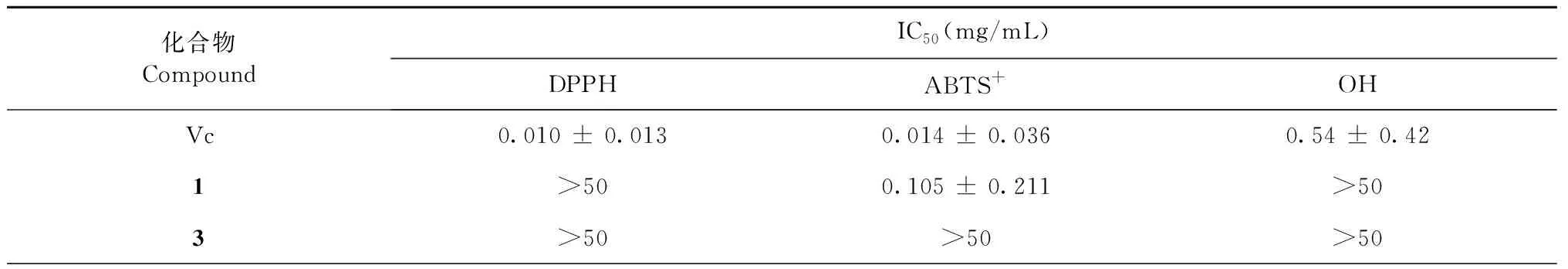
表1 化合物对DPPH、ABTS+、OH自由基的清除活性

续表1(Continued Tab.1)
3 结论
本论文通过对土壤真菌烟曲霉进行固体发酵培养,从该菌种中的乙酸乙酯层部位共分离鉴定了13个化合物,其中1、5、8、11、12和13均为聚酮类化合物,化合物6、7、9和10为甾体类,化合物3和4为其他类型。其中,除化合物6以外,其他化合物均从该菌种固体发酵物中首次分离。从该土壤真菌烟曲霉分离鉴定的化合物主要是聚酮和甾体,并对其进行抗氧化活性测试,聚酮类化合物8对DPPH、ABTS+和OH自由基都有一定的清除效果,化合物11和12对DPPH和ABTS+有清除效果,自由基清除活性表明,芳族羟基对清除自由基活性很重要,但是甾体类化合物6、9和10对DPPH没有的清除效果,只对OH自由基有较强的清除效果。前人的研究表明甾体类化合物对DPPH无清除效果,但是对OH自由基的效果较强,聚酮类化合物对DPPH具有较强活性,甾体化合物和聚酮化合物都是烟曲霉中主要抗氧化活性成分。聚酮类化合物具有一定的抗氧化作用,因为聚酮和黄酮的取代基类似,基于自由基理论,酚羟基有很强的还原性,聚酮类化合物也大多为多羟基结构,其抗氧化能力较强。本研究丰富了烟曲霉的化学成分,并为今后该菌种的固体发酵培养和开发利用提供了一定的参考价值。
