非霍奇金淋巴瘤患者程序性死亡受体1的表达情况及临床意义
2022-02-16肖建波史玉王亚秋李天一李海丽
肖建波 史玉 王亚秋 李天一 李海丽
非霍奇金淋巴瘤(NHL)是具备较强异质性的独立疾病的总称,是我国临床治疗中较为常见的肿瘤之一,通常临床上按照细胞来源分为B淋巴细胞、T淋巴细胞(简称 T细胞)及自然杀伤(NK)细胞3种类型,临床上较为常见的是B淋巴细胞型的NHL[1]。NHL患者的临床表现具有一定的相似性,这是由于其发病位置均为淋巴结[2-3]。但按照患者的病理类型、受侵犯的部位及受侵犯的范围差异,其临床表现存在差异性,其中局部表现主要是淋巴结肿大、淋巴结外器官受侵犯及鼻腔病变等,全身性表现则为发热、盗汗、体重减轻、皮肤病变或胃肠道病变等[4]。由于患者个体差异较大,在临床中需要具有针对性的进行治疗,临床上认为阻断程序性死亡受体1(PD-1)能够有效增强机体免疫能力,PD-1作为B7-CD28共刺激受体家族一员,其能够结合程序性死亡配体1和2(PD-L1和PD-L2),抑制T细胞活化,减少相应细胞因子的产生及T细胞的存活;同时,PD-1异常表达对于NHL的诊断也存在意义[5]。本研究对NHL患者的PD-1免疫组化特征进行研究,探究其临床价值。
对象与方法
1.对象:2018年4月~2020年4月我院收治的NHL患者84例,其中男49例,女35例,年龄15~65岁,平均年龄(47.22±3.55)岁。纳入标准:(1)经病理学检查确诊为NHL,符合NHL的形态学及免疫表型诊断标准;(2)未接受过化疗或放射性治疗,未服用过抗肿瘤药物;(3)病理资料及实验室检查相关资料完整。排除标准:(1)非首次确诊且此前已经接受过相关治疗;(2)跟踪研究过程中停止治疗。按照WHO的NHL病理类型及恶性病变程度[6],将84例患者分为高侵袭性肿瘤组(32例)、侵袭性肿瘤组(30例)及惰性肿瘤组(22例)。根据病理检测结果将84例患者分为非特殊型间变大细胞淋巴瘤组(18例)、T细胞淋巴瘤组(21例)、血管免疫母细胞淋巴瘤组(17例)、弥漫大B细胞淋巴瘤组(16例)、滤泡性淋巴瘤组(12例)。按Ann Arbor病理分期,84例患者中Ⅰ期23例,Ⅱ期21例,Ⅲ期19例,Ⅳ期21例。将所有患者病理组织切片的平均PD-1阳性表达细胞数作为临界值将84例患者分为高PD-1阳性表达组(38组)和低PD-1阳性表达组(46组)。本研究经我院伦理委员会审核通过,所有患者均签署知情同意书。
2.方法
(1)流式细胞术检测患者外周血PD-L1、CD4+T细胞、CD8+T细胞的表达水平:所有患者治疗前采集其空腹状态下的外周静脉血2 ml,使用同体积的磷酸盐缓冲液(PBS)稀释并清洗外周血单核细胞3次,去除上层清液后,采用流式细胞仪检测患者PD-L1、CD4+和CD8+T细胞表达水平,并计算CD4+/CD8+T细胞比值。
(2)免疫组化检测患者病理组织中PD-L1、PD-L2的表达:将所有患者病理组织切片进行常规脱蜡,经常规抗原修复、抗原暴露后以氧化氢处理,然后与1∶100比例稀释的抗PD-1单克隆抗体、1∶120比例稀释的PD-L1多克隆抗体及1:150比例稀释的抗PD-L2多克隆抗体共同孵育一夜。将PBS作为一抗空白对照,生物素化二抗以及HRP均孵育30 min后DAB显色3 min,之后根据显色情况进行苏木素复染,盐酸酒精分化处理后使用中性树胶封片。将5个光镜下视野区的PD-1阳性表达细胞平均数作为该患者阳性表达细胞数。以PD-L1、PD-L2阳性表达及细胞染色强弱情况共同确定标本是否PD-L1及PD-L2阳性表达(图1)。阳性细胞表达<10%记1分,阳性细胞表达为10%~50%记2分,阳性细胞表达>50%记3分;细胞染色强弱:无着色记0分,染色为淡黄色记1分,染色为棕黄色记2分,染色为褐黄色记3分。最后将两项评分相乘,数值≥3为阳性,<3则为阴性。
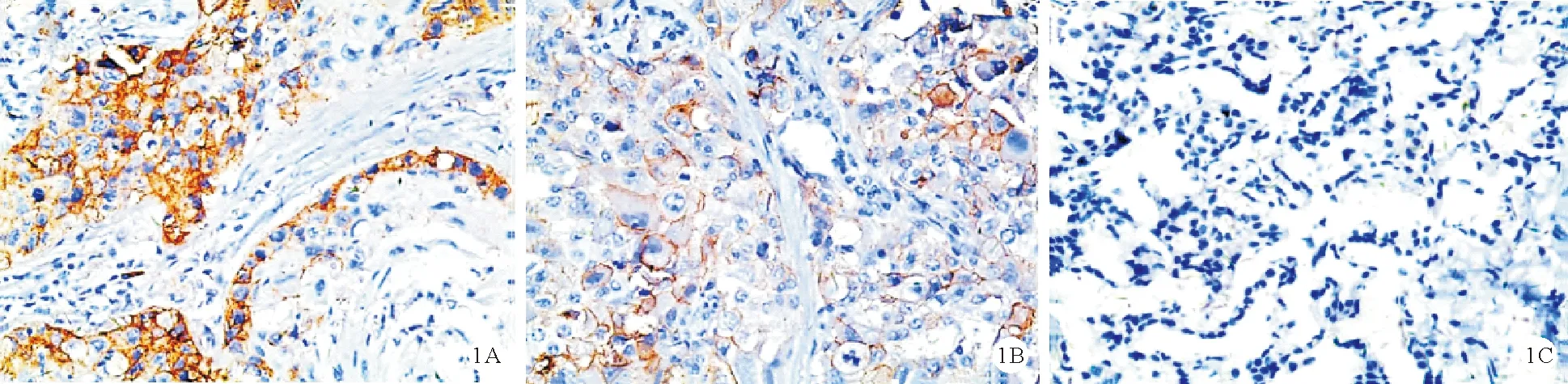
注:A:PD-1;B.PD-L1;C.PD-L2
结 果
1.不同病理类型组患者病理组织中PD-L1及PD-L2的阳性表达比较:高侵袭性肿瘤组PD-L1及PD-L2阳性表达率明显高于侵袭性肿瘤组及惰性肿瘤组,侵袭性肿瘤组PD-L1及PD-L2阳性表达率明显高于惰性肿瘤组(P<0.05)。见表1。

表1 不同病理类型患者病理组织中PD-L1及PD-L2的阳性表达比较[例,(%)]
2.不同类型肿瘤组患者外周血PD-L1表达水平比较:非特殊型间变大细胞淋巴瘤组患者外周血PD-L1水平为(378.22±72.56)pg/ml,T细胞淋巴瘤组患者外周血PD-L1水平为(151.26±29.64)pg/ml,血管免疫母细胞淋巴瘤组患者外周血PD-L1水平为(218.65±52.37)pg/ml,弥漫大B细胞淋巴瘤组患者外周血PD-L1水平为(465.37±169.87)pg/ml,滤泡性淋巴瘤组患者外周血PD-L1水平为(81.26±16.52)pg/ml。5组不同类型肿瘤患者外周血PD-L1水平比较差异有统计学意义(F=15.390,P<0.05)。其中非特殊型间变大细胞淋巴瘤组与弥漫大B细胞淋巴瘤组患者外周血PD-L1水平比较差异无统计学意义(t=0.353,P>0.05),其余类型肿瘤组患者外周血PD-L1水平均低于非特殊型间变大细胞淋巴瘤组(P<0.05)。
3.不同病理分期组患者PD-L1阳性表达比较:Ⅰ~Ⅱ期组(59.69%,26/44)与Ⅲ~Ⅳ期组(67.5%,27/40)患者PD-L1阳性表达率比较差异无统计学意义(χ2=1.522,P=0.217)。
4.高PD-1阳性表达组和低PD-1阳性表达组患者的免疫功能指标比较:高PD-1阳性表达组患者CD4+T细胞和CD4+/CD8+T细胞比值明显低于低PD-1阳性表达组(P<0.001)。见表2。
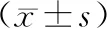
表2 高PD-1阳性表达组和低PD-1阳性表达组患者的免疫功能指标比较
讨 论
NHL属于人体全身都可能发病的临床疾病,对患者生活质量和生命健康安全造成了较为严重的影响,随着临床上对NHL研究的不断深入,相关药物的研发和治疗也越来越多,目前该病的主要治疗方式有全身化疗、局部放疗、生物免疫学、造血干细胞移植术等。此外,NHL虽然为全身性疾病,不同患者临床表现存在一定的共同点,但不同患者的病理类型、侵犯位置和范围还存在差异,临床上可据此进行个性化治疗[7]。PD-1是一种十分重要的免疫抑制分子,其作用具有双面性,一方面能抑制免疫系统对人体细胞产生反应,并通过降低T细胞炎性反应加强患者耐受能力,另一方面还会防止免疫系统杀死癌细胞[8-9]。PD-L1是PD-1的受体,其在癌细胞上的表达通过PD-1和效应T细胞相结合共同抑制肿瘤细胞活性[10]。由于PD-1在肿瘤细胞中的表达具有明显的特异性,且对免疫机制的调节作用明显,因此临床上考虑将其作为靶向治疗研究的方向,并已在实体瘤治疗中取得了良好效果。其治疗方式多样,小分子抑制剂、单克隆抗体、双特异性抗体、抗体药物耦联物及细胞免疫治疗均为其治疗的良好方法[11]。
本研究结果显示PD-L1阳性表达率与患者病理类型之间存在一定的关系,肿瘤侵袭性越强其表达率越高,与杨红丽等[12]的研究结果基本一致。表明PD-1及PD-L1的阳性表达率与肿瘤细胞的病变状况关系密切,能够对肿瘤存在的情况进行较为敏感的反应,能有效判断患者肿瘤细胞的侵袭强度,对其预后状况进行判断,同时还能够将其作为肿瘤因子存在情况的一项检测指标对患者临床分型治疗提供一定的借鉴。王平等[13]同样对肿瘤患者的PD-1和PD-L1水平进行研究,发现其对肿瘤的诊断效果良好,且与患者预后存在明显的相关性,与本研究结果一致,表明PD-1的表达与非小细胞癌患者的TNM分期及淋巴结转移有关,可能可以作为评价非小细胞癌恶性程度和预后的指标,指出了该指标对肿瘤患者病程进展评价的重要性。但本研究中患者不同病理分期的PD-1阳性表达率差异不显著,与李婷等[14]的研究结果相似,可能是由于非小细胞肺癌和NHL具体的致病机制不同。本研究结果发现,高PD-1阳性表达组患者免疫功能低于低PD-1阳性表达组。免疫机制是肿瘤患者病程进展过程中的重要影响因素,PD-1作为重要的免疫调节因子与PD-L1结合能够组织免疫系统杀死肿瘤细胞,且在肿瘤患者症具有较高水平的存在,这对患者的治疗进展造成了严重影响,同时也提示临床对PD-1进行拮抗阻断能够有效改善免疫系统对肿瘤细胞的消除作用,提升临床治疗效果。本研究受条件限制,未能纳入更大批量的临床患者展开研究,且缺乏复发患者再次活检与免疫组化检查的结果,因此可能对研究结果造成影响,存在一定局限性。
综上所述,PD-1及其配体PD-L1在NHL患者中的表达具有明显特征,肿瘤细胞侵袭性越强,表达率越高,对患者肿瘤细胞的侵袭作用具有一定的判断作用,还能作为患者肿瘤分型的借鉴性指标之一。此外,PD-1与患者免疫功能之间的关系明显,能够通过调节免疫机制对患者抗肿瘤能力进行改变,因此临床上可以采用PD-1阻断药物调节免疫机制,从而降低肿瘤细胞的侵袭性,提升临床疗效。
