艾滋病合并HBV相关慢加急肝衰竭患者临床特征和预后分析
2022-02-15邓浩辉楼燕高洪波陈伟烈
邓浩辉 楼燕 高洪波 陈伟烈
乙型肝炎病毒(HBV)感染是导致肝衰竭发生的常见病因,国内外对乙型肝炎病毒相关慢加急肝衰竭(HBV-ACLF)临床特征分析已有较多的报道。在我国,艾滋病(AIDS)患者常合并HBV感染,部分合并感染者可进展为HBV-ACLF,但目前国内外对AIDS合并HBV-ACLF患者临床特征和预后分析的报道较少,本研究拟纳入本院近年来AIDS合并HBV-ACLF患者临床诊疗数据和预后特征进行分析,总结其临床特点并提高对该病的认识。
资料与方法
一、研究对象
本研究纳入2012年6月至2020年10月在广州市第八人民医院住院的22例AIDS合并HBV-ACLF和39例HBV-ACLF患者,人类免疫缺陷病毒(HIV)和AIDS符合2018年发布的中国艾滋病诊疗指南的诊断标准,HBV符合2019年发布的慢性乙型肝炎防治指南的诊断标准,肝衰竭符合2018发布的肝衰竭诊治指南的诊断标准[1-3]。纳入分析的患者均为肝衰竭进展期且发病后首次在我院住院的患者。排除标准:排除合并非酒精性脂肪肝、酒精性肝病、自身免疫性肝炎和药物性肝炎的患者,另排除曾在外院住院治疗的肝衰竭患者。对符合入排标准的患者临床数据和预后进行回顾性分析和比较,所有纳入研究的患者均签署知情同意书。
二、患者的一般资料
本研究共纳入61例HBV-ACLF进行研究,平均年龄(41.9±11.3)岁,男性和女性分别为59例(96.7%)和2例(3.3%),纳入的61例患者在发病前均无使用包含抗HBV的抗病毒药物,其中1例(1.6%)患者合并丙型肝炎病毒感染,3例(4.9%)患者合并戊型肝炎病毒感染。纳入分析的22例患者为AIDS合并HBV-ACLF,39例患者为HBV-ACLF,两组患者的一般资料无显著性差异(P>0.05),具体见表1。
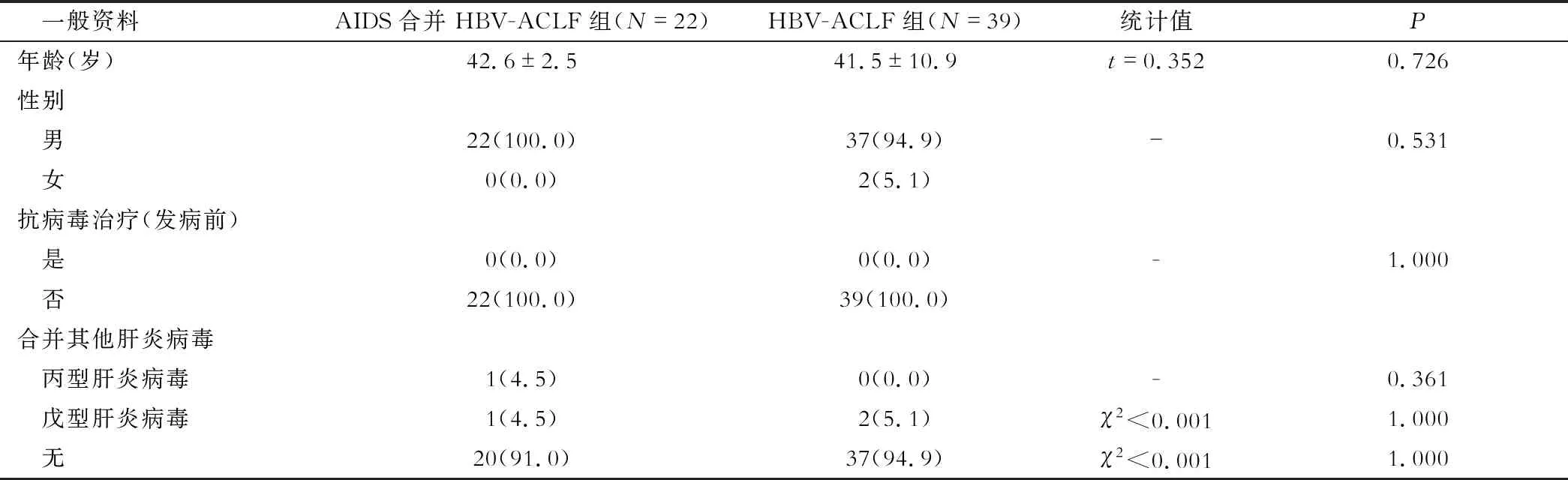
表1 AIDS合并HBV-ACLF和HBV-ACLF组患者一般资料比较
三、常规临床指标检测
本研究纳入分析的常规临床指标和使用的仪器或试剂如下:血红蛋白(Hb)和血小板(PLT)使用X1000全自动血液分析仪(Sysmex,日本)进行检测,血清丙氨酸氨基转移酶(ALT)、白蛋白(Alb)、总胆红素(TBil)和肌酐(Cr)等生化指标使用AU2700全自动生化仪(Olympus,日本)进行检测,凝血功能使用STA-R全自动凝血分析仪(Stago,美国),CD4+和CD8+T淋巴细胞计数使用Canto II流式细胞仪(BD,美国)进行检测,AFP和HBV e抗原使用电化学发光分析仪进行检测(Roche,瑞典),HBV DNA使用荧光定量PCR法进行检测(达安基因有限公司,广州),肝脏B超使用Vivid E9彩色超声诊断仪进行检查(GE,美国),MELD评分的计算参考文献[4]。所有临床指标均选自患者入院后首次的检查结果。
四、肝衰竭患者的临床预后判定标准
所有纳入研究的患者均给予常规护肝、退黄、抗病毒和人工肝等常规内科治疗,AIDS合并感染者尽量避免使用对肝脏有损害的抗感染药物进行治疗。肝衰竭患者的临床预后判定标准参考笔者前期发表的研究[5]。好转的标准:TBil下降至5倍正常值以下和PTA上升至40%以上;治疗失败的标准:包括死亡、肝移植、或TBil和PTA经内科保守治疗后无法达到好转标准,AIDS合并HBV-ACLF患者治疗失败的标准包括AIDS相关并发症所致的死亡。
五、统计学分析
结 果
一、AIDS合并HBV-ACLF和HBV-ACLF患者临床指标和预后比较
本研究纳入的22例AIDS合并HBV-ACLF和39例HBV-ACLF患者的临床资料如表2所示。其中,ALT(Z=-2.478,P=0.013)在AIDS合并HBV-ACLF组显著低于HBV-ACLF组,乙型肝炎病毒DNA(t=3.778,P<0.001)在AIDS合并HBV-ACLF组显著高于HBV-ACLF组。另外,Alb(t=-2.843,P=0.006),Hb(t=-2.218,P=0.030)和PLT(t=-2.451,P=0.017)在AIDS合并HBV-ACLF组也显著低于HBV-ACLF组。其余临床指标在两组患者无显著性差异(P>0.05)。12例(54.5%)AIDS合并HBV-ACLF患者治疗失败,18例(46.1%)HBV-ACLF患者治疗失败,两组患者预后的差异无统计学意义(P>0.05)。
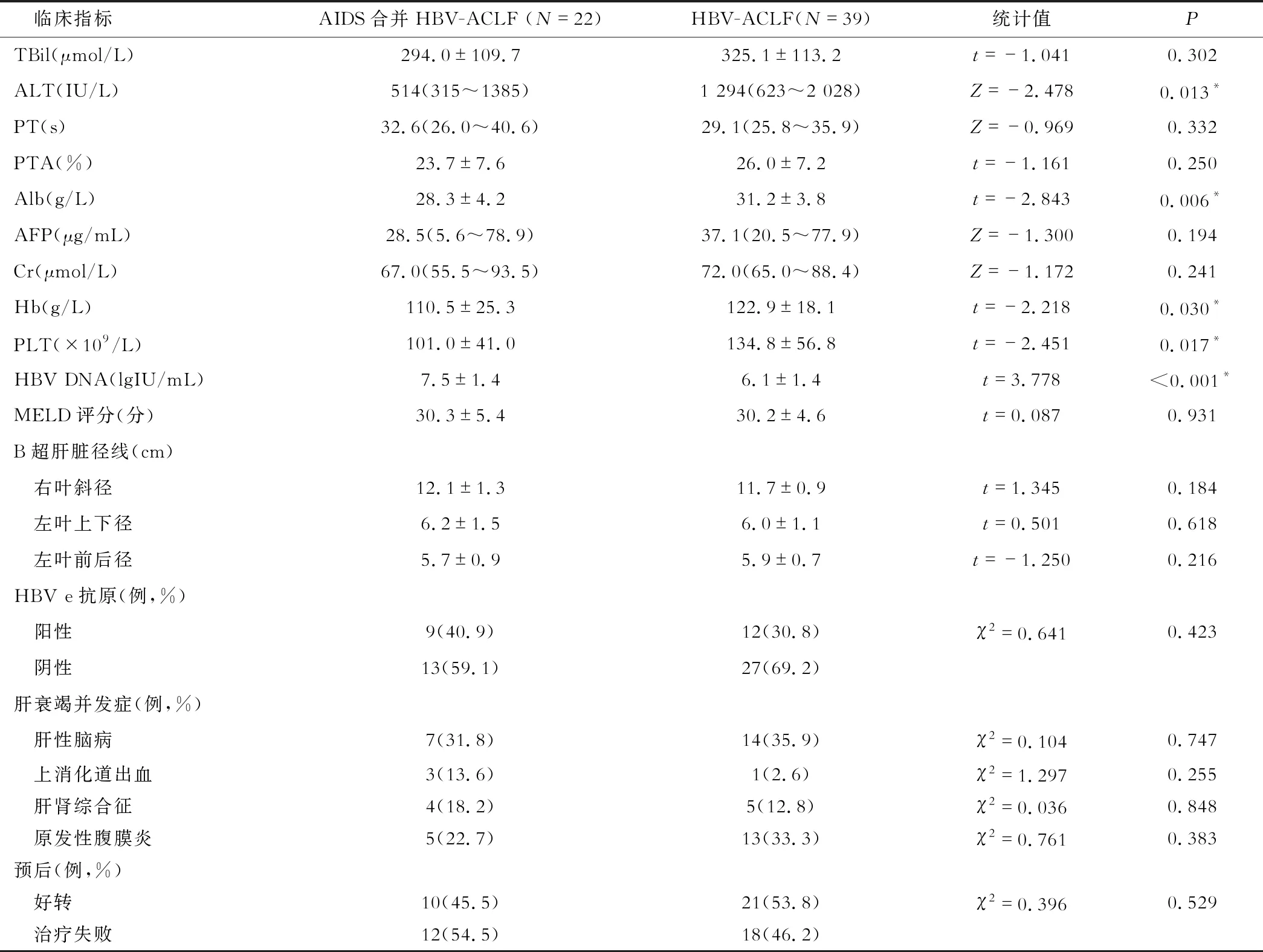
表2 AIDS合并HBV-ACLF和HBV-ACLF患者临床指标和预后比较
二、AIDS合并HBV-ACLF好转和治疗失败者临床指标比较
在本研究纳入分析的22例AIDS合并HBV-ACLF患者中,其中12例患者经内科保守治疗失败,2例(16.7%)因AIDS相关并发症(肺部感染)死亡,10例(83.3%)因肝功能衰竭及相关并发症死亡。好转组年龄(Z=-2.574,P=0.009),MELD评分(t=-2.206,P=0.042),CD4+T淋巴细胞计数(Z=-2.374,P=0.017)显著低于治疗失败组,AFP在好转组显著高于治疗失败组(Z=-2.317,P=0.020),其余临床指标在两组差异无统计学意义(P>0.05)。

表3 AIDS合并HBV-ACLF患者治疗好转和治疗失败者的临床资料比较
年龄、AFP、MELD评分和CD4+T淋巴细胞在好转组和治疗失败组差异有统计学意义(P<0.05)。
讨 论
HBV-ACLF病情进展迅速,死亡率高,预后差,是临床常见的终末期肝病之一[6]。在我国,HIV和HBV合并感染常见,临床上可见HBV-ACLF同样在AIDS患者中发生,但目前国内外对AIDS合并HBV-ACLF者临床特征和预后分析的报道较少。因此,本研究纳入本院AIDS合并HBV-ACLF患者,并以HBV-ACLF患者作为对照,总结分析其临床特点和预后差异。
既往研究表明,ACLF患者的疾病状态与机体免疫损伤机制有密切的相关性[7-8]。欧洲学者的研究结果提示,ACLF患者白细胞、血浆CRP、TNF-α、IL-6和IL-8等炎症因子的水平显著高于非ACLF者,且白细胞和血浆CRP水平与ACLF患者病情的严重程度有显著的相关性[9-10]。英国学者的研究表明,病原相关分子模式(PAMPs)、损伤相关分子模式(DAMPs)和细胞因子在ACLF肝脏炎症发作时,可激活肝脏微环境的巨噬细胞和启动天然免疫,导致肝脏免疫损伤[11]。我国学者的研究结果提示,HBV-ACLF患者外周血Th17细胞的构成比显著高于慢性乙型肝炎患者和健康对照者,且与血清ALT水平和肝组织炎症活动正相关[12]。日本对学者研究结果表明,ACLF患者HBV特异细胞毒性T淋巴细胞在外周血和肝组织显著增加,且活化的CD8+T淋巴细胞也显著增加[13]。总之,ACLF与机体的天然免疫和适应性免疫的关系密切。
本研究的结果表明,ALT在AIDS合并HBV-ACLF组显著低于HBV-ACLF组,但HBV DNA在AIDS合并HBV-ACLF组显著高于HBV-ACLF组,根据既往研究结果,上述差异的原因可能为AIDS合并HBV-ACLF患者机体免疫功能显著下降,导致肝脏炎症反应程度以及对HBV清除能力显著弱于HBV-ACLF患者。笔者同时对AIDS合并HBV-ACLF和HBV-ACLF患者预后进行了分析,结果提示两组患者预后无显著性差异,其原因可能为AIDS合并HBV-ACLF患者的免疫功能低下,容易合并各种机会性感染,严重的机会性感染可增加患者的死亡率,导致虽其肝脏炎症反应较低。但是,由于AIDS合并HBV-ACLF病例数较少,预后无差异也可能与病例数相关。本研究的结果也提示AIDS合并HBV-ACLF组Alb、Hb和PLT显著低于HBV-ACLF组,可能与患者的疾病状态有关,与本院的前期研究的结果基本一致[14]。最后,笔者也对AIDS合并HBV-ACLF好转和治疗失败的患者进行各临床数据的初步比较和分析,提示除既往研究已表明与肝衰竭预后有关的因素(年龄、MELD评分、AFP)外[15-17],外周血CD4+T淋巴细胞计数在好转者显著低于治疗失败者,提示患者免疫功能越低下,肝脏炎症损伤可能越轻,这可能是导致预后差异的原因。但因AIDS合并HBV-ACLF发病率较低,收集病例的难度较大,本研究的病例数少,仅单因素初步分析提示上述指标有统计学差异,而多因素Logistics回归分析上述指标均无差异(数据未展示),放今后应继续扩大样本量,并重新进行相关统计分析。
综上所述,AIDS合并HBV-ALCF患者肝脏炎症反应程度和预后可能与患者的免疫状态有关。另本研究纳入分析的AIDS合并HBV-ACLF和HBV-ACLF患者在发病前均未接受抗病毒治疗,AIDS合并HBV-ACLF预后较差,因此,对HIV和HBV合并感染者应予积极干预,警惕HBV-ACLF的发生。
