白粉菌胁迫下苦荬菜生理指标和差异表达蛋白分析
2022-02-15胡远彬梁小玉季杨易军张靓
胡远彬 梁小玉 季杨 易军 张靓


摘要:研究白粉菌胁迫对苦荬菜叶片生理指标及蛋白组的影响,为揭示苦荬菜响应白粉菌胁迫的分子机制奠定基础。以龙牧苦荬菜(Lactuca indica L. cv. Longmu)为试验材料,测定其接种白粉菌72 h后叶片生理指标的变化,并利用同位素相对和绝对定量标记技术联合液相色谱-串联质谱技术(iTRAQ-LC-MS/MS)结合生物信息学方法分析叶片差异表达蛋白及其富集情况。结果表明,接种白粉菌后过氧化物酶活性较对照极显著增加(P<0.01),丙二醛含量和超氧化物歧化酶活性均显著增加(P<0.05),总叶绿素、叶绿素a和叶绿素b含量均下降。共筛选出200个差异表达蛋白,其中上调表达的蛋白有161个,下调表达的蛋白有39个。经过蛋白注释和富集分析,筛选出含Bet v 1结构域蛋白、含几丁质结合1型结构域蛋白、过氧化物酶、细胞色素P450、4-香豆酸-辅酶A连接酶-7、咖啡酸3-O-甲基转移酶和大根香叶烯A羟化酶7种差异表达蛋白与苦荬菜响应白粉菌胁迫有关。苦荬菜在白粉菌胁迫下,次生代谢和病程相关等蛋白显著上调表达以响应白粉病侵染,推测过氧化物酶可能在机体响应白粉菌胁迫的调控中发挥了重要作用。
关键词:苦荬菜;苍耳单囊壳白粉菌;同位素相对和绝对定量标记(iTRAQ);差异表达蛋白
中图分类号: S435.4 文献标志码: A
文章编号:1002-1302(2022)02-0147-07
收稿日期:2021-04-26
基金项目:四川省畜牧科学研究院基本科研业务费专项(编号:SASA2018A04);国家现代农业产业技术体系四川肉羊创新团队(编号:sccxtd-2021-14);四川省“十四五”牧草育种攻关项目(编号:2021YFYZ0013)。
作者简介:胡远彬(1988—),女,河南信阳人,硕士,助理研究员,主要从事牧草育种与栽培研究。E-mail:595368128@qq.com。
通信作者:梁小玉,博士,研究员,主要从事草种质资源评价与育种研究。E-mail:liangxiaoyucao@ 163.com。
苦荬菜(Lactuca indica)为菊科(Compositae)莴苣属(Lactuca)一年生或越年生草本植物,具有适应性强、产草量高、营养丰富及药用功能[1-2]等优点,是多种畜禽及鱼类喜食的优质青绿多汁饲草[3],也可作为功能性饲料添加剂[4]。随着草牧业的发展及种草养畜观念的增强,苦荬菜已在我国南北多省推广种植,因连作、密植及气候条件等因素,白粉病的危害日益突显,已经成为苦荬菜生产中的常见病害,在我国黑龙江[5]、四川[6]和贵州[7]等苦荬菜种植区多次报道,而防治该病害最为有效的措施是种植抗性品种,但尚未见免疫或高抗苦荬菜品种的报道。因此,研究白粉病病菌与苦荬菜之间的相互作用,筛选苦荬菜响应白粉病病菌侵染的防御相关蛋白,对深入研究苦荬菜响应白粉病胁迫的分子机制及选育高抗白粉病的苦荬菜品种具有重要意义。目前,关于苦荬菜白粉病的研究较少,仅在田间发病规律、防治及病原菌鉴定等方面有少量报道。研究发现,苦荬菜白粉病是由苍耳单囊壳白粉菌(Podosphaera xanthii)[7]或菊科高氏白粉菌(Golovinomyces cichoracearum)[8]引起的,主要危害叶片,导致叶片和植株早枯,对苦荬菜产量及饲用价值都有很大影响。目前,蛋白质组学技术已被广泛应用于植物与病原真菌的互作研究中[9],已鉴定出病程相关(pathogenesis-related,PR)蛋白家族、次生代谢途径蛋白及其他防御相关蛋白等[10]。植物与白粉病病菌互作的研究主要集中在小麦(Triticum aestivum)、黄瓜(Cucumis sativus)和葡萄(Vitis vinifera)上,研究者多采用双向凝胶电泳(2-DE)分离技术,但其分离精确度低,获得的差异蛋白数量偏少[11],而同位素相对和绝对定量标记(iTRAQ)是一种新型定量蛋白质组学技术,弥补了2-DE技术的不足。国内外未见苦荬菜响应白粉病病菌胁迫蛋白组学研究的报道,本研究结合生理指标,利用iTRAQ标记结合液相色谱与串联质谱(LC-MS/MS)技术,研究苦荬菜在白粉菌侵染后蛋白质组学的变化,以期为揭示苦荬菜响应白粉菌胁迫的分子机制及挖掘苦荬菜抗白粉病基因奠定理论基础。
1 材料与方法
1.1 供试材料
供试材料龙牧苦荬菜由黑龙江省畜牧研究所提供。白粉菌为苍耳单囊壳白粉菌(P. xanthii),采自四川省崇州市白头镇高笕村牧草试验基地田间自然感病的龙牧苦荬菜叶片,纯化后人工扩繁。
1.2 试验设计
2018年7月在四川省畜牧科学研究院开展试验,选取粒大饱满的龙牧苦荬菜种子,用1% NaClO溶液浸泡10 min消毒后,用無菌水冲洗干净,放入培养皿中保温催芽1~2 d,挑选露白一致的种子,种在装有灭菌营养土的花盆(上径29 cm,下径19 cm,高17 cm)中,每盆20株,共播种6盆,分为对照组和处理组。待幼苗长至2叶1心期时,接种组(TR)将浓度为5×104个/mL的白粉病病菌分生孢子悬浮液采用喷雾接种法进行接种;对照组(CK)喷施等量蒸馏水,保湿24 h后,置于昼/夜温度周期为 25 ℃/20 ℃、相对湿度为70%~80%、光/暗周期为16 h/8 h的人工气候箱中培养。接种72 h[12]后分别采集对照组、接种组的第2张真叶,每组设3次重复,用液氮冷冻后于-80 ℃保存,备用。
1.3 生理指标的测定
过氧化物酶(POD)活性、超氧化物歧化酶(SOD)活性、丙二醛(MDA)含量、总叶绿素含量、叶绿素a和叶绿素b含量均参照郝再彬等的方法[13]进行测定。
1.4 叶片总蛋白质的提取
称取适量的冷冻叶片至预冷的研钵中,加液氮研磨成粉,具体按照郭伟等的方法[14]进行总蛋白质的提取,用二奎啉甲酸 (BCA) 法测定蛋白质浓度。
1.5 iTRAQ标记和液质检测
蛋白质样品经胰酶酶解成肽段,用Phenomenex StrataX C18除盐后真空冷冻干燥。参照iTRAQ-4plex试剂盒说明标记肽段,混合标记后的肽段用Agilent 300Extend C18进行分级(分级梯度为8%~32%乙腈,pH值为9),合并为9个组分后进行真空冷冻干燥。然后采用EASY-nLC 1200超高效液相色谱仪、Q Exactive HF-X质谱仪进行液相分离和质谱分析。
1.6 质谱数据分析
用MaxQuant(v1.5.2.8)软件进行质谱数据解析。检索数据库为Uniprot Lactuca_ sativa_4236_PR_20190118(37 927条序列),蛋白质鉴定、肽匹配图谱鉴定的假阳性率均设置为1%。设定蛋白质的差异倍数>1.2或<1/1.2,P<0.05表示差异表达。
1.7 数据处理及生物信息学分析
用Excel 2010和SPSS 17.0 软件统计分析数据。对鉴定到的蛋白质进行COG、GO和KEGG数据库注释,并对筛选出的差异表达蛋白进行GO、KEGG和结构域富集分析。
2 结果与分析
2.1 生理生化指标的测定
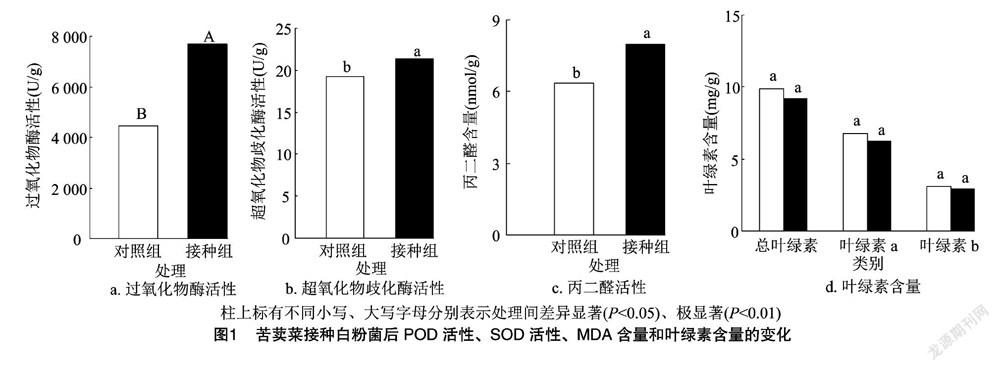
由图1可知,接种P. xanthii后,苦荬菜叶片中的MDA含量呈显著上升趋势(P<0.05),是对照组的1.25倍,说明此时细胞膜脂过氧化程度增加;POD活性呈极显著上升趋势(P<0.01),是对照组的1.72倍;SOD活性呈显著上升趋势(P<0.05),较对照组增加了11.34%。POD、SOD这2种抗氧化酶通过清除活性氧(ROS)维持机体的氧化还原平衡。此外,接种组总叶绿素、叶绿素a、叶绿素b含量均呈下降趋势,较对照组降低了6.66%~7.06%,表明机体的光合作用受到了一定影响。
2.2 差异表达蛋白的筛选
利用iTRAQ-LC-MS/MS技术在龙牧苦荬菜的处理组、对照组中共鉴定到6 758个蛋白质,其中6 104个蛋白质具有定量信息。在白粉菌胁迫下共有200个差异表达蛋白发生显著变化,其中显著上调表达的蛋白质有161个,显著下调表达的蛋白质有39个,显著上调表达的蛋白质数量明显多于下调表达的蛋白质(图2)。亚细胞定位分析发现,这些差异表达蛋白主要位于叶绿体、细胞质和细胞核中(图3)。
2.3 差异表达蛋白的COG功能分类
200个差异表达蛋白经COG数据库比对后,有140个被注释并进行了功能分类。从图4可以看出,被注释的差异表达蛋白共分为21类,其中次生代谢物的生物合成、运输和分解代谢类蛋白数量最多(18个),还有16个细胞内运输、分泌和囊泡运输类蛋白质,14个翻译后修饰、蛋白质折叠、分子伴侣类蛋白质,10个能量生产和转化类蛋白质,10个碳水化合物的运输和代谢翻译类蛋白质,此外还有细胞骨架類、防御机制类等,这些类别的蛋白质可能在植物与病原菌的互作中发挥着不同作用。
2.4 差异表达蛋白的GO注释与富集分析
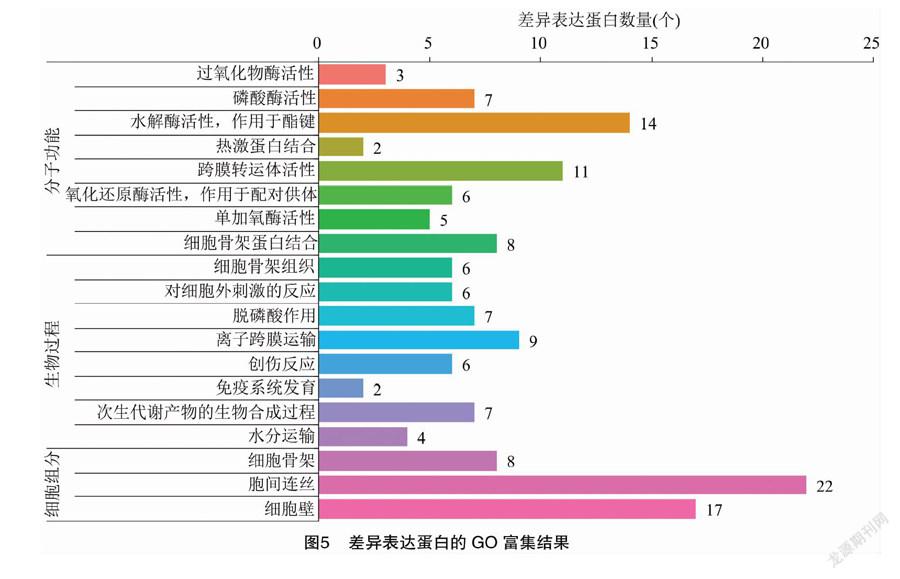
将差异表达蛋白进行GO注释和功能富集分析,以确定差异表达蛋白参与的生物学过程、行使的分子功能及所处的细胞环境。由图5可以看出,GO注释到差异表达蛋白有130个,显著富集条目有19个(P<0.05),细胞组分中有3个条目显著富集(P<0.05),其中极显著富集(P<0.01)的有2个条目,为细胞壁和胞间连丝,均富集上调蛋白;分子功能中有8个条目显著富集(P<0.05),主要有细胞骨架蛋白结合、氧化还原酶活性-作用于配对供体、水解酶活性-作用于酯键、过氧化物酶活性和热激蛋白结合、单加氧酶活性、跨膜转运体活性、磷酸酶活性等,主要富集上调蛋白,其中前2个条目极显著富集(P<0.01);生物过程有8个条目显著富集(P<0.05),主要有次生代谢产物的生物合成过程、创伤反应、免疫系统发育、水分运输、脱磷酸作用、离子跨膜运输、细胞骨架组织、对细胞外刺激的反应等,主要富集上调蛋白,其中前4个条目为极显著富集(P<0.01)。
2.5 差异表达蛋白的KEGG富集分析
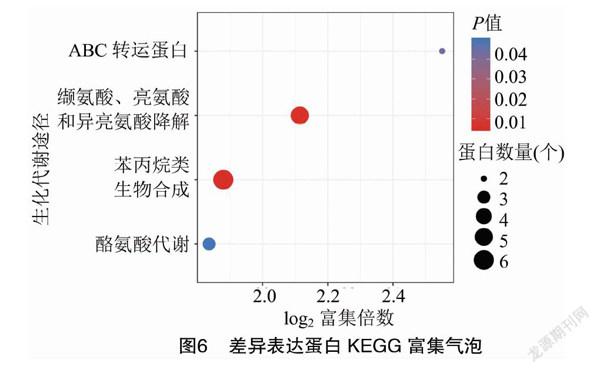
通过KEGG数据库对差异表达蛋白进行代谢通路显著性富集分析,确定差异蛋白可能参与的生化代谢途径。如图6所示,接种后差异表达蛋白显著富集到4条生化代谢途径,分别为苯丙烷类生物合成,缬氨酸、亮氨酸和异亮氨酸降解,ABC转运蛋白和酪氨酸代谢,其中前2条代谢途径为极显著富集(P<0.01),其包含的差异表达蛋白数量分别为6、5个,这4条生化代谢途径均富集上调表达蛋白。
2.6 差异表达蛋白的结构域富集分析
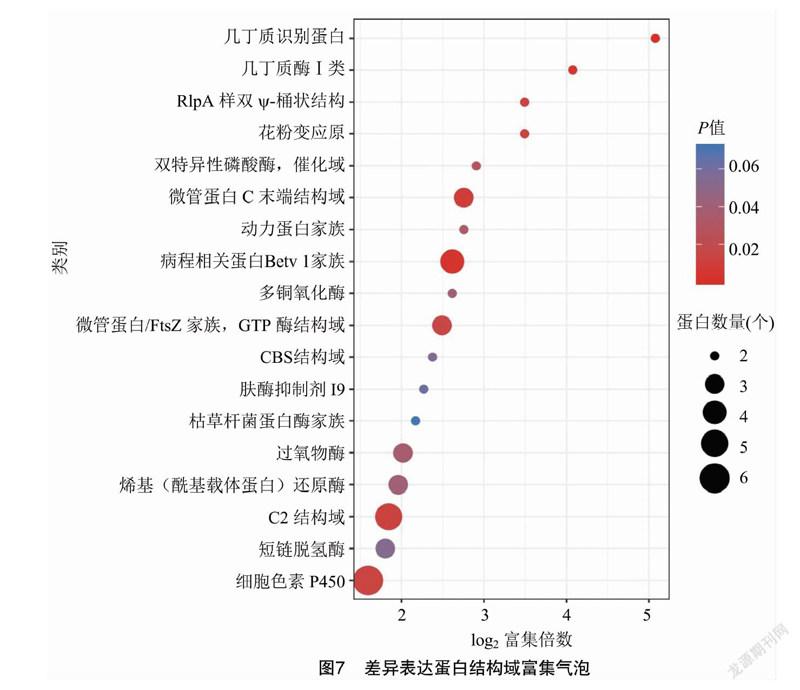
蛋白质结构域是具有相似的序列、结构和功能的蛋白质进化单元。对鉴定到的差异表达蛋白进行结构域富集分析发现,差异表达蛋白被富集到18个类别中,其中达到显著富集水平的有14类(P<0.05),达到极显著富集水平的有4类(P<0.01),分别为病程相关蛋白Bet v 1家族、几丁质酶Ⅰ类、几丁质识别蛋白和微管蛋白C末端结构域(图7)。此外,细胞色素P450、病程相关蛋白Bet v 1家族和几丁质酶Ⅰ类差异表达蛋白数量分别为6、4、2个,均为富集上调表达蛋白。
2.7 目标差异蛋白
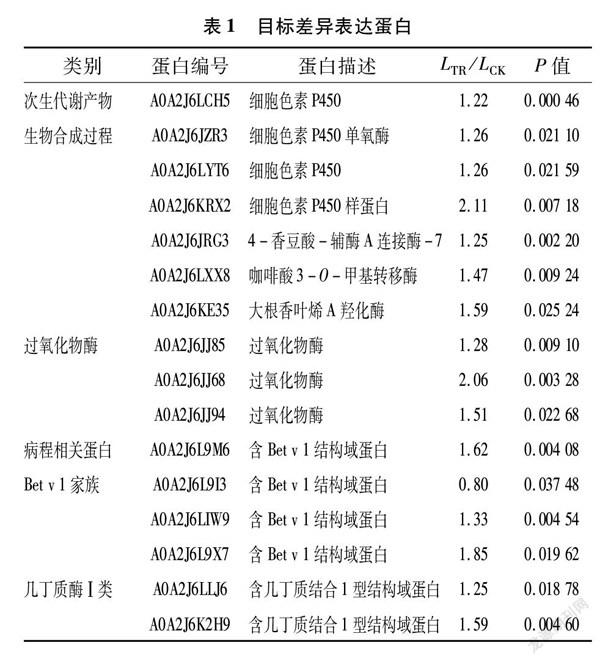
根据差异表达蛋白GO富集、KEGG富集及结构域富集结果,从参与苦荬菜响应白粉菌胁迫的次生代谢产物生物合成过程、病原相关蛋白Bet v 1家族、过氧化物酶和几丁质酶Ⅰ类4个途径或类别中筛选出7种共16个目标差异蛋白。其中参与次生代谢产物生物合成过程有7个差异表达蛋白,均为上调表达;POD包含3个上调表达的差异蛋白;病原相关蛋白Bet v 1家族包含4个含Bet v 1结构域蛋白, 除A0A2J6L9I3外,其余3个差异表达蛋白均上调表达;几丁质酶Ⅰ类包含 2个上调表达的含几丁质结合1型结构域蛋白(表1)。
3 討论与结论
病原真菌侵入植物体后可引起寄主体内发生复杂的生理变化。叶绿素与植物的光合作用密切相关,能客观反映植物抗病性的强弱。周梦韩等研究发现,黄瓜感染白粉病初期叶片叶绿素含量明显降低[15]。在本研究中,接种P. xanthii 72 h后苦荬菜叶片中的总叶绿素、叶绿素a和叶绿素b含量均下降。MDA含量主要反映细胞膜脂过氧化的程度,其含量越高,说明细胞膜稳定性越差[16]。SOD、POD在植物体内活性氧清除过程中起重要作用。苹果感病品种接种白粉菌后,SOD、POD等相关酶活性增强,MDA含量增加,叶绿素含量下降[17]。在本研究中,苦荬菜接种P. xanthii后,POD活性、SOD活性及MDA含量均极显著或显著上升,这与前人研究结果[17]一致,且POD活性的变化规律与其相关蛋白A0A2J6JJ85、A0A2J6JJ68、A0A2J6JJ94的表达情况一致,在接种后均呈上调表达。
本研究利用iTRAQ-LC-MS/MS技术对苦荬菜接种P. xanthii 72 h后差异表达蛋白进行分析,共发现200个差异表达蛋白发生显著变化,其中上调表达的蛋白质有161个,下调表达的蛋白质有39个,上调表达蛋白的数量明显多于下调表达蛋白,主要有PR蛋白和次生代谢相关蛋白等,其中PR蛋白在宿主响应病原菌侵染的防御反应机制中起关键作用[18]。在本研究中,发现4个含Bet v 1结构域蛋白、2个含几丁质结合1型结构域蛋白及3个POD蛋白,除1个含Bet v 1结构域蛋白(A0A2J6L9I3)下调外,其余均上调表达。病程相关蛋白Bet v 1家族含Bet v 1结构域蛋白,属于PR10[19],葡萄接种白粉菌后,鉴定出PR10及与PR10具有相同保守结构域Bet v 1-like蛋白[20-21],推测PR10与葡萄的白粉病抗性有关,可能通过降解病原体RNA和诱导宿主细胞程序性死亡发挥双重作用[22]。多数研究发现,几丁质酶通过水解真菌菌丝细胞壁中的几丁质聚合物影响真菌的生长[23],同时产生的几丁质产物,可作为信号分子诱发进一步的防御反应。葡萄敏感品种受葡萄钩丝壳(Uncinula necator)感染后,叶片中几丁质酶等病程相关蛋白基因被强烈诱导,其中几丁质酶Ⅰ类在严重感染的叶片中被检测到[24]。POD属于 PR-9,可由真菌诱导产生,通过建立结构屏障或产生高毒性环境来限制感染扩散,同时作为一种植物保护酶,在后期负责清除H2O2以减轻植物所受损害[25]。李杰对高感病小麦品种西农979接种白粉菌72 h后的蛋白组表达分析发现,POD大量表达[26]。因此可见,含Bet v 1结构域蛋白、含几丁质结合1型结构域蛋白和POD这3类PR蛋白在白粉菌侵染后上调表达可能与其响应侵染有关。
另外,次生代谢物木质素、酚类、萜类等在植物抵御病原真菌中发挥着重要作用[27-28]。本研究在龙牧苦荬菜响应白粉菌胁迫中共获得5种与次生代谢产物生物合成相关的差异蛋白,包括细胞色素P450(CYP450)、咖啡酸3-O-甲基转移酶(COMT)、4-香豆酸-辅酶A连接酶-7(4-CLL7)、POD和大根香叶烯A羟化酶,均为上调表达蛋白。CYP450是一类多功能氧化酶,参与木质素、萜类等次生代谢产物的合成[29-30]。薛飞利用基因芯片分析小麦N9134在白粉菌生理小种E09胁迫下的表达谱,发现CYP450、POD等差异表达基因参与抗白粉病代谢调控[31];Li等利用转录组技术鉴定到CYP450等6个候选基因在大麦高抗品种凤7中持续上调表达,增强了植株对白粉病的抗病性[32]。有研究发现,4-香豆酸-辅酶A连接酶(4CL)、COMT和POD均与木质素合成有关[33-35];Wang等研究发现,小麦COMT基因(TaCOMT-3D)可能通过促进木质素的积累来提高对纹枯病的抗性[36]。在本研究中,CYP450、COMT、4-CLL7和POD这4类差异蛋白的表达水平显著升高,说明苦荬菜与白粉菌互作过程中苯丙烷生物合成活跃,木质素等代谢物质大量合成,可通过植物细胞壁木质化以抵御病原菌的侵染。这可能是植株被白粉菌侵染后,其粗纤维含量升高从而影响营养价值的原因。此外,大根香叶烯A羟化酶参与倍半萜内酯的生物合成[37],该蛋白上调表达可能与响应白粉菌胁迫有关。
白粉病影响苦荬菜的正常生长发育,从而导致降质减产。接种P. xanthii后,苦荬菜叶片MDA含量增加使膜脂过氧化程度升高,叶绿素含量降低导致光合作用受影响,机体通过增加POD、SOD防御酶活性来维持动态平衡。同时,Bet v 1结构域蛋白、几丁质结合1型结构域蛋白等PR蛋白和CYP450、COMT、4-CLL7等次生代谢相关蛋白出现显著差异表达,它们主要通过上调表达以响应白粉菌的胁迫。由此推测,POD可能在机体响应白粉菌胁迫的调控中发挥重要作用。
参考文献:
[1]Ha J M,Lee T,Kim M Y,et al. Comprehensive transcriptome analysis of Lactuca indica,a traditional medicinal wild plant[J]. Molecular Breeding,2017,37(9):112.
[2]Yi T G,Park Y,Park J E,et al. Enhancement of phenolic compounds and antioxidative activities by the combination of culture medium and methyl jasmonate elicitation in hairy root cultures of Lactuca indica L.[J]. Natural Product Communications,2019,14(7):1-9.
[3]斯日古楞,范铁力,贾卫星,等. 不同品种苦荬菜比较研究[J]. 内蒙古民族大学学报(自然科学版),2007,22(2):172-174.
[4]Harikrishnan R,Kim J S,Kim M C,et al. Lactuca indica extract as feed additive enhances immunological parameters and disease resistance in Epinephelus bruneus to Streptococcus iniae[J]. Aquaculture,2011,318(1):43-47.
[5]杨伟光,李 红,毛小涛,等. 早熟苦荬菜与晚熟苦荬菜性状比较[J]. 草业科学,2011,28(12):2221-2224.
[6]梁小玉,胡远彬,季 杨,等. 川畜1号苦荬菜新品种比较试验[J]. 黑龙江畜牧兽医,2019(19):116-121.
[7]Li D L,Yu H P,Dai Y F,et al. Powdery mildew of Pterocypsela indica caused by Podosphaera xanthii in China[J]. Plant Disease,2019,103(8):2131.
[8]王麗丽,李克梅,赵震宇,等. 新疆阿勒泰地区草地植物的白粉菌和锈菌(Ⅰ)[J]. 菌物研究,2016,14(2):81-85.
[9]丁丽娜,杨瑞英,杨国兴. 植物与病原菌互作的蛋白质组学研究进展[J]. 微生物学通报,2016,43(2):394-402.
[10]张彩霞,李 壮,陈 莹,等. 植物与病原菌互作的蛋白质组学研究进展[J]. 西北植物学报,2010,30(3):626-632.
[11]李春娟,闫彩霞,王 娟,等. 基于iTRAQ技术的黄曲霉胁迫花生蛋白质组分析[J]. 花生学报,2020,49(1):25-30.
[12]钟 俐. 白粉病胁迫下甜瓜叶片蛋白组学分析[J]. 新疆大学学报(自然科学版),2020,37(3):282-288.
[13]郝再彬,苍 晶,徐 仲,等. 植物生理实验[M]. 哈尔滨:哈尔滨工业大学出版社,2004.
[14]郭 伟,湛孝东,黄月娥,等. 杨絮总蛋白肽段中的T细胞和B细胞表位[J]. 现代免疫学,2020,40(3):192-196.
[15]周梦韩,汪 静,孟新刚,等. 感染白粉病菌初期黄瓜叶片生理指标的变化[J]. 北方园艺,2013(3):133-135.
[16]韩志顺,郑敏娜,梁秀芝,等. 干旱胁迫对不同紫花苜蓿品种形态特征和生理特性的影响[J]. 中国草地学报,2020,42(3):37-43.
[17]田小敏. 基于转录组水平的苹果抗白粉病基因筛选与感病叶片生理指标分析[D]. 杨凌:西北农林科技大学,2019:27-28.
[18]Zhang J R,Wang F,Liang F,et al. Functional analysis of a pathogenesis-related thaumatin-like protein gene TaLr35PR5 from wheat induced by leaf rust fungus[J]. BMC Plant Biology,2018,18(1):76.
[19]Radauer C,Lackner P,Breiteneder H. The Bet v 1 fold:an ancient,versatile scaffold for binding of large,hydrophobic ligands[J]. BMC Evolutionary Biology,2008,8(1):286.
[20]张军科,罗世杏,张玉洁,等. 葡萄抗、感白粉病植株叶片蛋白质组差异比较[J]. 西北农林科技大学学报(自然科学版),2012,40(10):149-153.
[21]张 娟. 白粉菌接种诱导的葡萄叶片蛋白质组差异分析[D]. 杨凌:西北农林科技大学,2015:35-37.
[22]Xu T F,Zhao X C,Jiao Y T,et al. A pathogenesis related protein,VpPR-10.1,from Vitis pseudoreticulata:an insight of its mode of antifungal activity[J]. PLoS One,2014,9(4):e95102.
[23]Shibuya N,Minami E. Oligosaccharide signalling for defence responses in plant[J]. Physiological and Molecular Plant Pathology,2001,59(5):223-233.
[24]Jacobs A,Dry I,Robinson S P. Induction of different pathogenesis-related cDNAs in grapevine infected with powdery mildew and treated with ethephon[J]. Plant Pathology,1999,48(3):325-336.
[25]Almagro L,Ros L V G,Belchi-Navarro S,et al. Class Ⅲ peroxidases in plant defence reactions[J]. Journal of Experimental Botany,2009,60(2):377-390.
[26]李 杰. 小麦白粉病引致的叶片与籽粒差异表达蛋白分析[D]. 郑州:河南农业大学,2017:34-68.
[27]Bhuiyan N H,Selvaraj G,Wei Y D,et al. Gene expression profiling and silencing reveal that monolignol biosynthesis plays a critical role in penetration defence in wheat against powdery mildew invasion[J]. Journal of Experimental Botany,2009,60(2):509-521.
[28]陳 瑶,谢琴鼎,唐亚琴,等. 植物萜类合成代谢途径及限速酶的研究进展[J]. 分子植物育种,2018,16(7):2371-2379.
[29]赵志新,鹿鹏鹏,王 通. 植物三萜皂苷代谢中细胞色素P450的生物信息学分析[J]. 西南农业学报,2019,32(10):2304-2312.
[30]Gou M Y,Ran X Z,Martin D W,et al. The scaffold proteins of lignin biosynthetic cytochrome P450 enzymes[J]. Nature Plants,2018,4(5):299-310.
[31]薛 飞. 小麦抗白粉病基因的分子作图及其与白粉菌互作的表达谱分析[D]. 杨凌:西北农林科技大学,2012:78.
[32]Li Y B,Guo G M,Zhou L H,et al. Transcriptome analysis identifies candidate genes and functional pathways controlling the response of two contrasting barley varieties to powdery mildew infection[J]. International Journal of Molecular Sciences,2020,21(1):151.
[33]于娟娟,李 玲,金 青,等. 砀山酥梨石细胞发育过程中木质素代谢关键酶POD类型的分析[J]. 园艺学报,2011,38(6):1037-1044.
[34]Chen X H,Wang H T,Li X Y,et al. Molecular cloning and functional analysis of 4-Coumarate:CoA ligase 4(4CL-like 1) from Fraxinus mandshurica and its role in abiotic stress tolerance and cell wall synthesis[J]. BMC Plant Biology,2019,19(1):231.
[35]Sattler S E,Funnell-Harris D L. Modifying lignin to improve bioenergy feedstocks:strengthening the barrier against pathogens?[J]. Frontiers in Plant Science,2013,4:70.
[36]Wang M X,Zhu X L,Wang K,et al. A wheat caffeic acid 3-O-methyl transferase TaCOMT-3D positively contributes to both resistance to sharp eyespot disease and stem mechanical strength[J]. Scientific Reports,2018,8(1):6543.
[37]de Kraker J,Franssen M C,Dalm M C,et al. Biosynthesis of germacrene A carboxylic acid in chicory roots. Demonstration of a cytochrome P450(+)-germacrene a hydroxylase and NADP+-dependent sesquiterpenoid dehydrogenase(s) involved in sesquiterpene lactone biosynthesis[J]. Plant Physiology,2001,125(4):1930-1940.
