壳聚糖/明胶/茶多酚复合膜的溶胀溶失性能
2022-02-14俞杨销宋功吉张子凡赵明达孙纯洁孙嘉琦许建梅
俞杨销 宋功吉 张子凡 赵明达 孙纯洁 孙嘉琦 许建梅
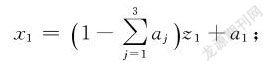


摘 要:为了获得不易随环境湿度发生形变,不易吸水增重、溶解失重的复合膜,采用配方试验设计确定了6种配比的壳聚糖/明胶/茶多酚复合膜,通过流延法制备了这6种不同配比的壳聚糖/明胶/茶多酚复合膜,对复合膜吸水增重、溶胀性能和失重性能进行测试。结果表明:当壳聚糖、明胶、茶多酚占比分别为67.55%、0%、32.45%时,所制备的复合膜吸水率最小,此時溶胀率接近0%且失重率较小;当3种组分的配比分别为63.08%、7.52%、29.40%时,所制备的复合膜的溶胀率为0%,但此时吸水率较大;当3种组分的配比分别为50.00%、0%、50.00%时,所制备的复合膜失重率最小,但此时溶胀率为负值,所制成的复合膜在水中发生了皱缩。因此最优配比可选用67.55%壳聚糖,0%明胶和32.45%茶多酚。实验同时表明,茶多酚的引入可以大大改善壳聚糖/明胶复合膜遇水易溶胀溶失的缺点。
关键词:壳聚糖;明胶;茶多酚;吸水性;溶胀性;失重性
中图分类号:R318.08
文献标志码:A
文章编号:1009-265X(2022)01-0070-08
Abstract: In order to obtain a composite film that is not easy to deform with environmental humidity, not easy to gain weight when absorbing water and lose weight when dissolved, we determined chitosan/gelatin/tea polyphenol composite films with 6 different ratios through a formula experiment, prepared them with tape casting method, and tested the water absorption, swelling performance and weight loss of the composite films. The result indicated that the prepared composite films had the lowest water absorption when the mass percentages of chitosan, gelatin, and tea polyphenols were 67.55%, 0%, 32.45%, respectively. At this moment, the swelling rate was close to 0% and the weight loss rate was low. When the proportions of the three components were 63.08%, 7.52%, and 29.40%, the swelling rate of the prepared composite film was 0%, but the water absorption rate was high. When the proportions of the three components were 50.00%, 0%, and 50.00%, the weight loss rate of the composite film prepared was the lowest, but the swelling rate was negative, indicating that the prepared composite film shrank in water. Therefore, the optimal ratio is 67.55% chitosan, 0% gelatin and 32.45% tea polyphenols. The experiment also shows that the introduction of tea polyphenols can significantly overcome the shortcomings of the chitosan/gelatin composite film, which is easy to swell and dissolve when exposed to water.
Key words: chitosan; gelatin; tea polyphenols; water absorption; swelling; weight loss
壳聚糖(CS)是甲壳素脱乙酰化的产物,是唯一普遍存在的高分子碱性氨基多糖[1]。壳聚糖具有良好的成膜性、抗菌性、生物相容性和可降解性等特性,在食品保鲜[2-3]和生物医用方面[4]应用前景广阔。明胶(GE)是动物中富含胶原蛋白的结缔组织中提取出来的高分子多肽复合物,具有产量大、价格低、良好的生物相容性和可降解性等特点。但是明胶制得的单膜较脆,成膜性较差。茶多酚(TPP)是茶叶中提取而出的多酚类物质,抗氧化能力优越,是一种理想的天然无毒的食品保鲜剂。
在酸性溶液中,壳聚糖因为—NH2基团的存在,易与氢离子结合而带正电荷,而明胶大分子则具有丰富的负电荷,明胶的加入会降低壳聚糖的结晶度,提高其成膜性。两者复合成膜能改善单膜的机械性能并且降低了单膜的水溶性[5]。
近年来,茶多酚优越的抗氧化性、抗菌性在作为添加剂应用到食品包装保鲜膜上的前景也备受关注。虽然茶多酚是水溶性的,但是茶多酚与明胶等富含辅氨酸的蛋白质材料会发生较为强烈的氢键作用,并且茶多酚与壳聚糖也会发生一定的相互作用。为此,采用壳聚糖、明胶、茶多酚这3种材料制成的复合膜可发挥茶多酚和壳聚糖的协同抗菌抗氧化效应,能够延长保质期,在食品包装中具有巨大的应用潜力。研究人员[6-7]将茶多酚与明胶或壳聚糖共混制成食品包装膜,所制备的复合膜具有较好的机械性能和抗氧化性能,能满足食品包装应用的要求。
壳聚糖/明胶/茶多酚复合膜可用于鲜肉制品[8]、海鲜产品[9-10]等食品活性包装材料,这就需要复合膜不易随环境湿度发生形变,不易吸水增重、溶解失重等特性。但是目前对于壳聚糖/明胶/茶多酚复合膜吸水性、溶胀性和失重性动态研究较少,而茶多酚是水溶性的,明胶亲水性也较强,溶于热水,因而两者与壳聚糖复合膜的溶胀溶失性能特别重要。作为食品包裝材料,若复合膜亲水性强,易吸水溶胀、溶解失重,其强度与弹性模量在吸水溶胀后将会急剧下降。本文以壳聚糖、明胶、茶多酚3种物质为原料,采用流涎法制备复合膜,探究不同配比下壳聚糖/明胶/茶多酚复合膜吸水性、溶胀性和失重性的动态变化,以求获得在湿态环境下不易发生形变且具有较低吸水率、失重率的复合膜配方,用于开发生物基活性包装材料。
1 实 验
1.1 实验试剂及仪器
1.1.1 实验试剂
乙酸(AR,上海泰坦化学有限公司),磷酸盐(PBS)缓冲液(AR,生工生物工程(上海)股份有限公司),壳聚糖(脱乙酰度不小于95%,上海迈瑞尔化学技术有限公司),明胶(AR,上海泰坦科技股份有限公司),甘油(99.5%,上海麦克林生化科技有限公司),茶多酚(98%,苏州福莱德生物科技有限公司)。
1.1.2 实验用主要仪器
移液枪(100~1000 μL)(大龙兴创实验仪器(北京)有限公司),AR224CN电子天平(美国奥豪斯公司),78-1A磁力加热搅拌器(杭州仪表电机有限公司),B11-2型恒温磁力搅拌器(上海司乐仪器有限公司),DHG-9077A干燥箱(上海精宏有限公司),SW-CJ-1FD 洁净工作台(苏州安泰空气技术有限公司),HZQ-X300 恒温振荡器(上海一恒科学仪器有限公司),NICOLET IS5傅里叶变换红外光谱仪(美国Thermo Nicolet公司)。
1.2 试验方案
利用3,2单纯形格子点设计表可以确定如表1所示的实验方案。在设计时,因为明胶和茶多酚是水溶性的,因此这两个组分的比例不宜占比过大,所以明胶和茶多酚的范围均取0~50%,相应的壳聚糖的配比范围取50%~100%。表1中z1,z2,z3为规范变量;x1,x2,x3分别为壳聚糖、明胶、茶多酚的配比,为自然变量。a1,a2,a3为各自然变量对应的最小值。因0.5≤x1≤1,0≤x2≤0.5,0≤x3≤0.5,则a1=0.5,a2=0,a3=0。表1前4列为3,2单纯形格子点设计表,根据该格子点设计表中6个试验点规范变量的取值,可以利用式(1)计算得到相应的自然变量的取值,各自然变量的取值如表1中后3列所示。
x1=1-∑3j=1ajz1+a1;
x2=1-∑3j=1ajz2+a2;
x3=1-∑3j=1ajz3+a3(1)
1.3 壳聚糖/明胶/茶多酚复合膜的制备
壳聚糖溶液的配制:称取21.6 g壳聚糖粉末,加入到720 mL、体积分数2%的乙酸水溶液中,在磁力搅拌机上以一定的速度搅拌至完全溶解,配制温度为60℃,静置除去气泡,制得质量浓度0.3 g/L的壳聚糖溶液。
明胶溶液的配制:称取5.4 g明胶粉末,加入到180 mL蒸馏水中,在磁力搅拌机上以一定的速度搅拌至完全溶解,配制温度为60℃,静置除去气泡,制得质量浓度0.3 g/L的明胶溶液。
茶多酚溶液的配制:称取5.4 g茶多酚粉末,置于180 mL蒸馏水中,在磁力搅拌机上以一定的速度搅拌至完全溶解,制得质量浓度0.3 g/L的茶多酚溶液。
复合膜的制备:将以上3种溶液按表1中配比混合,在磁力搅拌机上充分搅拌混合均匀,得到6种质量比不同的混合液各180 mL。配制时壳聚糖溶液需缓慢加入至明胶溶液中,并在磁力搅拌机上搅拌1h,得到壳聚糖/明胶混合液。茶多酚溶液应在最后加入,加入时同样缓慢加入,并在磁力搅拌机上搅拌1h。最后向配置的混合溶液中添加1.8 mL甘油,以一定速度搅拌1h,静置1h。将充分静置后的混合液在培养皿(Φ=9cm)上铺膜,静置消泡后,置于50℃烘箱中干燥两天,揭膜后得复合膜备用。
小样制备:将制成的复合膜剪成4cm×2cm的试样,每一配方取3个平行样,编号后放于培养皿(Φ=6cm)中备用。
1.4 壳聚糖/明胶/茶多酚复合膜的测试与表征
1.4.1 复合膜的吸水性
称得每个小样的干重m0,然后放回原培养皿中并加入PBS缓冲液,间隔0.5 h后将培养皿中的PBS缓冲液倒出,称得吸水后膜的质量m1,膜的吸水率R吸[11]如式(2)所示。
R吸/%=m1-m0m0×100(2)
1.4.2 复合膜的溶胀性
在原培养皿中并加入PBS缓冲液,间隔0.5 h后将培养皿中的PBS缓冲液倒出,测得溶胀后膜长为l1,宽为w1,膜的溶胀率R溶[12]如式(3)所示。
R溶/%=l1×w1-l0×w0l0×w0×100(3)
式中:l0=4cm,w0=2cm。
1.4.3 复合膜的失重性
称取每个小样的干重m0,然后放回原培养皿中并加入PBS缓冲液,将培养皿放于30℃水浴恒温振荡器中缓慢震荡。间隔不同时间后将培养皿从振荡器中取出,去除PBS缓冲液后置于60℃烘箱中干燥4h后称膜的质量m2,膜的失重率R失[13]如式(4)所示。
R失/%=m0-m2m0×100(4)
1.4.4 复合膜的结构表征
将制成的复合膜剪成2cm×2cm的试样,在干燥器中干燥30 min后直接用傅里叶变换红外光谱仪对复合膜的结构进行表征。测试条件如下:测试范围为4000~500cm-1,扫描次数为32次,分辨率为4cm-1。
2 结果与讨论
2.1 壳聚糖/明胶/茶多酚复合膜的吸水性
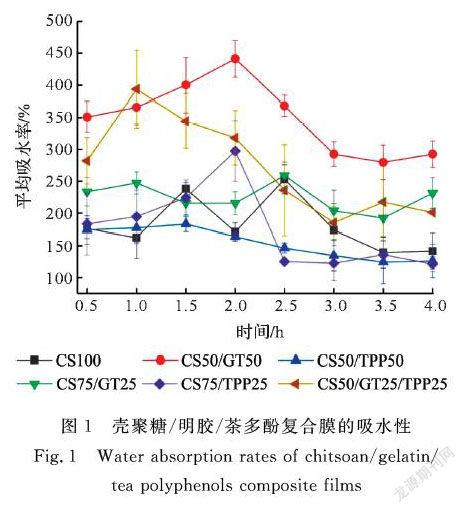
通过测量复合膜在一定时间浸没在水中重量的增加百分比可以来衡量复合膜的吸水性能。研究中对6个不同配比的样本(按试验号Ⅰ至Ⅵ分别将6个样本命名CS100,CS50/GT50, CS50/TPP50, CS75/GT25, CS75/TPP25, CS50/GT25/TPP25)进行了吸水增重测试,测试的数据结果如图1所示。从图1可看到,6个样本中明胶占比最大的CS50/GT50复合膜初始吸水率最大,这主要是因为明胶分子链上存在大量亲水性的—OH、—NH2和—C=O基团,极易形成氢键与水结合。随着溶胀时间的增加,复合膜的吸水率有所增加,这可能是由于未与壳聚糖分子交联的明胶分子做无规则运动逐渐与水接触,使得复合膜的吸水性随溶胀时间的增加而增加。随着明胶含量的减少,CS75/GT25复合膜吸水率明显下降且波动较小,这可能是由于在PBS溶液环境下复合膜中壳聚糖分子的—NH2基团和明胶分子的—COOH基团发生了静电作用,形成聚电解质络合物,产生一定的三维网络结构,增加了膜的致密性,使得复合膜结构相对稳定[14]。纯壳聚糖膜CS100的吸水率略低于CS75/GT25复合膜,壳聚糖分子结构中存在亲水性的—OH和—NH2基团,但整体亲水性不如明胶分子。
茶多酚的水溶性与明胶相比更好,但是将茶多酚替代明胶后,图1中CS50/TPP50的平均吸水率低于CS50/GT50,CS75/TPP25低于CS75/GT25,即在同一配比情况下壳聚糖/茶多酚膜与壳聚糖/明胶膜的平均吸水率相比反而降低,这说明茶多酚能与壳聚糖作用,降低复合膜的吸水性。原因可能是茶多酚分子中的酚羟基能与壳聚糖大分子中的氨基结合形成氢键,增强了分子间作用力,导致复合膜的吸水性降低。同样道理,将CS50/GT50中25%的明胶换成茶多酚,CS50/GT25/TPP25的吸水性能明显降低。随着溶胀时间的增加,壳聚糖/茶多酚膜(CS50/TPP50,CS75/TPP25)的吸水率有所增加,且壳聚糖占比高的复合膜吸水率增加量较大,这可能与CS50/GT50吸水率随时间增加的原因相同,未与茶多酚分子交联的壳聚糖分子做无规则运动逐渐与水接触,使得复合膜的吸水性随溶胀时间的增加而增加。
当溶胀一定时间以后,复合膜(CS50/GT50, CS50/TPP50, CS75/TPP25, CS50/GT25/TPP25)的吸水率出现一定的下降,主要表现在图1中CS50/GT50、CS75/TPP25、CS50/GT25/TPP25这三条曲线出现了明显的先增大后减小的波动。这可能是由以下两个原因引起的:一是复合膜发生了一定的物质溶解;二是复合膜中分子发生了重新排列,分子排列变得规整,缝隙空洞减少且变小,分子间结合力增加,使得吸水率下降。
2.2 壳聚糖/明胶/茶多酚复合膜的溶胀性
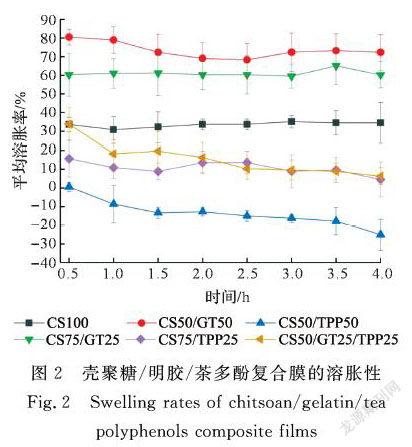
复合膜的溶胀性与吸水性是正相关的两个指标,一般材料在水中的溶胀主要体现在两个方面,一是含水率的增加,另一个是材料尺寸的增加。这里,复合膜的溶胀性能是通过测量膜在水中溶胀增大时面积上的增加百分比来进行衡量的,测量数据结果如图2所示。从图2可看到,明胶占比最大的CS50/GT50复合膜溶胀率最大,随着明胶含量的减少,CS75/GT25复合膜的溶胀率有所减小。纯壳聚糖膜CS100的溶胀率低于壳聚糖/明胶膜,这与2.1中壳聚糖/明胶膜的吸水性基本一致。当壳聚糖与茶多酚复合时,壳聚糖/茶多酚膜的溶胀率与壳聚糖/明胶膜相比有所减小。随着茶多酚占比的提高,CS50/TPP50复合膜的溶胀率有所减小,这可能是由于壳聚糖大分子链上的羟基、氨基等基团与茶多酚中含有的大量酚羟基结合形成氢键,增强了分子间作用力,使得复合膜的致密性增加,溶胀率减小。而CS50/GT25/TPP25复合膜溶胀率略低于壳聚糖/明胶膜,这可能是因为茶多酚的加入起交联剂的作用,使得大分子间作用力增强,溶胀率减小。这也与2.1中壳聚糖/明胶/茶多酚复合膜的吸水性基本一致。
随着溶胀时间的增加,含茶多酚的复合膜(CS50/TPP50, CS75/TPP25, CS50/GT25/TPP25)的溶胀率出现一定的减小,表现为复合膜在水中发生了一定的收缩,这也与2.1中复合膜吸水性基本一致。
2.3 壳聚糖/明胶/茶多酚复合膜的失重性
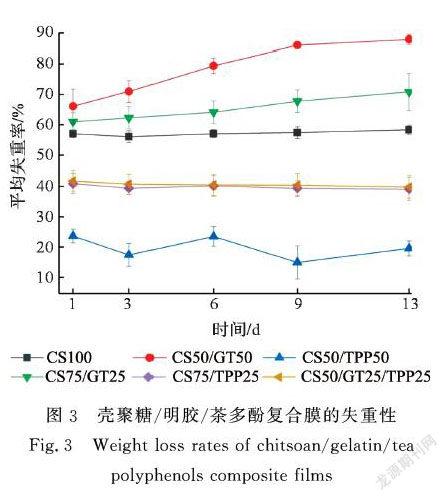
在复合膜的吸水性与溶胀性试验中,看到随着时间的增加部分配比的复合膜吸水率与溶胀率出现下降的趋势。这可能是因为在膜溶脹的过程中,膜表面的部分亲水性物质溶解于水中,使得复合膜发生了溶失。为此,有必要进一步通过复合膜的失重性试验来了解各配比复合膜遇水溶失情况。图3显示了壳聚糖/明胶/茶多酚复合膜的失重性试验数据。从图3可看到,明胶占比最大的CS50/GT50复合膜的失重率最大,由此印证了2.1中CS50/GT50复合膜溶胀一定时间后吸水率下降是由于复合膜中物质发生溶解所引起的猜想。随着明胶含量的减少,CS75/GT25复合膜的失重率有所减小,两者的失重率皆随震荡天数的增加而增加。明胶溶解于PBS缓冲液中,复合膜的本体质量减少。此外,随震荡天数的增加,壳聚糖/明胶复合膜的失重率逐渐增加,这可能是由于未与壳聚糖分子交联的明胶分子做无规则运动逐渐与水接触,溶解于PBS缓冲液中,使得复合膜的失重率随震荡天数的增加而增加。纯壳聚糖膜CS100的失重率低于壳聚糖/明胶复合膜的失重率且失重率随震荡天数的增加波动较小,这与壳聚糖的溶解性有关,壳聚糖在PBS缓冲液中溶解度小。
当壳聚糖与茶多酚复合时,复合膜的失重率明显减小。这可以确定2.1中含有茶多酚的复合膜在溶胀一定时间后吸水率下降是由于分子发生重新排列引起的。当茶多酚含量占25%时,复合膜(CS75/TPP25, CS50/GT25/TPP25)的失重率较小且两者失重率较为接近,失重率随震荡天数的增加波动较小,把25%的壳聚糖换成25%明胶后, CS50/GT25/TPP25复合膜的失重性没有明显变化,这可能是由于茶多酚与明胶的分子间通过氢键作用、疏水作用或静电作用发生了较为强烈的作用,极大地改变了明胶的失重性特点。当茶多酚含量占50%时,复合膜(CS50/TPP50)失重率最小。这与2.1和2.2中壳聚糖/明胶/茶多酚复合膜的吸水性、溶胀性试验现象相吻合,茶多酚的引入能够降低复合膜在PBS缓冲液中的吸水性、溶胀性和失重性。
2.4 壳聚糖/明胶/茶多酚复合膜的最优配比
通过对复合膜吸水4h的平均吸水率、平均溶胀率和失重13d的平均失重率的数据进行回归分析,可以得到如下式所示的各组分配比与吸水率y1、溶胀率y2和失重率y3的回归方程。
y1=-1.4145+2.8290×x1+4.7158×x2+3.5430×x3+2.2763×x1x2-2.0344×x1x3-1.3714×x2x3(5)
y2=-0.3447+0.6894×x1+0.9000×x2-0.4894×x3+1.0925×x1x2-0.0250×x1x3-2.7675×x2x3(6)
y3=-0.5832+1.1665×x1+1.9403×x2+0.3744×x3-0.3654×x1x2+0.0331×x1x3-2.2303×x2x3(7)
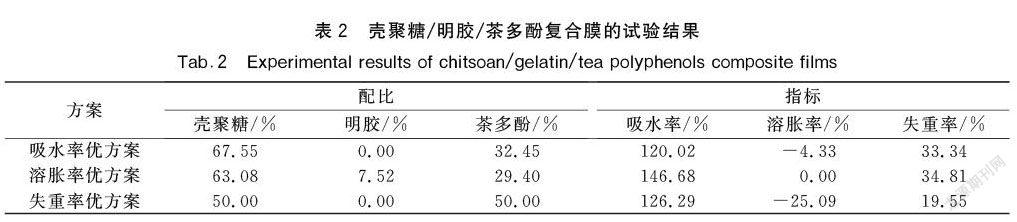
通过规划求解可得各式最优配方,见表2。其中对溶胀率进行规划求解时,目标值应为0,因为当溶胀率小于0时,意味着膜材料发生了皱缩,影响其使用性能。对吸水率和失重率进行规划求解时,目标值为最小值。
以吸水率为检验指标时,得到的最优配比是67.55%的壳聚糖和32.45%的茶多酚,求得吸水率为120.02%,将该组分配比带入式(6)求得溶胀率为-4.33%,将该组分配比带入式(7)求得失重率为33.34%。此时,复合膜几乎不发生溶胀,且吸水率及失重率也相对较低。
以溶胀率为检验指标时,得到的最优配比是63.08%的壳聚糖、7.52%的明胶和29.40%的茶多酚,求得溶胀率为0%,同样的方法可以求得该组分配比的吸水率为146.68%,失重率为34.81%。此时,该组分配比的复合膜随时间增加吸水率明显大于其余两组组分配比的吸水率,因此该方案可以舍弃。
以失重率为检验指标时,得到的最优配比是50.00%的壳聚糖和50.00%的茶多酚,求得失重率为19.55%,同样的方法可以求得该组分配比的吸水率为126.29%,溶胀率为-25.09%。此时,该组分配比的复合膜随时间增加会发生较为剧烈的绉缩,因此该方案可以舍弃。
为了获得不随环境湿度发生形变,不易吸湿溶胀的包装膜材料,通过对3个指标规划求解结果的综合评价,可以认为作为食品包装膜的最优配比应为67.55%的壳聚糖和32.45%的茶多酚。
2.5 壳聚糖/明胶/茶多酚复合膜的红外分析
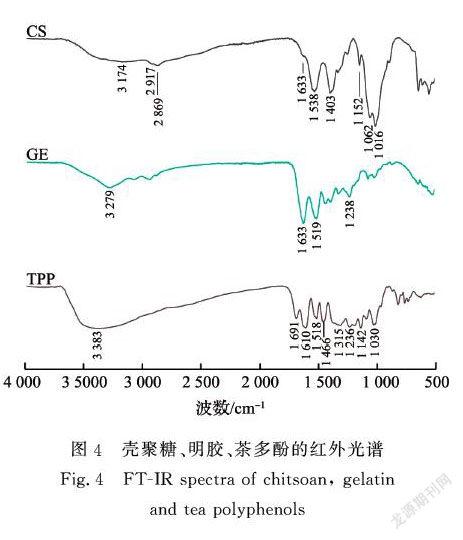
为了确定壳聚糖、明胶以及茶多酚的官能团,对纯壳聚糖膜、纯明胶膜以及茶多酚粉末进行了红外测试。如图4所示,在纯壳聚糖膜红外光谱上,3500~3000cm-1处出现的宽峰来源于O—H和N—H的伸缩振动以及分子间氢键作用[15],2917cm-1和2869cm-1处出现的峰归因于C—H的对称和不对称伸缩振动[16],1633 、1538cm-1和1403cm-1处出现的特征峰对应于C=O伸缩振动(酰胺Ⅰ)、N—H弯曲振动(酰胺Ⅱ)和C—N的伸缩振动(酰胺Ⅲ)[17],1152~1016cm-1处出现的特征峰是糖类化合物的特征结构[18]。在纯明胶膜红外光谱上,3279cm-1处的宽峰是酰胺A带所对应的特征峰,1633 、1519cm-1和1238cm-1分别对应于C=O伸缩振动(酰胺Ⅰ)、N—H弯曲振动(酰胺Ⅱ)和C—N的伸缩振动(酰胺Ⅲ)的特征峰[19]。在茶多酚粉末红外光谱上,在3383cm-1处出现高胖峰对应于O—H伸缩振动,1610~1466cm-1处出现特征峰对应于C—C伸缩振动,1236cm-1处出现特征峰对应于C—O伸缩振动,此外在1691cm-1处有一个较为尖锐的峰[20]。
为了确定壳聚糖、明胶、茶多酚三者之间的相互作用,对壳聚糖/明胶/茶多酚复合膜进行了红外测试。测试结果如图5所示,未观察到其他增加的峰,主要特征峰随复合膜配比变化发生轻微偏移,这表明壳聚糖、明胶、茶多酚三者之间无共价键产生[21]。
对于壳聚糖/明胶复合膜(CS50/GT50, CS75/GT25),随着明胶含量的增加,壳聚糖在1633cm-1附近处C=O伸缩振动(酰胺Ⅰ)得到加强,这与-NH2和-C=O基团有关,表明存在静电相互作用[22],验证了前文壳聚糖、明胶之间能够形成聚电解质络合物的猜想。当壳聚糖与明胶质量比为3∶1时(CS75/GT25),壳聚糖在1403cm-1处C-N的伸缩振动(酰胺Ⅲ)特征峰偏移至1388cm-1,这可能是由于壳聚糖、明胶之间形成一定的氢键,使得酰胺Ⅲ带振动频率有所损失。而当壳聚糖与明胶质量比为1∶1时(CS50/GT50),特征峰回偏至1402cm-1,表明分子間氢键数量减少,分子间结合力减弱,这与壳聚糖/明胶复合膜的吸水性、溶胀性、失重性试验现象相吻合。
对于壳聚糖/茶多酚复合膜(CS50/TPP50, CS75/TPP25),随着茶多酚含量的增加,壳聚糖在3174cm-1处宽峰向3100cm-1处偏移且变宽,表明茶多酚分子与壳聚糖链中的-OH或-NH2之间发生相互作用,游离O-H和N-H伸缩减少,分子间氢键得到加强[23]。位于1650~1300cm-1处的壳聚糖酰胺Ⅰ带、酰胺Ⅱ带、酰胺Ⅲ带均发生不同程度的振动频率降低,强度增加,这是由茶多酚上的酚羟基与壳聚糖上的C=O、C-N和N-H基团结合形成氢键引起的[24] 。壳聚糖/茶多酚复合膜(CS50/TPP50, CS75/TPP25)酰胺Ⅰ带、酰胺Ⅱ带、酰胺Ⅲ带右偏程度均大于壳聚糖/明胶复合膜(CS50/GT50, CS75/GT25),这表明茶多酚与壳聚糖之间形成的氢键数量大于明胶与壳聚糖之间形成的氢键数量。这也与壳聚糖/茶多酚复合膜的吸水性、溶胀性、失重性试验现象相吻合。
而在壳聚糖/明胶/茶多酚复合膜(CS50/GT25/TPP25)红外光谱上,茶多酚在1691cm-1处较为尖锐的峰消失,在壳聚糖/茶多酚复合膜(CS50/TPP50, CS75/TPP25)红外光谱上,该处尖峰随着壳聚糖含量的增加而减弱,这表明茶多酚上-OH可能与壳聚糖、明胶上的C=O存在相互作用,且壳聚糖、明胶、茶多酚共混时,相互作用增强。此外,壳聚糖/明胶/茶多酚复合膜(CS50/GT25/TPP25)在1622cm-1 C=O伸缩振动(酰胺Ⅰ)与壳聚糖/明胶膜(CS50/GT50, CS75/GT25)相比,振动频率有所损失,这表明壳聚糖、明胶、茶多酚三者之间分子间作用力增强,这与壳聚糖/明胶/茶多酚复合膜的吸水性、溶胀性、失重性试验现象相吻合。
3 結 论
采用流延法制备了不同质量比的壳聚糖/明胶/茶多酚复合膜,对复合膜溶胀性能和失重性能的影响进行了研究,得出以下结论:
a)含有茶多酚的壳聚糖复合膜吸水率、溶胀率、失重率明显偏小;并且随着时间增加,含茶多酚的复合膜的吸水率出现先增大后减小的趋势,溶胀率也出现一定程度的递减,失重率随时间增加没有明显变化。
b)结合红外光谱测试图,可以认为茶多酚与壳聚糖发生了分子间相互作用,茶多酚分子中的酚羟基与壳聚糖大分子中的氨基和羰基结合形成氢键,增强了分子间作用力,有效减少溶剂分子渗透进入材料内部。
c)明胶是水溶性高分子蛋白质,但是它与茶多酚氢键作用,疏水作用或静电作用发生了较为强烈的作用,极大地改变了明胶的水溶性特点。
d)作为食品包装材料的壳聚糖/明胶/茶多酚复合膜的最优配比为67.55%的壳聚糖,0%的明胶和32.45%的茶多酚,此配比制备的复合膜具有不随环境湿度发生形变,且不易吸水增重、溶解失重的优良性能。
参考文献:
[1]GOODAY G W. Physiology of microbial degradation of chitin and chitosan[J]. Biodegradation, 1990, 1(2/3): 177-190.
[2]BUTLER B L, VERGANO P J, TESTIN R F, et al. Mechanical and barrier properties of edible chitosan films as affected by composition and storage[J]. Journal of Food Science, 1996, 61(5): 953-956.
[3]VASCONEZ M B, FLORES SK, CAMPOS C A, et al. Antimicrobial activity and physical properties of chitosan-tapioca starch based edible films and coatings[J]. Food Research International, 2009, 42(7): 762-769.
[4]ZARGAR V, ASGHARI M, DASHTI A. A review on chitin and chitosan polymers: Structure, chemistry, solubility, derivatives and applications[J]. ChemBioEng Reviews, 2015, 2(3): 204-226.
[5]HOSSEINI S F, REZAEI M, ZANDI M, et al. Preparation and functional properties of fish gelatin-chitosan blend edible films[J]. Food Chemistry, 2013, 136(3-4): 1490-1495.
[6]LI J H, MIAO J, WU J L, et al. Preparation and characterization of active gelatin-based films incorporated with natural antioxidants[J]. Food Hydrocolloids, 2014, 37: 166-173.
[7]WANG Y H, ZHANG R, QIN W, et al. Physicochemical properties of gelatin films containing tea polyphenol-loaded chitosan nanoparticles generated by electrospray[J]. Materials & Design, 2020, 185: 108277.
[8]CARDOSO G P, DUTRA M P,FONTES P R, et al. Selection of a chitosan gelatin-based edible coating for color preservation of beef in retail display[J]. Meat Science, 2016, 114: 85-94
[9]ALISHAHI A, ADER M. Applications of chitosan in the seafood industry and aquaculture: A review[J]. Food and Bioprocess Technology, 2012, 5(3): 817-830.
[10]NOWZARI F, SHáBANPOUR B, OJAGH S M. Comparison of chitosan-gelatin composite and bilayer coating and film effect on the quality of refrigerated rainbow trout[J]. Food Chemistry, 2013, 141(3): 667-1672.
[11]BAJPAI SK, BAJPAI M, SHAH F F. Alginate dialdehyde(AD)-crosslinked casein films: Synthesis, characterization and water absorption behavior[J]. Designed Monomers and Polymers, 2016, 19(5): 406-419.
[12]趙麒.纤维素/聚芳醚酮复合膜的制备及性能研究[D].长春:长春工业大学,2019.
ZHAO Qi. Preparation and Properties of Cellulose/Polyether Ketone Composite Membrane[D]. Changchun: Changchun University of Technology, 2019.
[13]LIU J, MENG C G, LIU S, et al. Preparation and characterization of protocatechuic acid grafted chitosan films with antioxidant activity[J]. Food Hydrocolloids, 2017, 63: 457-466.
[14]王卉,邵东旭,赵由之,等.茶多酚在钙交联果胶/壳聚糖复合膜中的缓释性研究[J].现代食品科技,2013,29(4):719-721,744.
WANG Hui, SHAO Dongxu, ZHAO Youzhi, et al. Controlled release of tea polyphenols from calcium-crosslinked pectin/chitosan complex films[J]. Modern Food Science and Technology, 2013, 29(4): 719-721, 744.
[15]MARTíNEZ-CAMACHO A P, CORTEZ-ROCHA M O, EZQUERRA-BRAUER J M, et al. Chitosan composite films: Thermal, structural, mechanical and antifungal properties[J]. Carbohydrate Polymers, 2010, 82(2): 305-315.
[16]KADAM D, MOMIN B, PALAMTHODI S, et al. Physicochemical and functional properties of chitosan-based nano-composite films incorporated with biogenic silver nanoparticles[J]. Carbohydrate Polymers, 2019, 211: 124-132.
[17]YONG H M, WANG X C, BAI R Y, et al. Development of antioxidant and intelligent pH-sensing packaging films by incorporating purple-fleshed sweet potato extract into chitosan matrix[J]. Food Hydrocolloids, 2019, 90: 216-224.
[18]RIVERO S, GARCíA M A, PINOTTI A. Crosslinking capacity of tannic acid in plasticized chitosan films[J]. Carbohydrate Polymers, 2010, 82(2): 270-276.
[19]MUYONGA J H, COLE C G B, DUODUK G. Fourier transform infrared (FTIR) spectroscopic study of acid soluble collagen and gelatin from skins and bones of young and adult Nile perch (Lates niloticus)[J]. Food Chemistry, 2004, 86(3): 325-332.
[20]LIANG J, LI F, FANG Y, et al. Synthesis, characterization and cytotoxicity studies of chitosan-coated tea polyphenols nanoparticles[J]. Colloids and Surfaces B: Biointerfaces, 2011, 82(2): 297-301.
[21]SUN L J, SUN J J, CHEN L, et al. Preparation and characterization of chitosan film incorporated with thinned young apple polyphenols as an active packaging material[J]. Carbohydrate Polymers, 2017, 163: 81-91.
[22]YIN Y J, LI Z Y, SUN Y B, et al. A preliminary study on chitosan/gelatin polyelectrolyte complex formation[J]. Journal of Materials Science, 2005, 40(17): 4649-4652.
[23]WU Y, YANG W L, WANG C C, et al. Chitosan nanoparticles as a novel delivery system for ammonium glycyrrhizinate[J]. International Journal of Pharmaceutics, 2005, 295(1/2): 235-245.
[24]CHANPHAI P, TAJMIR-RIAHI H A. Conjugation of tea catechins with chitosan nanoparticles[J]. Food Hydrocolloids, 2018, 84: 561-570.
