微小RNA-21对脓毒症急性肺损伤小鼠肺组织的修复作用及其与PTEN的关系
2022-01-27葛晨刘俊行付优贾丽静龙玲杜全胜
葛晨,刘俊行,付优,贾丽静,龙玲,杜全胜
1河北省人民医院重症医学科,石家庄050000;2河北省儿童医院骨科
脓毒症是由感染诱发的宿主炎症失调反应,可导致进行性器官功能障碍,其中最早受损的脏器是肺脏[1],临床上表现为急性肺损伤或急性呼吸窘迫综合征。流行病学研究显示,脓毒症患者中急性肺损伤的发生率达40%,病死率高达40%~50%[2]。脓毒症急性肺损伤的病理机制复杂,包括炎症因子释放、氧化应激、免疫失调等。脓毒症导致免疫细胞群体性过度活化,引起炎症介质肿瘤坏死因子α(TNF-α)、白细胞介素6(IL-6)等过度释放,大量炎症细胞聚集到肺部,导致急性肺损伤[3]。同时,在脓毒症全身炎症反应过程中,炎症细胞被激活,合成和分泌大量活性氧,造成体内氧化—还原失衡,产生氧化应激状态,损伤机体细胞、组织和器官,最终发展为器官功能障碍和衰竭。氧化应激反应与炎症反应相互影响,相互促进,形成炎症—氧化应激的恶性循环[4]。微小RNA(miRNA)是一类长度约22个核苷酸的内源性非编码单链RNA,它通过抑制靶基因翻译调节蛋白表达,广泛参与人体生长、分化、免疫应答及炎症反应等生理过程,其表达及功能失调与心血管疾病、肿瘤、脓毒症等疾病密切相关[5-6]。研究显示,微小RNA-21(miR-21)在炎症疾病中发挥调控作用[7],并可通过负向调节磷脂酶和张力蛋白同源物(PTEN)影响细胞分化、生长和凋亡[8-10]。然而,目前miR-21与脓毒症诱导的急性肺损伤是否相关尚不清楚。2019年9月—2020年3月,我们通过建立脓毒症急性肺损伤小鼠模型,观察小鼠肺组织中miR-21的表达情况,并用腺病毒转染方法干预miR-21表达,观察其对肺水肿、血清炎症因子及氧化应激指标的影响,及其与PTEN的关系。
1 材料与方法
1.1 材料
1.1.1 动物 清洁级健康雄性昆明小鼠96只,体质量(30±5)g,由河北医科大学实验动物中心提供。饲养于清洁级动物房,饲养条件为明暗12 h/12 h交替,温度18~22 ℃,湿度40%~60%,自由进食、饮水。适应性饲养1周后用于实验。
1.1.2 主要试剂与仪器 载有miR-21前体或抑制剂的腺病毒(美国invitrogen公司),PTEN抑制剂(Sigma公司,美国),小鼠TNF-α、IL-6 ELISA试剂盒(杭州联科科技公司),小鼠活性氧(ROS)、超氧化物歧化酶(SOD)ELISA试剂盒(南京建成生物工程研究所),TRIzol提取液(美国Ambion公司),miRNA逆转录试剂盒(美国GeneCopoeia公司),RT-PCR试剂盒(美国GeneCopoeia公司),PTEN抗体和羊抗兔抗体(美国KPL公司)。血气分析仪(Premier 3000, 意大利GEM公司),低温离心机(德国Eppendorf公司),紫外分光光度仪(日本Shimadzu公司),反转录仪(美国ABI公司),Real-time PCR System(美国ABI公司)。
1.2 动物分组干预与模型制备 采用随机数字表法将小鼠分为假手术组(n=32)、模型组(n=32)、miR-21前体组(MP组,n=8)、miR-21抑制剂组(MI组,n=8)、miR-21前体+PTEN抑制剂组(MP+Anti-PTEN组,n=8)、miR-21抑制剂+PTEN抑制剂组(MI+Anti-PTEN组,n=8)。采用盲肠结扎穿孔术制备脓毒症急性肺损伤模型。小鼠术前禁食12 h,腹腔注射10%水合氯醛3 mL/kg进行麻醉。仰卧位固定,腹部备皮、消毒,沿腹正中线切开腹壁约1.0 cm切口,探查分离盲肠,用18号无菌注射器针头贯穿盲肠3次,后将穿刺盲肠还纳至腹腔,并逐层缝合腹部切口。假手术组仅开腹后探查盲肠,不进行穿刺处理;模型组采用盲肠结扎穿孔术制备脓毒症急性肺损伤模型;MP组、MI组于造模前4 d分别经尾静脉注入载有miR-21前体和miR-21抑制剂的腺病毒0.2 mL(1×109pfu/mL);MP+Anti-PTEN组、MI+Anti-PTEN组于造模前4 d分别转染miR-21前体、miR-21抑制剂,于造模前30 min给予尾静脉注射10 μg/kg PTEN抑制剂。
1.3 氧合指数(OI)测算 造模后24 h,每组各取8只小鼠,麻醉开腹,腹主动脉取血1 mL,使用血气分析仪进行血气分析,以氧分压/吸入氧浓度计算OI。
1.4 肺组织湿重/干重比值(W/D)测定 完成血气分析后,取小鼠左肺组织,用吸水纸吸干,置于电子天平称重,记录肺湿重;将肺组织置于70 ℃恒温烘箱干燥48 h再次称重,记录肺干重,计算肺W/D。
1.5 血清炎症因子TNF-α、IL-6和氧化应激指标ROS、SOD检测 造模后24 h,取小鼠腹主动脉血2 mL,静置后4 ℃ 4 000 r/min离心10 min,取血清-80 ℃保存。采用ELISA法检测血清TNF-α、IL-6、ROS、SOD水平,严格按照试剂盒说明书操作。绘制标准曲线和回归方程,测定样品吸光度,代入标准曲线计算样品浓度。
1.6 肺组织miR-21表达检测 采用qRT-PCR法。取假手术组、模型组造模后6、12、24、48 h 各8只小鼠右肺组织,液氮速冻,-80 ℃保存,用于肺组织miR-21表达检测;取冻存的肺组织,应用TRIzol提取肺组织RNA,使用超微量紫外分光光度计检测纯度和浓度,获得高质量RNA。按照miRNA逆转录试剂盒进行逆转录。miR-21引物序列:上游5′-GAAATGCCTCACAGCTATCGT-3′,下游5′-CCTCCA-CAAAGAGCCACC-3′。逆转录条件:37 ℃ 60 min,85 ℃ 5 min。扩增条件:95 ℃预变性10 min,95 ℃变性10 s,60 ℃退火20 s,72 ℃延伸20 s,40个循环。以U6为内参,采用2-ΔΔCt法计算miR-21的相对表达量。
1.7 干预miR-21表达对PTEN蛋白表达的调控作用观察 取假手术组、模型组、MP组、MI组造模后24 h的右肺组织,液氮速冻,-80 ℃保存,用于检测miR-21及PTEN蛋白表达。miR-21检测方法参照“1.6”,PTEN蛋白检测采用Western blotting法。取冻存的肺组织,称取100 mg,加入裂解液后充分匀浆,4 ℃ 12 000 r/min离心20 min,BCA法测定蛋白质浓度。取100 μg蛋白样品,加入上样缓冲液,沸水变性5 min,电泳后将蛋白转移到PVDF膜,5%脱脂奶粉室温封闭1 h。加入PTEN抗体(1∶1 000)4 ℃孵育过夜。TBST洗膜3次,每次15 min。加入羊抗兔抗体(1∶5 000)37 ℃孵育1 h,TBST洗膜3次,每次10 min。ECL显色,用Image J软件测定条带灰度值,以目的蛋白的灰度值与GAPDH的灰度值的比值代表目的蛋白的相对表达量。
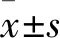
2 结果
2.1 各组OI比较 假手术组、模型组、MP组、MI组、MP+Anti-PTEN组、MI+Anti-PTEN组OI分别为295±28、180±19、225±21、125±13、262±25、256±26。与假手术组比较,模型组OI降低(P<0.05);与模型组比较,MP组、MP+Anti-PTEN组、MI+Anti-PTEN组OI均升高,MI组OI降低(P均<0.05);与MP组比较,MP+Anti-PTEN组、MI+Anti-PTEN组OI升高(P均<0.05);MP+Anti-PTEN组与MI+Anti-PTEN组比较差异无统计学意义(P>0.05)。
2.2 各组肺W/D比较 假手术组、模型组、MP组、MI组、MP+Anti-PTEN组、MI+Anti-PTEN组肺W/D分别为4.0±0.4、7.3±0.7、6.1±0.5、9.6±0.8、4.8±0.5、4.9±0.5。与假手术组比较,模型组W/D升高(P<0.05);与模型组比较,MP组、MP+Anti-PTEN组、MI+Anti-PTEN组W/D均下降,MI组W/D升高(P均<0.05);与MP组比较,MP+Anti-PTEN组、MI+Anti-PTEN组W/D下降(P均<0.05);MP+Anti-PTEN组与MI+Anti-PTEN组比较差异无统计学意义(P>0.05)。
2.3 各组血清TNF-α、IL-6、ROS、SOD水平比较 与假手术组比较,模型组血清TNF-α、IL-6、ROS、SOD水平升高(P均<0.05);与模型组比较,MP组、MP+Anti-PTEN组、MI+Anti-PTEN组血清TNF-α、IL-6、ROS、SOD水平下降(P均<0.05),MI组TNF-α、IL-6、ROS、SOD水平升高(P均<0.05);与MP组比较,MP+Anti-PTEN组、MI+Anti-PTEN组血清TNF-α、IL-6、ROS、SOD水平下降(P均<0.05);MP+Anti-PTEN组与MI+Anti-PTEN组比较差异无统计学意义(P均>0.05)。见表1。
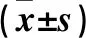
表1 各组造模后24 h血清TNF-α、IL-6、ROS、SOD水平比较
2.4 模型组造模后不同时间点肺组织miR-21表达变化 造模后6、12、24、48 h,模型组miR-21表达均较假手术组升高,造模后24 h达到峰值。见表2。
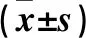
表2 假手术组和模型组造模后不同时间点肺组织miR-21表达比较
2.5 干预miR-21表达对PTEN蛋白表达的调控作用 与假手术组比较,模型组和MP组miR-21表达均升高、PTEN蛋白表达均下降,MI组miR-21表达下降、PTEN蛋白表达升高(P均<0.05);与模型组比较,MP组miR-21表达升高、PTEN蛋白表达下降,MI组miR-21表达下降、PTEN蛋白表达升高(P均<0.05)。
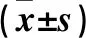
表3 干预miR-21表达对PTEN蛋白表达的调控作用
3 讨论
研究发现,多种miRNA在脓毒症中表达异常,其中miR-122、miR-133a、miR-146a变化较为显著,逐步成为早期诊断脓毒症的生物标志物,在脓毒症防治中发挥重要作用[11-13]。研究表明,miR-21参与多种疾病的炎症反应,且存在抗炎作用。miR-21在过氧化氢诱导的Ⅱ型肺泡上皮细胞凋亡中起保护作用[14],在动物试验中证实可以减轻高氧性肺损伤[15]。而miR-21在脓毒症急性肺损伤中的表达及如何发挥作用仍未可知。本研究结果显示,脓毒症急性肺损伤小鼠造模后6、12、24、48 h时miR-21表达水平均高于假手术组,24 h达到峰值,提示miR-21参与了脓毒症急性肺损伤的过程。我们对小鼠通过注射载有miR-21前体或抑制剂的腺病毒干预miR-21表达,结果显示,MP组肺组织miR-21表达较模型组升高,MI组肺组织miR-21表达较模型组下降。与模型组比较,MP组OI升高,W/D下降,MI组OI降低,W/D升高,表明增加miR-21表达可减轻脓毒症小鼠肺损伤,而抑制miR-21表达会加重脓毒症小鼠肺组织损伤。
在脓毒症急性肺损伤的发病及病理过程中,免疫反应导致大量炎症介质过度释放。TNF-α是炎症反应过程中出现最早的炎症介质,能激发炎症瀑布效应,促使IL-6、活性氧合成和释放,加重炎症反应;TNF-α可以损伤肺毛细血管细胞,增加血管通透性,导致肺水肿;还可通过直接损伤Ⅱ型肺泡上皮细胞,肺泡表面活性物质减少,进而出现肺泡萎陷[16],临床出现顽固性低氧血症、难治性呼吸困难、紫绀等症状。本研究结果显示,与模型组比较,MP组血清TNF-α、IL-6水平下降,MI组TNF-α、IL-6水平升高,说明上调miR-21表达可减轻脓毒症小鼠机体炎症反应。既往研究表明,多种miRNA通过抑制炎症因子受体mRNA表达以减少炎症介质的释放[17],提示miR-21可能通过与炎症通路中mRNA结合促其降解,抑制炎症反应,进一步改善临床症状。
在脓毒症发病过程中,除过度炎症反应外,氧化应激也是脓毒症急性肺损伤的重要发病机制之一,并且与炎症反应相互促进。大量炎症因子激活炎症细胞,导致大量活性氧合成和分泌,形成氧化应激状态。氧化应激对脂类、蛋白质产生强氧化作用,而这些物质是稳定细胞器和生物膜的重要成分,机体细胞的过氧化损伤导致组织缺血、水肿,造成组织器官损伤,进一步发展为器官功能障碍和衰竭。本研究结果显示,与模型组比较,MP组血清ROS、SOD水平下降,MI组血清ROS、SOD水平升高。表明增加miR-21表达可减轻脓毒症相关的炎症反应和氧化应激反应,抑制miR-21表达后炎症反应和氧化应激反应增加。miR-21可能通过减轻脓毒症相关的炎症反应及氧化应激反应,减轻炎症因子及活性氧对肺毛细血管细胞及Ⅱ型肺泡上皮细胞的损伤,增加肺泡表面活性物质的释放,进而减轻肺水肿及肺泡萎陷,使W/D下降、OI升高,改善呼吸困难及低氧血症。
关于人类癌症基因的研究显示,PTEN是miR-21-5p的靶基因,miR-21-5p通过抑制PTEN进而抑制蛋白激酶B(Akt)通路,促进巨噬细胞极化和肺癌细胞凋亡。有研究认为,miR-21-5p可作用于PTEN/Akt信号通路,抑制Ⅱ型肺泡上皮细胞凋亡,进而保护肺组织[15]。Akt是一个重要细胞信号转导通路,而PTEN是一种双蛋白脂质磷酸酶,可负性调节Akt信号通路。本研究通过观察miR-21变化对PTEN表达的影响,分析二者之间的关系,结果显示,与假手术组比较,模型组PTEN表达下降;MP组上调miR-21后PTEN表达下降,而MI组下调miR-21表达后PTEN表达增加。这表明在小鼠脓毒症急性肺损伤中PTEN是miR-21的作用靶点。为进一步验证PTEN的作用,本研究采用PTEN抑制剂降低PTEN蛋白表达,结果显示,与MP组造模后24 h比较,MP+Anti-PTEN组、MI+Anti-PTEN组TNF-α、IL-6、ROS、SOD水平、W/D下降,OI升高,说明抑制PTEN后miR-21对减轻炎症反应、氧化应激、改善肺损伤的作用更强,产生了累加效应。而MP+Anti-PTEN组与MI+Anti-PTEN组TNF-α、IL-6、ROS、SOD水平、W/D、OI比较差异无统计学意义,说明PTEN被抑制后,上调或下调miR-21表达对脓毒症中炎症反应、氧化应激、改善肺损伤影响无差异,进一步验证了PTEN确为miR-21的作用靶点。
综上所述,脓毒症小鼠急性肺损伤后肺组织中miR-21表达增加,增加miR-21表达可减轻脓毒症小鼠炎症反应及氧化应激从而减轻肺损伤;而抑制miR-21表达后可加重脓毒症小鼠炎症反应和氧化应激而加重肺损伤,其机制可能是通过抑制PTEN发挥保护作用。
