联合加入二氢杨梅素与吡柔比星培养的人肝母细胞瘤细胞活性及心肌细胞毒性反应观察
2022-01-27麦天赋冼晓晖黄敏诗庄智杰李明意
麦天赋,冼晓晖,黄敏诗,庄智杰,李明意
1广东医科大学附属医院小儿外科,广东湛江524000;2广东医科大学附属医院肝胆外科
肝母细胞瘤(HB)是儿童时期最常见的恶性肝脏肿瘤,大多数患儿在5岁以内发病。在过去30年里,得益于化疗方案、成像方式和手术管理方面的进步,HB的总体存活率从30%增加到70%[1]。竞争性手术切除术是治疗HB的主要手段,但是大量病例因肿瘤体积大、多灶或靠近主要血管而无法切除。辅助化疗可使肿瘤缩小而易于切除,并显著改善HB患者的预后和生存率[2-3]。蒽环类药物吡柔比星(THP)是HB的主要化疗药物之一,具有潜在的心脏毒性[4]。临床上多采用联合化疗提高药物的治疗效果,而药物的毒性不能重叠。二氢杨梅素(DHM)是存在于藤茶中的一种黄酮类化合物,具有抗炎、抗肿瘤、护肝等多种药理学活性[5]。我们的前期研究发现,DHM不仅能抑制肝癌细胞增殖并诱导其凋亡[6],而且还能增强肝癌细胞对奈达铂的化疗效果[7]。但目前尚不清楚DHM对HB的作用及机制,其与THP联合作用的效果也有待探讨。活性氧(ROS)被认为是DNA损伤的介质,能够触发肿瘤的程序性细胞死亡[8]。某些化疗药物通过形成线粒体DNA加合物来增加线粒体ROS生成,因此促氧化应激策略可作为增强化疗效果的辅助手段。此外,除了杀伤肿瘤细胞,化疗药物也可能引起正常组织细胞中ROS水平增加,这是化疗药物产生毒副作用的一个重要原因。因此,联合化疗在增强疗效的同时,应尽量避免ROS诱导的不良反应。研究表明,磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B(Akt)通路失调几乎存在于所有癌症包括HB中[9],通过阻断PI3K介导的Akt活化能够抑制肿瘤细胞增殖并促使其凋亡[10]。因此,靶向PI3K/Akt通路可能成为抗HB的潜在治疗方向。2020年9月—2021年9月,我们观察了THP、DHM单用及联合作用在体外对人肝母细胞瘤细胞株HuH-6增殖和凋亡相关通路的影响,及其对人心肌细胞株AC16的毒性,旨在了解DHM能否在不增加心脏毒性的基础上增强THP对HB的化疗疗效,并探讨其作用机制与Akt活化的关系。
1 材料与方法
1.1 材料
1.1.1 细胞与药物 人HB细胞株HuH-6和人心肌细胞株AC16,购自中国典型培养物保藏中心细胞库。THP和DHM购自上海皓元生物医药科技有限公司。
1.1.2 主要试剂 低糖DMEM培养基、高糖DMEM培养基、胎牛血清、青链霉素溶液、胰蛋白酶购自美国Gibco公司;CCK-8试剂盒、乳酸脱氢酶细胞毒性检测试剂盒、活性氧检测试剂盒、Western blotting及IP细胞裂解液、BCA蛋白浓度测定试剂盒、ECL化学发光试剂盒购自上海碧云天生物技术有限公司;AnnexinⅤ-FITC/PI细胞凋亡检测试剂盒购自美国BD公司;β肌动蛋白(β-actin)、增殖细胞核抗原(PCNA)、Akt、磷酸化Akt(p-Akt)、B淋巴细胞瘤2(Bcl-2)、Bcl-2关联X蛋白(Bax)、半胱氨酸蛋白酶3(caspase-3)、半胱氨酸蛋白酶9(caspase-9)、裂解的半胱氨酸蛋白酶-3(cleaved caspase-3)、5-溴脱氧尿嘧啶核苷(BrdU)抗体和二抗购自美国CST公司。
1.1.3 主要仪器 CO2细胞培养箱(美国赛默飞),荧光倒置显微镜(德国莱卡),Tanon5200成像系统(上海天能),高速冷冻离心机(美国赛默飞),流式细胞仪,酶标仪(美国赛默飞)。
1.2 细胞培养 取HuH-6和AC16细胞,分别加入含10%胎牛血清的高糖和低糖DMEM培养基,置于37 ℃、5% CO2培养箱中培养。当细胞融合度约90%时,进行传代接种。
1.3 DHM最佳作用浓度的筛选 取对数生长期HuH-6和AC16细胞,以3×103/孔的密度接种于96孔细胞培养板,待细胞融合度达到约70%,用不含胎牛血清的基础培养基饥饿培养24 h,以获得同步化生长。将细胞分为6组,分别加入0、100、150、200、250、300 μmol/L DHM,置于37 ℃、5% CO2培养箱中培养48 h。采用CCK-8法检测细胞活性。每孔加入100 μL稀释的CCK-8溶液,37 ℃孵育3 h,用酶标仪测量450 nm波长处的光密度(OD)值,以此代表细胞活性。选择能够有效抑制HuH-6细胞活性且对AC16细胞毒性作用最弱的浓度作为DHM的最佳作用浓度。
1.4 与DHM联合作用的THP最佳浓度筛选
1.4.1 HuH-6细胞活性检测 取对数生长期HuH-6细胞,以3×103/孔接种于96孔细胞培养板,待细胞融合度达到约70%,用不含胎牛血清的基础培养基饥饿培养24 h,以获得同步化生长。将细胞分为6组:①Ctrl组为正常培养的细胞;②DHM组给予2最佳作用浓度的DHM处理;③DHM+4、6、8、10 μmol/L THP组细胞分别给予最佳作用浓度的DHM与4、6、8、10 μmol/L THP混合液处理。各组置于37 ℃、5% CO2培养箱中培养48 h。采用CCK-8法检测细胞活性,具体步骤同“1.3”。
1.4.2 AC16细胞毒性反应观察 取对数生长期AC16细胞,按照“1.4.1”的方法进行培养、分组和给药。取处理后的AC16细胞,采用LDH释放试验检测细胞毒性。以400 g离心5 min,取上清液。PBS冲洗,加入150 μL LDH释放试剂孵育1 h,以400 g离心5 min,取上清液。将两次获得的上清液混合,加入60 μL LDH检测液,室温避光孵育30 min,上酶标仪在490 nm波长处读取OD值。LDH释放率(%)=[细胞培养液上清中的LDH/(细胞培养液上清中的LDH+细胞内的LDH)]×100%。
1.5 细胞内ROS水平检测 采用探针法。取对数生长期AC16细胞,待细胞融合度达到约70%时,进行24 h饥饿培养。将细胞分为4组:①Ctrl组,加入含2%胎牛血清的高糖DMEM培养基正常培养;②DHM组,加入DHM;③THP组,加入THP;④DHM+THP组,同时加入DHM和THP。培养48 h后,加入胰酶消化,以200 g离心5 min,收集细胞沉淀。加入终浓度10 μmol/L的DCFH-DA,37 ℃孵育20 min。PBS清洗3次,上流式细胞仪检测细胞的平均荧光强度,检测的激发波长为488 nm,发射波长为525 nm。由于DCFH-DA本身没有荧光,但其进入细胞内被酯酶水解生成DCFH,经细胞内的ROS氧化成有荧光的DCF,因此通过检测DCF荧光强度可反映细胞内ROS水平。
1.6 细胞增殖检测 采用BrdU掺入法。取对数生长期HuH-6细胞,接种于24孔细胞培养板,按照“1.5”的方法进行分组和给药,处理48 h后,加入10 μmol/L BrdU溶液孵育1 h。室温下用4%多聚甲醛固定细胞30 min,用0.2% Triton X-100透化30 min。加入1 mol/L盐酸冰上孵育10 min,加入2 mol/L盐酸室温孵育10 min,转37 ℃孵育20 min,然后用0.1 mol/L硼酸钠缓冲液(pH 8.4)中和12 min。PBS清洗3次,加入免疫染色封闭液室温封闭1 h,加入抗BrdU抗体(1∶500稀释)4 ℃孵育过夜。PBS清洗3次,滴加FITC标记的二抗,室温避光孵育1 h。细胞核用DAPI复染后,用荧光倒置相差显微镜拍照,计算BrdU阳性率,用来表示细胞增殖情况。
1.7 细胞凋亡检测 采用流式细胞术。取对数生长期HuH-6细胞,按照“1.5”的方法进行分组和给药,处理48 h后,加入胰酶消化,以1×Binding Buffer重悬细胞,调整细胞密度为1×106/mL。取100 μL细胞悬液加入流式管中,加入Annexin V-FITC和PI各5 μL,室温避光孵育15 min。补加400 μL 1×Binding Buffer,1 h内上流式细胞仪检测。计数FITC阳性和PI阳性细胞数量,以Q4象限(FITC阳性)代表早期凋亡,Q2象限(FITC阳性/PI阳性)代表晚期凋亡,计算细胞早期凋亡率和晚期凋亡率。
1.8 细胞中Akt、细胞增殖及凋亡相关蛋白表达检测 采用Western blotting法检测Akt、p-Akt,细胞增殖相关蛋白PCNA,以及细胞凋亡相关蛋白Bcl-2、Bax、caspase-3、caspase-9、cleaved caspase-3、cleaved caspase-9表达水平。提取各组HuH-6细胞的总蛋白,加入上样缓冲液煮沸5 min使蛋白变性。用十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白,然后将蛋白转印至PVDF膜,用5%脱脂奶粉在室温下封闭1 h。加入Akt、p-Akt、PCNA、Bcl-2、Bax、caspase-3、caspase-9、cleaved caspase-3、cleaved caspase-9(稀释比例均为1∶1 000)和内参β-actin一抗溶液,4 ℃孵育过夜。TBST洗膜3次,加入相应的二抗溶液(稀释比例均为1∶2 000)孵育1 h。TBST洗膜3次,ECL化学发光液显影,Image J软件分析蛋白条带的灰度值,以目标蛋白条带与内参β-actin条带灰度值的比值表示目标蛋白的相对表达量。以p-Akt/Akt表示Akt活化水平,Bcl-2/Bax表示细胞凋亡状态,cleaved caspase-3/caspase-3和cleaved caspase-9/caspase-9表示caspase-3和caspase-9的裂解程度。
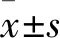
2 结果
2.1 DHM最佳作用浓度筛选结果 在HuH-6细胞中,与0 μmol/L DHM相比,150、200、250、300 μmol/L DHM作用下细胞活性均降低,其中250 μmol/L低于其他浓度(P均<0.05)。在AC16细胞中,与0 μmol/L DHM相比,100~250 μmol/L DHM作用下细胞活性无明显变化(P均>0.05),表明DHM在此浓度范围内对心肌细胞无明显毒性作用。见表1。故选择250 μmol/L作为DHM的最佳作用浓度。
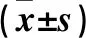
表1 不同浓度DHM对HuH-6和AC16细胞活性的影响
2.2 与DHM联合作用的THP最佳浓度筛选结果 在HuH-6细胞中,DHM+4、6、8、10 μmol/L THP组细胞活性均低于Ctrl组和DHM组(P均<0.05),其中DHM+6、8 μmol/L THP组细胞活性低于DHM+4、10 μmol/L THP组(P<0.05)。在AC16细胞中,DHM+4、6、8、10 μmol/L THP组细胞LDH释放率均高于Ctrl组和DHM组(P均<0.05),其中DHM+6 μmol/L THP组LDH释放率稍低于其他浓度组(P>0.05)。见表2。因此,250 μmol/L DHM联合6 μmol/L THP组在有效抑制HuH-6细胞活性的同时,对AC16细胞的毒性作用最弱,故选择250 μmol/L DHM联合6 μmol/L THP作为最佳作用浓度进行后续实验。
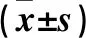
表2 DHM联合THP对HuH-6细胞活性和AC16细胞毒性的影响
2.3 DHM联合THP对AC16细胞ROS生成的影响 Ctrl组、DHM组、THP组、DHM+THP组细胞ROS水平分别为189.30±5.13、260.00±1.00、378.30±4.16、312.30±14.45,DHM组、THP组、DHM+THP组ROS水平均高于Ctrl组(P均<0.05),DHM+THP组低于THP组(P<0.05)。
2.4 DHM联合THP对HuH-6细胞增殖的影响 Ctrl组、DHM组、THP组、DHM+THP组BrdU阳性率分别为18.74%±1.76%、13.09%±1.47%、4.32%±0.99%、1.96%±0.84%%。与Ctrl组相比,DHM组、THP组、DHM+THP组BrdU阳性率均降低(P均<0.05);与DHM组比较,THP组、DHM+THP组BrdU阳性率降低(P均<0.05),DHM+THP组与THP组比较差异无统计学意义(P>0.05)。
2.5 DHM联合THP对HuH-6细胞凋亡的影响 与Ctrl组相比,DHM、THP、DHM+THP组早、晚期凋亡率均增加(P均<0.05);与DHM组相比,THP组早期凋亡率降低而晚期凋亡率增加(P均<0.05),DHM+THP组早、晚期凋亡率均增加(P均<0.05);与THP组相比,DHM+THP组早期凋亡率升高而晚期凋亡率降低(P均<0.05)。见表3。
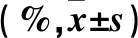
表3 DHM联合THP对HuH-6细胞凋亡的影响
2.6 DHM联合THP对细胞Akt活化及细胞增殖和凋亡相关蛋白表达的影响 与Ctrl组相比,DHM组和DHM+THP组p-Akt/Akt水平降低,DHM组、THP组和DHM+THP组PCNA、Bcl-2/Bax水平降低,DHM组、THP组和DHM+THP组cleaved caspase-3/caspase-3、cleaved caspase-9/caspase-9水平升高(P均<0.05)。与DHM组和THP组相比,DHM+THP组p-Akt/Akt、PCNA、Bcl-2/Bax水平降低,cleaved caspase-3/caspase-3、cleaved caspase-9/caspase-9水平升高(P均<0.05)。见表4。
3 讨论
HB是儿童时期最常见的恶性肝肿瘤,手术切除前后化疗可显著改善HB患儿的预后。目前针对HB的主要化疗药物包括顺铂、阿霉素、多柔吡星和THP等,但是这些药物具有耳肾毒性或心脏毒性。联合化疗指用两种或多种化疗药物进行化疗,目前临床上多采用联合化疗以提高药物的抗肿瘤效果,然而,联合化疗的毒副作用若有增强则不适用,特别是对于心肺功能差的患者。因此,本研究目的在于探究作用机制不完全相同且毒性不叠加的联合化疗药物组合,以增加化疗药物对HB的治疗效果。肿瘤联合化疗的基本原则是:组成方案的各种药物均有效;所用药物的作用机制和作用时相各不相同;各种药物之间可能互相增效;各种药物的毒性作用不重叠[11]。DHM是一种多酚羟基双氢黄酮醇类化合物,具有护肝、抗氧化、抗菌以及抑制肿瘤(如肝癌、乳腺癌、卵巢癌等)作用。既往研究显示,DHM能够抑制肝癌细胞增殖并促进其凋亡,但对正常肝细胞不具有毒性[6]。心脏毒性是蒽环类药物最严重的不良反应,因此HB患儿在应用这类药物时需早期监测其心脏毒性[12]。本研究采用常见的人源性心肌细胞株AC16在体外评估DHM与THP联合化疗的心脏毒性,结果显示,DHM在100~250 μmol/L范围内均不影响AC16细胞的存活,并且250 μmol/L DHM能最有效地抑制HuH-6细胞活性,因此将250 μmol/L作为DHM的最佳作用浓度;进一步观察显示,250 μmol/L DHM+6 μmol/L THP对HuH-6细胞有更好的抗肿瘤活性,并且对AC16细胞的毒性作用最弱。
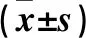
表4 DHM联合THP对细胞Akt活化及细胞增殖和凋亡相关蛋白表达的影响
ROS是一组短寿命、高活性的含氧分子,ROS蓄积不仅通过对肿瘤细胞存活或死亡信号级联的调控而参与介导化疗反应[13],还对正常组织细胞造成损伤。因此,本研究通过检测AC16细胞内ROS水平,从氧化应激方面探讨DHM与THP联合作用诱导心脏毒性的可能机制。CCK-8、LDH释放和ROS检测结果表明,THP对AC16细胞的毒性可能与其促进ROS产生有关;虽然250 μmol/L DHM单用也能引起AC16细胞ROS水平升高,但其并不影响AC16细胞的活性和LDH释放,说明DHM引起的ROS水平上调尚在AC16细胞的耐受范围之内,而且其与6 μmol/L THP联合作用时能轻微地抑制LDH释放和ROS生成,因此DHM在一定浓度范围内对心肌细胞不具有毒性作用,甚至可以减轻THP的心脏毒性。
本研究结果显示,DHM和THP单用均能抑制HuH-6细胞增殖,但二者联合作用后其抑制效果相对于单用THP并没有加强。此外,DHM引起的HuH-6细胞凋亡主要为早期凋亡,而THP主要导致晚期凋亡。这提示DHM和THP对HuH-6细胞的抗增殖作用机制及促凋亡作用时相可能存在差异,因此有潜力作为抗HB联合化疗的药物组合。
PI3K/Akt通路是肿瘤细胞生长中多种受体酪氨酸激酶的下游信号通路,对HB细胞的增殖和存活至关重要[14]。PI3K通过促进Akt磷酸化而发挥促肿瘤生长的作用[15]。PCNA在肿瘤细胞DNA复制过程中起关键作用,其翻译后修饰由Akt调控[16]。本研究结果显示,与Ctrl组相比,DHM组、THP组和DHM+THP组PCNA水平均降低,DHM组和DHM+THP组p-Akt/Akt水平降低,而DHM组无明显变化;与DHM组和THP组相比,DHM+THP组PCNA水平降低,p-Akt/Akt水平升高。这表明DHM和THP均可抑制HuH-6细胞增殖,但它们作用的机制可能不完全一致;DHM主要通过阻断Akt活化抑制HuH-6细胞增殖,而THP并非通过该途径,而且由于THP较DHM表现出更好的抑制增殖作用,导致其与DHM联合作用后效果没有明显增强。
Bcl-2和Bax通过控制线粒体膜的通透性来调节细胞的状态,Bax二聚体可增加线粒体膜通透性,而Bcl-2通过与Bax形成异聚体降低线粒体膜通透性。当线粒体膜通透性增加时,线粒体内促凋亡因子被释放到胞质中,通过裂解caspase-9使之激活,进而激活caspase-3以启动caspase级联反应,最终导致细胞凋亡。因此,Bcl-2/Bax比值降低代表促凋亡状态。本研究结果显示,与Ctrl组相比,DHM组、THP组和DHM+THP组Bcl-2/Bax降低,cleaved caspase-3/caspase-3、cleaved caspase-9/caspase-9升高;与DHM组和THP组相比,DHM+THP组Bcl-2/Bax降低,cleaved caspase-3/caspase-3、cleaved caspase-9/caspase-9升高。这表明DHM和THP在促进HuH-6细胞凋亡方面均通过线粒体途径,而且DHM和THP联合化疗在促进caspase-9裂解方面表现出协同效应,但其下游caspase-3的裂解却没有叠加作用。该机制解释了DHM和THP促进HuH-6细胞凋亡的时相存在一定差异的原因。
综上所述,HM与THP联合作用时抗HB肿瘤细胞效果增强且心肌细胞毒性不叠加;DHM可能通过阻断Akt活化从而抑制PI3K/Akt信号通路,增强THP对HuH-6细胞的增殖抑制作用及凋亡促进作用。该结果表明DHM与THP联合作用符合联合化疗的基本原则,体现为:单用DHM或THP均可抑制HuH-6细胞生长;DHM与THP作用机制不同,前者阻断Akt活化而后者却不能;DHM能协同THP抑制HuH-6细胞增殖并促进凋亡;DHM对AC16细胞没有毒性作用,并可轻微地减轻THP的心脏毒性。总体而言,DHM与THP联合作用有望成为HB化疗的新组合,今后我们将从体内水平进一步探讨二者联合化疗的作用及机制。
