小鼠腹腔手术睾丸注射抑制模型的建立
2022-01-19邹高焕许孟飞唐雅君江孙颖郑舒敏杨宇豪魏雅岚佘振宇
邹高焕, 许孟飞, 唐雅君, 江孙颖, 郑舒敏, 杨宇豪, 魏雅岚, 佘振宇
生殖生物学是生命科学的重要研究领域,是研究生殖活动及其基本规律的自然科学。WHO报告表明,不孕不育症已成为仅次于肿瘤和心血管疾病的第三大疾病。全球有4 800万对夫妇和1.86亿人患有不孕不育症。我国每8对育龄夫妇中有1对患不孕不育症,发病率为12.5%~15.0%。约30%的不孕不育症由男性不育导致,其中7%为精子质量问题,包括无精子症、少精子症、弱精子症和精子无力症等[1]。生精功能异常、染色体数目和结构异常是男性不育症的主要原因[2]。
精子发生包括精原细胞增殖、精母细胞减数分裂和精子形成等阶段[3]。减数分裂对同源染色体分离、染色体稳定性与生育能力维持至关重要。小鼠是生殖生物学常用的动物模型之一[4],其减数分裂起始于10 d龄。但2~3周龄小鼠的睾丸未沉降至阴囊,无法直接注射抑制剂或药物。早期小鼠睾丸抑制模型和减数分裂相关研究较为困难。本研究拟通过小鼠腹腔手术和睾丸生精小管注射法,实现睾丸内蛋白抑制,建立一种高效且简便的雄性减数分裂研究模型,为生殖生物学研究提供借鉴和参考。
1 材料与方法
1.1 材料
1.1.1 动物 清洁级20~30 g ICR雄性小鼠(3周龄),由福建医科大学动物实验中心提供[动物生产许可证号:2015000519041,实验动物许可证号:SYXK(闽)2016-0007]。
1.1.2 实验材料 Eg5抑制剂Dimethylenastron母液(200 mmol/L,MedChemExpress,货号:HY-19944);切片石蜡、苏木精溶液、伊红、盐酸、乙醇、二甲苯、碳酸锂、中性树胶、恒温水浴锅(DK-S22,上海精宏实验设备有限公司);石蜡超薄切片机(RM2235,德国Leica公司);光学显微镜(Ti-S2,日本Nikon公司)。
1.2 方法
1.2.1 术前准备 小鼠术前1 h断食断水。手术器械、1 × 磷酸盐缓冲液、枪头等物品高温高压灭菌(121 ℃,30 min)。
1.2.2 小鼠麻醉、固定及备皮 右手抓取小鼠尾部,置于笼盖上方,左手拇指与示指抓住小鼠颈背部皮肤。拎起后左手环指按住左腿,小指抓住鼠尾及右腿。腹中线处以30°~60°进针,深度不超过1 cm。进针后局部皮肤凹陷消失,并有落空感,回抽未见血后行腹腔注射10%水合氯醛,剂量为50 μL/10 g体质量[5]。注意不要刺入过深损伤内脏,或只进入皮下而未进入腹腔。麻醉完全后捆绑小鼠四肢,仰卧位固定于蜡盘,行下腹部至尿道口备皮。
1.2.3 腹腔手术 右手执笔式持手术刀,左手拇指和食指绷紧切口上端两侧皮肤,取下腹部正中切口逐层切开。保持切口5~10 mm,内外大小一致,充分暴露手术野。
1.2.4 睾丸注射 手术镊夹住小鼠外皮层,牵拉脂肪体,可见腹部两侧睾丸(特征为淡黄色,分布有红色睾丸动脉袢),轻夹至体外。镊子固定睾丸,注射器穿刺进行睾丸注射。缓慢注射后停留5 s拔出注射器,使药物通过生精小管扩散至整个睾丸(图1)。将50只小鼠随机分为对照组和实验抑制组。对照组注射10 μL 0.05%台盼蓝或磷酸盐缓冲液,实验抑制组注射10 μL 0.075% Dimethylenastron抑制剂。

A:腹部正中线腹部开口1 cm;B:逐层切开皮肤、筋膜层、腹膜;C:用镊子夹取睾丸至体外;D:使用1 mL注射器注射药物。图1 小鼠腹腔手术和睾丸生精小管注射的关键步骤Fig.1 Key steps of intraperitoneal surgery and testicular seminiferous tubule injection in mice
1.2.5 手术伤口缝合及术后护理 注射完成后,将睾丸轻推回腹腔,单纯间断缝合。苦味酸标记不同实验组小鼠,放回鼠笼,注意术后保暖和护理。
1.2.6 组织包埋、H-E染色和形态学观察 小鼠麻醉,切开腹腔,手术剪分离睾丸。睾丸经10%甲醛水溶液固定18 h,50%乙醇30 min,70%乙醇40 min,85%乙醇40 min,95%乙醇50 min,100%乙醇50 min,二甲苯30 min。65 ℃石蜡浸泡90 min,石蜡室温包埋过夜。超薄切片机行5 μm超薄切片,40 ℃水浴锅展片,37 ℃干燥24 h备用。
石蜡切片经无水乙醇6 min,95%乙醇、90%乙醇、80%乙醇、70%乙醇、蒸馏水各2 min。Mayer’s苏木素染色5 min,自来水5 min,蒸馏水2 min。1%盐酸乙醇溶液分色3 s后自来水洗3 min。碳酸锂饱和溶液返蓝1 min,蒸馏水洗2 min。1%伊红溶液5 min,95%乙醇脱水10 s,100%乙醇脱水3 min,二甲苯透明20 min,中性树胶封固。
2 结 果
小鼠共50只,术后死亡3只,存活率为94.0%,表明腹腔手术睾丸注射模型的小鼠存活率较高。术后小鼠的腹部切口完全愈合,无感染症状,生存状态良好。对照组和实验抑制组的小鼠体质量、小鼠睾丸质量、睾丸质量/体质量比比较,差别无统计学意义(P>0.05)。对照组和实验抑制组的小鼠睾丸长径分别为(0.68±0.01)和(0.73±0.02)cm,差别有统计学意义(P<0.05,图2)。两组小鼠睾丸的外形均完整,形态正常且无明显差异。对照组和实验抑制组小鼠睾丸的质量分别为(79.19±4.80)和(85.00±4.39)mg(图2),表明Dimethylenastron抑制剂注射对睾丸质量无明显影响。
石蜡切片和H-E染色可见,实验抑制组的睾丸生精小管内处于减数分裂的精母细胞数量增加,减数分裂中期染色体排列紊乱,部分染色体无法整齐排列。统计分析发现,Eg5抑制后生精小管的中期阻滞精母细胞数比例为(12.81±1.12)%,而对照组为(0.18±0.12)%,差别有统计学意义(P<0.05,图2),表明Dimethylenastron介导的Eg5蛋白抑制导致精母细胞中期停滞,细胞周期停滞和减数分裂染色体排列异常。
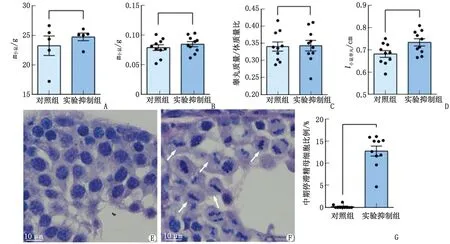
A:小鼠体质量比较;B:小鼠睾丸质量比较;C:睾丸质量/体质量比比较;D:小鼠睾丸长径比较;E:对照组生精小管(H-E染色 ×40);F:Eg5抑制组生精小管(H-E染色 ×40);G:中期停滞精母细胞比例比较。图2 小鼠睾丸内Eg5抑制导致精母细胞中期停滞和减数分裂染色体排列异常Fig.2 Eg5 inhibition in mouse testes led to spermatocyte metaphase arrest and abnormal meiotic chromosome alignment
3 讨 论
本研究介绍了腹腔手术进行睾丸注射模型的建立过程,通过腹腔手术成功实现Dimethylenastron介导的Eg5蛋白抑制,完成对小鼠睾丸内Eg5蛋白的抑制和减数分裂的相关研究,验证了实验模型的可行性。本研究具有以下优点:(1)不受小鼠年龄限制,可对2~3周龄小鼠的未沉降睾丸进行抑制剂注射,完成精子发生早期减数分裂的功能及机制研究。(2)可实现精准注射,避免因睾丸表面血管破裂出血或睾丸贯穿伤造成睾丸坏死。(3)腹腔手术睾丸注射可准确控制药物用量,添加台盼蓝指示剂可辅助注射实验和提高手术效率。(4)对生殖系统伤害较小,且阴囊壁完整。
小鼠是最典型的模式动物之一,使用也最为广泛。因此,小鼠睾丸注射抑制模型的建立对减数分裂及睾丸的研究提供了技术参考。既往的研究多采用直接经阴囊注射药物,操作简便、创口小,但易出血且无法判断药物是否注入睾丸内及是否造成睾丸贯穿伤,存在多种不确定因素[6-7]。此外,还有睾丸网注射和睾丸间质注射等方法[8]。上述注射法在睾丸两侧作切口,暴露睾丸进行注射。睾丸网注射需在显微镜下操作,对实验人员技术操作要求高;而睾丸间质注射对睾丸机械损伤过大,穿孔较多。上述几种方法均对睾丸及阴囊壁造成不同程度的损伤。传统阴囊注射法要求实验小鼠的睾丸沉降至阴囊,
一般需要鼠龄超过4周龄,对实验限制多,不利于减数分裂等精子发生的早期相关研究。另外,传统阴囊直接注射法较难保证注射的准确性,而腹腔手术睾丸注射法可保证注射位置的准确性和观察药物的扩散程度。不同的实验操作手法及选用不同试剂,对睾丸损伤程度尚无定论[8]。
小鼠腹腔手术睾丸注射实验模型仍存在一些需要关注的问题:小鼠麻醉剂的选择及其剂量;小鼠腹壁腹膜较薄,行腹腔手术时易伤及血管脏器,引发出血,污染手术野和导致术后感染,使小鼠存活率降低。腹腔手术脏器暴露时间与小鼠感染几率存在一定相关性,能否快速找到睾丸是本实验的难点,且缝合不当易引起术后腹膜粘连等问题[9],因此,要求实验人员熟练掌握各步骤方法。在小鼠腹腔手术过程,手术切口的位置选择在尿道口上方5 mm处,通过轻轻牵拉脂肪体定位睾丸和体视显微镜辅助观察,可加快寻找睾丸的速度和提高注射的精确性。在实验模型建立过程中,提高无菌操作技术、减少伤口大小、术后合理使用抗菌药物和加强术后护理,有助于提高手术安全性,减少术后并发症和提高小鼠术后存活率及实验成功率。
