Exendin-4对棕榈酸介导的胰岛β细胞TLR4/JNK/Bax通路的干预作用
2022-01-19沈喜妹杨立勇
江 震, 沈喜妹, 杨立勇
脂毒性在2型糖尿病的发病机制中起重要作用。长期暴露于高水平的游离脂肪酸(free fatty acids,FFA),如棕榈酸(palmitic acid,PA),可损害胰岛β细胞功能,干扰细胞代谢途径,诱导胰岛β细胞凋亡[1]。本课题组前期研究显示,PA主要通过激活Toll样受体4(Toll-like receptor 4,TLR4)介导β细胞损伤[2-3],导致细胞凋亡、胰岛素分泌障碍,但TLR4的下游靶信号有待进一步明确。艾塞那肽(Exendin-4)是胰高血糖素样肽-1(glucagon-like peptide-1,GLP-1)的类似物,在治疗糖尿病方面拥有很好的应用前景。Exendin-4可通过促进β细胞增殖、抑制β细胞凋亡改善β细胞的功能。本研究拟探讨TLR4下游信号c-Jun氨基末端激酶(c-Jun N-terminal kinase, JNK)/Bcl-2相关X蛋白(Bcl-2 associated X,Bax)通路在PA介导的胰岛β细胞损伤过程中所起的作用,并探讨应用Exendin-4的干预作用。
1 材料与方法
1.1 材料 (1)细胞:小鼠胰岛素瘤细胞系βTc6购自美国标准生物品收藏中心(ATCC)。(2)试剂:DMEM培养基、胎牛血清、0.25%胰酶(美国Gibco公司);PA、牛血清白蛋白(bovine serum albumin,BSA)、SP600125(美国Sigma公司);TLR4阻滞剂CLI-095(美国Invitrogen公司);TLR4激动剂LPS和JNK激动剂anisomycin(上海皓元生物医药科技有限公司);Exendin-4(以色列ProSpec-Tany公司);小鼠胰岛素ELISA试剂盒(武汉华美生物工程有限公司);TLR4、JNK、p-JNK、Bax、Bcl-2、β-actin(美国Santa Cruz公司);二抗抗体及Western-blot相关试剂(北京鼎国昌盛生物技术有限公司)。
1.2 方法
1.2.1 细胞培养及分组
1.2.1.1 细胞培养 使用含10%胎牛血清的DMEM培养基,在37 ℃、体积分数为0.05的CO2孵箱中培养细胞,生长至对数生长期后,将细胞分为对照组(无血清培养基)、BSA组(0.5% BSA)和PA组(0.5 mmol/L的PA),干预时间为24 h。
1.2.1.2 药物干预
1.2.1.2.1 TLR4或JNK阻滞剂干预试验 进入对数生长期的细胞分为对照组(无血清培养基培养24 h)、PA组(0.5 mmol/L的PA干预24 h)、CLI-095组(3 μmol/L CLI-095处理细胞24 h)、SP600125组(25 μmol/L SP600125处理细胞24 h)、PA+CLI-095组(3 μmol/L CLI-095预处理细胞4 h,再予CLI-095+PA处理细胞24 h)和PA+SP600125组(25 μmol/L SP600125预处理细胞4 h,再予SP600125+PA处理细胞24 h)。
1.2.1.2.2 Exendin-4干预试验 进入对数生长期的细胞分为对照组(无血清培养基培养24 h)、PA组(0.5 mmol/L的PA干预24 h)、Exendin-4组(50 nmol/L Exendin-4干预24 h)和Exendin-4+PA组(50 nmol/L Exendin-4预孵育细胞24 h,再予Exendin-4+PA共同干预24 h)。
1.2.1.2.3 TLR4、JNK激动剂或阻滞剂对Exendin-4干预试验 进入对数生长期的细胞分为对照组(无血清培养基培养24 h)、CLI-095组(3 μmol/L CLI-095处理细胞24 h)、SP600125组(25 μmol/L SP600125处理细胞24 h)、LPS组(10 mg/L LPS干预24 h)、anisomycin组(10 μmol/L anisomycin干预24 h)、Exendin-4+PA组(50 nmol/L Exendin-4预孵育细胞24 h,再予Exendin-4+PA共同干预24 h)、CLI-095+Exendin-4+PA组(3 μmol/L CLI-095处理细胞4 h,再予Exendin-4+PA共同干预24 h)、SP600125+Exendin-4+PA组(25 μmol/L SP600125预处理细胞4 h,再予Exendin-4+PA共同干预24 h)、LPS+Exendin-4+PA组(10 mg/L LPS预处理细胞4 h,再予Exendin-4+PA共同干预24 h)、anisomycin+Exendin-4+PA组(10 μmol/L anisomycin预处理细胞4 h,再予Exendin-4+PA共同干预24 h)。
1.2.2 葡萄糖刺激的胰岛素分泌(glucose-stimulated insulin secretion, GSIS)βTC6细胞接种于6孔板中培养至对数生长期,经各种实验因素干预特定时间后,吸弃培养液,用无糖克-林二氏重碳酸盐缓冲液(KRBB)(pH值为7.4)洗涤2遍后,用37 ℃无糖KRBB 1 mL预处理30 min,吸弃KRBB,再洗涤细胞1遍,每孔加入37 ℃ KRBB(20 mmol/L葡萄糖)孵育刺激细胞60 min,收集细胞上清,-20 ℃保存备用。
1.2.3 ELISA测定细胞上清液中胰岛素水平 取100 μL样品稀释液、100 μL各浓度标准品至包被抗体的96孔板微孔中,覆盖封板膜,37 ℃孵育2 h;移除各孔中液体,移液枪吸取100 μL生物素标记抗体工作液加入各微孔中,覆盖封板膜,37 ℃孵育1 h;吸取上清液,取300 μL 稀释好的洗涤液至各微孔中,静置1~2 min后,移除洗涤液,重复操作3次;移液枪吸取100 μL辣根过氧化物酶标记亲和素工作液加至各微孔中,覆盖封板膜,于37 ℃中孵育1 h;重复上述洗涤操作5次;取90 μL TMB底物溶液至各微孔,避光操作。在37 ℃中孵育20 min,移液枪吸取50 μL终止液至各微孔中,使液体变黄。反应终止后5 min内在450 nm波长酶标仪中检测各管OD值,并记录相应数据。裂解上述细胞,按照Trizol及BCA蛋白定量试剂盒说明书提取总蛋白,紫外分光光度计562 nm处检测蛋白量。
1.2.4 Western-blot检测蛋白表达 细胞内加入RIPA 200 μL和PMSF 2 μL,冰上裂解后吸取上清液,用BCA法进行蛋白定量。取40 μL蛋白进行SDS-PAGE电泳、转膜、封闭后,与抗体TLR4(sc-8694,1∶1 000)、JNK(sc-571,1∶500)、p-JNK(sc-6254,1∶500)、Bax(sc-6236,1∶500)、Bcl-2(sc-7832,1∶500)或β-actin(sc-47778,1∶1 000)4 ℃孵育过夜。洗膜后,取膜与稀释后的二抗(1∶5 000)室温摇晃1 h,ECL化学发光系统显色,凝胶成像分析系统进行分析。

2 结 果
2.1 PA对β细胞胰岛素分泌及TLR4/JNK/Bax信号表达的影响 PA干预βTC6细胞24 h后,βTC6细胞的GSIS水平降低(P<0.05),同时TLR4、p-JNK、Bax蛋白表达水平升高(P<0.05),Bcl-2蛋白表达、Bcl-2/Bax下降(P<0.05,表1,图1)。

表1 PA对β细胞胰岛素分泌及相关蛋白表达的影响

GSIS:葡萄糖刺激的胰岛素分泌;BSA:牛血清白蛋白;PA:棕榈酸。A:PA对胰岛素分泌的作用;B:蛋白质印迹法检测蛋白表达;C:PA对TLR4、JNK、Bax、Bcl-2蛋白表达的作用。与对照组比较,☆:P<0.05。图1 PA对β细胞胰岛素分泌及TLR4、JNK、Bax、Bcl-2蛋白表达的作用Fig.1 The effect of PA on the insulin secretion and protein expression of TLR4,JNK,Bax and Bcl-2 in β cell
2.2 TLR4及JNK抑制剂对PA作用的影响 抑制TLR4活性,可拮抗PA引起的GSIS障碍(P<0.05),下调Bax蛋白表达(P<0.05),并上调Bcl-2蛋白水平和Bcl-2/Bax(P<0.05);抑制JNK活性,亦可拮抗PA的上述损害作用(P<0.05,表2,图2)。

表2 TLR4及JNK抑制剂对PA引起的β细胞胰岛素分泌及相关蛋白表达的影响
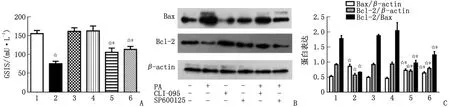
GSIS:葡萄糖刺激的胰岛素分泌。1:对照组;2:PA组;3:CLI-095组;4:SP600125组;5:PA+CLI-095组;6:PA+SP600125组。A:TLR4及JNK抑制剂对胰岛素分泌的作用;B:蛋白质印迹法检测蛋白表达;C:TLR4及JNK抑制剂对Bax、Bcl-2蛋白表达的作用。与对照组比较,☆:P<0.05;与PA组比较,#:P<0.05。图2 TLR4及JNK抑制剂对PA引起的β细胞胰岛素分泌及Bax、Bcl-2蛋白表达的作用Fig.2 The effect of TLR4 and JNK inhibitors on the insulin secretion and protein expression of Bax and Bcl-2 induced by PA in β cell
2.3 Exendin-4对PA作用的影响 Exendin-4干预可改善PA诱导的β细胞GSIS障碍(P<0.05),下调TLR4、p-JNK、Bax蛋白表达水平(P<0.05),并上调Bcl-2蛋白水平和Bcl-2/Bax(P<0.05,表3,图3)。

表3 Exendin-4对PA引起的β细胞胰岛素分泌及相关蛋白表达的影响
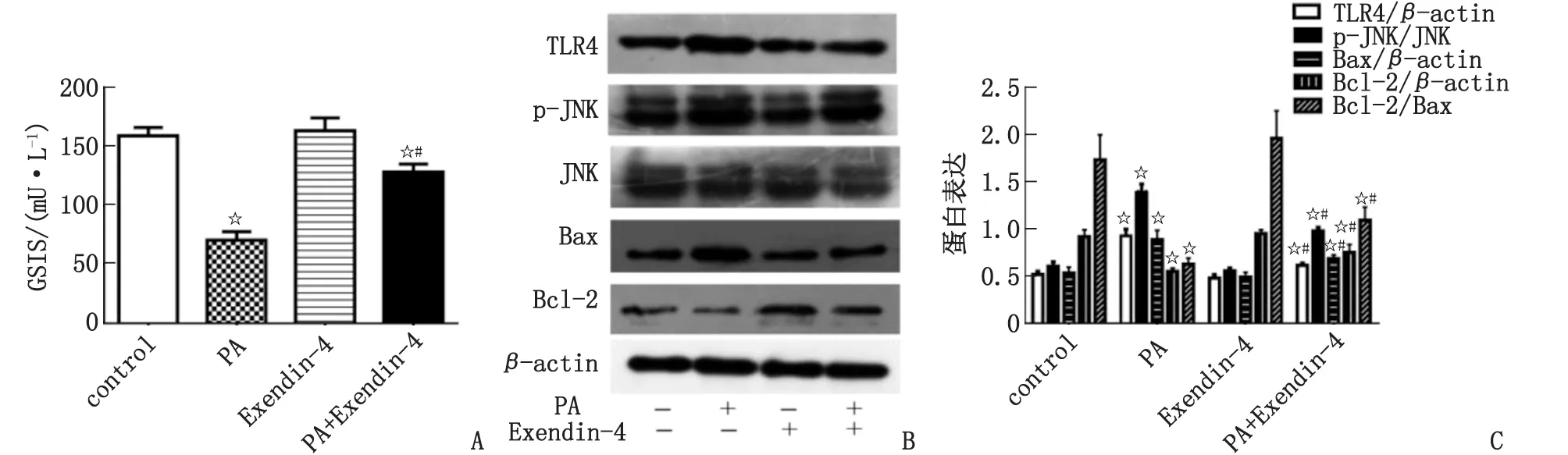
GSIS:葡萄糖刺激的胰岛素分泌。A:Exendin-4对胰岛素分泌的作用;B:蛋白质印迹法检测蛋白表达;C:Exendin-4对TLR4、JNK、Bax、Bcl-2蛋白表达的作用。与对照组比较,☆:P<0.05;与PA组比较,#:P<0.05。图3 Exendin-4对PA引起的β细胞胰岛素分泌及TLR4、JNK、Bax、Bcl-2蛋白表达的作用Fig.3 The effect of Exendin-4 on the insulin secretion and protein expression of TLR4, JNK, Bax and Bcl-2 induced by PA in β cell
2.4 调控TLR4或JNK活性对Exendin-4干预脂毒性β细胞胰岛素分泌作用的影响 抑制TLR4/JNK活性可增加Exendin-4改善脂毒性β细胞GSIS障碍的作用;反之,增强TLR4/JNK活性可削弱Exendin-4改善脂毒性β细胞GSIS障碍的作用(P<0.05,表4,图4)。
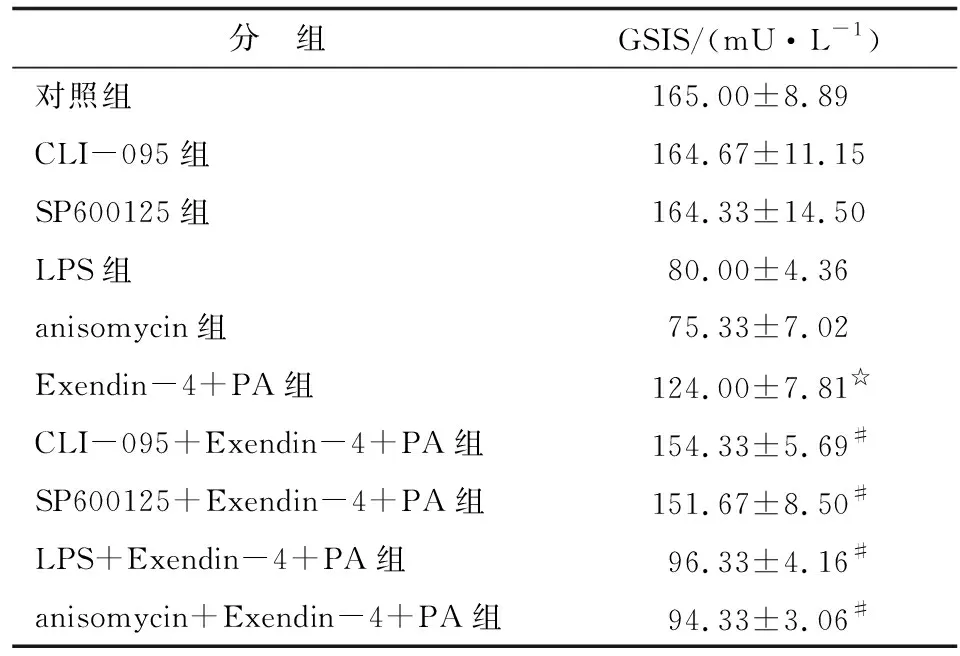
表4 TLR4或JNK的激动剂和抑制剂对Exendin-4干预脂毒性β细胞胰岛素分泌的影响
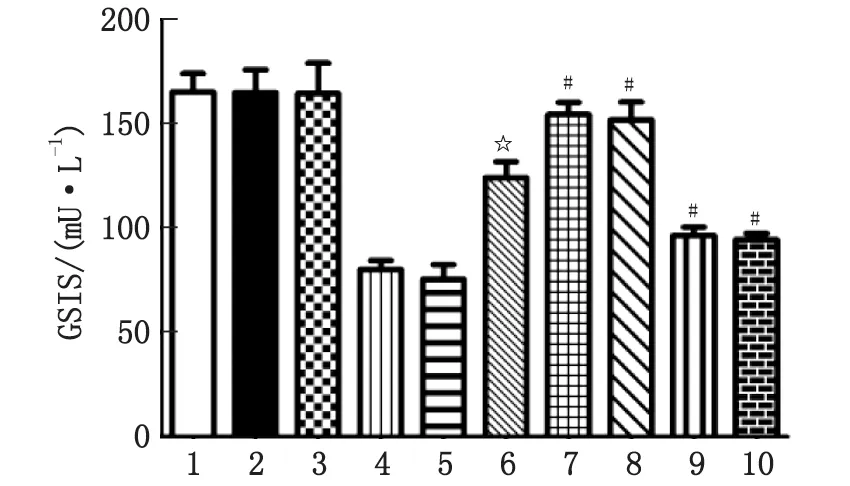
1:对照组;2:CLI-095组;3:SP600125组;4:LPS组;5:anisomycin组;6:Exendin-4+PA组;7:CLI-095+Exendin-4+PA组;8:SP600125+Exendin-4+PA组;9:LPS+Exendin-4+PA组;10:anisomycin+Exendin-4+PA组。TLR4激动剂和JNK激动剂及TLR4阻滞剂和JNK阻滞剂对Exendin-4干预脂毒性β细胞胰岛素分泌的作用。与对照组比较,☆:P<0.05;与Exendin-4+PA组比较,#:P<0.05。图4 调控TLR4或JNK活性对Exendin-4干预脂毒性β细胞胰岛素分泌的作用Fig.4 Regulating the activity of TLR4 or JNK affected the protective role of Exendin-4 on the insulin secretion of lipotoxic β-cells
3 讨 论
糖尿病患病率不断飙升,肆虐人类健康,而延缓胰岛β细胞功能持续恶化是当今防治糖尿病的主要策略。研究显示,脂毒性是诱导β细胞胰岛素分泌功能失代偿和衰竭的重要机制[4]。本课题组前期研究证实,脂毒性诱导的代谢性炎症是代谢压力引起β细胞功能衰退的关键病理机制,但尚缺乏特异干预措施[5]。
代谢性炎症是胰岛β细胞对糖脂代谢应激的适应性反应,但持续的代谢免疫失衡可不断削弱β细胞的适应性修复能力,诱导β细胞静默[6],最终导致β细胞功能衰竭和凋亡。本课题组前期的体内外研究显示,脂代谢压力可诱导β细胞持续的代谢炎症损伤,致使β细胞最终应激失代偿以及凋亡[7-9]。TLR4是介导上述代谢性炎症损伤的枢纽调控因子:TLR4是脂毒性诱导β细胞损伤的必需因素之一,但TLR4通过怎样的分子机制诱导胰岛β细胞代谢应激失代偿有待探讨。为此,在原有研究的基础上,本研究进一步探讨PA诱导胰岛β细胞功能损伤与TLR4下游信号分子JNK和Bax的关系。结果显示,PA诱导胰岛β细胞功能损伤的同时,诱导TLR4及下游信号分子JNK和Bax高表达,提示PA诱导胰岛β细胞功能损伤与TLR4/JNK/Bax蛋白表达有关。既往研究也支持该研究结果:活化的JNK在细胞质内通过调控Bax和Bcl-2分子介导线粒体途径引起的凋亡[10]。Bax和Bcl-2作为促凋亡蛋白和抗凋亡蛋白的代表,相互之间产生拮抗作用,从而实现对细胞凋亡的调控[11]。Bcl-2和Bax两蛋白间的比例关系是决定对细胞凋亡抑制作用强弱的关键因素,Bax升高促进细胞凋亡,Bcl-2升高则抑制细胞凋亡[11]。当凋亡发生时,Bax由细胞质转移到线粒体并与线粒体膜结合,使得细胞色素酶C穿过线粒体膜,激活caspase-9,继而活化caspase-3,导致细胞凋亡[12-13]。目前,国内外大多数学者把细胞Bcl-2/Bax作为判断细胞凋亡被抑制或加强的主要标志之一[14]。研究证实,链脲佐菌素或高糖干预下的INS-1细胞,通过激活JNK信号通路诱导胰岛β细胞[15-16]。本研究发现,PA可增加β细胞p-JNK和Bax表达,下调Bcl-2蛋白表达,使Bcl-2/Bax降低,抑制TLR4或JNK活性均可拮抗PA的作用,提示TLR4的介导作用可能活化JNK/Bax信号通路。TLR4/JNK/Bax通路可能在PA诱导脂毒性效应中发挥重要作用。
本研究进一步探讨降糖药物Exendin-4对TLR4/JNK/Bax通路的作用。Exendin-4作为GLP-1的类似物,具有改善胰岛β细胞功能和非胰岛素依赖途径降血糖、维持糖化血红蛋白稳定等特点[17]。本课题组既往研究发现,Exendin-4可抑制脂毒性诱导的胰岛β细胞的氧化应激[2],这一保护机制与抑制TLR4信号通路有关,由此推测TLR4是Exendin-4拮抗脂毒性效应的一个调控靶点,具体机制有待探讨。本研究发现,Exendin-4下调PA所致的p-JNK水平的升高,推测Exendin-4可通过干预JNK信号途径起保护胰岛β细胞的作用。同时,Exendin-4干预后Bax蛋白表达下调、Bcl-2蛋白表达上调,说明Exendin-4通过调控Bax和Bcl-2蛋白的比例拮抗PA的脂毒性效应。研究还发现,激活TLR4或JNK的活性可削弱Exendin-4改善脂毒性β细胞胰岛分泌功能的作用,反之抑制两者的活性均可增加Exendin-4的良性干预作用,可见Exendin-4的干预作用与抑制TLR4/JNK/Bax信号通路有关。目前鲜有报道Exendin-4通过TLR4介导胰岛β细胞脂毒性保护作用机制涉及其下游信号通路JNK/Bax,本研究对Exendin-4发挥脂毒性保护作用提供了新的补充。
综上所述,本研究发现PA引起胰岛β细胞功能障碍可能与TLR4/JNK/Bax通路有关;而Exendin-4则可抑制PA诱导的胰岛β细胞GSIS障碍,下调TLR4、p-JNK和Bax的表达,并上调Bcl-2的表达。Exendin-4抑制脂毒性诱导的TLR4/JNK/Bax通路活化可能是其保护胰岛β细胞功能的机制之一。本研究也存在局限性:(1)缺乏相关靶基因的敲除或过表达,以便进一步验证因果关系;(2)尚需进行动物实验进一步证实体外的研究结果。
