抗阻训练改善骨骼肌衰老的关键基因与信号通路鉴定
2022-01-12丁孝民尚画雨苏全生王前进
夏 志 ,赵 艳 ,丁孝民 ,尚画雨 ,苏全生 ,王前进 *
人类机体从40岁开始衰老,随着年龄增长逐渐加剧(Yamada,2018)。衰老与骨骼肌萎缩、衰弱和功能障碍等表型密切相关,衰老性肌萎缩(age-related sarcopenia)可累及高达33.6%的老龄人群(Dalle et al.,2017)。骨骼肌衰老的病原学因素较为复杂。随着衰老进程的发展,许多常见的生理过程如凋亡、氧化应激、蛋白质周转、炎症、激素失调及线粒体功能障碍等逐渐与骨骼肌的退行性变化发生潜在关联(Yoo et al.,2018)。研究表明,机体衰老的转录组标记可用于评估衰老性肌萎缩与癌性恶病质的临床干预效果(Ebhardt et al.,2017)。这一方法已被用于探讨热量限制对小鼠骨骼肌的有益促进(Lee et al.,1999)。
目前,临床对衰老性肌萎缩的治疗仍无公认标准与指引。如ACSM与AMA倡导的“Exercise is medicine”理念所言,运动带来的健康收益极为显著。现实中,运动亦常作为二级预防手段用于多种慢病干预(Stoutenberg et al.,2018)。有研究甚至将运动称作“Polypill”,视为对抗与机体衰老相关的9个细胞与分子标志(基因组不稳定性、端粒消减、表观遗传性改变、蛋白质稳态失衡、营养素感应失调、线粒体功能紊乱、细胞衰老、干细胞耗竭及细胞间信息交换的改变)的关键手段(Rebelo-Marques et al.,2018),抗阻运动被认为在防治衰老性骨骼肌萎缩的发生与发展方面具有重要作用。自Rosenberg于1989年定义衰老性肌萎缩至今,学界就抗阻运动对肌肉质量、力量与功能等衰老骨骼肌表型的影响开展了大量有益探讨,抗阻训练对衰老骨骼肌的健康收益业已得到公认。数据显示,抗阻训练可使衰老骨骼肌体积增长高达21%,肌力增幅可达90%(Borde et al.,2015)。但是除骨骼肌表型之外,抗阻运动究竟能否改变健康老年人基因表达谱的衰老性变化,迄今仍未定论。有研究提示,运动可使衰老心肌组织转录组谱呈现年轻化特征(Bronikowski et al.,2003),逆转肌球蛋白重链mRNA丰度的一些退行性改变(Raue et al.,2012)。此类研究多集中探索抗阻运动对单一靶蛋白或信号转导通路的影响,究竟是何种关键基因通过何种信号转导通路在抗阻运动改善衰老骨骼肌表型过程中发挥关键作用,亦不清楚。可见,在探讨衰老骨骼肌表型变化的基础上,进一步丰富包括全基因组转录组在内的数据,厘清基因表达谱响应抗阻运动刺激发生的适应性变化,有助于更加系统地阐明抗阻运动改善骨骼肌衰老的分子机制,为骨骼肌衰老的临床防治提供更多研发靶点。需要指出的是,采用基因芯片进行的独立研究往往存在甄别阈值低、样本量受限和主观偏倚明显等问题,导致筛选出的差异基因数量庞大,假阳性风险与错误发现率相应升高,亟待采用更科学、严谨的研究范式对前人的既有数据进行整合与深入挖掘,从而使研究结果与结论更稳健。
鉴于此,本研究拟采用生物信息学研究范式,对前人研究中的基因表达谱数据进行系统挖掘。首先,比较衰老机体与青年的骨骼肌基因表达谱差异,对初始数据进行质量控制。其次,分析衰老骨骼肌响应长期抗阻训练干预发生的适应性基因表达谱变化。最后,通过生物信息学分析工具筛选出发挥重要作用的关键基因(hub genes)与信号转导通路,以明确长期抗阻训练对衰老骨骼肌基因表达谱和生物代谢过程的影响及重要作用靶点。
1 材料和方法
1.1 微阵列基因表达数据
DNA微阵列是一种能够分析基因组和基因表达特征图谱的新型工具。目前,已开发出多种商业化DNA微阵列和DNA芯片用于基因组研究。DNA微阵列分析包括寡核苷酸芯片、cDNA芯片和基因组芯片等,其分为两种模式:一种是将目的基因固定于支持物上,适于分析大量、不同的目的基因;另一种是将大量探针固定于支持物上,适于对相同目的基因进行不同探针序列的分析(Mar‐zancola et al.,2016)。
本研究采用关键词“skeletal muscle”“aging”和“resis‐tance exercise”在GEO数据集数据库进行组合检索,限定人类种属,检出微阵列数据集25套。筛除与本研究需求不符及样本量过小(n<7)和/或缺失值过多的低质量数据集后,纳入3套数据集进行分析,分别为GSE 25941(GDS 5216)(Raue et al.,2012)、GSE 38718(Liu et al.,2013)和 GSE 8479(Melov et al.,2007)。GSE 25941 和GSE 38718数据集均基于GPL 570平台构建(表1)。GSE 25941数据集含36名被试,其中青年对照被试15名[(25±3)岁]:男性7名,女性8名;老年被试21名[(78±6)岁]:男性10名,女性11名。GSE 38718数据集含22名被试,其中青年对照被试14名(19~28)岁:男、女各7名;老年被试8名(65~76岁);男、女各4名。GSE 8479数据集基于GPL 2700平台构建(Sentrix HumanRef-8 Expression BeadChip),含14名老年被试(65~79岁),其中男性6名,女性8名,接受为期26周的抗阻训练:每周训练2次(周一与周四,或周二与周五),训练内容包括腿举、卧推、坐姿腿屈伸、俯卧腿屈伸、肩上推举、坐姿高位下拉、提踵、卷腹和坐姿背伸展等,每个动作完成3组,每组10次重复。训练采用递增负荷运动方式,初始负荷为50%1RM,每2周重新测定1RM值,训练期结束时负荷增至80%1RM。

表1 本研究采用的GEO微阵列数据集信息Table 1 Details for GEO Microarray Datasets
1.2 数据预处理
下载平台注释文件和预处理过的基因表达矩阵文件(series matrix),分离出各样本的基因表达(Matrix_Ta‐ble_Begin~Matrix_Table_End)并保存为txt文件。将平台注释文件作为背景文件,转换数据使各数据集探针名ID为对应基因的国际标准名(gene symbol),应用R包对下载文件进行背景校正、中位数标准化和Log2转换。由于GSE 8479数据集只选择满足本研究设计需求的老年被试,因此预处理时下载原始数据后剔除冗余数据,采用RMAExpress软件对芯片原始数据进行背景校正与中位数标准化,形成基因表达矩阵文件再进行后续分析。
1.3 差异表达基因筛选
本研究进行两重比较:静息衰老与静息青年被试骨骼肌基因表达谱;衰老被试接受抗阻训练干预前后。
基因差异表达采用R语言Bioconductor系列包中的Limma包进行分析。在R中输入操作命令代码后通过Limma包对数据集中的静息青年对照和静息衰老被试,以及静息衰老被试与训练干预衰老被试的差异表达基因(differentially expressed genes,DEGs)进行分析,满足|LogFC|>1.5和P<0.05条件的基因被视为DEGs(FC为Fold Change)。对各数据集筛选出的DEGs进行层次聚类,采用欧式距离计算法度量样本相似性。
1.4 微阵列数据整合分析
鉴于独立研究存在的潜在偏倚与不足,本研究采用重叠分析法(overlapping analysis)对两重比较获得的全部DEGs进行整合分析并绘制韦恩图,筛选出在3套微阵列数据集中均差异显著的基因用于后续分析。
1.5 差异表达基因的GO功能注释和KEGG通路富集分析
采用DAVID数据库在线分析工具和KOBAS在线分析数据库对候选基因进行富集分析(Sherman et al.,2007),显著性水平置于0.05。DEGs的KEGG通路分析采用KO‐BAS与Revigo数据库进行联合处理,当P值与校正P值均小于0.05时视为显著性富集通路,富集通路后采用Cyto‐scape软件进行可视化。
1.6 差异基因编码蛋白的蛋白质-蛋白质互作分析
采用STRING网络分析数据库鉴定蛋白质之间的互作关系(protein-protein interaction,PPI)。互作结果来源于实验数据、数据库、文本挖掘和生物信息学预测等(Von Mering et al.,2003)。将STRING分析结果导入Cytoscape进行可视化,每个节点代表一个蛋白,节点间的连线反映蛋白之间的交互,用于鉴定DEGs编码蛋白间的互作与通路。采用3种数据挖掘方法共同鉴定关键基因:首先,在STRING分析结果中通过节点计数进行筛选,将计数10以上的节点纳入筛选范围;其次,采用Cytoscape的MCODE App对构建的整个网络进行模块挖掘,筛选得分最高的模块及相应蛋白;最后,采用CytoHubba App对STRING分析结果按照节点度(degree)进行排序,筛选出前10位节点。将3种分析与挖掘的结果进行比对,结合PPI交互网络确定功能最集中的蛋白并采用BinGo App进行二次富集分析。此联合鉴定方法可有效规避单一筛选存在的潜在偏倚与假阳性风险。
2 研究结果
2.1 微阵列数据信息与差异表达基因筛选
对本研究3套数据集中的骨骼肌基因表达谱数据经中位数标准化处理后,采用R语言的Limma包对标准化数据进行基因筛选,在GSE 25941数据集中筛选出1 291个DEGs(图1A),在GSE 38718数据集筛选出581个DEGs(图1B),在GSE 8479数据集筛选出60个DEGs(图1C)。

图1 GSE 25941(A)、GSE 38718(B)和GSE 8479(C)数据集差异表达基因数据火山图Figure 1. Differential Expression of Data between Two Sets of Samples in GSE25941(A),GSE38718(B)and GSE8479(C)Datasets
2.2 差异表达基因整合分析结果
本研究采用重叠分析法对3套微阵列数据集进行分析(图2),筛选出共同表达的差异基因共计60个(表2)。差异基因重叠分析较RobustRankAggreg算法(RRA)更为严谨,可更好地筛除边缘显著基因或仅在单个、两个微阵列数据集中表达显著的差异基因。

表2 整合微阵列数据筛选的差异表达基因Table 2 Screening DEGs by Integrated Microarray
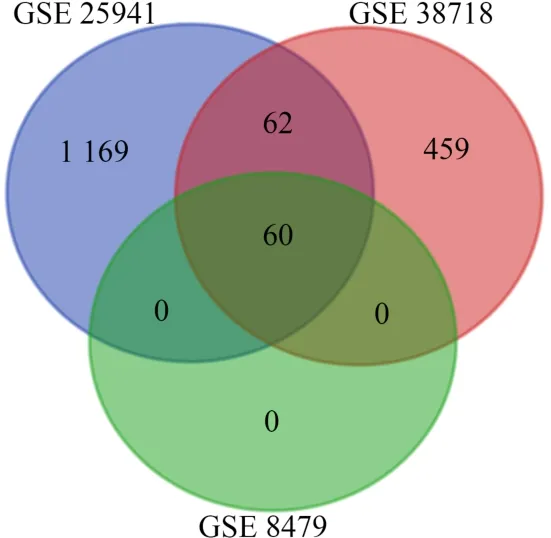
图2 数据集差异表达基因重叠分析韦恩图Figure2. Venn Diagram for DEGs Based on Overlapping Analysis
2.3 差异表达基因的GO富集分析结果
GO功能富集分析包括3个功能组,分别为生物过程(biological process)、分子功能(molecular function)和细胞组成(cellular component)。就衰老骨骼肌响应抗阻运动干预的DEGs的GO富集分析显著性条目(图3)而言,在细胞组成功能组中,抗阻运动对衰老骨骼肌影响的DEGs富集于细胞骨架蛋白、Poly(A)RNA、脂肪酸、蛋白质结合以及运动、抗氧化、转运体与酶催化活性;在细胞组成功能组中,DEGs富集于内膜系统、细胞质、细胞器及细胞外区域;在分子功能中,DEGs主要富集于单细胞-多细胞有机物过程(如肌肉系统过程与肌肉收缩)、信号转导、细胞器组织、响应应激与刺激、调节细胞死亡、氮端蛋白质氨基酸乙酰化、细胞过程及代谢等功能。
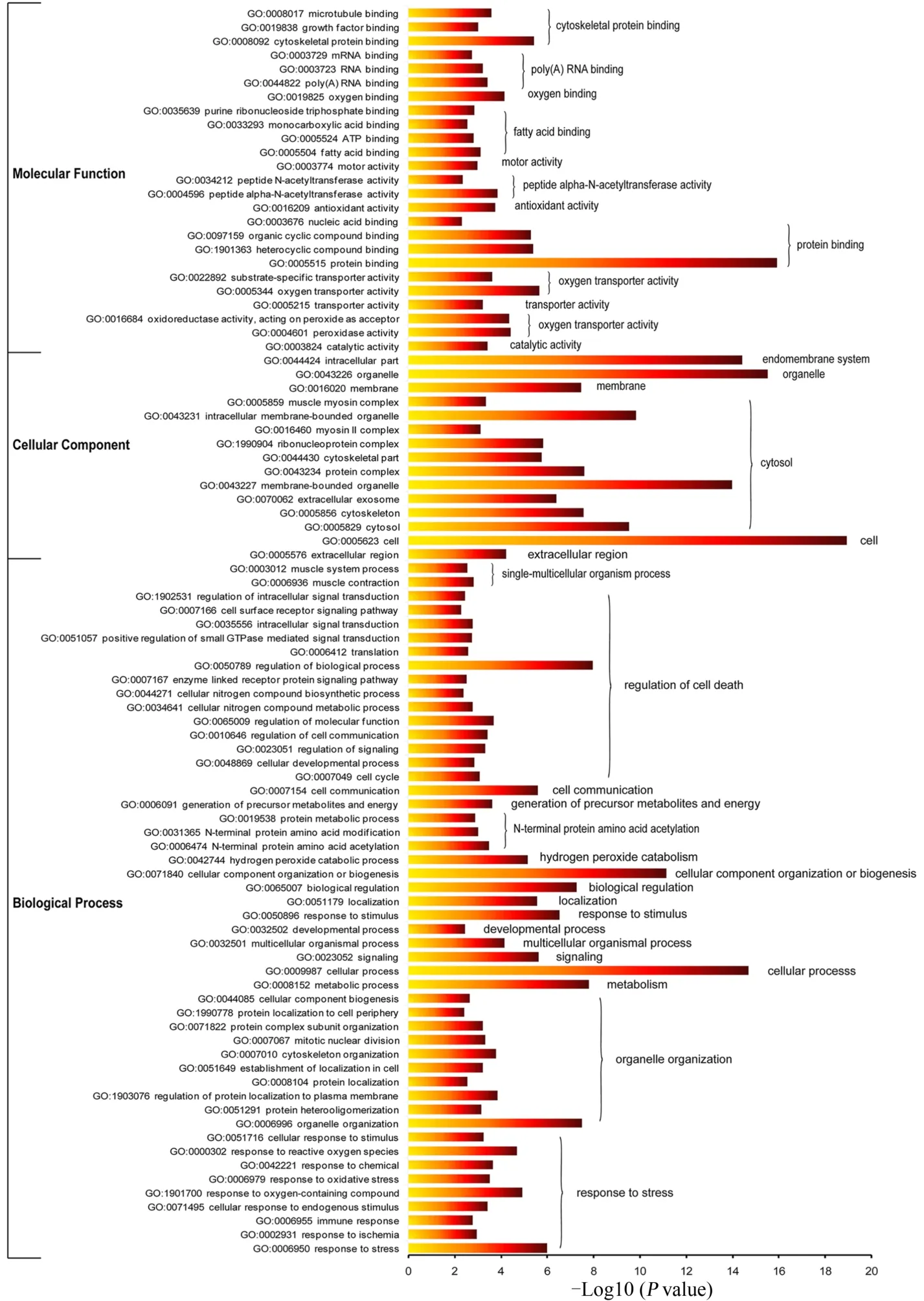
图3 差异表达基因GO功能富集分析的显著性条目Figure 3. Significant Terms of GO Enrichment Analysis
2.4 差异表达基因的KEGG通路分析结果
采用KOBAS在线分析和Revigo数据库对筛选出的DEGs进行KEGG通路分析(表3)发现,在P值与校正P值显著性水平均置于0.05时,共有10个DEGs显著富集于MAPK、胰岛素、PI3K-Akt与actin细胞骨架调节信号通路。导入Cytoscape计算网络拓扑特点并确定每个节点,基因与通路节点间的交互如图4。
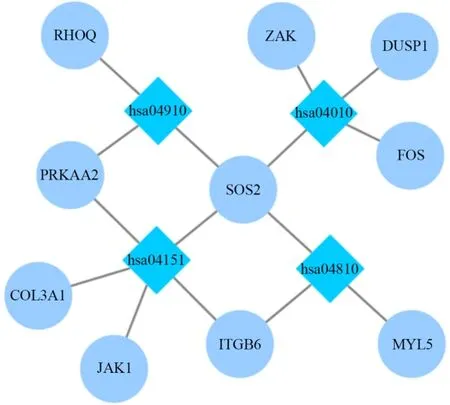
图4 差异表达基因的显著通路富集Figure 4. Significant Pathway Enrichment of DEGs

表3 差异表达基因的KEGG通路分析Table 3 KEGG Pathway Analysis of DEGs
2.5 PPI拓扑网络分析结果
DEGs的PPI拓扑网络分析(图5)显示,共计60个节点(node)与176条边(edge),平均节点度(degree)为5.87,平均聚类系数为0.453,PPI富集P值为0.017 5。圈体内所示蛋白与其他蛋白存在≥5的相互作用关系,为拓扑网络结构的中心节点,删除这些节点蛋白后,网络结构稳定性降低。MCODE模块挖掘(图6A)与CytoHubba基于degree排序筛选出的关键基因(图6B),结合STRING数据库节点计数结果(表4),鉴定出交互最显著的基因共计15个:MXRA5、JAK1、CCNG1、FOS、MYH1、RHOQ、ZAK、ASB11、CCNI、KIF5B、DUSP1、MYL5、ASB15、PRKAA2与SLMAP。
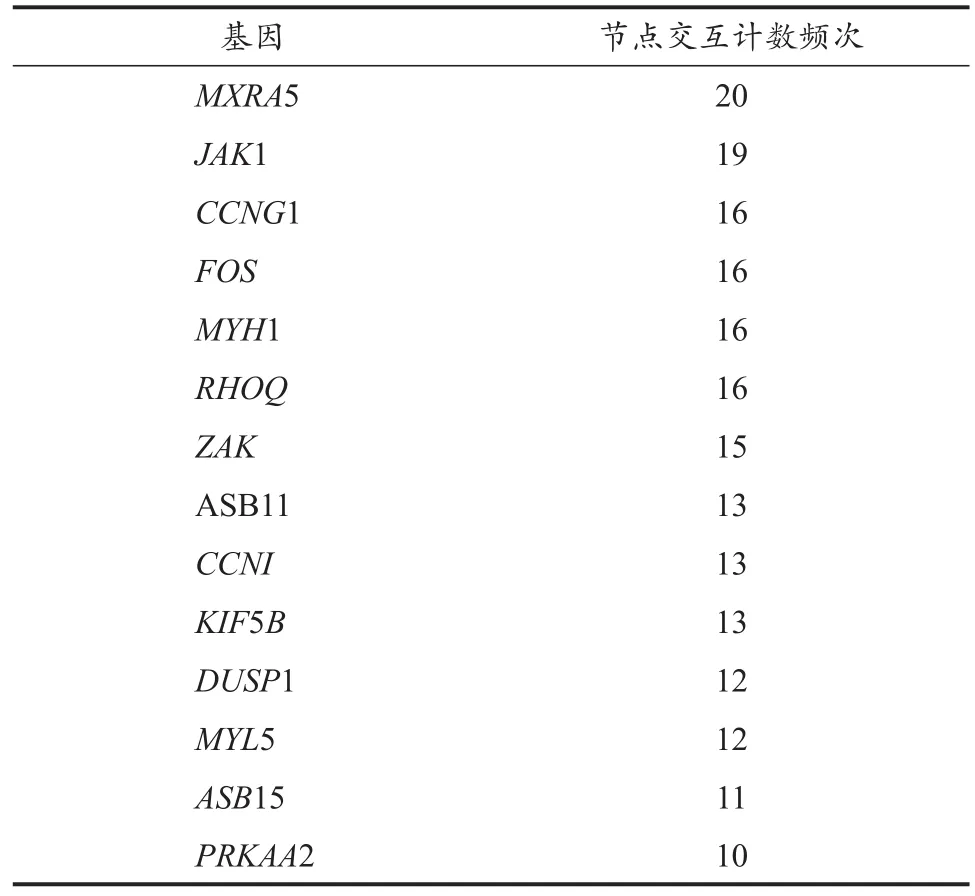
表4 STRING节点计数筛选关键基因结果Table 4 The Results of Gene Screening by Nodes Counting from STRING Database
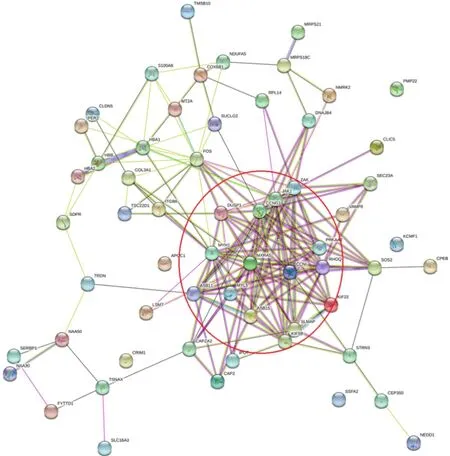
图5 蛋白质-蛋白质交互网络图Figure 5. Protein-Protein Interaction Network

图6 MCODE模块挖掘(A)与degree排序(B)筛选基因结果Figure 6. The Results of Gene Screening by MCODE Mining(A)and Degree Ranking(B)
2.6 关键基因的GO功能与KEGG通路富集分析
应用BinGO进行功能富集分析(表5),展示显著性前5位结果,发现生物过程主要富集到骨骼肌对内源与外源性刺激的响应及骨骼肌细胞内的信号转导;分子功能富集到运动(神经元)活性,及核糖核苷酸、Rho GTPase结合阈、嘌呤核糖核苷酸与蛋白质的结合;细胞组成富集到II型肌球蛋白复合物、肌肉肌球蛋白复合物、细胞骨架、细胞骨架组分与蛋白质复合物。就KEGG通路而言,主要富集到MAPK、胰岛素与PI3K-Akt信号通路。ZAK、DUSP1、FOS、JAK1、RHOQ 和 PRKAA2可能是抗阻训练改善衰老骨骼肌表型的关键靶点。
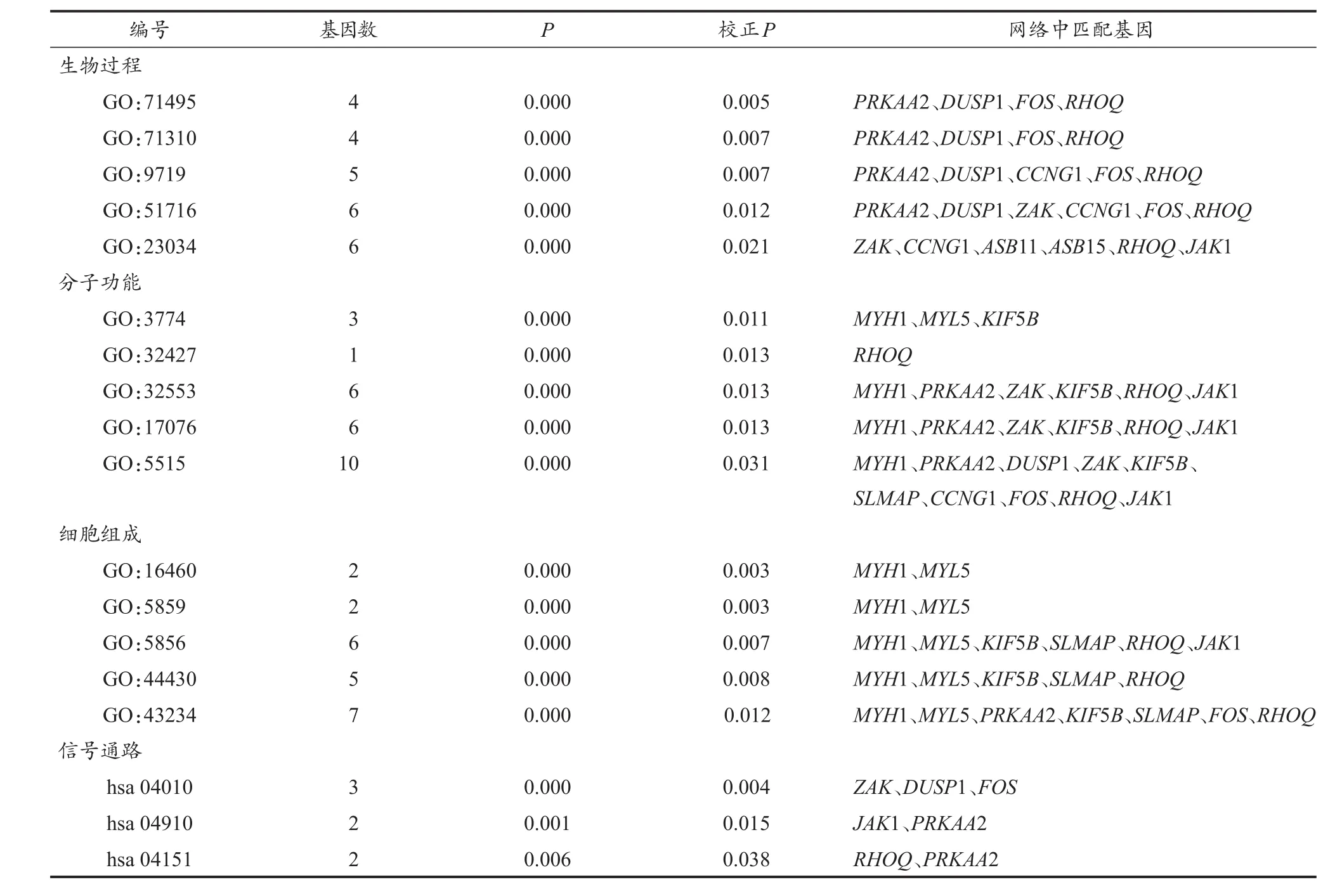
表5 关键基因GO功能与KEGG通路富集分析结果Table 5 The Results of GO and KEGG Enrichment Analysis for Hub Genes
3 分析与讨论
衰老性肌萎缩是骨骼肌衰老退行性病变的关键表型,主要表现为骨骼肌质量的丢失以及功能衰退。衰老性肌萎缩患者的骨骼肌质量以每年1%的速率衰减,随着年龄增长而逐渐加速(Yamada,2018)。其发生与发展可显著增加老年人跌倒、残疾甚至死亡的风险,严重影响身心健康与生活质量,成为影响健康老龄化的重大社会问题。因此,厘清衰老性肌萎缩发生与发展的分子机理具有重要意义。
文献梳理表明(夏志等,2016),衰老性骨骼肌萎缩与多种病原学因素相关,可能包括:1)营养状态失衡:机体组织对营养素的反应下降和/或营养不良,造成蛋白质代谢紊乱;2)缺乏体力活动和/或运动:现代社会静坐少动的生活方式使得老年人群易于进入“缺乏体力活动—体质健康下降—难以运动”这一循环;3)自由基攻击:线粒体DNA缺失突变所致的氧化损伤;4)内分泌功能改变:激素、生长因子的分泌与释放发生变化,如雌激素、生长激素、睾酮、脱氢表雄酮减少和/或机体组织对胰岛素、胰岛素样生长因子刺激的响应性改变;5)慢性炎症:IL-1、TNF-α和IL-6等促炎性细胞因子的分解代谢效应;6)神经-肌肉完整性损害:不可逆的纤维损伤或永久性失去神经支配使神经-肌肉之间失去正常联系;7)卫星细胞募集水平改变:衰老过程中,Ⅱ型肌纤维卫星细胞的数量和募集能力大幅下降;8)细胞凋亡:肌细胞的凋亡及其诱导的线粒体DNA突变。尽管基于表型指标的研究提供了多种可能性机制线索,但是骨骼肌衰老的机制迄今仍未澄清。
基因组的不稳定性(genomic instability)是机体衰老的首要生物标志,因此,有机生命体在生命周期中的基因损伤累积被视为衰老的共同特性(Lopez-Otin et al.,2013)。前人采用微阵列手段就衰老骨骼肌的基因表达谱变化进行了探讨,但其响应长期抗阻训练干预的适应性变化迄今鲜见相关报道(Jozsi et al.,2000;Su et al.,2015)。就本研究分析的数据集而言,虽然研究者已公开报道研究结果,但其对微阵列数据的分析尚有不足,如GSE 25941(GDS 5216)(Raue et al.,2012)与 GSE 38718(Liu et al.,2013)并未对衰老骨骼肌与青年被试骨骼肌的基因表达谱差异进行细致比较,未能明确两者之间存在显著表达差异的具体基因,从而未能进行相应的功能富集与通路分析;GSE 8479(Melov et al.,2007)重点关注力量等骨骼肌表型响应运动干预发生的适应变化,对于运动导致的衰老骨骼肌基因谱变化未作深入分析,亦未能明确抗阻运动究竟通过何种基因与通路介导改善骨骼肌衰老。本研究中,通过重叠分析法整合3套微阵列数据集的结果,结合LogFC阈值筛除边缘显著基因与仅在单个或两个微阵列数据集中表达显著的差异基因,最终筛选出衰老骨骼肌接受26周抗阻训练干预后的DEGs共计60个,通过PPI网络分析鉴定出15个基因的编码蛋白交互最显著。其中,ZAK、DUSP1、FOS、JAK1、RHOQ和 PRKAA2主要富集于MAPK、胰岛素和PI3K-Akt信号转导通路。与既有研究相比,它不仅深入分析挖掘了研究中的微阵列数据,而且进一步鉴定了可能介导抗阻运动改善骨骼肌衰老的关键基因与信号转导通路。
ZAK、DUSP1与FOS富集于MAPK信号转导通路,其编码蛋白均为MAPK信号途径的重要调节因子。其中,ZAK基因是信号转导分子MAPK3家族成员,编码一种N端含激酶催化结构域的蛋白。该蛋白具有促凋亡活性,在骨骼肌细胞周期调节中有重要贡献。DUSP1编码一种具有酪氨酸/苏氨酸双重特异性的磷酸酶,该蛋白可去磷酸化MAP激酶MAPK1/ERK2,在骨骼肌细胞响应环境刺激以及对增殖的负向调控中均发挥重要作用。FOS基因家族编码亮氨酸拉链蛋白,使其与JUN家族的蛋白质形成二聚体转录因子复合物AP-1,行使调节骨骼肌细胞增殖、分化和转化的功能。MAPK是一类重要的丝氨酸/苏氨酸蛋白激酶家族,主要由ERK1/2、ERK3/4、ERK5、p38和JNK/SAPK 5个亚类组成。其信号通路在所有真核生物中均存在,在骨骼肌细胞基因表达、分化、再生和响应环境刺激等方面发挥重要调节作用。这与GO功能富集分析中细胞过程及细胞功能富集到的结果(表5)一致。ERK1/2和p38 MAPK是最重要的两条通路,均可响应运动刺激发生表达变化。ERK1/2可通过活化核转录因子影响基因转录,与骨骼肌响应运动刺激的适应性变化密切相关。运动可使ERK1/2活性迅速上调并诱导MAPK活化,参与预防骨骼肌萎缩(Kramer et al.,2007)。William‐son等(2003)观察到:与年轻被试[(21.8±0.9)岁]相比,衰老被试[(79.1±3.3)岁]股外侧肌内MAPK信号通路蛋白表达总量并无差异,ERK1/2与p38 MAPK磷酸化表达水平升高。但进行急性抗阻运动后,年轻被试骨骼肌ERK1/2与p38 MAPK磷酸化水平进一步上调,衰老被试则呈相反变化趋势。Parkington等(2004)采用电刺激进行的动物实验结果亦得出相同结论。p38 MAPK信号转导途径作为骨骼肌内多种细胞信息传递的中介通路,可参与骨骼肌细胞增殖、发育、响应环境刺激等多种胞内生理过程,影响干细胞的自主丢失与更新。研究表明,衰老小鼠骨骼肌内的卫星细胞稳态过程因p38 MAPK信号转导通路的失调而受到影响(Bernet et al.,2014)。p38 MAPK的增龄性变化与抗阻运动干预后变化与ERK1/2一致(Williamson et al.,2003)。Mylabathula等(2006)的大鼠实验也观察到衰老导致的相同变化趋势。衰老骨骼肌处于被称为“stress-like conditions”的状态,这可能是ERK1/2与p38 MAPK较年轻被试呈现出高磷酸化表达水平的重要原因(韩雨梅等,2009)。响应抗阻运动刺激后的表达下调可能标志着衰老骨骼肌响应营养、药物、运动等合成代谢刺激的能力下降,是形成合成抵抗(anabolic resis‐tance)的因素之一(Potsch et al.,2014)。
JAK1、RHOQ分别与PRKAA2共同富集于胰岛素或PI3K-Akt信号转导通路。其中,JAK1编码一种膜蛋白,该蛋白是一类蛋白酪氨酸激酶的成员,可催化ATP上的γ-磷酸转移到蛋白酪氨酸残基,在骨骼肌细胞生长、增殖、分化中具有重要作用。RHOQ编码Rho GTPases家族成员,与GTP水解密切相关。PRKAA2编码AMPK的催化亚基,上调其功能表达水平,可磷酸化下游众多与骨骼肌代谢相关的限速酶。胰岛素是主要的餐后(postprandial)合成代谢激素,胰岛素抵抗可能发生衰老性肌萎缩。就胰岛素与衰老性肌萎缩的关联而言,Morais等(2018)得出两个结论:其一,老年人合成代谢反应的削弱是由于胰岛素不能产生与年轻人相似的蛋白质合成刺激水平;其二,蛋白质反应的敏感性降低与糖有关。通过多重回归分析发现,衰老过程中常见的绝对去脂体质量降低和体脂含量增加与胰岛素在刺激蛋白质合成时的合成代谢作用变化密切相关。因此,通过运动改善胰岛素敏感性被视为改善老年人骨骼肌健康水平的重要途径(Villareal et al.,2011)。尽管衰老骨骼肌响应急性抗阻运动产生的基因表达谱变化显著低于青年(Rivas et al.,2014),但长期抗阻训练仍然可以对衰老机体胰岛素信号转导产生积极影响。究其机理,可能主要基于两方面:一方面,抗阻训练可经IGF-1/PI3K/Akt信号通路刺激衰老骨骼肌细胞蛋白质合成。Ribeiro等(2017)对衰老大鼠进行为期12周爬梯抗阻训练,观察到IGF-1介导的骨骼肌合成代谢上调,认为其对调控骨骼肌衰老(形态学与代谢适应)关键因子的基因表达具有重要影响。另一方面,抗阻训练可影响GLUT-4转位至骨骼肌细胞膜,改善胰岛素敏感性。胰岛素抵抗与骨骼肌衰老及蛋白质合成代谢削弱存在联系,因此,其对衰老骨骼肌的蛋白质代谢平衡亦有贡献。PI3K-Akt信号通路在改善调节衰老骨骼肌结构功能状态方面的作用已达成广泛共识(Mayhew et al.,2009),加之其与胰岛素信号通路交互,因此在维持衰老骨骼肌健康水平方面亦有重要影响。本研究中,PRKAA2同时富集于胰岛素与PI3K-Akt信号途径,也为两条通路的互作提供佐证。由于PRKAA2编码AMPKα2,进一步提示抗阻运动对衰老骨骼肌的AMPK信号通路可能亦有影响。Fortes等(2017)指出,抗阻运动促进骨骼肌肥大的机制同时涉及PI3K-Akt途径的活化,以及对AMPK功能表达的抑制。
MAPK、胰岛素、PI3K-Akt以及AMPK信号通路在衰老骨骼肌响应抗阻训练干预时究竟如何互作,目前尚未澄清。但有研究表明,哺乳动物雷帕霉素靶蛋白复合物1(mTORC1,含mTOR、Raptor和mLST8)可能是其共同作用途径之一。mTORC1是骨骼肌响应合成代谢刺激、调节蛋白质合成与适应性肥大的关键信号分子,mTOR-p70S6K-4EBP1通路对抗阻运动的响应性更是直接影响其抗衰老性肌萎缩效应(Ogasawara et al.,2017)。因此,组织特异性mTORC1激动剂的研发在骨骼肌萎缩干预领域始终是备受关注的热点问题(Saxton et al.,2017)。衰老骨骼肌mTORC1底物磷酸化水平下调(Wilkinson et al.,2018),抗阻运动可能通过 MAPK、PI3K-Akt、胰岛素(IGF-1)及AMPK介导逆转这一趋势。但是,ZAK、DUSP1、FOS、JAK1、RHOQ和PRKAA2作为涉及其中的关键基因,其编码蛋白如何参与这一调节网络,能否作为临床改善衰老性骨骼肌萎缩的潜在靶点,有待大量基础实验予以证实。
4 结论
衰老可致骨骼肌基因表达谱发生显著变化,抗阻训练亦可通过调节基因表达变化而改变骨骼肌表型。本研究通过生物信息学研究方法,深入挖掘、分析了既有微阵列数据,鉴定出相关DEGs共计60个。其中,MXRA5、JAK1、CCNG1、FOS、MYH1、RHOQ、ZAK、ASB11、CCNI、KIF5B、DUSP1、MYL5、ASB15、PRKAA2与 SLMAP可能是介导衰老骨骼肌响应长期抗阻训练的关键基因;ZAK、DUSP1、FOS、JAK1、RHOQ和PRKAA2可能通过MAPK、胰岛素、PI3K-Akt及AMPK信号级联介导响应抗阻训练刺激,调节mTORC1功能表达,改善衰老骨骼肌表型,可能是临床防治骨骼肌衰老的候选靶点。
