噬菌体裂解酶结构特征、重组策略及其在控制食源性致病菌中的应用
2022-01-06黄振华张昭寰童金蓉刘海泉潘迎捷
黄振华,张昭寰,2,*,童金蓉,吴 倩,刘 静,刘海泉,3,4,潘迎捷,3,4,赵 勇,3,4,*
(1.上海海洋大学食品学院,上海 201306;2.上海海洋大学水产与生命学院,上海 201306;3.农业农村部(上海)水产品贮藏保鲜质量安全风险评估实验室,上海 201306;4.上海水产品加工及贮藏工程技术研究中心,上海 201306)
食源性致病菌如单核细胞增生李斯特菌(Listeria monocytogenes)(简称单增李斯特菌)、沙门氏菌(Salmonellaspp.)、大肠杆菌(Escherichia coli)、梭状芽孢杆菌(Clostridium)、副溶血性弧菌(Vibrio parahemolyticus)和金黄色葡萄球菌(Staphylococcus aureus)等的污染,给全球食品工业和卫生保健系统带来了持久的挑战,导致食源性疾病的暴发,并带来高额的经济负担。而细菌耐药性的不断出现与传播以及生物被膜的形成,加剧了食源性致病菌的潜在风险,成为全球普遍关注的公共卫生焦点问题[1]。尽管国内外食品卫生条件不断改善,公众食品安全意识显著增强,但食源性疾病仍严重影响着食品安全与人类健康[2]。据世界卫生组织报道[3],每年依旧约有6亿 人在食用污染食品后患病,导致约42万 人死亡,中低收入国家每年因食品安全问题而在生产力和医疗费用方面损失近1 100亿 美元。
传统的食源性致病菌杀灭与控制技术中,基于热加工的技术有可能破坏食品本身的质地与营养,化学类杀菌技术不仅容易诱导细菌产生耐药性,而且部分消毒处理可促使致病菌进入“活的不可培养”状态[4],增加了食品二次污染风险。因此,为了保证现代食品工业的可持续发展,迫切需要新型杀菌、控菌技术的研发。噬菌体裂解酶是大部分裂性噬菌体在裂解期释放一种蛋白,具有很强肽聚糖降解活性,与宿主细菌接触后能立即破坏其细胞壁结构,从而快速杀死细菌[5-6]。许多研究表明噬菌体裂解酶在体内外均具有较高的抗菌活性,可以靶向作用于相应的食源性致病菌,以细胞壁为靶点水解肽聚糖中不同的化学键[7],避免致病菌耐药性的产生[8]。在食品工业中,噬菌体裂解酶可作为一种高效、安全[9-10]、易获取的杀菌控菌策略,以靶向降低食品中特定致病菌的污染水平,如葡萄球菌属[11]、单增李斯特菌[12]等。而且,因其高度的特异性,噬菌体裂解酶不会破坏食品中有益微生物的群落,并对食品的感官和结构特性不产生有害影响[13-14]。
本文通过综述噬菌体裂解酶的模块化结构特征及活性位点,着重讨论噬菌体裂解酶的重组策略和方法,介绍噬菌体裂解酶生物学的关键概念,总结天然噬菌体裂解酶在控制食源性致病菌方面的应用进展,并对噬菌体裂解酶在食品工业中的应用进行展望,讨论将噬菌体裂解酶作为潜在天然抗菌剂添加到某些高风险食品中的可能性,旨在为食源性致病菌及其耐药性的有效控制提供一种行之有效的新策略。
1 噬菌体裂解酶的结构特征与作用位点
1.1 结构特征
在自然界中,革兰氏阳性菌的噬菌体裂解酶呈现模块化结构,大小约为25~40 kDa[14-16]。如图1A所示,革兰氏阳性菌噬菌体裂解酶包含两个结构域:N端催化结构域(catalytic domain,CD)和C端细胞壁结合结构域(cell walls binding domains,CBD),N端与C端通过一段小肽连接[17]。CD能够作用于细菌细胞壁肽聚糖网络中大部分化学键[7],CBD则负责将噬菌体裂解酶靶向于底物并赋予其识别宿主细胞的特异性。例如大多数靶向葡萄球菌的噬菌体裂解酶具有模块化结构:包括1个N端的半胱氨酸/组氨酸依赖的酰胺水解酶/肽酶结构域(cysteine,histidine-dependent amidohydrolases/peptidase domain,CHAP)、1个中心酰胺酶结构域和1个细胞壁结合域[18]。
革兰氏阴性菌的外膜结构可有效阻止外源酶进入细胞内部,为菌体提供一个天然的屏障。研究发现,大部分革兰氏阴性菌的噬菌体裂解酶是单域结构,大小约为15~20 kDa[14-16],如图1B所示,此类裂解酶中存在两亲性螺旋结构,或携带正电荷基团,赋予其渗透或破坏细菌外膜的能力,从而接触和降解肽聚糖层,最终导致菌体破裂而死亡[19-20]。例如噬菌体裂解酶AcLys的C端形成的α-螺旋结构使其能够穿透外膜,而C端的带正电荷基团也增强了其穿透外膜的能力[19]。此外,一些革兰氏阴性菌的噬菌体裂解酶也呈现模块化的结构:N端含有CBD、C端含有CD[21]( 图1B),这种模块化结构赋予此类裂解酶更强的裂解活性[21-22]。例如,噬菌体裂解酶OBPgp279在N端有1个CBD、在C端有一个溶菌酶结构域,呈现类似革兰氏阳性菌的模块化结构,且裂解活性比T4溶菌酶高160 倍[21]。
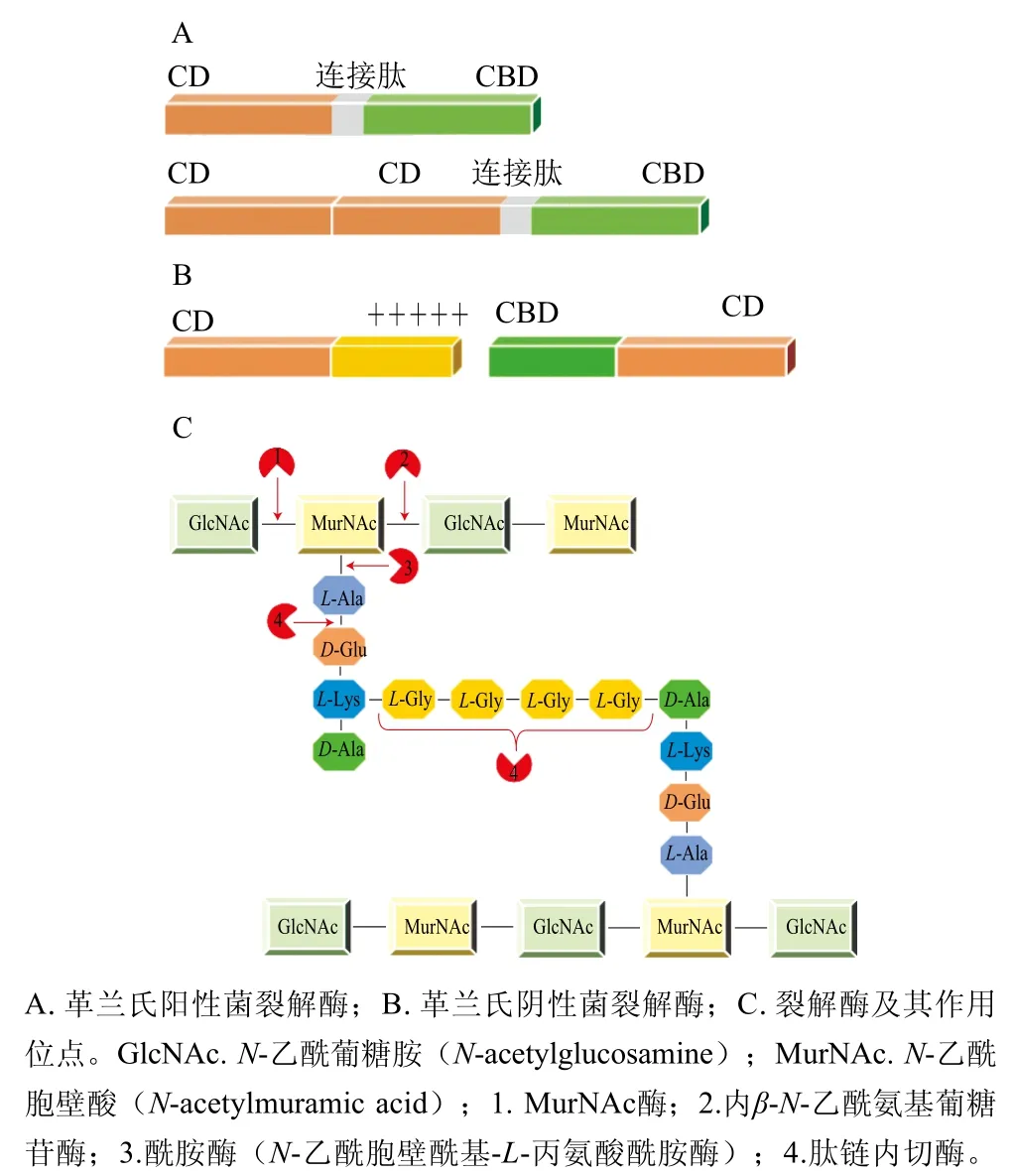
图1 典型噬菌体裂解酶的结构及作用位点[7,14-17]Fig. 1 Structures and action sites of typical phage lysins[7,14-17]
1.2 作用位点
噬菌体裂解酶能够破坏细菌细胞壁肽聚糖层的主要化学键(图1C),按作用位点不同,可将其分为4 类[13,17,23]:1)MurNAc酶和溶菌糖基转移酶,可作用于肽聚糖链中的GlcNAc或与其相邻的MurNAc,溶菌糖基转移酶虽与MurNAc酶的作用位点相同,但作用方式不同,不会裂解糖苷键而形成胞壁酸残基,只能够使糖苷键脱水。溶菌糖基转移酶在自然界中比较罕见,只有极少数相关报道,如噬菌体phiKZ的裂解酶gp144[24];2)内β-N-乙酰氨基葡糖苷酶,可作用于肽聚糖链中MurNAc和GlcNAc之间的糖苷键;3)酰胺酶,可作用于肽聚糖链中MurNAc和L-Ala之间的关键酰胺键;4)肽内肽酶,可作用于肽聚糖链中茎肽和肽间桥氨基酸之间的化学键。
2 噬菌体裂解酶的重组策略
噬菌体裂解酶模块化结构和独立活性为酶的重组进化提供了可能,可以此为基础对天然裂解酶的功能域进行删除衍变和重新组合,并为其与其他抑菌分子的融合重建提供机会,从而设计出具有特殊功能的生物工程裂解酶。噬菌体裂解酶的重组策略能使其具有裂解谱更广、环境适应性更强等新特性,还能实时地应对细菌耐药性突变问题。因此,为满足裂解活性及谱系的需要,可通过多种噬菌体裂解酶功能域的重组,以设计活性更高和杀伤范围更广或具备靶向性的重组噬菌体裂解酶。为满足其在不同食品基质、不同加工工艺中广泛的应用范围,可将其与特殊功能片段重组,以设计稳定性强、溶解性好的重组噬菌体裂解酶。本文进一步系统地阐述了嵌合重组、衍生突变、异源融合这3 种噬菌体裂解酶的重组策略(图2)。
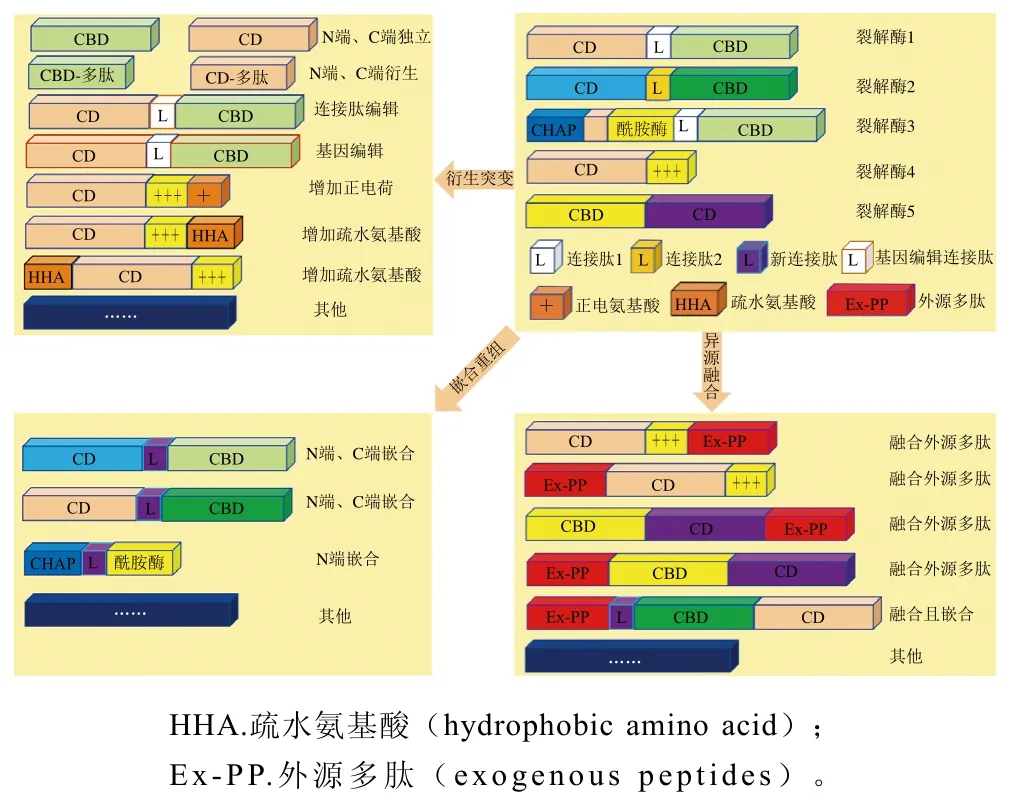
图2 噬菌体裂解酶的重组方式Fig. 2 Recombination strategies of phage lysins
2.1 嵌合重组
嵌合重组是指通过对预期细胞壁CD、CBD进行改组而获得嵌合噬菌体裂解酶的一种重组策略(图2),具有简单、易操作等优势,能够提高噬菌体裂解酶活性、裂解谱系等特性。Idelevich等[25]构建了一种新型的嵌合裂解酶PRF-119,对776 株耐甲氧西林的金黄色葡萄球菌(methicillin-resistantStaphylococcus aureus,MRSA)、395 株甲氧西林敏感型金黄色葡萄球菌(methicillin susceptibleStaphylococcus aureus,MSSA)均具有良好的裂解活性。776 株MRSA的半数抑菌质量浓度(50%minimal inhibit concentration,MIC50)和90%抑菌质量浓度(90% minimal inhibit concentration,MIC90)平均值均为0.391 g/mL;而398 株 MSSA的MIC50和MIC90平均值分别为0.098 g/mL和0.391 g/mL。研究表明,同类宿主噬菌体裂解酶的嵌合或能扩大其裂解谱[26],而不同类宿主噬菌体裂解酶的嵌合或能改变并拓展其在多种菌属中的应用功效。Fernandes等[27]将粪肠球菌噬菌体裂解酶Lys168和Lys170的CD与葡萄球菌属噬菌体裂解酶Lys87的CBD进行重组,得到Lys168-87和Lys170-87嵌合体,可用于裂解96%以上的受试金黄色葡萄球菌临床分离株。Dong Qiuhua等[28]将葡萄球菌属噬菌体裂解酶Ply187的CD与具有肠球菌属、链球菌属裂解活性的噬菌体裂解酶PlyV12的CBD嵌合,得到Ply187N-V12C,不但具有类似Ply187N的葡萄球菌菌株裂解活性,而且扩展到了链球菌属和肠球菌属,如乳链球菌、无乳链球菌、化脓性链球菌和粪肠球菌等。此外,噬菌体裂解酶LysK CD的CHAP和酰胺酶可以嵌合成CHAP-酰胺酶[29],对MRSA252细胞具有显著的裂解活性[24],而单个CHAP与CBD嵌合也能显著增加其抑菌活性[30]。Mancos等[31]通过将金霉素链霉菌噬菌体裂解酶Lyt mu 1/6与T4溶菌酶中可穿透外膜的两亲阳离子肽融合,得到人工噬菌体裂解酶LytAmfi,不仅具有与亲本Lyt mu 1/6相似的链霉菌裂解活性,而且拓展了其对革兰氏阴性菌的裂解活性。
重组的噬菌体裂解酶也可用于控制由致病微生物引起的乳腺炎所造成的经济损失和安全风险,Schmelcher等[32]通过将链球菌噬菌体裂解酶SA2的内肽酶结构域分别与溶葡萄球菌酶和葡萄球菌属噬菌体裂解酶LysK的CBD重组,得到嵌合λSA2-E-Lyso-SH3b和λSA2-E-LysKSH3b,两种嵌合体均可杀死乳腺炎中具有青霉素抗性的金黄色葡萄球菌。二者联合使用时,可以减少乳腺中3.36(lg(CFU/mL))的金黄色葡萄球菌。在加工牛奶中,100 μg/mL的λSA2-E-Lyso-SH3b和λSA2-E-LysK-SH3b可使金黄色葡萄球菌在3 h内分别降低3、1(lg(CFU/mL))。Verbree等[33]将溶葡萄球菌素与重组噬菌体裂解酶CHAPK_CWT-LST应用于牛奶中金黄色葡萄球菌的杀灭,可在几分钟内降低到无法检测的水平,并能够持续作用24 h,与对照相比细菌数量约降低了9(lg(CFU/mL))。
2.2 衍生突变
研究表明,对噬菌体裂解酶的一些功能域进行单独表达,可以获得具有抑菌活性的小分子衍生物。例如,对噬菌体裂解酶PlyV12的CBD进行单独表达,可获得具有预防和控制MRSA感染的衍生物V12CBD,并能通过核因子κB途径激活并促进巨噬细胞的吞噬作用,增强宿主免疫防御能力[9]。而对葡萄球菌属噬菌体裂解酶Ply187的CD片段进行单独表达,其裂解活性远远高于全长的Ply187[28]。Kong等[34]研究发现蜡样芽孢杆菌噬菌体裂解酶LysPBC2除了具有CD和CBD片段外,还有一个特殊的孢子结合结构域(spore binding domain,SBD),由几个氨基酸残基组成并部分重叠于CD,单独表达该结构域可靶向作用于蜡样芽孢杆菌的孢子。
对噬菌体裂解酶的小分子衍生物进行净正电荷数量改变、疏水性修饰、基因编辑等定向突变,可进一步提升衍生物的杀菌效果。噬菌体裂解酶CD衍生物的裂解活性可能与其携带净正电荷数量相关,使其能够通过离子相互作用到达带负电荷的细菌表面,并赋予其膜渗透能力。研究发现,增加噬菌体裂解酶LysAm24、LysECD7和LysSi3的C端净正电荷数量,可显著提升其裂解活性[35]。除了增加净电荷,修饰疏水性氨基酸也可能增强噬菌体裂解酶衍生物的裂解活性。Peng等[36]通过改变氨基酸序列降低噬菌体裂解酶LysAB2衍生肽P3的疏水性,使其具有更强的抑菌活性。而Yan Guangmou等[37]将3~12个疏水氨基酸依次添加到大肠杆菌噬菌体裂解酶Lysep3的C末端,生成了5 种不同疏水性的裂解酶,增强了其体外杀伤大肠杆菌的活性。与以上两种突变技术相比,对噬菌体裂解酶衍生物进行基因编辑也表现出一定的潜力。Yang Hang等[38]通过编辑噬菌体裂解酶ClyJ的CD和CBD连接肽序列,提高了其溶解性和稳定性,并增强了其杀菌活性。Resch等[39]通过在噬菌体裂解酶Cpl-1的C端引入特定半胱氨酸序列构建二聚体,增强了其抗菌活性和在环境中的稳定性。
2.3 异源融合
异源融合是指将噬菌体裂解酶(或其部分结构域)与具有外膜穿透性(或局部扭曲脂多糖功能)的外源多肽分子融合,而获得人工噬菌体裂解酶的一种重组策略。Briers等[40]通过将铜绿假单胞菌噬菌体裂解酶KZ144与一种绵羊来源的螺旋状抗菌肽SMAP-29融合,获得人工噬菌体裂解酶Art-085和Art-175,均能更好地透过细菌外膜,并快速高效清除5(lg(CFU/mL))的多重耐药铜绿假单胞菌;此外,使用延时显微镜检查发现,Art-175能在1 min内刺穿细菌外膜的肽聚糖层,从而导致内膜的膨胀和裂解。
Lukacik等[41]解析了鼠疫耶尔森氏菌外膜转运体FyuA的晶体结构,并找到一种靶向这种转运体的细菌素,即鼠疫菌素。鼠疫菌素具有两个结构域,一端能与FyuA结合,另一端与噬菌体T4溶菌酶结构相似。因此,Lukacik等[41]将鼠疫菌素的结合域与T4溶菌酶N端融合得到重组裂解酶。这种人工噬菌体裂解酶不仅可以杀死特定的耶尔森菌和致病性大肠杆菌,还可以逃避鼠疫菌素免疫蛋白Pim的攻击。Heselpoth等[42]参考Lukacik[41]、Yan Guangmou[43]等的重组方法,将铜绿假单胞菌的细菌素S2(PyS2)与噬菌体裂解酶GN4融合,得到人工裂解酶-细菌素杂交分子PyS2-GN4。这种杂交分子能通过主动运输穿过外膜上的FpvAI蛋白通道,并进入细胞周质而接触到肽聚糖层,导致肽聚糖层破坏、细胞内膜失衡、细胞质渗漏。如图3所示,FpvAI是外膜转运蛋白,ExbB、ExbD、TonB1膜蛋白构成内膜Ton输入系统,PyS2-GN4的杀菌机制有以下4 步:1)人工噬菌体裂解酶PyS2-GN4的结构域I能与FpvAI特异性结合;2)特异性结合导致受体构象变化并允许FpvAI的一小段无序氨基酸(TonB box,TBB)在周质中与TonB1结合而生成复合物,导致TBB部分展开并形成通道;3)PyS2-GN4 N端I的非结构化区域通过新形成的通道,并将其自身TBB与周质附近另一个TonB1结合,随后诱导其余部分的展开和导入;4)PyS2-GN4在周质中重新折叠,并通过水解释放GN4,作用于肽聚糖层,引起内膜失衡,最终导致细胞死亡。进一步研究发现,PyS2-GN4不但能裂解铜绿假单胞菌和多种革兰氏阴性致病菌,而且还能有效清除生物被膜。

图3 人工噬菌体裂解酶PyS2-GN4的杀菌机制[42]Fig. 3 Description of the bactericidal mechanism of PYS2-GN4[42]
Briers等[44]通过将具有模块化结构的革兰氏阴性菌噬菌体裂解酶OBPgp279和PVP-SE1gp146与多种不同的异源多肽(阳离子肽、疏水性肽、两亲螺旋肽等)进行融合,评价了重组噬菌体裂解酶的活性并探究了异源肽结合位点的影响。研究表明,这种具有模块化的噬菌体裂解酶与异源多肽融合后,能够对其裂解活性产生不同程度的影响。其中,与多阳离子肽融合后,重组的裂解酶可以在30 min内使耐药性铜绿假单胞菌和鲍曼不动杆菌数量降低4~5(lg(CFU/mL))。此外,异源肽在N端与噬菌体裂解酶融合的效果优于C端[44]。Gerstmans等[22]提出了一种通用型高通量靶向先导物(H2L)筛选方法,以建立重组噬菌体裂解酶的开发平台。通过这种平台快速构建了靶向鲍曼不动杆菌的模块化重组噬菌体裂解酶(膜渗透肽-连接肽-结合域-催化域),并得到了近10 000个重组噬菌体裂解酶。
3 噬菌体裂解酶的应用研究
2006年,美国食品和药物管理局(Food and Drug Administration,FDA)批准了一种含有六株噬菌体的鸡尾酒制剂ListexTMP100,用于控制即食肉类中单增李斯特菌的污染[45]。美国Intralytix公司的研究表明,EcoShield PXTM噬菌体对大肠杆菌、大肠杆菌O157:H7、产志贺毒素大肠杆菌均有较好的抑制作用[46]。虽然噬菌体能够作为提高食品安全和减少食源性感染风险的有效抗菌剂,但是通过活体添加噬菌体的方式,往往很难让消费者所接受。噬菌体裂解酶避免了噬菌体的一些缺点[13],因而在食品工业中具备更广阔的应用前景,可作为具备天然抑菌和防腐功能的食品添加剂,靶向消除或控制食品中致病菌和腐败菌。此外,生物被膜的形成已成为食品工业控制致病菌污染的一大障碍。研究表明,噬菌体裂解酶可有效破坏生物被膜结构或杀死被膜基质中的细菌,从而消除预形成的生物被膜[47]。
3.1 控制革兰氏阳性菌
食源性革兰氏阳性致病菌包括金黄色葡萄菌、单增李斯特菌、蜡样芽孢杆菌、肉毒杆菌、产气荚膜梭菌等,对食品工业和公共健康造成了极大的安全隐患。噬菌体裂解酶可靶向作用于革兰氏阳性菌暴露的肽聚糖层,直接从外识别并裂解菌体,从而有效控制食源性革兰氏阳性菌的污染,表1总结了近年来革兰氏阳性菌噬菌体裂解酶的相关研究进展。

表1 天然噬菌体裂解酶控制革兰氏阳性菌Table 1 Natural lysins control gram-positive pathogens
3.1.1 控制金黄色葡萄球菌
金黄色葡萄球菌具有多种毒力因子,是导致食源性疾病的主要致病菌之一,可迅速引起恶心、呕吐、腹泻等症状,严重的可造成感染者死亡。噬菌体裂解酶为控制食源性金黄色葡萄球菌提供了一种新的选择。Yu等[61]研究表明,噬菌体裂解酶LysSAP8对MRSA在内的葡萄球菌属具有广谱裂解活性,并且具有很强的环境适应度,在4~43 ℃、pH 3~9和0~1 000 mmol/L NaCl下均能保持较好的裂解活性。在优化条件下,LysSAP8可在30 min内使处于指数生长阶段的浮游细胞降低约3.46(lg(CFU/mL))。噬菌体裂解酶不仅是一种高效的食品抗菌剂,而且可以作为一种实用的器具消毒剂。研究表明,LysSA11对食品和器具中人工污染的MRSA均有杀菌活性[62],在冷藏温度(4 ℃)下,经LysSA11处理15 min,可分别降低牛奶和火腿上MRSA的菌量1.44(lg(CFU/mL))和3.12(lg(CFU/cm3)),而在室温(25 ℃)下处理15 min可分别降低MRSA的菌量2.02(lg(CFU/mL))和3.37(lg(CFU/cm3));经1.35 mmol/L的LysSA11处理30 min后,可完全清除聚丙烯塑料砧板和不锈钢菜刀上4(lg(CFU/cm2))的MRSA载量。噬菌体裂解酶LysH5不仅能够将巴氏杀菌奶中的金黄色葡萄球菌污染降低到无法检测水平[63],还能降解葡萄球菌属的生物被膜。但LysH5对葡萄球菌属生物被膜的破坏与生物被膜胞外基质无关,而是直接杀死附着菌株细胞导致生物被膜的破坏[58]。另外一种噬菌体裂解酶LysCSA13不但在不同pH值及Ca2+、Mn2+条件下对葡萄球菌属具有较强的抗菌活性,而且可高效去除聚苯乙烯、玻璃和不锈钢等表面80%~90%的生物被膜[64]。
3.1.2 控制单增李斯特菌
单增李斯特菌在环境中的持久性和在冷藏条件下的生长能力,给食品制造和加工过程带来极大风险。基于噬菌体控制单增李斯特菌的研究已在多种食品中广泛开展,其中,两种基于噬菌体生物制剂ListShield( 美国Intralytix公司生产)和ListexTMP100(荷兰Micreos公司生产)已被美国FDA批准应用于食品生产。纯化后的噬菌体裂解酶被认为可用于解决单核增生李斯特菌对食品的持续污染问题[65],为防控单增李斯特菌食源性风险提供了一种新的选择。van Tassell等[48]比较了噬菌体裂解酶PlyP100在不同环境下对单增李斯特菌的裂解活性,并将应用于多种单增李斯特菌混合污染的新鲜奶酪模型中。研究发现,在纯培养条件下,PlyP100可在30 min内使菌株浊度降低70%~80%,而在冷藏新鲜奶酪中,PlyP100对单增李斯特菌有较好的抑制效果,可靶向作用于菌体细胞壁的肽聚糖层。此外,PlyP100在模拟奶酪冷藏4 周货架期内可持续性抑制单增李斯特菌的生长。另一项研究表明,噬菌体裂解酶LysZ5处理冷藏温度下的豆奶3 h,有效裂解人工接种的单增李斯特菌超过4(lg(CFU/mL))[50]。
3.2 控制革兰氏阴性菌
如表2所示,尽管关于噬菌体裂解酶的研究大多集中于革兰氏阳性细菌的控制,但近年来也有研究将噬菌体裂解酶单独使用或与膜渗透剂(如多黏菌素B、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)等)联用,以克服革兰氏阴性菌的外膜屏障。
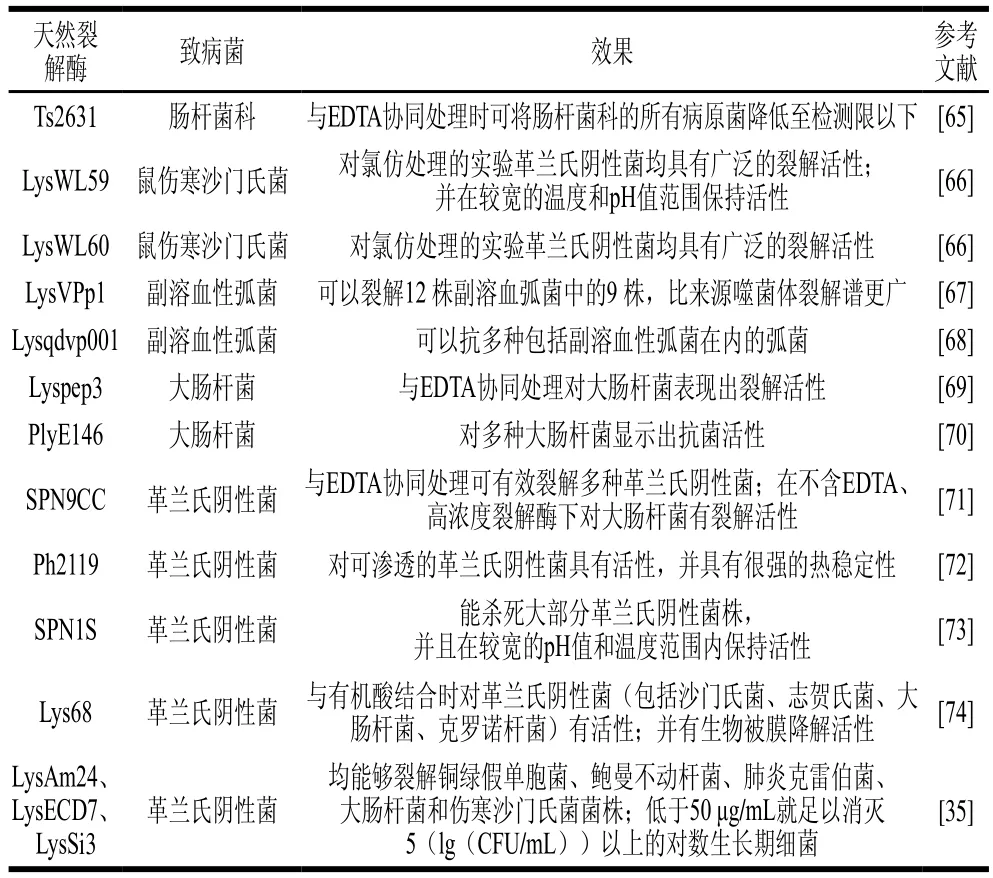
表2 天然噬菌体裂解酶控制革兰氏阴性菌Table 2 Natural lysins control gram-negative bacteria
噬菌体裂解酶SPN1S具有类溶菌酶超家族结构域,能杀死大部分革兰氏阴性菌株,并且在不同pH值和温度范围内(pH 7.0~10.5和25~45 ℃)均保持稳定的抗菌活性[73]。当与螯合剂EDTA联用时,SPN1S通过细菌外膜的能力和裂解活性显著增强。另一种噬菌体裂解Ts2631与EDTA联用时,可将多重耐药柠檬酸杆菌在内的所有肠杆菌科病原菌降低到检测限以下(降低6(lg(CFU/mL)))[65]。Liu Aiping等[66]从噬菌体LPST10中鉴定并制备了两种噬菌体裂解酶LysWL59和LysWL60,对氯仿处理后的革兰氏阴性菌均具有广泛的裂解活性。其中,LysWL59表现出更强的稳定性,在pH 6.0~10.0和温度4~90 ℃条件下均保持良好的裂解活性。当LysWL59与外膜渗透剂联用时,可裂解Tris-HCl缓冲液中鼠伤寒沙门氏菌的活细胞,2.50 mmol/L的LysWL59与0.50 mmol/L的EDTA联用时,在1 h内清除了生菜上93.03%的鼠伤寒沙门氏菌。
4 结 语
在细菌耐药性大流行的背景下,噬菌体裂解酶是一种天然来源的功能蛋白,具有相对安全、高效、特异、可清除生物被膜、低耐药风险等诸多优点,有助于控制食品中的致病菌与腐败菌,可作为一种具有极大应用前景的食品杀菌保鲜技术。同时,噬菌体裂解酶不会改变食品质地和口感,也不会影响食品中的有益菌群,合理的开发及应用将有益于食品工业的发展。但是,天然噬菌体裂解酶的理化性质、裂解效果、安全性等均存在一些不确定性,大大限制了其在食品工业中的应用。人工重组的噬菌体裂解酶能够克服以上缺陷,根据噬菌体裂解酶的模块化结构,基于现代酶工程技术通过嵌合重组、衍生突变、异源融合等工程方法,对噬菌体裂解酶进行定向改造,优化其理化性质、裂解效果、安全性等特性,以适应复杂多变的实际食品加工环境。基于以上综述与分析,本文进一步对噬菌体裂解酶在食品工业中的发展及应用进行展望。
4.1 深度挖掘噬菌体裂解酶生物信息资源
噬菌体是地球上最为丰富的生命形式之一,其数量为细菌的10 倍,广泛分布于各种环境之中。目前,基于高通量测序技术的基因组学、宏基因组学快速发展,为噬菌体裂解酶生物信息资源的进一步深度挖掘提供了可靠的技术支持。随着海洋噬菌体资源和基因组信息的不断挖掘,系统性地研究并构建噬菌体裂解酶生物信息资源数据库,将有助于拓展噬菌体裂解酶的应用潜力,获得环境适应性强、裂解谱系广、杀菌功效高的噬菌体裂解酶;而对噬菌体裂解酶生化结构和抗菌特性的相关性分析,将为噬菌体裂解酶的重组提供更多的理论信息,以更好地服务于食品中致病与腐败微生物的有效控制。
4.2 针对不同食物基质定向重组噬菌体裂解酶
与纯培养物不同,复杂多变的食物基质容易对噬菌体裂解酶的活性造成影响[13-14]。因此,未来对于噬菌体裂解酶的研究,应模仿食品实际加工条件,研究在特定食物基质环境下,鉴定噬菌体裂解酶的功效和特性,以更好地了解其作为有效食品抗菌剂的潜力。噬菌体裂解酶的模块化特征为其人工重组改造提供了可能,基于不同食物基质的特性,明确噬菌体裂解酶定向进化的需求,通过嵌合重组、衍生突变、异源融合等策略对其进行优化以量身定制重组噬菌体裂解酶,以更好地服务于食品工业与食品安全。此外,充分了解某些食品基质参数对噬菌体裂解酶功效的影响,也有助于为食品制定噬菌体裂解酶的使用方法,为噬菌体裂解酶的精准使用和产业化应用提供支持。
4.3 表达策略优化增加经济效益
噬菌体裂解酶在食品工业中实际应用需要规模化的纯化与生产,而目前以发酵为基础的生产方法成本过高,对其进一步的产业化应用造成了障碍。因此,采用新型表达系统,以降低噬菌体裂解酶生产和纯化的成本,有助于降低生产成本并推动其在食品工业中的广泛应用。最近,绿色微藻[75]、植物病毒表达系统[76]和可食用植物[77]等已被证明能够用于噬菌体裂解酶的表达和生产,并能持续保留良好的抗菌活性。此外,当使用植物作为表达系统时,不需要昂贵的生物反应器和培养基,有研究指出植物表达抗菌蛋白的生产成本为每克3.00~6.88 美元[78],可为噬菌体裂解酶的工业化生产应用提供一种新策略。
4.4 多工艺结合深化应用前景
噬菌体裂解酶之间的联用、与其他抗菌制剂或杀菌技术之间的协同作用,可进一步提高其对致病菌的杀灭效果。基于噬菌体裂解酶独特的杀菌特性、低耐药性及高安全性等优势,可联合食品添加剂(如香精油、化学防腐剂等)、细菌素(如乳酸链球菌素)、抗菌肽等,以提升其杀菌保鲜功效。还可利用噬菌体裂解酶作为食品生物涂层材料或者食品包装材料,以长期控制食品中的致病菌与腐败菌,有效延长食品的货架期。特定的噬菌体裂解酶还可与其他消毒工艺(如巴氏消毒等)、杀菌工艺(如高静水压力、酸性电解水等)结合使用,为食品安全提供多重保障。
4.5 建立监管框架和使用标准
噬菌体裂解酶具有独特的作用位点和高度特异性,难以对真核细胞和非特异性微生物产生不良影响,体内外实验均表明噬菌体裂解酶是一种安全的酶制剂[9],目前,基于噬菌体裂解酶SAL200的人体二期临床实验也已经开展[10]。噬菌体裂解酶的种类繁多,理化性质和稳定性都不尽相同,因此,后续研究需要对噬菌体裂解酶的理化性质(如其裂解活性、裂解谱、耐受温度、耐受pH值、盐耐受程度、溶解性、稳定性等)进行系统性评价,以筛选出合适的产品来应对不同的应用场景。尽管噬菌体裂解酶在食品工业中具有极大的应用前景,但是目前缺乏相关使用标准和法律框架,这是噬菌体裂解酶规模化生产应用的关键障碍,因为噬菌体裂解酶很可能是作为一种食品添加剂或食品消毒剂使用,这需要在允许的工业和监管框架内协调生产许可和批准使用。从这个意义上说,一方面,有关部门应积极讨论这种新型抗菌剂在食品工业中的使用范围,为其合理、安全的使用提供相应的行业标准和法律依据;另一方面,高校、研究院等科研机构应针对其杀菌效果、作用机理、毒理学分析等方面进行更深入的研究,并建立系统的理化性质、毒理安全、稳定性评价方法和体系,为其有效性和安全性提供数据支撑和理论依据,以推动噬菌体裂解酶行业标准和法律依据的制定。
