乳源抗菌肽BCp12对金黄色葡萄球菌多靶点抑菌机制
2022-01-06李钰芳顾韦维黄艾祥施娅楠
李钰芳,杨 昆,顾韦维,赵 琼,黄艾祥,施娅楠
(云南农业大学食品科学技术学院,云南 昆明 650201)
金黄色葡萄球菌属于有害的革兰氏阳性病原体,是世界第三大食源性微生物[1-2],多重耐药金黄色葡萄球菌在动物产品中检出率较高[3-4],特别是在生奶和奶制品中[5-6],目前由多重耐药金黄色葡萄球菌引发的公共卫生问题十分严峻[7]。抗菌肽因其具有抗菌谱广、抗菌活性强以及多靶点抗菌不易产生耐药性的原因[8],成为国内外学者研究的热点。
目前研究认为,抗菌肽的抑菌作用机制主要分为膜结构破坏模式和非膜结构破坏模式[9],郭娟等[10]发现抗菌肽P-1通过影响粉红单端孢(Trichothecium roseum)壁膜通透性、抑制蛋白和核酸的合成3个方面共同作用达到抑菌效果;钟亨任等[11]发现抗菌肽Brevinin-GR23通过破坏细菌细胞膜进入细胞与DNA相互作用,干扰DNA的转录;4 种富含脯氨酸的pyrrhocoricin、drosocin、apidaecin和Bac7均能与细菌的热休克蛋白Dnak和分子伴侣GroEl结合,抑制其活性[12-13];Miao Jianyin等[14]报道,经抗菌肽F1处理后埃希氏大肠杆菌蛋白表达受到影响,31个差异蛋白通过影响其三羧酸循环、氧化磷酸化、甘油磷脂代谢和细胞周期的途径,抑制细胞生长、诱导细胞形态改变和细胞死亡。蛋白质翻译后修饰可调节蛋白质的活性、折叠以及蛋白与其他生物大分子间(包括蛋白、核酸、脂质等)相互作用,是机体快速高效适应环境的保证,包括蛋白的磷酸化、乙酰化、琥珀酰化、丙二酰化、糖基化、2-羟基异丁酰化、丙酰化等。近年来,越来越多的研究发现,许多生命活动、生理功能、疾病的发生不仅与蛋白质的丰度相关,更重要的是还与各类蛋白质翻译后修饰有关。目前对致病菌蛋白修饰的研究主要集中在各种修饰对菌体分泌毒素、菌体耐药基因等的影响以及酸、碱、盐、金属离子等对致病菌蛋白修饰的影响[15-16],对蛋白修饰介导的抗菌肽抑菌机理的研究报道较少。
本实验所用抗菌肽BCp12为自主研发,利用贯筋藤凝乳酶酶解槟榔江水牛乳后,基于活菌亲和吸附联合反相高相液相色谱纯化,得到单一色谱峰,经液相色谱串联质谱鉴定,该色谱峰中包含了4个肽段,经活性筛选确定目标活性肽BCp12,其氨基酸序列为YLGYLEQLLRLK,是一种αs1酪蛋白源抗菌肽。该抗菌肽稳定性好,具有广谱抗菌效果,对哺乳动物显示低溶血性和低毒性[17-18],但对多重耐药金黄色葡萄球菌的抑菌效果及抑菌机制尚不明确。本实验以乳制品中分离出的多重耐药金黄色葡萄球菌(对青霉素、苯唑西林、红霉素、克林霉素、四环素、头孢西丁显示耐药性)为靶标菌,明确BCp12对其壁膜损伤、核酸合成、蛋白合成及蛋白翻译后修饰4个方面的影响,以期从膜透化致死和非膜靶向致死两方面阐明BCp12对耐药金黄色葡萄球菌的抑菌机制,旨在为乳源抗菌肽、天然食品防腐剂的研制提供理论依据。
1 材料与方法
1.1 材料、菌株与试剂
抗菌肽BCp12分离纯化于贯筋藤凝乳酶酶解的槟榔江水牛酪蛋白,由安徽国平药业有限公司合成,纯度为98.798%。
金黄色葡萄球菌DC.RB-015(Staphylococcus aureus)由云南省疾病预防控制中心提供。
LB肉汤 广东环凯微生物科技有限公司;正十六烷、碘化丙啶(polyimide,PI)、溴化乙锭(ethidium bromide,EB) 山东西亚化学工业有限公司;细菌基因组DNA提取试剂盒 北京索莱宝科技有限公司;十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfatepolyacrylamide gel electrophoresis,SDS-PAGE)蛋白上样缓冲液(5×) 北京兰杰柯科技有限公司;革兰氏阳性菌蛋白提取试剂盒 上海贝博生物科技有限公司;SDS-PAGE凝胶速配试剂盒 美国GenScript公司;一抗(赖氨酸乙酰化抗体PTM-101、赖氨酸琥珀酰化抗体PTM-419、赖氨酸2-羟基异丁酰化抗体PTM-802、赖氨酸丙二酰化抗体PTM-902) 杭州景杰生物科技有限公司;二抗(Pierce抗体) 美国赛默飞世尔公司。
1.2 仪器与设备
LDZM-60KCS高压灭菌锅 上海申安医疗器械厂;FlexSEM1000扫描电子显微镜 日本日立高新公司;JEM-2100透射电子显微镜 日本电子公司;C6流式细胞仪 美国BD Biosciences公司;全波长荧光酶标仪美国Biotek公司;BioPowerPacTM电泳仪、Chem1DOC MF电泳自动成像仪 美国Biorad公司;TGL20M高速冷冻离心机 湖南湘立科学仪器有限公司。
1.3 方法
1.3.1 抗菌肽BCp12对金黄色葡萄球菌抑菌活性的测定
参照曹海鹏等[19]的方法测定BCp12的最小抑菌质量浓度(minimum inhibitory concentration,MIC)。取对数期的菌体,用0.02 mol/L pH 7.2磷酸盐缓冲液(phosphate buffer saline,PBS)洗涤菌体3 次后制备成菌悬液(菌液浓度为108CFU/mL),加入96 孔板内。用二倍稀释法将BCp12稀释后加入菌悬液中,空白对照组为等量无菌水。将96 孔板置于37 ℃恒温培养箱孵育18 h,测定OD600nm值,以抗菌肽质量浓度为横坐标、OD600nm值为纵坐标绘制曲线,拐点即为MIC。
参照付云等[20]的方法将BCp12加入到金黄色葡萄球菌菌悬液(菌液浓度为108CFU/mL)中,使其终质量浓度为MIC。37 ℃恒温培养箱连续培养24 h,每隔2 h进行取样,测定OD600nm值,绘制生长曲线,空白对照组为等量无菌水代替抗菌肽加入菌悬液中。
1.3.2 抗菌肽BCp12对金黄色葡萄球菌壁膜影响的测定
1.3.2.1 菌体细胞表面疏水性的测定
参照Hou Lixia[21]和Prasath[22]等的方法稍作修改,离心收集对数期菌体,用PBS洗涤3 次后用0.1 mol/L KNO3溶液重悬(菌液浓度为108CFU/mL),取不同质量浓度BCp12溶液与菌悬液等体积混合,使BCp12终质量浓度分别为1/4 MIC、1/2 MIC、MIC、3/2 MIC、2 MIC,对照组为等量无菌水。37 ℃恒温培养12 h,测定OD405nm值(记为A0);然后吸取体积为1.2 mL的菌悬液,向其中加入200 μL十六烷,漩涡2 min,静置15 min,直至菌悬液和十六烷两相溶液完全分层,小心吸取水相,测定OD405nm值(记为A1)。细菌细胞表面疏水性用细胞吸附率表征,计算公式如下。
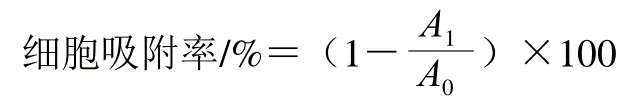
1.3.2.2 菌体细胞膜完整性的测定
根据陈飞龙[23]的方法测定细胞膜完整性,离心收集对数期菌体,PBS洗涤3 次后重悬得到菌悬液(菌液浓度为108CFU/mL),加入BCp12使其终质量浓度为MIC,以加入无菌水组作为对照,置于37 ℃摇床中,120 r/min振荡培养2 h,加入终质量浓度为10 μg/mL的PI溶液,4 ℃避光静置孵育15 min,用流式细胞仪记录被PI着染的细菌细胞数。
1.3.2.3 透射电子显微镜观察菌体微观结构
参照孙亚楠[24]的方法稍作修改,离心收集对数期金黄色葡萄球菌,用PBS缓冲液洗涤3 次,并重悬(菌液浓度为108CFU/mL),实验组加入终质量浓度为MIC的BCp12,对照组加入等量的无菌水,于37 ℃恒温培养箱培养14 h,离心去上清液,PBS洗涤3 次后再离心收集菌体沉淀。菌体沉淀加2.5%戊二醛固定12 h,将固定好的金黄色葡萄球菌离心后除去固定液,PBS洗涤3 次后加入锇酸固定2 h,用PBS洗涤3 次得到菌体沉淀。分别依次用30%、50%、70%、80%、90%和100%乙醇脱水,每次脱水时间为10 min。然后用包埋剂浸透菌体室温静置2 h,包埋过夜,再于60 ℃静置48 h后取出,切片染色后透射电子显微镜下观察、拍照。
1.3.3 抗菌肽对金黄色葡萄球菌DNA和蛋白合成影响的测定
1.3.3.1 抗菌肽对菌体DNA的影响
参照李莉蓉[25]的方法稍作修改,离心收集对数期菌体,利用细菌基因组DNA提取试剂盒参照其说明书提取菌体DNA,用蒸馏水将菌体DNA稀释为50 μg/mL,加入96 孔板内,每孔加入50 μL DNA溶液和0.75 μL 100 μg/mL EB溶液,混匀后置于37 ℃培养箱中避光孵育10 min,加入50 μL不同质量浓度的BCp12溶液,对照组用50 μL无菌水代替BCp12溶液,混匀之后置于37 ℃恒温培养箱中避光孵育30 min。孵育结束后,用多功能酶标仪测定样品在激发波长535 nm及发射波长550~700 nm范围内的荧光光谱。
1.3.3.2 抗菌肽对菌体蛋白合成的影响
参照宁亚维等[26]的方法稍作修改,离心收集对数期菌体用PBS洗涤3 次并重悬(菌液浓度为108CFU/mL),分别加入不同质量浓度的BCp12溶液,使其终质量浓度分别达到MIC和2 MIC,对照组加入等体积的无菌水,37 ℃培养箱培养12 h,离心收集菌体沉淀,参照革兰氏阳性菌蛋白提取试剂盒的步骤对其总蛋白进行提取,用BCA法测定蛋白浓度,对提取的总蛋白进行SDS-PAGE。每个样品取等量蛋白到离心管中,加入5 μL 4×蛋白上样缓冲液,再加入2% SDS使总体积为20 μL,依次上样1 μL预染蛋白Marker和20 μL蛋白样品,调节电流至35 mA开始电泳,待样品跑至胶底部,将胶板取下银染2 h,加入脱色液脱色至背景无色、条带清晰后放置凝胶成像系统观察。
1.3.4 抗菌肽对金黄色葡萄球菌蛋白翻译后修饰的影响
参照杭天蓉[27]的方法稍作修改,离心收集对数期菌体用PBS洗涤3 次并重悬(菌液浓度为108CFU/mL),加入BCp12使其终质量浓度为MIC,对照组加入等体积的无菌水,37 ℃培养箱培养12 h,离心收集菌体沉淀,参照革兰氏阳性菌蛋白提取试剂盒的步骤对菌体总蛋白进行提取,将提取的蛋白质浓度调节至2 mg/mL,进行SDS-PAGE(分离胶质量分数12%),通过电转印迹将蛋白转移至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上。室温用5%牛血清白蛋白(bovine serum albumin,BSA)的TBS缓冲液(25 mmol/L Tris-HCl,pH 8.0,150 mmol/L NaCl)对膜封闭2 h。加入一抗(赖氨酸乙酰化抗体、赖氨酸琥珀酰化抗体、赖氨酸2-羟基异丁酰化抗体、赖氨酸丙二酰化抗体),1∶1 000稀释,孵育过夜。用TBST缓冲液(25 mmol/L Tris-HCl,pH 8.0,150 mmol/L NaCl、0.1% Tween 20)洗涤3 次后,37 ℃加二抗羊抗鼠IgG,1∶5 000稀释,孵育1 h。将膜用TBS缓冲液重新洗涤,再加入荧光底物孵育5 min后进行曝光处理。
1.4 数据统计与分析
所有实验均做3 次平行,使用GraphPad Prism 8.0软件进行数据分析,两组间比较采用独立T检验(两尾法),P≤0.05为差异显著。
2 结果与分析
2.1 抗菌肽BCp12对金黄色葡萄球菌的抑菌活性
如图1A所示,BCp12对金黄色葡萄球菌的MIC为2 mg/mL;如图1B所示,在24 h内BCp12能够显著抑制菌体的生长(P≤0.05、P≤0.01),BCp12处理组细菌生长8 h开始与对照组相比具有显著性差异(P≤0.05),生长至16 h趋于稳定。有研究发现,从短芽孢杆菌发酵液中提取出的抗菌肽Tostadin对金黄色葡萄球菌的MIC为32 μg/mL[28],从巴西树蛙表皮提取得到的抗菌肽HS-1对革兰氏阳性菌具有显著抑菌活性,其中对金黄色葡萄球菌的MIC为11.7 μmol/L(0.025 mg/mL)[29],与其相比,BCp12的MIC较大,但BCp12是一种新型乳源抗菌肽,采用酶法水解得到,安全性较高。
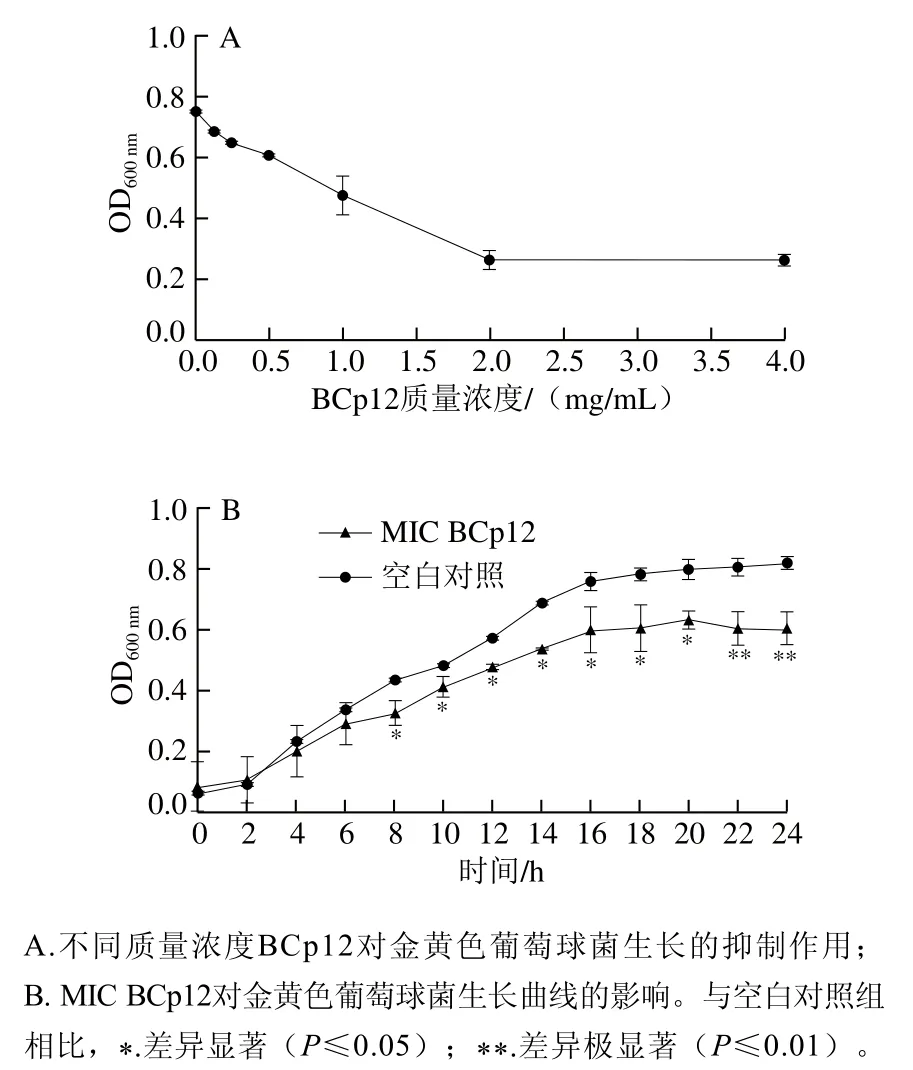
图1 抗菌肽BCp12对金黄色葡萄球菌的抑制作用Fig. 1 Inhibitory effect of antimicrobial peptide BCp12 on S. aureus
2.2 抗菌肽BCp12对菌体壁膜的损伤机制
2.2.1 抗菌肽BCp12对菌体细胞表面疏水性的影响
如图2所示,质量浓度大于等于MIC的BCp12作用于金黄色葡萄球菌后,细胞表面的疏水性显著降低(P≤0.001),从对照组的86.6%降为MIC BCp12处理组的73.1%,且BCp12对菌体细胞表面疏水性的影响呈浓度依赖性。有研究表明,家蝇抗菌肽Hf-1处理6 种细菌后,其表面疏水性由43.71%~45.14%降至2.00%~34.57%[21],螺旋藻抗菌肽SP-1作用于大肠杆菌后其表面疏水性由70.03%降至20.86%[30],说明抗菌肽降低了细菌表面疏水性,所得结果与本实验一致。郭文杰等[31]提出抗菌肽表面富含正电荷,抗菌肽YD1、Melittin和Bac8c通过其表面的正电荷与耐甲氧西林金黄色葡萄球菌表面的负电荷结合并黏附于细菌表面,进一步破坏细胞膜从而杀灭细菌。BCp12与细胞膜的结合过程及抑菌活性的发挥可能与其诱导的细胞表面疏水性的变化有关。
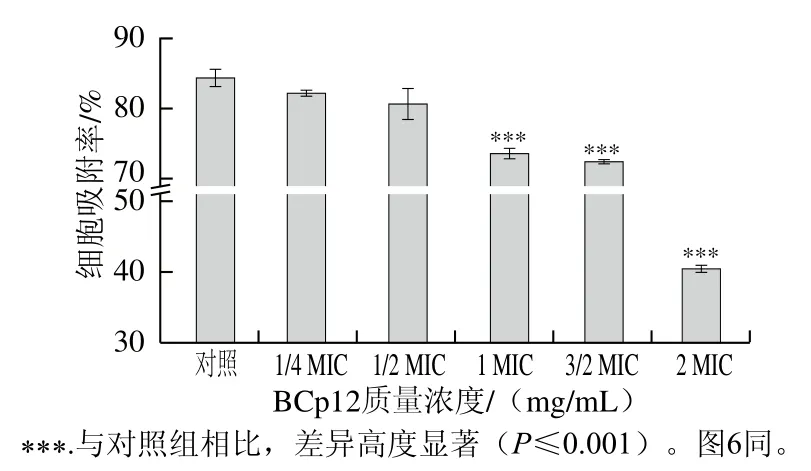
图2 抗菌肽BCp12对金黄色葡萄球菌细胞表面疏水性的影响Fig. 2 Effect of antimicrobial peptide BCp12 on the cell surface hydrophobicity of S. aureus
2.2.2 抗菌肽BCp12对细菌细胞膜完整性的影响
如图3所示,经BCp12处理后,完整细胞比例由对照组的72.8%降至实验组的47.6%,说明实验组的细胞膜损伤率为52.4%,BCp12会导致细胞膜完整性显著降低(P≤0.05)。细胞膜受损主要表现为细胞膜通透性增加,而PI不能透过完整的细胞膜,当细胞膜受到损伤后才可进入细胞内部与核酸结合发出荧光,Chia等[32]发现,抗菌肽Litoria caerlea和抗菌肽Litoria geninaculata通过破坏活细胞细胞膜完整性发挥抑菌作用,陈飞龙[23]研究发现经抗菌肽处理的细胞膜损伤率由对照组的0.53%升高至实验组10.32%(P≤0.05),与本实验结果相符,说明抗菌肽能够破坏金黄色葡萄球菌的细胞膜,引起内容物外泄,致使细胞死亡。
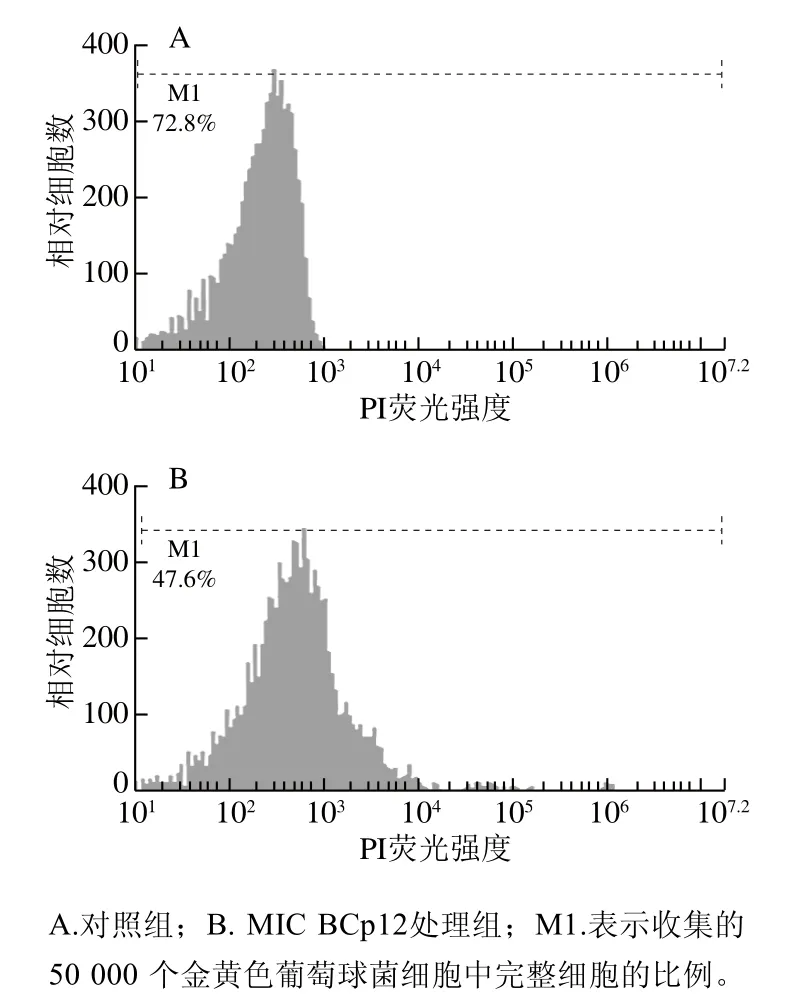
图3 流式细胞仪分析抗菌肽BCp12处理后的金黄色葡萄球菌细胞膜完整性Fig. 3 Effect of antimicrobial peptide BCp12 on the membrane integrity of S. aureus as analyzed by flow cytometer
2.2.3 抗菌肽BCp12对菌体微观结构的影响
利用透射电子显微镜可以直接观察到S. aureus细胞膜的损伤情况及超微结构的变化。如图4A所示,未经BCp12处理的金黄色葡萄球菌细胞呈球形,形态完整饱满,细胞质分布均匀,其胞内呈现黑色,是蛋白质、DNA等内容物被重金属染色造成的;由图4B可知,经MIC BCp12处理后,金黄色葡萄球菌细胞出现皱缩并发生严重的形变,细胞颜色变浅,部分细胞的内容物丢失出现空腔。Hartmann等[33]研究发现,金黄色葡萄球菌经抗菌肽PGLa处理后,透射电子显微镜观察到金黄色葡萄球菌细胞发生皱缩,细胞器完全溶解,细胞质丢失甚至出现空腔,从而使染色的细胞颜色变浅;Yang Shen等[34]通过透射电子显微镜观察发现,抗菌肽LCWAP处理金黄色葡萄球菌后,细菌细胞膜被部分破坏并随细胞质流出,说明抗菌肽能够破坏金黄色葡萄球菌细胞膜,造成细胞质外泄;Fitriyanti等[35]通过透射电子显微镜观察到抗菌肽CecropinP1导致细菌细胞膜破裂致使细胞内物质泄漏,进而造成细胞死亡,与本研究结果一致。说明BCp12会破坏金黄色葡萄球菌的细胞膜导致细胞内容物外泄形成空腔,致使细胞死亡。
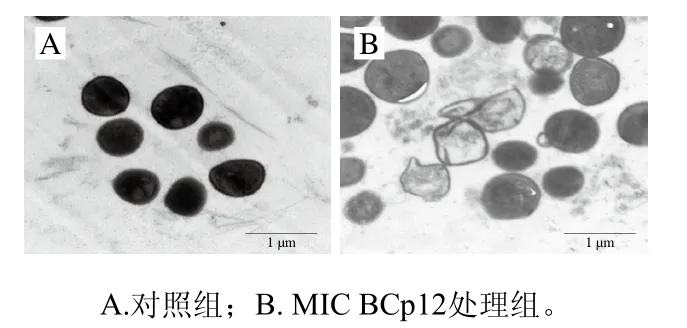
图4 透射电子显微镜观察抗菌肽BCp12对金黄色葡萄球菌细胞微观结构的影响Fig. 4 Effect of antimicrobial peptide BCp12 on the microstructure of S. aureus observed by TEM
2.3 抗菌肽BCp12对金黄色葡萄球菌DNA和蛋白合成的影响
2.3.1 抗菌肽BCp12对菌体DNA的影响
如图5所示,对照组菌体DNA的荧光强度明显高于实验组,并且荧光强度随着BCp12质量浓度的增加而下降,说明BCp12存在会与EB竞争结合DNA使EB-DNA复合物体系荧光强度下降。有研究表明,EB是一种可以和DNA结合的荧光染料,其结合方式有两种,当它与DNA嵌插结合时荧光强度增强,当它通过静电作用与DNA结合时荧光强度不变[36-37],唐亚丽发现家蝇抗菌肽MDpep5和MDpep9能与细菌DNA结合使荧光强度降低,可进一步影响DNA的复制、转录、表达功能,达到迅速抑菌、杀菌的作用[38],与本实验结果一致。
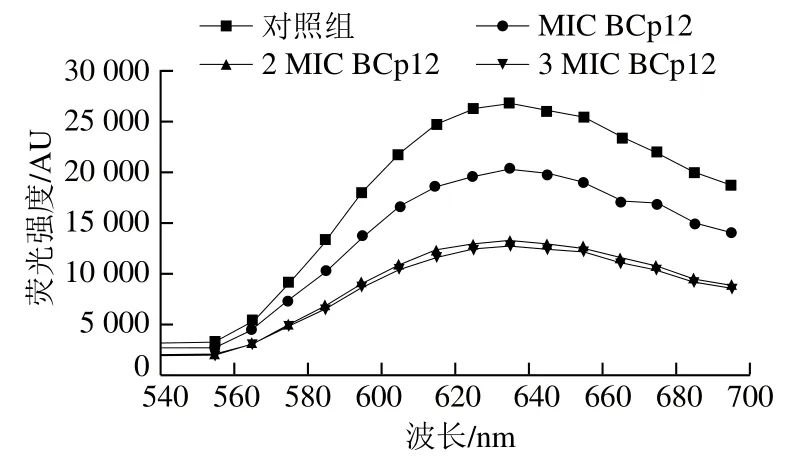
图5 抗菌肽BCp12与EB竞争性结合金黄色葡萄球菌DNAFig. 5 Antimicrobial peptide BCp12 and ethidium bromide (EB)competitively bound to DNA of S. aureus
2.3.2 抗菌肽BCp12对菌体蛋白合成的影响
由图6A可知,经BCp12处理的实验组与对照组相比胞内蛋白质量浓度呈现显著下降的趋势(P≤0.001)。由图6B可知,对照组的蛋白条带清晰完整,而经BCp12处理后金黄色葡萄球菌胞内蛋白条带出现不同程度的缺失现象,其中,菌体经MIC BCp12处理后,蛋白条带缺失较多的部分主要集中在分子质量为15~35 kDa之间,当BCp12质量浓度上升至2 MIC时,分子质量在10~35、55、100 kDa处的蛋白条带几乎消失,说明增大BCp12质量浓度,金黄色葡萄球菌胞内蛋白质量浓度急剧降低,金黄色葡萄球菌胞内蛋白质的合成完全受到抑制。付云等[20]研究了抗菌肽SP-AP-1和Iturin A对金黄色葡萄球菌胞内蛋白的影响,发现抗菌肽能够造成分子质量为17、20、25~35 kDa的蛋白质含量降低,蛋白条带颜色显著变浅,从而导致菌体死亡。
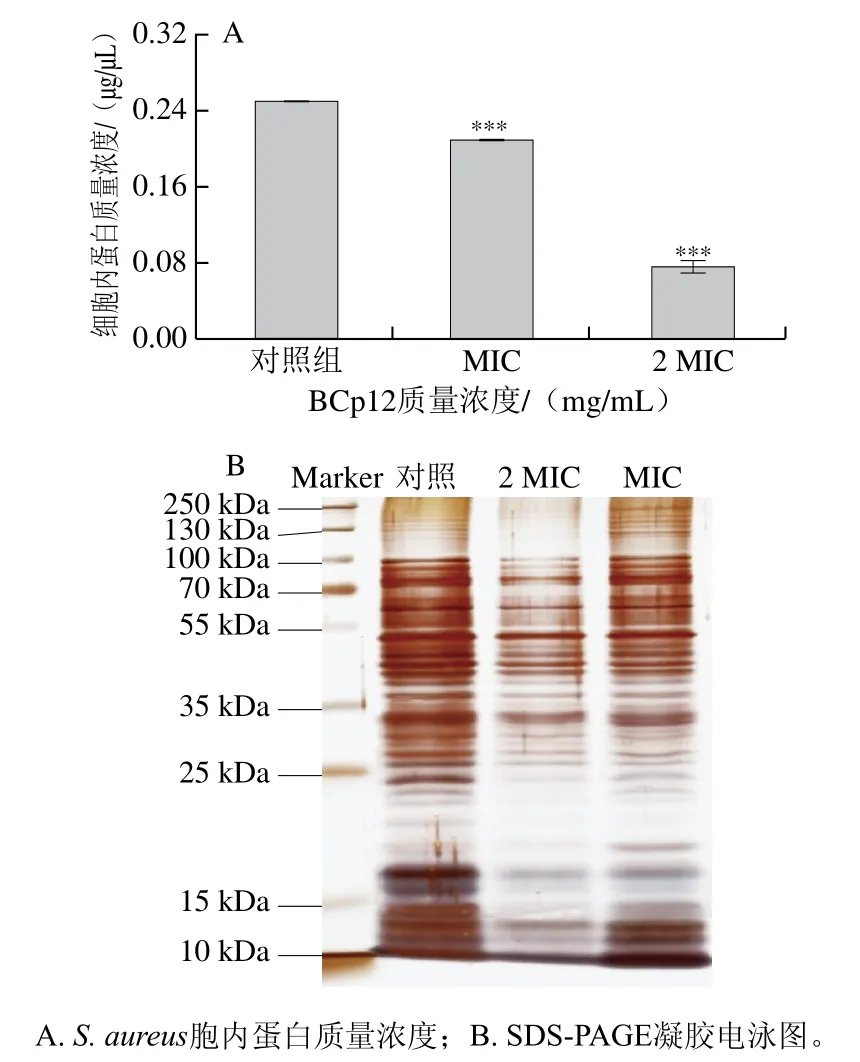
图6 抗菌肽BCp12对金黄色葡萄球菌蛋白的影响Fig. 6 Effect of antimicrobial peptide BCp12 on the protein profile of S. aureus
2.4 抗菌肽BCp12对菌体蛋白翻译后修饰的影响
经过修饰后,含有赖氨酸的蛋白性质,如结构、稳定性或酶活性发生改变,可发挥控制菌体生长代谢的作用。如图7所示,金黄色葡萄球菌蛋白存在大量的赖氨酸乙酰化、琥珀酰化、丙二酰化修饰,而赖氨酸2-羟基异丁酰化修饰不明显。已有研究发现,芽孢杆菌、欧文氏菌、肠炎沙门杆菌、枯草芽孢杆菌内蛋白质存在明显的赖氨酸乙酰化、琥珀酰化修饰,菌体蛋白质与能量代谢途径中关键代谢酶存在翻译后修饰,这些发生修饰的蛋白质/酶在蛋白质降解、毒力因子表达、碳源代谢、线粒体能量代谢、脂肪酸合成、氧化应激反应等过程中起着关键作用[39]。在哺乳动物中,赖氨酸丙二酰化修饰与能量代谢密切相关,但在原核生物中作用仍知之甚少。Tan Minjia等[40]阐明了大肠杆菌的丙二酰化修饰谱,发现蛋白质的丙二酰化在调节大肠杆菌能量代谢途径和蛋白质功能中起重要作用。Xie Jianping等[41]发现结核分枝杆菌中大量的代谢酶和抗生素抗性蛋白发生赖氨酸琥珀酰化,揭示了琥珀酰化在结核分枝杆菌中的病理及生理代谢中的作用。
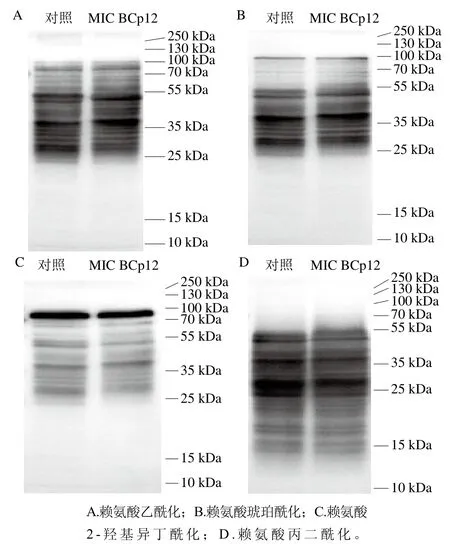
图7 免疫印迹分析抗菌肽BCp12对金黄色葡萄球菌蛋白修饰的影响Fig. 7 Effect of antimicrobial peptide BCp12 on protein modification in S. aureus evaluated by Western blot
本研究利用MIC BCp12处理金黄色葡萄球菌后,发现菌体的生长受到抑制,通过分析实验组菌体的4 种赖氨酸酰化修饰程度,发现金黄色葡萄球菌的蛋白丙二酰化修饰发生了明显的下调,乙酰化修饰水平在一定程度上也发生变化,而对赖氨酸琥珀酰化和2-羟基异丁酰化修饰的影响不明显。Reynolds等[42]报道了牙龈卟啉单胞菌中用于能量产生的关键代谢酶在某些赖氨酸残基上被赖氨酸乙酰化,证实赖氨酸乙酰化在牙龈卟啉单胞菌的代谢调节中起重要作用,对它的增殖至关重要。Fan Ben等[43]研究得到赖氨酸丙二酰化可能影响糖多孢红霉菌中心能量代谢和糖多孢红霉菌的生物合成途径。β-内酰胺类抗生素能与青霉素结合蛋白PBPs的转肽酶功能域(TPase domain)选择性结合,使其乙酰化而灭活TPase,阻断细菌肽聚糖合成,进而杀灭金黄色葡萄球菌[44]。相关研究报道也指出sirtuin 5(sirt5)作为蛋白质脱酰基酶,能催化去除翻译后修饰,例如赖氨酸残基上的琥珀酰化和丙二酰化修饰,进而调节细胞能量代谢[45]。Jin Qi等[46]研究了毛廯菌不同生长阶段蛋白质水平和乙酰化修饰水平,并通过细胞实验表明,外源添加赖氨酸乙酰基转移酶(k (lysine) acetyltransferase,KATs)抑制剂和组蛋白赖氨酸去乙酰酶(histone deacetylases,KDACs),可以显著影响真菌细胞的存活,为新型抗真菌药物的研制提供了直接的实验依据。蛋白质翻译后修饰是抗菌肽作用机制研究、抗菌药物研发、菌体分泌毒素研究中尚未被充分重视的一大方向,对蛋白质翻译后修饰的深入研究,有助于了解生命活动特征、鉴定作用靶点、揭示代谢通路,为抗菌类药物、食品防腐剂研发提供思路。
3 结 论
抗菌肽BCp12能够显著抑制金黄色葡萄球菌的生长。BCp12破坏细胞壁膜通透性,菌体形变严重,部分细胞内容物外泄形成空腔;BCp12以嵌插方式与金黄色葡萄球菌的DNA结合,阻碍菌体遗传信息正常表达,影响蛋白合成,尤其对分子质量15~35 kDa的蛋白质抑制明显;金黄色葡萄球菌蛋白存在大量的赖氨酸乙酰化、琥珀酰化、丙二酰化修饰,其中MIC BCp12处理组菌体的丙二酰化修饰下调。基于本研究结果,可以得出抗菌肽BCp12对金黄色葡萄球菌的抑菌作用是通过影响其壁膜通透性、抑制DNA和蛋白的合成、阻碍菌体赖氨酸丙二酰化修饰共同作用的结果。
