革兰氏阳性细菌与革兰氏阴性细菌所致脓毒症大鼠心肌损伤后心肌酶变化的比较
2019-10-21陈雪阳
陈雪阳,任 珊,许 航
脓毒症是各种微生物及免疫原性物质引起的机体免疫应答反应,是外科大手术、严重创伤或烧伤等常见的并发症。脓毒症可累及多个器官,常伴有心血管系统的异常改变,包括脓毒症心肌损伤[1-3]。目前脓毒症心肌损伤的发病机制尚未完全明确。有观点认为脓毒症心肌损伤与信号通路介导的炎症因子大量释放、促炎/抗炎平衡失调,以及免疫系统紊乱均可能相关,并非单一致病机制[4,5]。革兰氏阳性细菌(Gram-positive bacteria,G+)释放的外毒素与革兰氏阴性细菌(Gramnegative,G-)释放的内毒素所导致的脓毒症心肌损伤的机制及严重程度不同,故本实验拟采取腹腔内注射G+细菌(金黄色葡萄球菌)、G-细菌(大肠埃希菌)模拟不同细菌种类所致的脓毒症,并腹腔注射等容积生理盐水作为对照,分析G+和G-细菌所致脓毒症大鼠不同时间点心肌酶的表达变化,探讨G+和G-细菌所致脓毒症心肌损伤严重程度的差别。
1 对象与方法
1.1 实验动物与试剂仪器
1.1.1 实验动物及分组 健康雄性SD 大鼠45 只,体重250~350 g,7~9 周龄,购自新疆维吾尔自治区乌鲁木齐疾控中心。动物合格证号:SCXK(新)2016—0004。实验前适应性饲养大鼠1~2 周,自由饮食。实验时将45 只大鼠称重并分别编号,按照随机数字表法随机分为3 组:革兰氏阳性细菌脓毒症组、革兰氏阴性细菌脓毒症组和生理盐水组,每组各15 只大鼠。
1.1.2 试剂及仪器 模型制备所需金黄色葡萄球菌、大肠埃希菌由新疆石河子大学医学院第一附属医院感染疾控中心惠赠,cTnT、CK 和CK-MB 检测试剂盒均购自宁波瑞源生物科技有限公司(批号:20140409)。7600-020 型全自动生化分析仪购自日本HITACHI 公司。KDC-1044 低速离心机购自安徽中科中佳科学仪器有限公司。
1.2 实验方法 采用腹腔内注射细菌的方法制备大鼠脓毒症模型。革兰氏阳性细菌脓毒症组:7.35×1012CFU/kg,3 ml;革兰氏阴性细菌脓毒症组:1.26×1012CFU/kg,3 ml;生理盐水组:3 ml。大鼠腹腔注射选择1 ml 注射器针头连接5 ml 注射器针管,腹腔注射时右手持注射器,左手手指分别抓住老鼠尾部及背部皮肤,使大鼠头部向下,防止注射器刺入时损伤大肠、小肠等器官。使注射器针孔向上,针尖以小于20 度的方向刺入皮下,贴腹壁向大鼠头部方向稍推进针头,再以45 度方向刺入腹腔,进针动作轻柔;注射后大鼠放入笼内,术后保持室温在25℃,给予大鼠饲料和自来水,单笼饲养。
1.3 标本处理 革兰氏阳性细菌脓毒症组、革兰氏阴性细菌脓毒症组和生理盐水组分别于造模成功后6、12 和24 h 经尾静脉采集静脉血0.5 ml,分别采用试剂盒检测血浆心肌钙蛋白(cardiac troponin,cTnT)、肌酸激酶(creatine kinase,CK)和肌酸激酶同工酶(creatine kinase-MB,CK-MB)表达。
1.4 统计学方法 采用SPSS22.0 统计学软件进行统计学分析,计量资料以表示,数据整体分析采用两因素重复测量方差分析,不同时间点下各组比较采用t检验,以P<0.05 为差异有统计学意义。
2 结 果
2.1 大鼠模型的建立 革兰氏阳性细菌脓毒症组大鼠于4 h 时开始出现竖毛、呼吸频率加快,8 h 时出现腹泻、大小便失禁和进食水减少,14 h 时出现反应迟钝、呼吸急促和四肢肌张力降低,20 h 时出现嗜睡、皮温低和眼球血性分泌物增加等症状;革兰氏阴性细菌脓毒症组大鼠于6 h 时开始出现呼吸频率加快和活动减少;9 h 时出现呼吸加快、进食水减少和腹泻,16 h 时出现呼吸急促、皮温低和拒食;22 h 时出现四肢肌张力降低、眼球血性分泌物和嗜睡等症状;生理盐水组大鼠均无上述症状。见表1。
2.2 血浆cTnT水平比较 革兰氏阳性细菌脓毒症组大鼠6、12 和24 h 血浆cTnT 浓度均显著高于革兰氏阴性细菌脓毒症组大鼠和生理盐水组大鼠(P<0.05);且随着时间的延长,三组大鼠血浆cTnT 水平逐渐升高,均于24 h 达到峰值。革兰氏阴性细菌脓毒症组大鼠6、12 和24 h 血浆cTnT 浓度均显著高于生理盐水组(P<0.05,表2)。

表1 革兰氏阳性细菌对脓毒症大鼠存活期生存率的影响
表2 各组大鼠血浆cTnT 变化(ng/ml,)
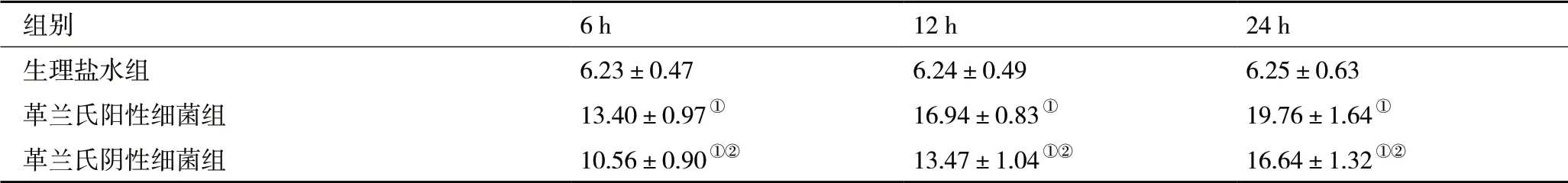
表2 各组大鼠血浆cTnT 变化(ng/ml,)
注:与生理盐水组相比,①P<0.05;与革兰氏阳性细菌组相比,②P<0.05
组别 6 h 12 h 24 h生理盐水组 6.23±0.47 6.24±0.49 6.25±0.63革兰氏阳性细菌组 13.40±0.97① 16.94±0.83① 19.76±1.64①革兰氏阴性细菌组 10.56±0.90①② 13.47±1.04①② 16.64±1.32①②
2.3 血浆CK水平比较 革兰氏阳性细菌脓毒症组大鼠6、12 和24 h 血浆CK 均显著高于革兰氏阴性细菌脓毒症组大鼠及生理盐水组大鼠(P<0.05);且随着时间的延长,三组大鼠血浆CK 水平逐渐升高,均于24 h 达到峰值。革兰氏阴性细菌脓毒症组大鼠6、12 和24 h 血浆CK 浓度均显著高于生理盐水组大鼠(P<0.05,表3)。
2.4 血浆CK-MB水平比较 革兰氏阳性细菌脓毒症组大鼠6、12 和24 h 血浆CK-MB 均显著高于革兰氏阴性细菌脓毒症组大鼠及生理盐水组大鼠(P<0.05);且随着时间的延长,三组大鼠血浆CK-MB 水平逐渐升高,均于24 h 达到峰值(P<0.05)。革兰氏阴性细菌脓毒症组大鼠6、12 和24 h 血浆CK-MB 浓度均显著高于生理盐水组大鼠(P<0.05,表4)。
表3 各组大鼠血浆CK 变化(U/L,)

表3 各组大鼠血浆CK 变化(U/L,)
注:与生理盐水组相比,①P<0.05;与革兰氏阳性细菌组相比,②P<0.05
组别 6 h 12 h 24 h生理盐水组 403.23±64.23 409.64±53.29 411.07±57.24革兰氏阳性细菌组 703.81±100.42① 901.70±90.62① 993.47±89.69①革兰氏阴性细菌组 643.41±80.62①② 727.69±89.62①② 836.67±103.74①②
表4 各组大鼠CK-MB 变化( IU/L,)

表4 各组大鼠CK-MB 变化( IU/L,)
注:与生理盐水组相比,①P<0.05;与革兰氏阳性细菌组相比,②P<0.05
组别 6 h 12 h 24 h生理盐水组 7.64±1.08 7.96±0.97 8.03±1.14革兰氏阳性细菌组 30.68±3.37① 49.67±3.49① 56.49±2.58①革兰氏阴性细菌组 16.87±3.37①② 24.84±0.83①② 33.26±1.67①②
3 讨 论
目前对革兰氏阴性细菌导致脓毒症的作用及病理生理机制已有较充分的认识,但随着革兰氏阳性细菌脓毒症发生率的逐年升高,革兰氏阳性细菌及其外毒素的作用亦逐渐引起重视。由于近年来多重耐药菌的出现,脓毒症的发病率持续升高,进展迅速,严重程度也逐渐增加,严重时可进展为感染性休克和引起多脏器功能障碍综合征(multiple organ dysfunction syndrome,MODS)[6,7]。脓毒症仍是目前重症患者死亡的主要原因。在脓毒症导致的死亡患者中,超过50%的患者被证实有心肌损害和心肌功能障碍[8]。Martin 等[9]研究发现脓毒症患者均伴有心功能障碍,包括心脏收缩和(或)舒张功能障碍,尤其在严重脓毒症和感染性休克患者中。脓毒症时交感神经兴奋性增加,引起促炎症细胞因子的表达[10]。另外脓毒症还可通过多种途径激发全身细胞因子的释放,炎性细胞因子的增加可直接损害心肌细胞[11]。
肌钙蛋白(Tn)是肌肉收缩蛋白,位于收缩蛋白及细肌丝上,而心肌肌钙蛋白仅存于心肌细胞中,cTnT 是其中一种亚单位组成的络合物,cTnT 是心肌细胞特有的抗原在心肌细胞损伤时从心肌纤维上降解下来,cTnT 是心肌损伤的标志物,对脓毒症心肌损伤时的诊断有重要临床意义;血清肌酸激酶(CK)广泛存在于各组组织中,与三磷酸腺苷(ATP)的再生相关,在生理水平上维持细胞内ATP 浓度,其同工酶(CK-MB)主要存在于心肌细胞中,二者皆可反映心肌细胞损伤的程度。脓毒症引起心肌损害时,促凋亡因子/抗凋亡因子比例失调,心肌细胞膜mPTP 孔道开放[12,13],膜电位下降,线粒体崩解,ATP 生成障碍,从而亦使血清中肌酸激酶(CK)及其同工酶(CK-MB)升高,因此,血浆cTnT、CK 和CK-MB 是诊断心肌损伤的常用指标,其上升幅度与心肌损害程度呈正比[14],严重脓毒症时机体产生的毒素作用可致肌纤维的膜通透性异常或肌纤维损伤,大量心肌炎症因子入血,血浆毒素水平上升[15]。因此,本实验选择cTnT、CK、CK-MB 为脓毒症后心肌损伤及其程度的评价标准。
革兰氏阴性细菌主要通过释放内毒素引起组织器官损伤,内毒素是革兰氏阴性细菌菌体中存在的毒性物质的总称,是多种革兰氏阴性细菌的细胞壁成分,由菌体裂解后释放出的毒素,其化学成分是磷脂多糖-蛋白复合物,毒性成分主要是类脂类A[16]。革兰氏阳性细菌的致病主要通过释放外毒素,外毒素是病原菌生长繁殖过程中分泌到菌体外的一种代谢产物,是次级代谢产物,其主要成分为可溶性蛋白。革兰氏阳性细菌释放的外毒素可产生一种中毒性休克综合毒素-1(超抗原)作用下,引起体内炎症因子的瀑布效应[17],使体内产生大量炎症因子,促炎/抗炎比例失调,从而攻击心肌细胞,引起脓毒症心肌损伤和心肌功能障碍。
本实验研究表明分别采用腹腔内注射金葡萄球菌和大肠埃希菌分别建造革兰氏阳性细菌脓毒症和革兰氏阴性细菌脓毒症模型,笔者发现随着脓毒症病情的发展,心肌损伤不断加重,革兰氏阳性细菌脓毒症组在各时间点的cTnT、CK 和CK-MB 浓度均显著高于革兰氏阴性细菌脓毒症组,表明外毒素作为免疫炎症反应中的“超抗原”,可引起炎症因子产生级联瀑布放大,攻击心肌细胞致心肌细胞损伤,且造成的损伤要严重高于内毒素引起的心肌损伤。
综上,革兰氏阳性细菌所致大鼠脓毒症时对心肌细胞损伤程度要显著高于革兰氏阴性细菌,因此在临床上,革兰氏阳性细菌所致脓毒症心肌损伤应引起足够的重视。
