脂质体递药系统靶向大鼠缺血心肌及减少缺血再灌注损伤的研究*
2022-01-06王秋玲沈罟丁芷萱王俊珊汪芳诸葛萦
王秋玲 沈罟 丁芷萱 王俊珊 汪芳 诸葛萦
心肌缺血再灌注损伤(myocardium ischemiareperfusion injury,MI-RI)是指心肌组织经过急性缺血事件后,当迅速恢复血流灌注时,缺血组织不仅没有得到改善或恢复,反而引起心肌细胞凋亡、心肌结构功能损伤加剧的现象[1]。MI-RI通常引起心律失常及心功能持续恶化,其发生机制复杂,涉及氧自由基爆发、细胞凋亡、钙超载及代谢障碍等。目前治疗心肌梗死无法有效避免MIRI,这严重制约了冠心病的治疗效果。
脂质体可天然存在,也可人工合成[2],类似于生物细胞膜,是由亲水头部和亲脂尾部构成的脂质双分子层,该结构可将药物包载其中。脂质体递药系统(liposome drug delivery system,LDDS)是指脂质体包载药物并使药物选择性地浓集于靶向部位的给药系统[3],这种天然的炎症靶向效应使药物更多地聚焦病变部位,从而增强药物在局部组织的疗效,同时延长了药物血浆半衰期、减少药物有效剂量和药物不良反应。为此,本研究分别制备IR-775 荧光脂质体、胺碘酮脂质体和丙酮酸乙酯(ethyl pyruvate,EP)脂质体等药物,并在缺血-再灌注(I-R)损伤模型中考察其靶向性及治疗优势。进而探讨治疗MI-RI的一种新策略。
1 材料与方法
1.1 实验材料与仪器
雄性SD(Sprague-Dawley)大鼠,鼠龄8~9周,体重(260±20)g(购自上海市崇明区实验动物中心)、盐酸胺碘酮(上海泰坦化学有限公司)、丙酮酸乙酯(南京化学试剂股份有限公司)、IR-775荧光染料(上海泰坦化学有限公司)、GAPDH 鼠单克隆抗体(巴傲得生物科技有限公司)、Bax鼠单克隆抗体(杭州华安生物技术有限公司)、Bcl-2鼠单克隆抗体(巴傲得生物科技有限公司)、Caspase-3鼠单克隆抗体(上海朗顿生物科技有限公司)、ECL 发光试剂盒(GE 公司)、BCA 蛋白定量试剂盒(美国Sigma-Aldrich公司)。小动物呼吸机(型号ALC-V8,上海奥尔科特生物科技有限公司)、Western 显影仪。
1.2 实验方法
1.2.1 脂质体药物制备及考察 采用薄膜分散-超声-膜挤出法制备载药脂质体,使用Box-Behnken设计法,以磷脂与胆固醇质量比、磷脂与药物质量比以及超声时间为优化设计的三个因素,以包封率为响应值,优化脂质体的处方和制备工艺,得到最优载药脂质体处方,使用马尔文粒度仪考察脂质体粒径、zeta电位及粒度分布,并测量脂质体的包封率[4]。
在室温条件下称取一定量的胺碘酮或者EP药物以及适量的胆固醇和蛋黄卵磷脂置于100 ml的圆底烧瓶中,加入20 ml氯仿搅拌均匀,使药物完全溶解,将烧瓶置于旋转蒸发仪中,在60℃水浴条件下减压旋蒸,以彻底挥发有机溶剂,当看到瓶底形成半透明膜或者白色蜂巢状膜时,加入7 ml生理盐水,充分摇晃震荡直至薄膜水化,探针超声一定时间后,过0.45μm 聚碳酸酯膜3次,即可得到脂质体药物的混悬液。将制备好的胺碘酮脂质体及EP脂质体放于4℃冰箱保存备用。
1.2.2 实验动物建模与分组 雄性SD 大鼠术前禁食禁饮8 h。用1%戊巴比妥钠(50 mg/kg)腹腔注射麻醉。在喉镜直视下插管,气管与小动物呼吸机相连进行机械通气。具体参数:呼吸频率80次/分,潮气量为每100 g体重2 ml,呼吸比1∶2,吸入气中氧浓度99%。I-R 组制备:在第四肋间打开大鼠胸腔,暴露左胸腔,尾静脉注射300 u/kg普通肝素,10 min后在肺动脉圆锥与左心耳交界处下方约2 mm处用无创动脉夹夹闭冠状动脉左前降支(LAD),建立缺血模型,缺血30 min后打开动脉夹恢复LAD血流。术后立即尾静脉注射0.2 ml相关药物或溶液。假手术组制备:大鼠开胸,暴露LAD 不予夹闭,其余操作同前。大鼠建立MI-RI模型时,在四肢皮下各置入一电极,连接心电图机,观察建模、用药前后心电图变化。
1.2.3 大鼠心肌I-R 模型IR-775荧光成像实验IR-775氯化物属七甲吲哚类近红外染料,属亲脂性阳离子化合物。其荧光最大激发及发射波长在795~815 nm 之间,作为IR 系列近红外染料的一种,广泛运用于活体动物或细胞的荧光成像。IR-775 脂质体制备操作如下:在50 m L 圆底烧瓶中,加入精密称得的处方量蛋黄卵磷脂、IR-775 和胆固醇,再加入适量氯仿,于超声辅助下充分溶解。在40℃、40 rpm 下,减压蒸发除去氯仿,得到透明均匀的脂质体膜。加入适量生理盐水剧烈振摇至薄膜完全脱落溶解,并及时封口。将烧瓶置于水浴中,充分水化,得到白色乳状脂质体混悬液。然后,超声波细胞破碎仪探头超声处理脂质体(10 min,工作1 s,间隔1 s)。最后分别经过直径为0.45μm 和0.22μm 聚碳酸酯膜依次挤压后形成IR-775脂质体。
取16只SD 大鼠随机分成4组(每组4只):①假手术+IR-775 脂质体组;②I-R+IR-775 脂质体组;③I-R+IR-775溶液组;④I-R+生理盐水组。48 h后处死大鼠,取整个心脏置于IVIS Lumina III活体成像系统箱(激发波长770 nm,发射波长830 nm)内,考察各组大鼠体内荧光信号强度。
1.2.4 评估脂质体药物对大鼠术后心律失常事件的影响 取24 只SD 大鼠,分4 组处理(每组6只):①I-R+空白脂质体组;②I-R 组;③I-R+胺碘酮脂质体组;④I-R+胺碘酮溶液组。其中胺碘酮药物浓度为2.5 mg/kg。
连续跟踪记录每只大鼠的心电图,再结合MIRI 30 min 后的心电图,使用Cutis and walker(1988)心律失常评分法评估每组大鼠的心律失常事件:房性心律失常或无心律失常—0分;单个室性早搏(简称室早)—1分;频发室早—2分;单次室性心动过速(简称室速)时长<60 s—3分;一阵室速总时长>60 s或累计多阵室速总时长<60 s—4分;多阵室速总时长>60 s—5分;心室颤动(简称室颤)—6分;室颤时长>5 min或术中死亡—7分。
1.2.5 评估脂质体药物对大鼠术后细胞凋亡的影响 取24 只SD 大鼠,分4 组处理(每组6只):①I-R+空白脂质体组;②假手术+EP 脂质体组;③I-R+EP 脂质体组;④I-R+EP 溶液组;其中EP为50 mg/kg。
48 h后处死大鼠,沿LAD 走向取其供血的左室前壁心肌,剪碎制成心肌组织冷匀浆,置于放射免疫沉淀法(radio immunoprecipitation assay,RIPA)裂解缓冲液中充分研磨,离心,取上清液,用BCA 试剂盒测定蛋白质浓度。每个蛋白样本取20 u 上样,经聚丙烯酰胺凝胶电泳(SDS-PAGE)后转移到聚偏二氟乙烯(PVDF)膜上,用5%脱脂牛奶封闭约90 min后,分别加入一抗(抗GAPDH 抗体、抗Bax抗体、抗Bcl-2 抗体、抗Caspase-3 抗体)4℃孵育过夜,其中抗GAPDH 抗体作为内部参照;用Tris缓冲盐水和TBST 洗膜后,加入二抗,室温孵育1 h 后再洗膜,最后使用增强化学发光法(enhanced chemiluminescence,ECL)显示膜上的蛋白条带。
1.3 统计学分析
运用SPSS23.0 软件对数据资料进行统计分析,使用One-Way ANOVA 检验和t检验进行数据处理,以P<0.05为差异具有显著性。
2 结果
2.1 脂质体药物的表征
所制备的脂质体药物粒径均匀(见表1),制备后24天内药物渗漏不高于18%,稳定性良好。

表1 胺碘酮脂质体与EP脂质体的粒径、zeta电位及粒度分布
2.2 各组荧光信号强度表现
I-R+IR-775脂质体组荧光强度最高,I-R+生理盐水组(无荧光信号),I-R+IR-775 溶液组和假手术+IR-775组介于上述二者之间(图1A、1B)。

图1 大鼠心肌I-R 模型IR-775荧光成像图(A)及对应实物图(B)
2.3 大鼠心律失常事件及评分
夹闭LAD 30 min后打开动脉夹,相比于正常心电图,I-R 后心电图观察到T 波高耸、缺血性ST段弓背向上抬高,再灌注后可见室速(见图2)。
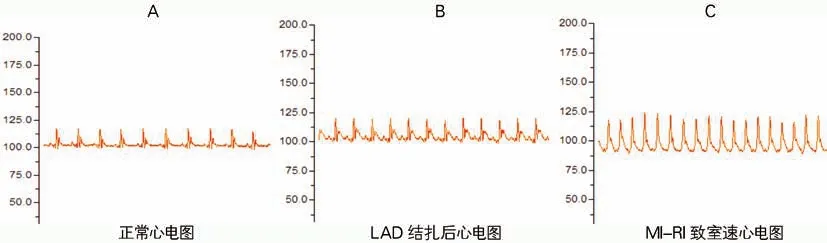
图2 MI-IR 手术前后大鼠心电图的演变
I-R+空白脂质体组、I-R 组、I-R+胺碘酮脂质体组、I-R+胺碘酮溶液组的心律失常评分分别为4.0±0.82、4.5±0.96、1.5±0.96、3.0±0.82。与其他三组相比,I-R+胺碘酮脂质体组心律失常评分明显降低(P<0.01),且低于胺碘酮溶液组(P<0.05)。
2.4 各组凋亡相关蛋白的表达水平
与其他三组相比,I-R+空白脂质体组的Bax、caspase-3表达水平最高(P<0.05),假手术+EP脂质体组和I-R+EP脂质体组明显低于I-R+空白脂质体组和I-R+EP溶液组;而Bcl-2蛋白正好相反,假手术+EP脂质体组和I-R+EP脂质体组表达水平明显高于I-R+空白脂质体组和I-R+EP溶液组(P<0.05)(见图3,表2)。与I-R+空白脂质体组相比,I-R+EP 脂质体组的Bax/Bcl-2 比值明显下降。

表2 各组细胞凋亡蛋白的相对表达量的比较

图3 Western Blot法检测相关蛋白的表达
3 讨论
MI-RI是目前急性心肌梗死患者行血运重建术中难以避免的一项难题,探索治疗MI-RI的新方法是本研究的主要内容。LDDS具有诸多优点,可大大改善药物的体内分布和药代动力学特征,不仅使药物具有缓释效果,并且得益于LDDS天然的炎症靶向效应,使药物更多地靶向至病变部位:脂质体药物进入体内后被网状内皮系统吞噬,特别是吞噬细胞,当出现MI-RI时,病变组织释放大量炎症因子,动员和引导包括吞噬细胞在内的大量炎症细胞浸润[6],从而将所携带的药物传递给病变组织,使药物在病变部位聚集,降低药物副作用的同时,显著提高药物疗效[7]。此外,MI-RI中血管的通透性增加,诱导纳米药物的长滞留效应[8],增强了脂质体药物在MI-RI的靶向效应。本研究重点考察了LDDS在大鼠MI-RI组织中的靶向效应和独特作用。
在本项研究中,笔者通过结扎SD 大鼠冠状动脉LAD 的方法,制备了SD 大鼠的MI-RI模型,其继发室速的现象与I-R 损伤密切相关,与文献报道的氧自由基堆积[9]和细胞内钙超载[10]等机制下所导致的临床表现一致。在该动物模型上,本研究首先验证了IR-775荧光脂质体在心肌缺血区域的炎症靶向效应,结果证实,与游离IR-775、假手术组对比,IR-775脂质体明显增强了I-R 心肌组织中的荧光信号,这说明在MI-RI区域,脂质体药物确实能发挥炎症靶向作用。
此后,笔者通过胺碘酮脂质体和EP脂质体,考察了LDDS靶向效应的治疗优势。胺碘酮是经典的抗心律失常药物,可用于致命性心律失常的紧急治疗。本研究证实,与游离药物相比,胺碘酮脂质体显著改善了MI-RI心律失常事件评分。
另一方面,EP具有清除氧自由基,减少促炎因子的表达,抑制心肌细胞凋亡的作用[5,11],因此,本研究也通过EP脂质体评估了靶向效应对MI-RI区域凋亡蛋白的影响。
Bcl-2家族蛋白是调控细胞凋亡的关键因素之一[12-13],尤其Bax与Bcl-2的比值与细胞凋亡水平密切相关:当Bax/Bcl-2 比值增高时,促进细胞凋亡,反之,则抑制细胞凋亡[14]。而Caspase-3被认为是细胞凋亡过程中最重要的终末剪切酶,Caspase-3激活和超表达均可诱导细胞凋亡[15]。因此,Bax、Bcl-2、Caspase-3,及Bax/Bcl-2 比值都可以作为评价细胞凋亡的重要指标。
本研究结果显示,与对照组相比,EP脂质体均显著降低了MI-RI中Bax蛋白、Caspase-3 表达水平,而Bcl-2 表达水平明显增高,Bax/Bcl-2 比值显著下降;与游离药物相比,LDDS增强了对上述凋亡蛋白表达的影响。因此,LDDS增强了EP在MI-RI中对细胞凋亡的调控作用,减轻了I-R 损伤。
通过该项研究,证实LDDS可在MI-RI中发挥炎症靶向效应,并借助于该效应,可使相关药物进一步改善MI-RI对心脏的不利影响,增强治疗效果,或许是一种治疗MI-RI的新策略。
